La pandemia por SARS-CoV-2 determinó la presentación de pacientes con una forma extremadamente grave de síndrome de distrés respiratorio agudo (SDRA).
La autopsia clínica puede ofrecer información para conocer y comprender esta nueva infección viral. El objetivo del presente trabajo es caracterizar la anatomía patológica (AP), microbiología y carga viral a nivel pulmonar de una serie de pacientes fallecidos con SDRA por SARS-CoV-2.
Se realizó un estudio prospectivo observacional de pacientes fallecidos en la Unidad de Medicina Intensiva (UMI) (Hospital Universitario; Centro de Referencia para pacientes con infección por SARS-CoV-2) con diagnóstico confirmado de infección por SARS-CoV-2. El estudio fue aprobado por el Comité de Ética del Hospital Español (ASSE 2015). Se solicitó consentimiento informado al familiar más cercano.
Se incluyó a pacientes con SDRA (definición de Berlín)1 secundario a infección por SARS-CoV-2 (período: diciembre del 2020-noviembre del 2021).
Las principales características clínicas se muestran en la tabla 1 y en material electrónico suplementario (MES) (anexo). Se clasificó a los pacientes según la estancia en UMI en 3intervalos (hasta 10 días, 11-20 días, más de 20 días) de acuerdo con las etapas evolutivas del SDRA2.
Características generales de la población (n=21)
| Características demográficas | n=21 |
|---|---|
| Edad (años), media (DE) | 62±12 |
| Sexo, femenino n (%) | 6 (29) |
| Comorbilidades | |
| EPOC, n (%) | 8 (38) |
| HTA, n (%) | 10 (48) |
| Diabetes, n (%) | 4 (19) |
| Obesidad, n (%) | 8 (38) |
| Variables al día 1 | |
| APACHE II, media (DE) | 21±9 |
| SOFA Score, media (DE) | 12±3 |
| Dímeros-D (ng/ml), media (DE) | 13164±17718 |
| Ferritina (ng/ml), media (DE) | 2448±1329 |
| PCR (mg/l), media (DE) | 175±89 |
| LDH (U/l), media (DE) | 849±432 |
| Linfocitos/mm3, media (DE) | 631±427 |
| Disfunciones orgánicas | |
| Shock circulatorio, n (%) | 17 (85) |
| IRA, n (%) | 11 (55) |
| Causa de muerte | |
| Disfunción orgánica múltiple, n (%) | 4 (19) |
| Hipoxemia refractaria, n (%) | 9 (43) |
| Shock circulatorio, n (%) | 8 (38) |
| Días de ventilación mecánica, media (DE) | 15±10 |
| Estancia en UCI (días), media (DE) | 17±10 |
APACHE II: Acute Physiology And Chronic Health Evaluation II; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IRA: daño renal agudo; LDH: láctico deshidrogenasa plasmática; PCR: proteína C reactiva plasmática; SOFA: Sequential Organ Failure Assessment.
Las autopsias se realizaron antes de cumplirse las 3 h del fallecimiento para asegurar la calidad de las muestras microbiológicas. Se realizó análisis macroscópico del pulmón y toma de muestras de tejido de las zonas más comprometidas; análisis microbiológico (tinción de Gram, cultivos y estudio micológico); análisis histológico (tinción de hematoxilina/eosina) y técnica tricrómica de Masson para fibrosis y trombosis; análisis del virus mediante extracción de ARN y cuantificación de genomas virales (técnica de RT-PCR); un Ct (Cycle Threshold) menor de 35 se definió como positivo3.
Se estudió a 21 pacientes; la macroscopia evidenció pulmones edematosos, pesados (1.130±349g), hemorrágicos y eritro-cianóticos (MES, anexo)-
La microscopia evidenció daño alveolar difuso (DAD) en 20 casos (95%) (MES, anexo).
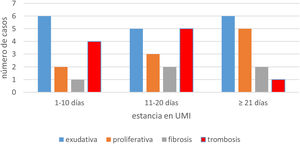
En los pacientes fallecidos hasta el día 10 de estancia, como en aquellos fallecidos entre días 11 a 20, predominó la fase exudativa que coexistió con elementos proliferativos y fibrosis incipiente. En pacientes con más de 20 días de estancia predominó el patrón proliferativo, aunque persistían sectores con elementos exudativos, siendo este el patrón predominante en 2casos (fig. 1).
Se evidenció trombosis microvascular pulmonar en 10 casos, predominando en aquellos con estancia menor a 20 días (fig. 1).
Los cultivos de tejido pulmonar fueron positivos en 17 casos (81%); en 6 (85%) de aquellos con estancia hasta 10 días; 6 (75%) de aquellos con estancia entre 11 y 20 días y en 5 (83%) con estancia mayor a 20 días. En los primeros predominaron los gérmenes sensibles, mientas que luego de los 20 días predominaron los aislamientos de cándida y gérmenes con resistencia extendida y pan resistentes4. En 2casos se aisló Aspergillus (evidenciado también en la AP), constituyendo casos de aspergilosis pulmonar invasiva5.
La carga viral de SARS-CoV-2 se analizó en 17 pacientes. Las muestras evidenciaron altas cargas virales hasta 30 días del inicio de síntomas (MES, anexo).
Los hallazgos anatomopatológicos evidenciaron predominio de DAD similar al descrito en pacientes con SDRA sin infección por SARS-CoV-2. Coincide mayormente con los hallazgos de Katzenstein et al.2, evidenciando un predominio del patrón exudativo durante los primeros 10 días y elementos proliferativos y fibrosis a partir de la segunda semana.
Sin embargo, la presencia de elementos exudativos que constituían en algunos casos el patrón predominante luego de 3semanas de estancia en la unidad difiere de Katzenstein et al.2, que limitan la etapa exudativa a los primeros 15 días. Concuerda con los hallazgos de Thille et al., que encuentran un 17% de autopsias pulmonares con patrón exudativo luego de 3 semanas. Al igual que él, encontramos casos con predominio de cambios proliferativos en la primera semana de enfermedad, avalando el hecho que la etapa proliferativa puede tener un inicio muy precoz6.
Otro aspecto anatomo-patológico a destacar fue la frecuencia de microtrombosis pulmonar, encontrada en el 50% de los casos. Este hecho ya ha sido descrito en fallecidos con infección por SARS-CoV-27. La misma es un fenómeno conocido en el SDRA2,8, que se observa precozmente en el contexto del DAD y concuerda con nuestros hallazgos, donde la trombosis fue un elemento precoz. Recientemente, Ackermann et al. demostraron la presencia de microtrombosis precapilar en pacientes con infección SARS-CoV-2 y con influenza H1N1. Sin embargo, el compromiso de microtrombosis a nivel de los capilares alveolares fue 9veces mayor en los casos de SARS-CoV-27. Esta diferencia podría explicar el grado de hipoxemia tan severa y refractaria observada. La hipoxemia refractaria da cuenta en general de 15% de las muertes por SDRA no SARS-CoV-28, mientras que en nuestra serie fue responsable directa del 43% de los decesos.
De los hallazgos microbiológicos se destaca el alto porcentaje de cultivos positivos en pacientes con estancia hasta 10 días y el aislamiento de gérmenes resistentes (en concordancia con la ecología de la unidad) en aquellos con estancia prolongada. Queda pendiente evaluar la importancia clínica del aislamiento de cándida en este grupo de pacientes.
La carga viral en el tejido pulmonar evidenció niveles altos y persistentes. Coincide con lo reportado por Schurink et al.9. Sin embargo, difiere de lo reportado por Merdji et al. que no hallaron restos del virus luego de la primera semana en muestras pulmonares obtenidas por punción biópsica, lo cual podría explicar la diferencia10.
Nuestro estudio tiene limitaciones: el haber sido realizado en un único centro y el pequeño número de pacientes incluidos; como fortalezas destacamos la precocidad de las autopsias, que permitió realizar el estudio microbiológico y de la carga viral del tejido pulmonar.
En suma, el SDRA por SARS-CoV-2 presenta un patrón anatomo-patológico caracterizado por DAD similar al SDRA secundario a otras etiologías. Evidenciamos un patrón con cambios de acuerdo con el tiempo de evolución, aunque se destaca la persistencia y aun el predominio del patrón exudativo en casos con más de 30 días de evolución. Se destaca asimismo la alta prevalencia de microtrombosis y la persistencia del virus SARS-CoV-2 en el parénquima pulmonar, con cargas virales altas aún en pacientes con enfermedad prolongada.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.