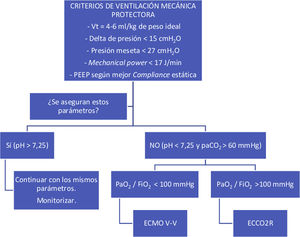
La ventilación mecánica es un procedimiento para salvar la vida de los pacientes con insuficiencia respiratoria grave que, si bien en sí misma no produce la curación del proceso, sí que puede ser perjudicial para quien la recibe. Este daño inducido por el respirador (VILI) se debe minimizar mediante la individualización de la ventilación mecánica1. Aunque siempre es complicado dar cifras, las recomendaciones pasan por aplicar un volumen tidal (Vt) de 4-6ml/kg del peso ideal; delta de presión (ΔP) menos de 15 cmH2O; presión meseta de menos de 27 cmH2O; energía mecánica menor de 17J/min y aplicar PEEP según mejor compliance estática2. Las metas son encontrar una adecuada oxigenación, con la que se asegure un transporte de oxígeno suficiente a los tejidos y la eliminación de CO2, evitando la hipercapnia grave, que es un conocido factor asociado a morbimortalidad3.
Pero, ¿qué ocurre si no podemos mantener todas estas premisas? Podríamos ajustar el respirador para realizar una ventilación mecánica potencialmente dañina o utilizar un sistema de soporte respiratorio extracorpóreo. Esta última parece la mejor opción, si bien es verdad que no hay suficiente evidencia en el momento actual para un juicio categórico. El principal estudio en pacientes con síndrome de distrés respiratorio agudo (SDRA) para evaluar la eficacia de la oxigenación de membrana extracorpórea venovenosa (ECMO-VV) utilizó 3criterios para su aplicación. Dos de ellos fueron criterios de oxigenación y, el tercero, de acidosis respiratoria: pH menor de 7,25 con presión parcial de CO2 mayor de 60mmHg durante más de 6 h4. Los resultados globales mostraron una reducción de la mortalidad global bruta a los 60 días del 11%, si bien esta diferencia no fue estadísticamente significativa. Cabe destacar aquí que el grupo con un beneficio superior de la técnica fue claramente el que tenía la acidosis respiratoria como criterio de inclusión, con una reducción del 31% en la mortalidad4. Este beneficio se ha relacionado con un menor VILI, puesto que se demostró que en este tipo de pacientes hay una disminución del Vt, de la frecuencia respiratoria, de la presión meseta, de la ΔP y de energía mecánica5.
La eliminación de CO2 mediante dispositivos extracorpóreos (ECCO2R) es más eficiente que la oxigenación del paciente y ello es debido a que, a nivel fisiológico, el contenido de CO2 para un volumen determinado de sangre venosa es mucho mayor que el contenido de oxígeno. Además, el CO2 es más soluble que el oxígeno, por lo que difunde mejor a través de la membrana del circuito. Para entender el rendimiento de la eliminación de CO2 en los dispositivos, es importante saber que esta aumentará con los aumentos en el contenido sanguíneo de CO2, la presión parcial de CO2 venoso, el área de superficie de la membrana, así como los aumentos en el gas de barrido y de la sangre que fluye a través de la membrana, con efectos de techo para ambos6. Las bases fisiológicas y técnicas, así como los diferentes dispositivos para la eliminación extracorpórea de CO2, se detallan en otro número de esta revista7.
Se han desarrollado estudios prospectivos a pacientes con insuficiencia respiratoria hipoxémica para realizar una ventilación mecánica ultraprotectora y se ha demostrado que es factible, mediante un dispositivo de ECCO2R, bajar el Vt de 6ml/kg a 3 o 4ml/kg del peso ideal. En general, se puede afirmar que en ninguno de los 3estudios principales se obtuvieron diferencias significativas en ninguno de los grupos en cuanto a días de ventilación mecánica, estancia en UCI o en el hospital, ni en la mortalidad8-10 (fig. 1).
Propuesta de aplicación de los diferentes dispositivos extracorpóreos en pacientes tratados mediante ventilación mecánica.
ECCO2R: extractor extracorpóreo de monóxido de carbono; ECMO-VV: oxigenador de membrana extracorpóreo venovenoso; paCO2: presión arterial de monóxido de carbono; PaO2/FiO2: ratio entre la presión arterial de oxígeno y la fracción inspirada de oxígeno; Vt: volumen tidal.
Por lo tanto, tras el análisis de estos estudios, se podría concluir que la utilización de ECCO2R no parece una opción para todos los pacientes con SDRA moderado. Sin embargo, si nos fijamos en qué pacientes se incluyeron en estos estudios, veremos cómo la mayoría de ellos no parecía tener problemas ventilatorios que resolver. En el estudio REST, la mitad de los pacientes del grupo ECCO2R tenían un ΔP por debajo de 15 cmH2O. Surge aquí otra indicación que es necesario explorar: su utilización en aquellos pacientes en los que no se puede mantener una ventilación protectora y en los que el ECMO-VV ha demostrado ya su eficacia. Nosotros hemos utilizado ECCO2R de bajo flujo, no con la intención de eliminar toda la producción de CO2 del paciente, sino el suficiente como para mantener un pH>7,25 con ΔP<15cmH2O y frecuencia respiratoria<30rpm. Si los pacientes también presentan SDRA grave, se instaura una terapia con ECMO-VV. Sin embargo, si la ratio paO2/FiO2 es mayor de 100mmHg, se implantará en el paciente un dispositivo de ECCO2R a través de una canulación de 14 F, similar a la utilizada en hemofiltración venovenosa continua.
Con estos criterios, en el momento actual hemos incluido a 34 pacientes con una mediana de pH de 7,17, pCO2 de 90mmHg y ΔP de 19cmH2O. La terapia ECCO2R consiguió sus objetivos en el 50% de los pacientes a las 24h y en 67% a las 72h. Las complicaciones principales fueron coagulación del circuito en el 82% de los casos, hemorragias en el 14%, incluyendo casi un 6% de hemorragias cerebrales, y alcalosis mixta en el 20%. La supervivencia global del grupo fue del 60%.
En conclusión, podemos afirmar que el ECCO2R es una técnica alternativa al ECMO-VV para tratar la acidosis hipercápnica, ya que nos asegura una ventilación mecánica ultraprotectora en aquellos pacientes que la necesitan. No estaría indicada para todos los pacientes con SDRA, si bien las indicaciones se pueden ampliar a pacientes con reagudización de EPOC, asma bronquial, fístula broncopleural o destete de ECMO. Es probable que la utilización de ECCO2R con bombas que alcancen flujos intermedios de 400-700mL/m con una membrana de oxigenación de superficie amplia, de al menos 1,8 m2, sean la solución ideal para conseguir demostrar el beneficio neto de su utilidad en pacientes con acidosis hipercápnica de cualquier etiología, garantizando una ventilación mecánica que minimice el desarrollo de VILI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.