Editado por: Ana Ochagavía - Hospital Universitario de Bellvitge. L'Hospitalet de Llobregat. Barcelona. Spain.
Última actualización: Febrero 2024
Más datosLa utilidad de la ultrasonografía para la exploración del tórax fue descrita en 1968. No es hasta la década de los 90 cuando se generaliza su uso en las unidades de cuidados intensivos como una herramienta diagnóstica, de seguimiento y guía en procedimientos invasivos. Que sea una herramienta no invasiva, accesible a pie de cama, con una sensibilidad y especificidad cercanas a la tomografía computarizada (TC) y con una curva de aprendizaje corta, la ha convertido en una técnica de uso obligado en el manejo del paciente crítico.
Es fundamental conocer que la distinta relación aire/fluido que generan las distintas patologías pulmonares da lugar a distintos patrones ecográficos. La identificación de estos patrones junto con la información clínica nos permitirá hacer un diagnóstico acertado en la mayor parte de causas de insuficiencia respiratoria.
Asimismo, no debemos olvidar la importancia de la evaluación de la función diafragmática mediante ecografía durante la desconexión de la ventilación mecánica.
The usefulness of ultrasound for chest exploration was described in 1968. It was not until the 1990s, when its use became widespread in Intensive Care Units as a diagnostic, monitoring and procedural guide tool. The fact that it is a non-invasive tool, accessible at the bedside, with a sensitivity and specificity close to computerized tomography (CT) and with a short learning curve, have made it a mandatory technique in the management of critically ill patients.
It is essential to know that there are different air/fluid ratio generated by different pathologies that gives rise to one echographic pattern or another. The identification of these patterns together with the clinical information will allow to make an accurate diagnosis in most settings of respiratory failure.
Likewise, we must not forget the importance of evaluating diaphragmatic function by ultrasound during weaning from mechanical ventilation.
El uso de la ecografía para la exploración del tórax fue descrito por primera vez por Ross et al. en 1968. Sin embargo, no fue hasta los años 90 cuando el profesor Lichtenstein demostró que el dogma clásico de que el pulmón no era un órgano explorable mediante ultrasonografía era falso. En las últimas dos décadas la ecografía torácica y diafragmática se han convertido en una herramienta diagnóstica, de monitorización y guía de procedimientos invasivos indispensable en cualquier unidad de cuidados intensivos (UCI).
En el presente capítulo nos centraremos en explicar los fundamentos y peculiaridades de esta técnica, describir los patrones fundamentales que nos permitirán realizar un diagnóstico correcto de las causas más frecuentes de insuficiencia respiratoria aguda (IRA) y dedicaremos una sección específica para introducir la sistemática y parámetros más empleados para la evaluación de la función diafragmática mediante ecografía.
Fundamentos básicos y peculiaridades de la ecografía torácicaLa ecografía es una técnica que ha incrementado su empleo progresivamente en las UCI. La información obtenida mediante las diferentes modalidades de ultrasonografía puede ser interpretada e integrada en la valoración global, durante la exploración del paciente.
Aportaciones de la ecografía torácica al paciente críticoVarias son las ventajas que han convertido a la ecografía torácica en un procedimiento indispensable en el manejo del paciente crítico:
- •
Ausencia de emisión de radiaciones: tradicionalmente el abordaje diagnóstico del tórax en el paciente crítico se ha basado en la radiografía simple y debido al elevado número de pruebas no es desdeñable la radiación evitable1.
- •
Portabilidad a la cabecera del paciente: supone minimizar los riesgos de traslados, evitando riesgos de exposición al personal sanitario.
- •
Permite repetir la prueba tantas veces como sea necesaria, su grabación y comparación temporal1.
- •
Superior a la radiología simple para detectar neumotórax, DP, neumonía, síndrome alveolo-intersticial (SAI) y en el diagnóstico diferencial de la disnea aguda. La evaluación de los pacientes con IRA a través del protocolo BLUE (Bedside Lung Ultrasound in Emergency) es una de las aplicaciones conocidas y consolidadas de la ecografía pulmonar2.
- •
En los procedimientos invasivos, ha demostrado aumentar su seguridad.
- •
Los dispositivos portátiles son más fáciles de esterilizar por presentar áreas de superficie más pequeñas que otros dispositivos radiológicos3.
La técnica presenta algunas limitaciones1–3, comunes en su mayoría a otras exploraciones:
- •
Su aprendizaje exige un proceso estructurado de formación, por lo que la interpretación es dependiente de la experiencia y formación del médico que realiza la exploración.
- •
La clínica es el factor determinante que ayuda a interpretar los datos obtenidos mediante ecografía torácica (signos poco específicos pero muy sensibles).
- •
El ecógrafo y el transductor pueden ser un reservorio de gérmenes y ser una fuente de contaminación.
- •
Es una técnica de imagen de superficie. Si el proceso patológico no alcanza la pleura, no se visualizará la patología subyacente.
La elección de la sonda de exploración ecográfica es el punto más importante para una correcta evaluación ecográfica pulmonar. Debido al conflicto existente entre resolución y penetración, es importante escoger la sonda adecuada a la patología que se desee explorar. En la valoración de patología pleural es fundamental una sonda de alta resolución con rango de emisión en torno a los 7-10MHz. Esta sonda alcanza una profundidad de exploración próxima a los 6cm de profundidad. Para el estudio de la patología pulmonar se necesita una profundidad de exploración de aproximadamente 25-30cm, que se consigue con sondas cuyo rango de frecuencia está en torno a los 3,5-5MHz1.
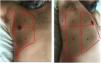
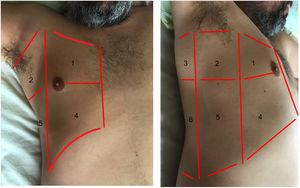
La exploración se realiza en la posición de decúbito supino, dividiendo cada hemitórax en cuadrantes. Existen varios protocolos para la exploración transtorácica con ecografía pulmonar. La mayoría de ellos identifican tres áreas de exploración1,4 (fig. 1). La exploración se inicia con el estudio de las porciones superiores del pulmón continuándose con las zonas inferiores, con los siguientes pasos:
- 1.
Exploración bidimensional del cuadrante: colocando el transductor en sentido perpendicular a las costillas y centrado en un espacio intercostal.
- 2.
Una vez obtenida la imagen bidimensional se realiza el estudio en modo M, fundamental en el diagnóstico del pulmón normal, el neumotórax y el DP.
- 3.
Estudio con Doppler color: siempre que aparezca un patrón de consolidación pulmonar subpleural, permitiendo la identificación de la circulación pulmonar.
Áreas para la exploración ecográfica del tórax.
El área anterior comprende el espacio delimitado entre el esternón (medial), la línea axilar anterior (lateral), la clavícula (craneal) y el diafragma (caudal). El área lateral comprende el espacio delimitado por la línea axilar anterior (medial), línea axilar posterior (lateral), axila (craneal) y diafragma (caudal). El área posterior comprende el espacio delimitado por la línea axilar posterior (lateral), línea paravertebral (medial), borde del trapecio (craneal) y diafragma (caudal). Cada una de ellas puede subdividirse en una zona superior y otra inferior dando como resultado 6 áreas ecográficas de exploración.
Para interpretar una ecografía torácica es fundamental conocer tres principios básicos:
- 1.
El aire no conduce los ultrasonidos.
Por tanto, si el pulmón está ventilado por debajo de la línea pleural únicamente vemos artefactos. En caso contrario, visualizamos la imagen anatómica real, como ocurre en una consolidación neumónica o un derrame con colapso pulmonar (Supl. fig. 1)5.
- 2.
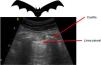
Todos los signos/artefactos parten de la línea pleural.
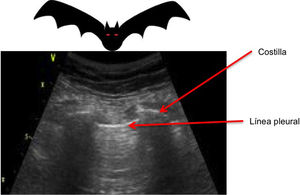
Al iniciar la interpretación de la imagen lo primero que tendremos que identificar es la línea pleural, que aparece como una estructura hiperecoica localizada entre las dos sombras acústicas que generan dos costillas consecutivas. Colocando el transductor perpendicular a las costillas obtenemos el denominado «signo del murciélago» o bat sign (fig. 2) y el deslizamiento entre la pleura visceral y parietal dará lugar a lo que se denomina sliding o «deslizamiento pleural» (vídeo 1)5,6.
- 3.
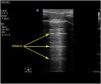
Relación aire / líquido.
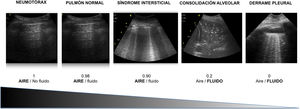
Los distintos patrones ecográficos reflejan una distinta relación aire / líquido (fig. 3)5.
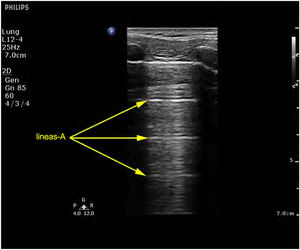
Patrones ecográficosPatrón A: se caracteriza por la presencia de sliding (vídeo 1) y el artefacto que lo define son las líneas A (fig. 4)5,7. Si exploramos en modo M, aparece el «signo de la orilla» o seashore sign (Supl. fig. 2)5.
Patrón A’: muestra ausencia de sliding y presencia de líneas A (vídeo 2). Este patrón sugiere la existencia de neumotórax. Confirma la presencia de neumotórax el hallazgo del denominado «punto pulmón» o lung point, punto en que las dos pleuras vuelven a deslizarse la una sobre la otra en un neumotórax no masivo (vídeo 3)6.
Patrón B: la ocupación del intersticio pulmonar por líquido, productos inflamatorios o material fibrótico da lugar a la existencia de dos regiones con una impedancia acústica distinta, mostrando el artefacto característico de este patrón, las líneas B (vídeo 4)6. Para poder hablar de un patrón B tenemos que evidenciar 3 o más líneas B entre dos costillas, en 2 o más regiones y separadas por 7mm o menos.
Patrón B’: similar al B, con ausencia de sliding. Aparece en patologías como el síndrome de distrés respiratorio agudo (SDRA), neumonías y fibrosis pulmonar, en las cuales se producen adherencias pleurales que condicionan una disminución o ausencia del sliding, así como engrosamiento pleural o aparición de anomalías pleurales (vídeo 5). Es característico que la afectación pulmonar sea heterogénea y que en el mismo paciente ocurran distintos patrones ecográficos8.
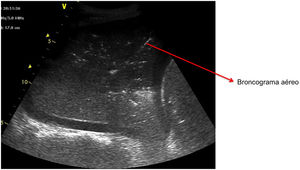
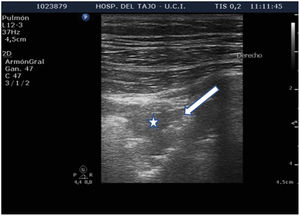
Patrón C: muestra el tissue-like sign o el shred sign. En el tissue-like sign: el parénquima pulmonar consolidado tiene una ecogenicidad similar a la del hígado. Dentro de la consolidación podemos evidenciar imágenes hiperecogénicas correspondientes a broncograma aéreo (fig. 5). El shred sign consiste en consolidaciones de menor tamaño, que aparecen como una disrupción en la línea pleural, de borde irregular o aserrado que separa la consolidación del pulmón aireado (fig. 6) (vídeo 6)5.
La relación entre el contenido de gas y de líquidos determina las imágenes que encontramos en la ecografía pulmonar (fig. 3), imágenes que se modifican rápidamente con la evolución del paciente. De este modo, el SAI explorado mediante ultrasonidos muestra diferentes patrones que apuntan hacia distintas causas.
Patrón intersticialSe caracteriza por la presencia de múltiples líneas B, de distinto grosor y de forma simétrica o asimétrica en el tórax. Puede indicar tanto edema pulmonar cardiogénico como cualquier proceso inflamatorio con infiltrado intersticio-alveolar. Para entender la causa de este patrón es necesario explorar también la función cardiaca y la precarga.
El patrón intersticial incluye los siguientes hallazgos: abundantes líneas B bilaterales o unilaterales dependiendo de la etiología, posible aparición de zonas de condensación y posible presencia de DP.
En el SAI se encuentran líneas B proporcionales al grado de afectación pulmonar. La presencia de líneas B separadas con una distancia inferior a 3mm se asocia a edema alveolar, correspondiéndose con el patrón en vidrio deslustrado que observamos en la TC6,9–11. El número de líneas B en cada área explorada se correlaciona con el contenido líquido11–16 (Supl. fig. 3).
El SAI aparece en enfermedades crónicas (fibrosis pulmonar) o agudas (edema pulmonar agudo cardiogénico, SDRA, neumonía) que cursan con depósito en el intersticio de tejido proliferativo o líquido. La aparición de abundantes líneas B en ambos hemitórax de forma difusa favorece el diagnóstico de edema pulmonar cardiogénico o SDRA; su existencia unilateral hace pensar en procesos neumónicos o inflamatorios locales (Supl. fig. 4).
Afectación pleuralEn el SAI existen con frecuencia procesos inflamatorios que afectan a la pleura. En este caso, la ecografía muestra engrosamiento e irregularidad de la línea pleural, a diferencia de una pleura muy fina y homogénea en el pulmón normal o en el caso del SAI secundario a un edema pulmonar cardiogénico (Supl. fig. 5).
Los cambios inflamatorios que afectan a la pleura y al pulmón se reflejan también en una disminución del deslizamiento pleural normal, especialmente si existe, además, una disminución de la ventilación de la zona explorada. Este hallazgo obliga a excluir la existencia de una atelectasia en la misma región. La ausencia completa del deslizamiento pleural ocurre en la atelectasia, la hepatización completa, el neumotórax y la ausencia de ventilación en el pulmón explorado en el paciente intubado.
La presencia de una línea pleural fragmentada (irregular o discontinua) explorada en modo M se muestra a favor de que el SAI se deba a una causa no cardiogénica17,18.
Condensaciones subpleuralesLas condensaciones subpleurales aparecen como zonas hipoecoicas, con bordes mal definidos, en contacto con la pleura (fig. 6), que no suelen superar 1-2cm de diámetro máximo. Se encuentran generalmente en las zonas anteriores del tórax en pacientes en decúbito supino y se corresponden con fenómenos inflamatorios pulmonares.
Patrón de consolidación alveolar o hepatización pulmonarLa hepatización pulmonar se describe como la apariencia de tejido hepático que toma el pulmón consolidado en la ecografía. Esta imagen es apreciable con mayor facilidad en las consolidaciones supradiafragmáticas (Supl. fig. 6).
NeumotóraxAnte la sospecha de neumotórax, la ecografía cobra especial relevancia en situaciones clínicas, como traumatismos torácicos, barotrauma asociado a ventilación mecánica (VM), tras la canalización de accesos venosos centrales y en pacientes que se van a trasladar mediante transporte aéreo. Estas situaciones podemos encontrarlas en un área de pacientes críticos o en un servicio de urgencias, en donde deberemos disponer de un equipo de ecografía con sonda lineal preferentemente (7,5-12MHz), para poder descartar la presencia de neumotórax.
Signos ecográficos relacionadosLos signos ecográficos a considerar para detectar o excluir la presencia de aire en la cavidad pleural son los siguientes (Supl. tabla 1)19:
- a.
Líneas A (fig. 4): indican la presencia de aire en tórax. Es un hallazgo siempre presente al diagnosticar un neumotórax.
- b.
Ausencia de lung sliding: ante un neumotórax, desaparece el deslizamiento pleural (vídeo 2) ya que el gas separa las pleuras. Este hallazgo no es patognomónico de neumotórax, encontrándose también en situaciones en las que el pulmón no esté siendo aireado (intubaciones selectivas y esofágicas o atelectasias). La presencia de deslizamiento pleural excluye el neumotórax con un valor predictivo negativo y una sensibilidad del 100%2. Cuando se combinan la presencia de líneas A y la ausencia de sliding se alcanza una sensibilidad del 100% y una especificidad del 96%2
- c.
Líneas B: la presencia de al menos una línea B descarta este diagnóstico.
- d.
Enfisema subcutáneo y líneas E: el aire que invade los tejidos blandos ante un neumotórax nos impide reconocer la línea pleural. Se identifican entonces las líneas E (vídeo 7), líneas verticales originadas en capas superficiales que borran por completo la línea pleural, dificultándonos reconocer cualquier artefacto en el espacio de Merlín.
- e.
«Punto pulmón» o lung point: signo patognomónico de neumotórax. Representa el punto de disrupción pleural, es decir, donde se separan ambas hojas pleurales (vídeo 8). En la imagen ecográfica dinámica, vemos el punto exacto donde el deslizamiento pleural conservado (en inspiración) coexiste con la ausencia de deslizamiento pleural (en espiración) y por ello, se localiza el punto exacto del desgarro pleural. La ausencia de detección del lung point no descarta completamente la presencia de neumotórax, ya que no existirá en el neumotórax masivo. Cuanto más lateral e inferior se localice este punto, mayor la extensión del neumotórax, siendo aún más mayor al ser muy posterior.
- f.
Signo del «código de barras» o de la «estratosfera»: representa en modo M la ausencia de deslizamiento pulmonar. Consiste en el hallazgo de múltiples líneas horizontales de diferente ecogenicidad (vídeo 9).
- g.
Lung pulse o «pulso pulmón»: en ausencia de deslizamiento pleural, representa la transmisión del latido cardiaco sobre el pulmón colapsado o consolidado, excluyendo el neumotórax. En modo M viene representado por las líneas T descritas por Lichtenstein (Supl. Figura 7), que son líneas verticales estrechas que parten en modo M de la línea pleural.
Ante dolor torácico o inestabilidad hemodinámica en un caso de infección por covid-19, la ecografía es una herramienta diagnóstica fundamental para el diagnóstico de embolismo pulmonar, DP o neumotórax.
Una línea pleural irregular, con consolidaciones subpleurales y abundantes líneas B de distribución parcheada, son hallazgos ecográficos típicos de la infección por covid-19. También, el «signo del haz de luz» o light beam, descrito por Volpicelli et al., presente en la fase hiperaguda de la neumonía como artefactos verticales en forma de bandas caracterizadas por ser luminosas, anchas, moverse rápidamente con el lung sliding y que presentan fenómeno de on/off durante la respiración, apareciendo y desapareciendo sobre un patrón de líneas A20.
Derrame pleural (DP)La ecografía valora el volumen (detecta milimétricas cantidades) y las características de un DP, permitiendo orientar el lugar de punción para su evacuación cuando se precisa. Para ello, la sonda ideal será de baja frecuencia como la sonda cónvex (2,5-5Hz) que, sacrificando su capacidad de resolución, permite una mayor penetración de las ondas de ultrasonido para alcanzar mayor profundidad y poder visualizar diafragma e hígado o bazo, y su relación con el parénquima pulmonar.
Con el paciente en decúbito supino posicionaremos el transductor en la línea axilar media e iremos a localizar la referencia fundamental del estudio: el diafragma. Toda imagen anecoica localizada por encima del diafragma pertenece a la cavidad torácica (líquido pleural); en cambio, si este hallazgo se encuentra por debajo del diafragma, corresponderá a la cavidad abdominal (líquido ascítico) (vídeo 10).
Signos ecográficos relacionados con el derrame pleuralEl DP es una imagen real, no un artefacto. Clásicamente se definió como una imagen anecogénica. El aspecto de estas efusiones en los pacientes críticos no siempre es así, puesto que pueden coexistir hemotórax, derrames complicados y empiemas, mostrando distintos grados de ecogenicidad.
El DP ecográficamente se define por estos signos:
- a.
Signo del límite regular o quad sign (Supl. fig. 8): es un signo estático, definido por un cuadrilátero de bordes regulares. El borde superior está formado por la pleura parietal, el inferior por la pleura visceral, y los laterales por las sombras de dos costillas consecutivas.
- b.
Signo del sinusoide (Supl. fig. 8) (vídeo 11): es un signo dinámico. Representa en modo M la forma de un sinusoide como reflejo de la variación de la distancia interpleural con los movimientos respiratorios. De esta forma, en inspiración la distancia es menor y en espiración ambas pleuras están más separadas. Cuando el líquido es más viscoso o está tabicado, este signo puede estar ausente.
Pequeños DP (casi inapreciables por la TC) se detectan por ecografía mediante el «signo del borde regular» y el «signo del sinusoide», de ahí la importancia de su valoración en un estudio de ecografía torácica.
- c.
Signo de la medusa o de la cola de sirena: cuando hay líquido intrapleural significativo, el pulmón subyacente se colapsa, mostrando en su parénquima broncograma aéreo estático. Este pulmón atelectasiado flota dentro del DP significativo, y su parte más inferior se aprecia danzando libremente dentro de este líquido recordando el movimiento de una especie de alga (vídeo 12).
Hasta el momento actual, no hay ningún signo ecográfico que con certeza apoye la diferenciación entre trasudado y exudado. Lo que sí podemos interpretar es el aspecto del líquido. Podemos encontrar DP simple (generalmente anecoico), DP complejo tabicado o no tabicado (generalmente corresponde a exudados) (vídeo 13) y líquido ecogénico difuso (que se asocia frecuentemente a la presencia de fibrina o proteínas). El signo del plancton (vídeo 14) consiste en la presencia de un punteado ecogénico flotando libremente en el DP. Aunque puede hacer sospechar que nos encontramos ante un DP complicado, no permite de forma rigurosa y certera esta diferenciación.
Cuantificación del derrame pleuralLa valoración del DP se puede realizar de forma cualitativa o cuantitativa. La estimación cualitativa permite la clasificación en derrame mínimo, moderado o severo, mientras que la aproximación cuantitativa requiere del empleo de fórmulas.
La realización de una punción torácica tiene riesgos y por ello se debiera encontrar una fórmula simple, rápida y rigurosa que oriente a esta necesidad. Por su simplicidad, una de las más utilizadas es la que propuso Balik21. Se realiza en decúbito supino, a 15° aproximadamente, y en espiración se toma en cuenta el diámetro mayor en el espacio interpleural en milímetros. Este valor obtenido se multiplica por 20 y obtenemos la cantidad de mililitros aproximados. Esta fórmula se encuentra validada en VM.
Ecografía diafragmáticaEl diafragma es el principal músculo respiratorio y consta de dos hemidiafragmas, con una doble inervación. Su contracción producirá un desplazamiento caudal que aumenta el volumen de la caja torácica y genera una presión negativa en respiración espontánea. Existen numerosas situaciones que favorecen la aparición de disfunciones en este músculo y que pueden complicar de forma considerable el destete de la VM. La disfunción diafragmática resulta de problemas anatómicos, neuromusculares o biomecánicos que alteran su contracción. Patologías torácicas y abdominales (atelectasias, cirugías, etc.) y afecciones neurológicas centrales o periféricas reducirán la movilidad del diafragma. Esta disfunción condicionará el ingreso hospitalario, el uso de VM o su prolongación y/o el fallo en la extubación.
En los últimos años se ha incrementado e implementado el uso de la ecografía diafragmática, ya que permite evaluar de forma bilateral tanto la morfología y la función diafragmática en tiempo real como el seguimiento funcional22–25.
La observación de la cinética del diafragma en los pacientes en UCI es esencial para diagnosticar de manera temprana y eficaz la parálisis diafragmática, la disfunción diafragmática postoperatoria y el momento ideal para la retirada de la VM22–29. Se han propuesto varios métodos para evaluar la función diafragmática, siendo fundamentalmente dos: el desplazamiento o excursión de la cúpula y el grosor diafragmático con la fracción de engrosamiento (vídeo 15)22,26,30,31.
Desplazamiento o excursiónLa medición del desplazamiento evalúa la capacidad del diafragma de generar cambios de volumen en la caja torácica29,31. Se coloca al paciente en decúbito supino, con el tronco elevado 30°, buscando el hemidiafragma de estudio en modo 2D. Para ello, se procede a un abordaje subcostal usando una sonda convexa de baja frecuencia a nivel de la línea medio clavicular, buscando el tercio posterior de la cúpula diafragmática en el lado derecho, a través de la ventana hepática (posicionaremos el cabezal del ecógrafo entre las líneas medio-clavicular y antero-axilar y la dirigiremos hacia medial, craneal y dorsal para que el haz alcance el tercio posterior del diafragma) (Supl. fig. 9)22,26,28,30. En el lado izquierdo se utiliza la ventana esplénica, pero la cúpula es más difícil de localizar, generalmente por interposición de vísceras abdominales (Supl. fig. 10). Para obtener la mejor imagen se colocará la sonda en la zona subcostal o intercostal inferior entre las líneas medio-axilares y anterior o a nivel medio-clavicular. La sonda se dirigirá de manera similar que en el lado derecho para visionar también el tercio posterior. Una alternativa es el abordaje lateral, colocando la sonda en posición perpendicular en los espacios intercostales inferiores a nivel de la línea medio axilar (Supl. fig. 10)22.
Tras la localización de la cúpula en modo 2D, el modo ecográfico M facilita la identificación de la porción de la cúpula con mayor movilidad, para su medición en un corte sagital. En ambos lados observaremos una línea curva e hiperecogénica que corresponderá al diafragma (Supl. fig. 11). Observaremos una curva correspondiente al ciclo respiratorio en el que la parte superior corresponde al tiempo inspiratorio (durante la inspiración, el movimiento del diafragma es caudal y la línea se acercará hacia el transductor) y la parte inferior al tiempo espiratorio (el desplazamiento es craneal y la línea se alejará del transductor) (Supl. fig. 11)30–32.
Por lo general, se interpretan ciclos respiratorios correspondientes a respiraciones lentas y profundas en pacientes en respiración espontánea aunque también se puede medir durante esfuerzos de olfateo nasal o sniffing (poco utilizado en UCI). Podemos decir de una manera práctica que se mide el desplazamiento en respiración en reposo (Supl. fig. 13) y en inspiración y espiración profundas (Supl. figs. 11 y 12).
Dibujamos una línea vertical con el primer calibrador en la base de la curva inspiratoria que se corresponde con el final de la espiración normal, y en el segundo calibrador se fija en el pico de la curva inspiratoria. Tomamos como valor la media de las mediciones de 3 o más ciclos o el valor más elevado de 5 ciclos.
Existen diversos estudios que han evaluado la excursión en voluntarios sanos, siendo sus valores los referenciados en la Supl. tabla 227,31,32.
Grosor diafragmático y fracción de engrosamiento diafragmático o thickening fractionLa medición del grosor diafragmático es otro método empleado que permite determinar la masa muscular diafragmática y valorar la fracción de engrosamiento, o thickening fraction (TF)27,30–32,38.
Para esta medición se utiliza una sonda lineal de alta frecuencia, colocada entre los últimos espacios intercostales (colocamos la sonda en la línea axilar anterior perpendicular, por lo general a los espacios intercostales 7°-8°, 8°-9°, y 9°-10° comprendiendo el transductor 2 costillas para visualizar la zona de aposición del diafragma (Supl. fig. 13) con el paciente en supino idealmente. Se ha descrito también una localización de la sonda algo más posterior, entre las líneas axilares anterior y media. De esta forma se localiza la «zona de aposición», donde el diafragma se inserta en la pared costal. El diafragma se identifica como la franja hipoecoica limitada por dos líneas hiperecoicas, que corresponden a la pleura y al peritoneo (Supl. fig. 14)22,31–35.
La medición del grosor diafragmático se realizará al final de la espiración no forzada. Se recomienda capturar al menos 3 imágenes para su cálculo. Existe una variabilidad entre las cifras de normalidad entre los diferentes estudios35. Tras el estudio de una muestra de 109 sujetos sanos, se publicaron unas cifras de normalidad de 0,16±0,04cm, con un valor medio para mujeres de 0,14±0,03cm y de 0,19±0,04cm para hombres (Supl. fig. 15)36.
A diferencia del grosor, la variación del grosor diafragmático durante la inspiración supone una aproximación indirecta a la actividad del diafragma. Las fibras musculares se acortan durante la contracción y causan el aumento en el grosor muscular. Este aumento durante la inspiración ha sido utilizado como una medida indirecta de la capacidad de contracción.
El TF es la relación entre el grosor en reposo y en máxima inspiración. Mide el porcentaje de aumento del grosor del diafragma durante la inspiración máxima respecto a su grosor al final de una espiración no forzada (Supl. fig. 16)30–32. Se recomiendan al menos 3 mediciones para el cálculo de este parámetro al final de la inspiración máxima y al final de una espiración no forzada o de reposo, y se realiza una media de ambas para el cálculo de la fracción de acortamiento (Supl. fig. 16) utilizando la formula siguiente:30–32,34–37.
TF=grosor al final de la inspiración – grosor al final de la espiración / grosor al final de la espiración.
Se acepta como normal en personas sanas un TF mayor del 20-30%. La ausencia de cambio en el grosor durante la inspiración se ha considerado un método sensible y específico para el diagnóstico de parálisis diafragmática38.
ConclusionesUna curva de aprendizaje proporcionada a su propósito, y una sensibilidad y especificidad próxima a la TC en distintas situaciones de IRA, han convertido a la ecografía toracopleural y diafragmática en una herramienta diagnóstica indispensable en el manejo del paciente crítico. Permite acotar el diagnóstico diferencial en situaciones críticas y una monitorización no invasiva inmediata y repetida de las actuaciones terapéuticas. Todo ello hace indispensable un conocimiento creciente de esta exploración y genera la necesidad de continuar evaluando sus posibilidades.
Contribución de los autoresLos autores Diego Aníbal Rodríguez Serrano, Purificación Pérez Terán, Rafael Blancas y Marta Arroyo han participado por igual en la elaboración, redacción y revisión del presente artículo.
Conflicto de interesesLos autores Diego Aníbal Rodríguez Serrano, Purificación Pérez Terán, Rafael Blancas y Marta Arroyo declaran no tener ningún conflicto de intereses para este artículo, no habiendo recibido financiación alguna en su elaboración y redacción.