Hasta el momento, los vasopresores más utilizados en los pacientes críticos son las catecolaminas exógenas, fundamentalmente la noradrenalina. Sin embargo, estas pueden tener efectos secundarios graves e incluso pueden aumentar la mortalidad, sobre todo si se administran a dosis elevadas. En los últimos años se ha propuesto la adición de la vasopresina para contrarrestar sus efectos deletéreos (decatecolaminización) con la intención de mejorar el pronóstico de estos pacientes. Actualmente, la vasopresina tiene 2 indicaciones principales: el shock séptico y el shock vasopléjico en el postoperatorio de cirugía cardíaca. En el shock séptico, la evidencia actual favorece el inicio temprano de vasopresina antes de alcanzar dosis elevadas de noradrenalina. En el postoperatorio de cirugía cardíaca se han estudiado los diferentes beneficios del uso de vasopresina, sobre todo en los pacientes con fibrilación auricular e hipertensión pulmonar. El uso correcto de la vasopresina lo hace un fármaco generalmente seguro y eficaz para estas indicaciones.
The most used vasopressors in critically ill patients are exogenous catecholamines, mainly norepinephrine. Their use can be associated with serious adverse events and even increased mortality, especially if administered at high doses. In recent years, the addition of vasopressin has been proposed to counteract the deleterious effects of high doses of catecholamines (decatecholaminization) with the intention of improving the prognosis of these patients. Currently, vasopressin has two main indications: septic shock and vasoplegic shock in the postoperative period of cardiac surgery. In septic shock, current evidence favors its early initiation before reaching high doses of norepinephrine. In the postoperative period of cardiac surgery, the different benefits of the use of vasopressin have been studied, especially in patients with atrial fibrillation and pulmonary hypertension. When used properly, vasopressin is a safe an effective drug for the indications described above.
La reanimación hemodinámica del shock precisa medidas encaminadas a incrementar el transporte de oxígeno con el fin de restablecer una adecuada perfusión tisular1,2.
En este proceso de reanimación inicial, es esencial, junto con la terapia antimicrobiana y el control del foco de infección, la administración de fluidos y fármacos vasopresores. Las catecolaminas son los vasopresores más utilizados, aunque pueden presentar efectos secundarios graves e incluso pueden aumentar la mortalidad a dosis elevadas3,4. Por otro lado, se ha evidenciado en los pacientes con shock séptico que su eficacia puede disminuir debido a alteraciones del receptor adrenérgico o por la acción de diversos mediadores inflamatorios5,6. En consecuencia, existe un interés creciente en la búsqueda de nuevos fármacos vasopresores que aporten mayor eficacia y seguridad en este proceso de reanimación hemodinámica. En los últimos años, se ha propuesto la adición de la vasopresina para disminuir la dosis de catecolaminas y mejorar el pronóstico de los pacientes críticos7.
El objetivo de este documento es proporcionar una información breve y precisa sobre 10 aspectos clave de la vasopresina que pueda ser útil en la práctica clínica de los profesionales de las unidades de críticos.
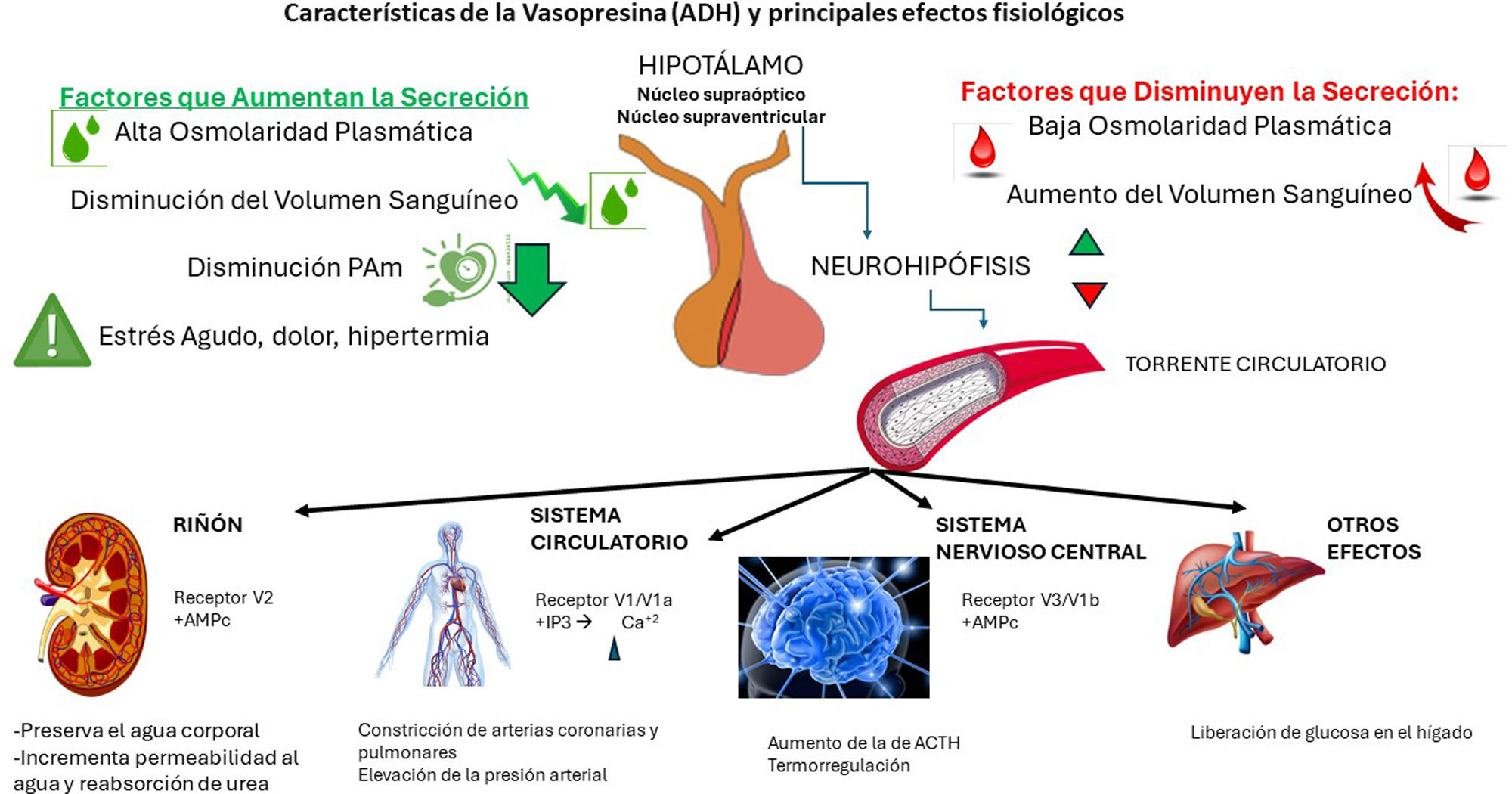
Características de la vasopresinaLa vasopresina, también conocida como hormona antidiurética (ADH), es un nonapéptido producido de forma fisiológica por el núcleo supraóptico y paraventricular del hipotálamo. A partir de un gen en el cromosoma 20 p13, se produce inicialmente como prehormona y junto a la neurofisina II (que da estabilidad a la vasopresina), en el aparato de Golgi, formando gránulos de secreción que son transportados por los axones hasta las terminales axónicas en la neurohipófisis, donde se almacenan como cuerpos de Herring. Al recibir un potencial de acción se produce una despolarización de estas terminales, con la apertura de canales de calcio y la exocitosis vesicular con la salida de vasopresina al torrente sanguíneo. Su semivida de eliminación es de aproximadamente 10min8,9.
Los estímulos que pueden activar la producción y liberación de vasopresina son fundamentalmente 3 (fig. 1). En primer lugar, el aumento de la osmolaridad del plasma, detectado por los osmorreceptores del hipotálamo anterior y pared anterior del tercer ventrículo; un cambio del 1% de la osmolaridad es suficiente para estimular la secreción. En segundo lugar, una reducción en el volumen plasmático. Los receptores de volumen, localizados en las aurículas y en la unión a venas pulmonares y aparato yuxtaglomerular, que detectan disminuciones mayores de un 5%, y envían la información a través del nervio vago. La estimulación generada por la reducción de la volemia sobre la secreción de vasopresina es mayor que la originada por el aumento de la osmolaridad. Por último, la disminución de la presión arterial media (PAM) también estimula la secreción de ADH. En este caso, los receptores (barorreceptores) se ubican en el denominado sistema de presión (receptores carotideos, aórticos y ventriculares) que se activan frente a disminuciones superiores al 10%, mandando su información a través de las ramas sensoriales de los nervios glosofaríngeo y vago.
Otros factores que pueden estimular la producción de vasopresina son el estrés, dolor, náuseas, hipertermia, agonistas colinérgicos, nicotina, angiotensina II o interleucina 1; también existen factores que pueden suprimirla, como la hipotermia, niveles altos de cortisol, agonistas alfa adrenérgicos, alcohol, opioides, o el péptido natriurético auricular, entre otros10.
Efectos de la vasopresinaLos efectos fisiológicos de la vasopresina resultan de su acción sobre 3 tipos de receptores principales:
- -
V1 o V1a: su activación media la vasoconstricción. Tras su unión, y por medio de proteínas G, estimula la fosfolipasa C, que hidroliza el fosfatidilinositol convirtiéndose en inositol trifosfato (IP3), el cual promueve la liberación de calcio intracelular y la contracción del musculo liso vascular.
- -
V2: su activación produce un efecto antidiurético. Tras unirse, por medio de proteínas G estimula al adenilato ciclasa aumentando los niveles de AMPc, activando la proteína cinasa A. Esto a su vez produce un reclutamiento de acuaporina 2 en la membrana luminal del túbulo renal, permitiendo la reabsorción de agua.
- -
V3 o V1b: son receptores pituitarios que tienen un efecto central, produciendo un aumento de la de ACTH a través de la activación de diferentes proteínas G y el incremento de AMPc8.
Además, la vasopresina puede producir efectos sobre la circulación pulmonar (vasodilatación), sobre la función renal (aumenta la perfusión renal y el filtrado glomerular al producir vasodilatación en las arteriolas aferentes glomerulares y vasoconstricción en las arteriolas eferentes mediante su acción sobre los receptores V2) y sobre la coagulación sanguínea (liberación de factor VIII y factor de von Willebrand)8.
Niveles de vasopresina en el shockAlgunos estudios han reflejado los cambios que se producen en los niveles de vasopresina en las diferentes fases del shock. Lin et al.11, demostraron que los pacientes en fases iniciales de sepsis tenían valores medios de vasopresina en sangre mayores a 10,6pg/ml, mientras que en pacientes con shock séptico establecido se reducían a 3,6pg/ml. Landry et al.12 hallaron niveles de vasopresina similares en pacientes con shock séptico (3,1pg/ml), mientras que en otros tipos de shock como el cardiogénico eran muy superiores (22,7pg/ml) y mantenidos en el tiempo. Se considera que estos niveles de vasopresina plasmática inapropiadamente bajos en pacientes con shock séptico se deben a una alteración de la secreción de vasopresina mediada por barorreceptores. La administración de vasopresina exógena proporciona la concentración plasmática esperada para el grado de hipotensión con una marcada respuesta presora en estos pacientes12. Estos resultados indican que los bajos niveles endógenos de hormonas en el shock séptico contribuyen a la vasodilatación de la sepsis.
Indicaciones de la vasopresinaActualmente la vasopresina tiene dos indicaciones principales basadas en la evidencia científica: el shock séptico y el shock vasopléjico en el postoperatorio de cirugía cardíaca13. Cabe comentar, sin embargo, que en España Empressin® solo tiene indicación por ficha técnica en el shock séptico14, mientras que Vasostrict® (nombre comercial en otros países) está indicado en el tratamiento del shock vasopléjico, independientemente de la etiología.
La vasopresina en el tratamiento del shock sépticoLos pacientes con shock séptico presentan un perfil hemodinámico clásico de vasoplejía con aumento de la permeabilidad vascular, hipovolemia y alteraciones de la microcirculación15. Además, se ha evidenciado en numerosos estudios clínicos y experimentales, la presencia de disfunción miocárdica sistólica y diastólica biventricular transitoria16,17. Esta disfunción puede estar enmascarada y no detectarse en un estudio convencional debido a la disminución de la poscarga secundaria a la vasoplejía, que permite mantener una fracción de eyección normal y un gasto cardíaco normal o elevado (si se ha realizado una adecuada reposición de volumen)17. Esta disfunción oculta se podría detectar mediante otros métodos ecocardiográficos más avanzados como el Doppler tisular o el Strain18.
El objetivo final del proceso de reanimación hemodinámica en cualquier tipo de shock es la restauración del aporte de oxígeno a los tejidos de acuerdo con sus necesidades metabólicas. Esta reanimación requiere alcanzar una PAM mínima y adecuar el transporte de oxígeno para lograr la normalización de parámetros metabólicos como el lactato plasmático, la saturación venosa, tanto central (SvcO2) como mixta (SvO2), y parámetros de perfusión regional como el tiempo de relleno capilar (TRC)1,2.
En este proceso de reanimación, la administración de líquidos y de fármacos vasopresores constituye el pilar fundamental del tratamiento. Hasta el momento, los vasopresores más utilizados son las catecolaminas exógenas, fundamentalmente la noradrenalina. Estos fármacos son útiles en la estabilización hemodinámica, pero pueden tener efectos secundarios graves e incluso se han asociado a un aumento de la mortalidad, sobre todo si se administran a dosis elevadas19,20.
De hecho, en el shock séptico ya existen concentraciones elevadas de catecolaminas endógenas (adrenalina y noradrenalina)21, que son necesarias para contrarrestar los efectos cardiovasculares de la sepsis, como la vasoplejía y la depresión miocárdica. Estos fenómenos son perjudiciales cuando se presentan de forma acentuada y prolongada22. Los niveles suprafisiológicos de catecolaminas endógenas o exógenas, se asocian a una mala adaptación en estados de estrés fisiológico y a un incremento de gasto energético, reducción de la perfusión esplácnica e inmunogenicidad intestinal, disfunción hepática, inmunosupresión y aumento de la mortalidad23.
Además de sus efectos secundarios, otro inconveniente de los fármacos catecolamínicos en el shock es que su acción en los pacientes con shock séptico puede verse reducida debido a una alteración y regulación a la baja (término en inglés downregulation) de los receptores alfa y betaadrenérgicos originado por la acción de mediadores inflamatorios y el tratamiento con dosis elevadas de catecolaminas4,5. La aparición de este fenómeno puede asociarse a un estado de shock refractario a catecolaminas, en el que el aumento de fármacos vasopresores no restaura una adecuada perfusión tisular, persistiendo una hipotensión arterial e hipoperfusión en ausencia de hipovolemia.
Recientemente se han propuesto estrategias que permitan reducir la cantidad de catecolaminas para contrarrestar sus efectos deletéreos, lo que se conoce como decatecolaminización24. La posibilidad de añadir fármacos vasoconstrictores no adrenérgicos como la vasopresina abre la discusión de cómo definir shock séptico refractario a noradrenalina. Dosis superiores a 0,5μg/kg/min de noradrenalina (calculado por peso real en IMC<30 o por peso ajustado a talla en IMC>30)25 se asocian a mayores efectos adversos sin añadir beneficio clínico, por lo que este valor se ha sugerido como dosis máxima o como punto de corte para definir shock refractario a fármacos adrenérgicos26. Otras estrategias de decatecolaminización son la adición de corticosteroides para mejorar la respuesta cardíaca y vasopresora, o el uso de analgesia y sedación para contrarrestan la liberación de catecolaminas endógenas. De hecho, los corticosteroides restablecen la sensibilidad vascular de los receptores agonista alfa en cuestión de minutos u horas mediante efectos no genómicos, con el consiguiente aumento de la PAM y de la resistencia vascular sistémica27. Las últimas recomendaciones de la Surviving Sepsis Campaign sugieren administrar hidrocortisona 50mg por vía intravenosa cada 6h o en infusión continua cuando se alcance una dosis de noradrenalina ≥0,25μg/kg/min13.
Las recomendaciones de la Surviving Sepsis Campaign de 2021 sugieren añadir vasopresina en pacientes adultos con shock séptico y valores de PAM inadecuados a pesar de dosis de noradrenalina en el rango de 0,25-0,5μg/kg/min en lugar de seguir aumentando la dosis de noradrenalina13.
Esta recomendación de nivel débil y la calidad de la evidencia moderada se basa fundamentalmente en los estudios clínicos VASST28 y VANISH29, así como en un metaanálisis interno de las guías en que se analizan 10 ensayos clínicos controlados. El estudio VASST analizó los efectos de vasopresina a dosis bajas (0,01-0,03U/min) como ahorrador de noradrenalina, y por lo tanto no hay que entenderlo como un estudio de valoración de vasopresina en pacientes con shock refractario sin respuesta a catecolaminas. Este estudio no mostró mejoría significativa de la mortalidad a los 28 días. Sin embargo, en un análisis de subgrupos se encontró que los pacientes con shock menos grave que requerían noradrenalina <15μg/min tenían menor mortalidad cuando se les asociaba vasopresina (26,5 vs. 35,7%; p=0,05). De este estudio se pudo inferir que la adición de dosis bajas de vasopresina en pacientes con shock séptico permite un rápido descenso de la dosis de noradrenalina administrada y que puede reducir la mortalidad en los pacientes con un perfil de menor gravedad. Por otro lado, el estudio VANISH fue diseñado para valorar si el uso precoz de vasopresina con dosis de hasta 0,06U/min podría mejorar el pronóstico renal en comparación con noradrenalina en pacientes con shock séptico, además de intentar valorar el rol de la hidrocortisona. Para ello se aleatorizaron pacientes con shock séptico a recibir vasopresina o noradrenalina, en un diseño factorial 2×2, analizando los días libres de lesión renal aguda. Aunque el uso precoz de vasopresina comparado con noradrenalina no mejoró significativamente el número de días libres de lesión renal, el grupo que recibió vasopresina presentó menor necesidad de iniciar terapia de reemplazo renal. Finalmente, en el metaanálisis interno de la Survivng Sepsis Campaing, en el que se analizan 10 ensayos clínicos aleatorizados, encontró una mejoría de la mortalidad con la utilización adyuvante de vasopresina (RR: 0,91; IC 95%: 0,83-0,99)13.
La dosis óptima de vasopresina varía según la indicación y la respuesta al tratamiento. Siguiendo el esquema del estudio VASST, la dosis inicial recomendada es de 0,01U/min, que se puede ir incrementando hasta llegar a una dosis de 0,03U/min, incluso hasta 0,06 empleada en el estudio VANISH. Su asociación a hidrocortisona puede mejorar los resultados30,31.
Hasta la fecha, no existen recomendaciones claras acerca del momento más adecuado para iniciar la vasopresina. Si bien la Surviving Sepsis Campaign13 recomienda su inicio cuando la dosis de noradrenalina es de 0,25μg/kg/min, la tendencia actual es iniciarla de forma mucho más precoz, especialmente en aquellos pacientes que precisan un rápido incremento de la dosis de noradrenalina32. Por otra parte, estudios recientes sugieren que la mortalidad puede ser menor con el inicio de vasopresina con dosis equivalente de noradrenalina de 10μg/min o con concentraciones de lactato inferiores a 2,3mmol/l33.
Vasopresina en el postoperatorio de cirugía cardíacaEsta indicación se deriva de los resultados del ensayo clínico aleatorizado (ECA) multicéntrico, y doble ciego, VANCS34. El objetivo principal de este estudio fue la reducción en las complicaciones graves, incluida la mortalidad, a los 30 días de la cirugía cardíaca. Trescientos pacientes que presentaron shock por vasoplejía (PAM<65mmHg después de una correcta reanimación con cristaloides (2,4l de media) y un Índice cardíaco >2,2l/m2) en el postoperatorio de cirugía cardíaca fueron aleatorizados a recibir noradrenalina (10-60μg/min) o vasopresina (0,01-0,06UI/min). El 49% de los pacientes tratados con noradrenalina presentaron complicaciones graves mientras que en el grupo vasopresina un 32,2% (OR ajustada: 0,52 [0,36-0,75]; p=0,0005), fundamentalmente porque el grupo de vasopresina tuvo menor lesión renal aguda (OR: ajustada: 0,26 [0,15-0,46]; p<0,0001). También los pacientes tratados con vasopresina presentaban menor incidencia de fibrilación auricular (OR ajustada: 0,37 [0,22-0,64]; p=0,0004), aunque no hubo diferencias significativas entre los 2 grupos en cuanto a efectos adversos isquémicos. Un metaanálisis posterior de 8 estudios obtuvo los mismos resultados35.
A raíz de estos resultados, un documento de consenso posterior sobre el tratamiento vasopresor en cirugía cardíaca36 recomienda el uso de la vasopresina en la vasoplejía en estos pacientes, especialmente en presencia de fibrilación auricular (recomendación fuerte, nivel de evidencia moderado). También la recomienda en caso de hipertensión pulmonar (recomendación débil, nivel de evidencia muy bajo), basándose en resultados experimentales que demuestran un efecto vasodilatador sobre la arteria pulmonar a dosis bajas (0,01-0,03UI/min)37,38.
Vasopresina en reanimación cardiopulmonarLa vasopresina asociada a metilprednisolona podría tener beneficios en la reanimación cardiopulmonar (RCP) intrahospitalaria, ya que se ha demostrado que durante y después de la RCP los niveles de cortisol son bajos35. Tres ensayos clínicos que aleatorizaron pacientes en paro cardiorrespiratorio intrahospitalario39–41 y un metaanálisis posterior42, han demostrado que los pacientes aleatorizados a recibir, después de la primera adrenalina, 20UI de vasopresina con 40mg de metilprednisolona, presentaron un mayor porcentaje de recuperación de la circulación espontánea y menor incidencia posterior de lesión renal aguda que los pacientes que recibían placebo. Un subanálisis posterior del ensayo clínico de Andersen et al.37 sobre la recuperación funcional a los 6 meses y al año, valorada por la escala Cerebral Perfomance Category (CPC)43, no objetivó mejoría en la misma, pero con una potencia estadística muy baja. Las últimas guías europeas de reanimación cardiopulmonar (2021), no aconsejan el uso de vasopresina en la RCP44. Los resultados de los ECA realizados al respecto se publicaron posteriormente a estas guías. En espera de la publicación actualizada de las guías europeas de resucitación y, con la evidencia que aporta el ECA de Anderson et al.37 y el metaanálisis de Saghafi et al.38, se podría recomendar la asociación de 20UI de vasopresina y 40mg de metilprednisolona después de la primera adrenalina administrada durante la RCP intrahospitalaria, con el fin de conseguir que una mayor proporción de pacientes recuperen la circulación espontánea. De cara a evaluar su efecto sobre CPC, se deberían realizar nuevos ECA con suficiente potencia estadística.
Monitorización hemodinámica durante el uso de vasopresinaEn los pacientes que presentan shock séptico, la monitorización hemodinámica requiere una adaptación individualizada basada en la fase de shock en la que se encuentre el paciente, la respuesta al tratamiento y las características específicas de cada individuo.
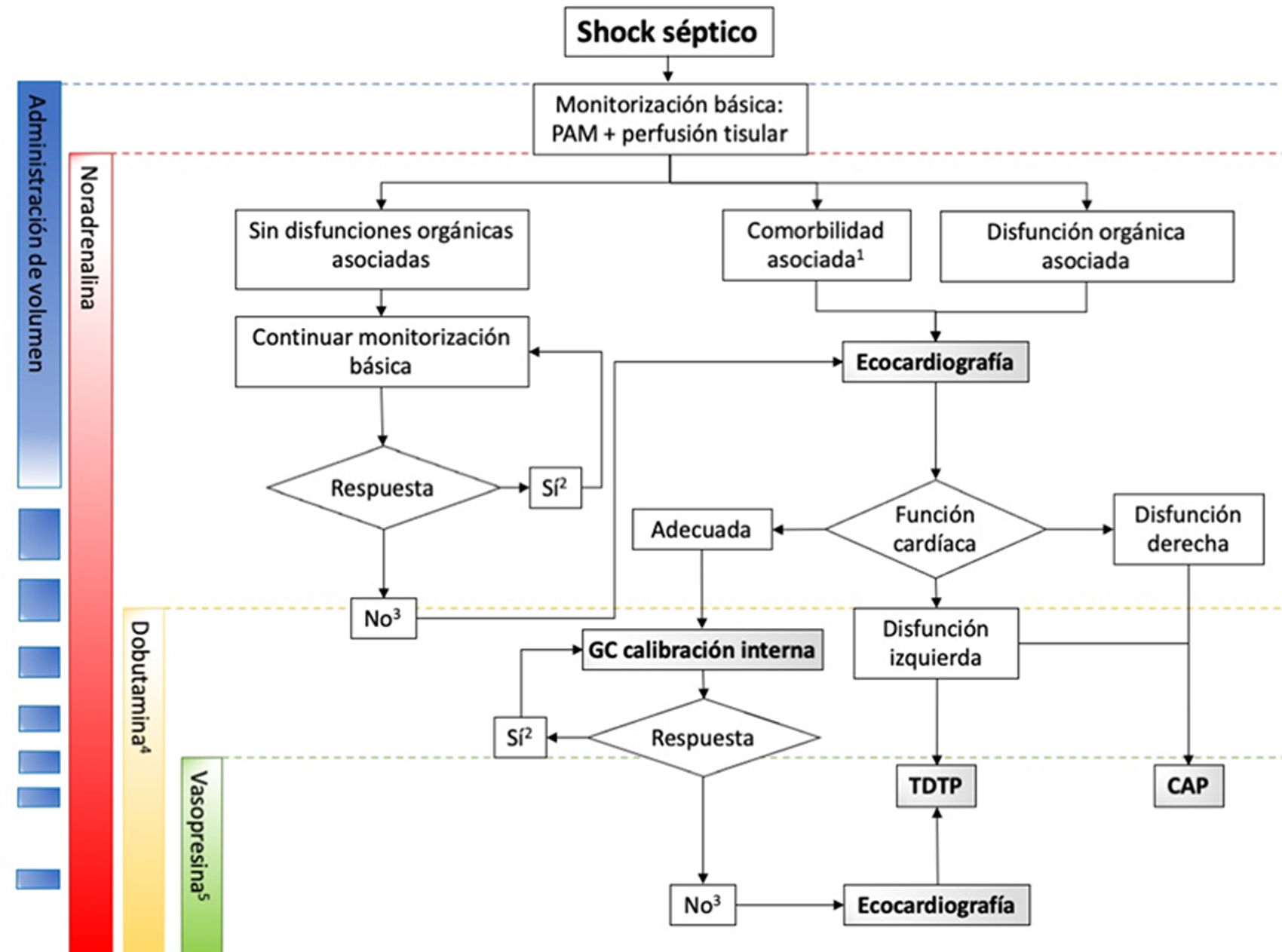
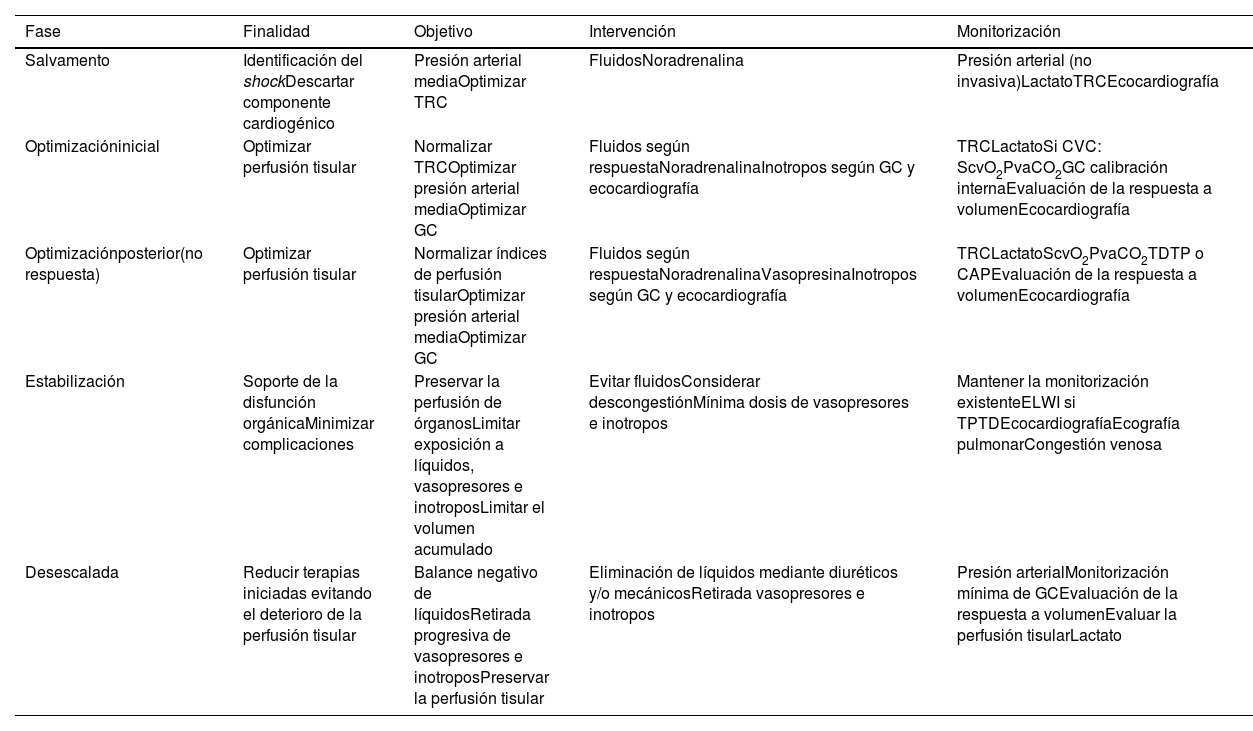
Recientemente, se han identificado 4 fases del shock séptico: Salvamento, Optimización, Estabilización y Desescalada45. Cada fase demanda distintas técnicas de monitorización y objetivos para la reanimación (tabla 1 y fig. 2).
Fases del shock séptico mostrando los objetivos y la monitorización propuesta para cada una de ellas
| Fase | Finalidad | Objetivo | Intervención | Monitorización |
|---|---|---|---|---|
| Salvamento | Identificación del shockDescartar componente cardiogénico | Presión arterial mediaOptimizar TRC | FluidosNoradrenalina | Presión arterial (no invasiva)LactatoTRCEcocardiografía |
| Optimizacióninicial | Optimizar perfusión tisular | Normalizar TRCOptimizar presión arterial mediaOptimizar GC | Fluidos según respuestaNoradrenalinaInotropos según GC y ecocardiografía | TRCLactatoSi CVC: ScvO2PvaCO2GC calibración internaEvaluación de la respuesta a volumenEcocardiografía |
| Optimizaciónposterior(no respuesta) | Optimizar perfusión tisular | Normalizar índices de perfusión tisularOptimizar presión arterial mediaOptimizar GC | Fluidos según respuestaNoradrenalinaVasopresinaInotropos según GC y ecocardiografía | TRCLactatoScvO2PvaCO2TDTP o CAPEvaluación de la respuesta a volumenEcocardiografía |
| Estabilización | Soporte de la disfunción orgánicaMinimizar complicaciones | Preservar la perfusión de órganosLimitar exposición a líquidos, vasopresores e inotroposLimitar el volumen acumulado | Evitar fluidosConsiderar descongestiónMínima dosis de vasopresores e inotropos | Mantener la monitorización existenteELWI si TPTDEcocardiografíaEcografía pulmonarCongestión venosa |
| Desescalada | Reducir terapias iniciadas evitando el deterioro de la perfusión tisular | Balance negativo de líquidosRetirada progresiva de vasopresores e inotroposPreservar la perfusión tisular | Eliminación de líquidos mediante diuréticos y/o mecánicosRetirada vasopresores e inotropos | Presión arterialMonitorización mínima de GCEvaluación de la respuesta a volumenEvaluar la perfusión tisularLactato |
CAP: catéter de arteria pulmonar; CVC: catéter venoso central; ELWI: índice de agua pulmonar extravascular; GC: gasto cardíaco; PvaCO2: diferencia arteriovenosa de dióxido de carbono; ScvO2: saturación venosa central de oxígeno; TDTP: termodilución transpulmonar; TRC: tiempo de relleno capilar.
Secuencia de monitorización en función de la respuesta a los tratamientos hemodinámicos. 1: Comorbilidad cardiovascular asociada; 2: PAM ≥ objetivo y sin síntomas ni signos de hipoperfusión; 3: PAM ≤ objetivo y/o síntomas o signos de hipoperfusión; 4: Si se objetiva disfunción sistólica del ventrículo izquierdo; 5: Habiendo descartado la presencia de disfunción cardíaca. CAP: catéter de arteria pulmonar; GC: gasto cardíaco; PAM: presión arterial media; TDTP: termodilución transpulmonar.
Durante esta etapa, se debe detectar el shock séptico y aplicar un tratamiento inicial que incluya reposición de volumen y noradrenalina. Se debería emplear una monitorización básica mediante la medición de la presión arterial, la frecuencia cardíaca y la exploración física15.
Es esencial identificar tempranamente los signos clínicos de hipoperfusión, ya que la hipotensión no es siempre un indicador definitivo del shock, debido a la vasoconstricción compensatoria que puede mantener la presión arterial, aun cuando la perfusión y oxigenación de los tejidos estén significativamente reducidas15.
La medición de la concentración de lactato en sangre es útil para evaluar el deterioro de la perfusión tisular. Basado en estudios que correlacionan la dinámica del lactato y la mortalidad, las guías de la Surviving Sepsis Campaign recomiendan monitorizar la reanimación hemodinámica mediante la medición repetida de los niveles de lactato en sangre cada 2 a 4h hasta que se normalicen13. Recientemente se ha demostrado que una estrategia de resucitación temprana guiada por el TRC produce resultados superiores a la estrategia guiada por lactato46. El TRC se ha correlacionado con la mortalidad y puede ser útil para monitorizar la respuesta al tratamiento con fluidos, siendo un objetivo de reanimación alcanzar valores de TRC inferiores a 3s47. No obstante, el TRC no identifica la causa de la hipoperfusión tisular.
Durante esta fase, en caso de falta de respuesta al tratamiento inicial, o en caso de historia previa de disfunción cardíaca, las guías recomiendan la realización de una ecocardiográfica a pie de cama15, ya que esta técnica no invasiva permite estimar el gasto cardíaco e identificar la causa de bajo gasto48.
Fase de optimizaciónEn esta fase, el objetivo es optimizar la perfusión tisular ajustando la presión de perfusión y el gasto cardíaco. Para aquellos pacientes que no responden al tratamiento inicial y continúan con hipoperfusión tisular, se debe considerar una monitorización hemodinámica avanzada para evaluar la respuesta al volumen, la función cardiovascular y el gasto cardíaco15. Esto permitirá ajustar la precarga en pacientes que respondan al volumen, la poscarga añadiendo vasopresina al tratamiento con noradrenalina o la contractilidad mediante el uso de inotrópicos.
Existen diferentes herramientas fiables para medir el gasto cardíaco, y la elección de la técnica debe basarse en variables específicas del paciente. En pacientes sin comorbilidades y con mínima disfunción orgánica, se pueden utilizar dispositivos de monitorización del gasto cardíaco no calibrados o calibrados internamente49. Por otro lado, los pacientes con comorbilidades asociadas (p. ej., enfermedad cardíaca) o disfunción orgánica grave (especialmente síndrome de distrés respiratorio agudo) pueden beneficiarse de una monitorización multimodal mediante técnicas de termodilución transpulmonar (TDTP) o, en algunos casos, mediante el uso de un catéter de arteria pulmonar (CAP) en combinación con ecocardiografía seriada15.
La TDTP combina una medición calibrada del gasto cardíaco, una estimación precisa del volumen sistólico latido a latido, indicadores estáticos de precarga, índices de función cardíaca y estimaciones del agua pulmonar extravascular y permeabilidad vascular. De esta manera, la TDTP no solo es útil para predecir y monitorizar la respuesta al volumen, sino que también proporciona información sobre los riesgos asociados con su administración50.
El CAP, mediante la medición del gasto cardíaco, las presiones pulmonares y la saturación venosa mixta de oxígeno, permite evaluar la adecuación del gasto cardíaco y sus determinantes. Aunque no predice la capacidad de respuesta al volumen, el CAP es útil para evaluar la eficacia y la tolerancia a los fluidos. La medición simultánea de la presión venosa central y la presión de la arteria pulmonar hace que el CAP sea ideal para monitorizar pacientes con disfunción cardíaca derecha51.
Fases de estabilización y desescaladaDurante estas etapas, el objetivo del soporte hemodinámico cambia de optimizar la perfusión tisular a prevenir complicaciones asociadas, minimizando la exposición al volumen, los vasopresores y los inotrópicos52.
En esta fase, es posible que persista la disfunción cardíaca y aparezcan efectos secundarios relacionados con la sobrecarga de volumen inducida por la reanimación inicial. Por lo tanto, los sistemas de monitorización implementados anteriormente pueden seguir utilizándose. La monitorización del agua extravascular pulmonar, la ecografía pulmonar y la evaluación de los patrones de flujo venoso portal, renal y hepático mediante ecografía pueden ayudar a identificar signos de congestión e indicar la necesidad de retirar volumen53.
Por otro lado, para la desescalada de los vasopresores, puede ser útil evaluar la elastancia arterial dinámica, que se calcula mediante la relación entre la variación de la presión del pulso y la variación del volumen sistólico. Esta evaluación puede predecir la aparición de hipotensión e identificar los candidatos a la reducción de los vasopresores54.
Seguridad en la administración de vasopresina en el paciente críticoDe los vasopresores utilizados en la práctica clínica habitual, la vasopresina es el que posee mayor capacidad vasoconstrictora en modelos experimentales con animales55.
Esta potente acción vasoconstrictora es la que se ha relacionado con los eventos adversos más graves en el paciente crítico y ha cuestionado su uso en este tipo de pacientes durante mucho tiempo.
El uso de vasopresina a dosis altas (entendida como dosis superiores a 0,04-0,05UI/min) se ha relacionado con deterioro del gasto cardíaco en el paciente séptico y complicaciones isquémicas importantes como hipoperfusión hepática, mesentérica, isquemia digital o isquemia lingual56–58, especialmente en pacientes obesos o con enfermedad aterosclerótica basal56.
A pesar de estas complicaciones graves, la administración de este fármaco a dosis bajas (de 0,01 a 0,04UI/min) ha demostrado, como se ha comentado con anterioridad, ser eficaz en el tratamiento del shock séptico o del shock distributivo en el postoperatorio de cirugía cardíaca con hipotensión arterial persistente a pesar de noradrenalina28,59,60 sin relacionarse con un aumento en la incidencia de complicaciones cardiovasculares (p. ej., deterioro del gasto cardíaco o arritmias)59–61 ni isquémicas a ningún nivel (territorio esplénico, coronario, digital o cerebrovascular)28,34,60.
Por tanto, podríamos afirmar que la administración de vasopresina a dosis bajas en pacientes con shock séptico o con shock distributivo poscirugía cardíaca con hipotensión arterial a pesar de noradrenalina a 0,2μg/kg/min y una adecuada reanimación con cristaloides, es segura y eficaz. En aquellos pacientes obesos, con enfermedad aterosclerótica previa o en pacientes de edad avanzada con factores de riesgo cardiovascular, el uso de vasopresina deberá acompañarse de una monitorización más estrecha para detectar precozmente posibles eventos adversos de tipo isquémico.
Retirada del soporte vasopresor o weaning, de la vasopresinaSi bien en la actualidad existen recomendaciones respecto al inicio de la vasopresina como segundo vasopresor en el shock séptico, no se ha establecido ninguna recomendación sobre cómo realizar su descontinuación o retirada13.
Durante la fase de recuperación del shock se produce la recuperación del tono vascular y los vasopresores son gradualmente retirados. Sin embargo, incluso en esta fase, la discontinuación de los vasopresores puede producir hipotensión significativa con riesgo de nuevos fallos orgánicos.
Si bien la literatura es escasa al respecto, la mayoría de los estudios parecen favorecer la retirada inicial de noradrenalina antes que la vasopresina, dado que la retirada de la vasopresina primero suele asociarse a una mayor frecuencia de hipotensión. Bauer et al.62 encontraron que aquellos pacientes en los cuales se retiró primero la vasopresina desarrollaron una incidencia significativamente mayor de hipotensión durante las primeras 24h (55,6 vs. 15,6%; p<0,008), con un riesgo hasta 5 veces mayor (RR: 5,9; IC 95%: 1,7-21). De manera similar, otros autores encontraron que la retirada de la vasopresina se asoció al desarrollo de hipotensión clínicamente significativa, sobre todo cuando se retiró en las primeras 48h y que dicha hipotensión parece persistir durante las primeras 24h tras la retirada63,64. En ningún caso se encontraron diferencias significativas en términos de mortalidad o días de estancia en UCI. Dos metaanálisis también confirman estos resultados65,66.
Aunque estos estudios presentaron limitaciones relacionadas a su carácter retrospectivo, en la actualidad hay un único estudio aleatorizado que parece favorecer la retirada inicial de la vasopresina al evidenciar una mayor incidencia de hipotensión tras retirar primero la noradrenalina (68,4 vs. 22,5%; p<0,005)67. Sin embargo, en este estudio solo se evaluó la primera hora tras retirada del vasopresor y no se pudo confirmar la persistencia de la hipotensión más allá de este período. Por lo tanto, estos hallazgos pueden estar más relacionados con la semivida de los fármacos y no con el efecto generado tras su retirada. Este mismo estudio evidenció que los niveles de copeptina eran significativamente menores en aquellos pacientes que desarrollaron hipotensión tras retirada de la vasopresina, sugiriendo la utilidad de este marcador para evaluar la deficiencia de vasopresina. Este estudio tampoco demostró diferencias significativas en la mortalidad o estancia hospitalaria.
Por tanto, la literatura actual parece favorecer la retirada inicial de la noradrenalina antes que la vasopresina para evitar la hipotensión reactiva, aunque el orden de retirada de uno u otro vasopresor no parece relacionarse con un aumento de la mortalidad ni mayor estancia hospitalaria.
La tabla 2 recoge las principales consideraciones prácticas sobre el uso de la vasopresina en el paciente crítico.
Principales consideraciones prácticas sobre el uso de la vasopresina en el paciente crítico
| Pacientes que se benefician de la administración de vasopresina: |
| 1. Pacientes en situación de shock séptico, en los que tras la adecuada resucitación con cristaloides y con dosis de noradrenalina >0,25μg/kg/min, persisten con PAM<65mmHg (especialmente a expensas de una PAD baja). |
| 2. Pacientes en situación de shock distributivo poscirugía cardíaca, en los que tras la adecuada resucitación con volumen y con dosis de noradrenalina >0,25μg/kg/min, presentan PAM sostenidamente <65mmHg (especialmente a expensas de una PAD baja). |
| Dosis iniciales y progresión de la vasopresina: |
| 1. Se recomienda iniciar la perfusión intravenosa de vasopresina a dosis de 0,01UI/min e incrementar a intervalos de 0,005UI/min cada 10-15min hasta obtener respuesta o hasta alcanzar una dosis de 0,03UI/min. Dosis superiores a 0,04UI/min hasta 0,06UI/min requieren una monitorización cuidadosa de posibles efectos secundarios. |
| 2. Es recomendable una monitorización hemodinámica avanzada que incluya la función cardíaca. |
| Retirada de vasopresores: |
| 1. Una vez alcanzada la PAM objetivo, se recomienda iniciar la retirada de vasopresores por la noradrenalina. |
| 2. Una vez retirada la noradrenalina, se aconseja iniciar la desescalada de la vasopresina. |
| 3. En caso de reaparición de hipotensión arterial tras la retirada de vasopresina, se recomienda reiniciar la noradrenalina. |
PAD: presión arterial diastólica; PAM: presión arterial media.
La vasopresina es un fármaco que se ha estudiado como alternativa al uso de dosis altas de vasopresores catecolaminérgicos. Diferentes estudios han demostrado que, a dosis bajas, es un fármaco eficaz para mantener los objetivos de PAM en los pacientes con shock séptico y shock vasopléjico en el postoperatorio de cirugía cardíaca. La práctica médica actual debe considerar la aplicación de la evidencia favorable sobre el uso de la vasopresina en pacientes críticos y evitar el uso de dosis altas de vasopresores catecolaminérgicos que se asocian a efectos deletéreos y peor pronóstico. Su uso debe ir acompañado de la monitorización hemodinámica necesaria para optimizar el tratamiento. Son necesarios más estudios para ampliar las indicaciones en determinados grupos de pacientes, y para optimizar el manejo del uso combinado de vasopresores cuando se añade vasopresina al tratamiento de los pacientes.
FinanciaciónAOP Health ha facilitado la asistencia a una reunión en presencia física de los autores. El resto del trabajo se ha realizado por correo electrónico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Erika P. Plata-Menchaca.