Realizar una revisión sistemática de la literatura para evaluar la capacidad predictiva de las escalas utilizadas en la predicción de mortalidad en pacientes con cáncer admitidos en unidades de cuidados intensivos.
DiseñoSe realizó una revisión sistemática cualitativa de la literatura, con un algoritmo de búsqueda en octubre de 2022, ajustado a las bases de datos virtuales: PubMed, Scopus, Biblioteca virtual en salud (BVS) y Medrxiv. El riesgo de sesgos se evaluó con la escala QUADAS-2.
ÁmbitoUnidades de cuidados intensivos con admisión de pacientes oncológicos.
ParticipantesEstudios que incluyeron pacientes adultos con diagnóstico activo de cáncer, que fueron admitidos en unidades de cuidados intensivos.
IntervencionesEstudio integrativo sin intervenciones.
Variables de interés principalesPredicción de mortalidad, mortalidad estandarizada, discriminación y calibración.
ResultadosSe analizaron 7 modelos de predicción de riesgo de mortalidad en pacientes con cáncer en unidad de cuidados intensivos. La mayoría de los modelos (APACHE II, APACHE IV, SOFA, SAPS-II, SAPS-III y MPM II) subestimaron la mortalidad, mientras que el ICMM la sobrestimó. El APACHE II tuvo el valor de la razón estandarizada de mortalidad (SMR, standardized mortality ratio) más cercano a 1, lo que indica una mejor capacidad pronóstica en comparación con los demás modelos.
ConclusionesLa predicción de mortalidad en pacientes con cáncer en la unidad de cuidados intensivos es compleja. No existe un modelo que sea claramente superior a los demás. Las herramientas disponibles presentan limitaciones en cuanto a su exactitud. Se recomienda tener en cuenta la familiaridad del equipo médico y las limitaciones intrínsecas de cada modelo para tomar decisiones informadas en la evidencia. Es necesario desarrollar nuevos instrumentos o realizar estudios de validación a gran escala para mejorar la predicción de la mortalidad en este grupo de pacientes.
To evaluate the predictive ability of mortality prediction scales in cancer patients admitted to intensive care units.
DesignA systematic review of the literature was conducted using a search algorithm in October 2022. The following databases were searched: PubMed, Scopus, Virtual Health Library (BVS), and Medrxiv. The risk of bias was assessed using the QUADAS-2 scale.
SettingIntensive care units admitting cancer patients.
ParticipantsStudies that included adult patients with an active cancer diagnosis who were admitted to the intensive care unit.
InterventionsIntegrative study without interventions.
Main variables of interestMortality prediction, standardized mortality, discrimination, and calibration.
ResultsSeven mortality risk prediction models were analyzed in cancer patients in the ICU. Most models (APACHE II, APACHE IV, SOFA, SAPS-II, SAPS-III, and MPM II) underestimated mortality, while the ICMM overestimated it. The APACHE II had the SMR (Standardized Mortality Ratio) value closest to 1, suggesting a better prognostic ability compared to the other models.
ConclusionsPredicting mortality in intensive care unit cancer patients remains an intricate challenge due to the lack of a definitive superior model and the inherent limitations of available prediction tools. For evidence-based informed clinical decision-making, it is crucial to consider the healthcare team's familiarity with each tool and its inherent limitations. Developing novel instruments or conducting large-scale validation studies is essential to enhance prediction accuracy and optimize patient care in this population.
El cáncer es uno de los principales contribuyentes de la carga de morbimortalidad en todo el mundo y se estima que la carga global seguirá creciendo durante las próximas décadas1. En el año 2019 se presentaron 23,6 millones de casos incidentes de cáncer a nivel mundial y 10 millones de muertes por esta causa2. Aunque los avances en el tratamiento han mejorado la supervivencia, también han aumentado las complicaciones y la necesidad de ingreso en unidad de cuidados intensivos (UCI)3. La admisión de los pacientes con cáncer a UCI ha sido controvertida, debido a la percepción de un pronóstico desfavorable y la competencia por recursos limitados3. Como consecuencia de lo anterior, se evidencia que actualmente existe poca literatura sobre las características de los pacientes que son admitidos en UCI, estado al ingreso, evolución durante la estancia y desenlaces críticos como la mortalidad.
Diferentes estudios han intentado identificar la mejor escala pronóstica para predecir mortalidad en pacientes con cáncer en la UCI, y, por ende, facilitar su admisión y el esfuerzo terapéutico en esta población. Varios han sido validados en la población general, pero en los pacientes con cáncer ninguno ha sido lo suficientemente preciso o particularmente superior4–7. Investigar la validez de las escalas de predicción de mortalidad en pacientes que ingresan en UCI por un proceso agudo relacionado con la enfermedad neoplásica o con el tratamiento recibido podría favorecer la toma de decisiones clínicas, incluyendo la admisión a la UCI, guiar el esfuerzo terapéutico, y la adecuación de los recursos disponibles. El objetivo de esta revisión es evaluar el desempeño pronóstico de escalas validadas a la fecha de la revisión que determinan el riesgo de mortalidad (APACHE, SAPS, SOFA, MPM, ICMM) en pacientes con cáncer que requieren manejo en la UCI.
MetodologíaPregunta de investigaciónUtilizando la estrategia PIRD (tabla 1), se construyó la pregunta: ¿Cuál es la calibración y capacidad de discriminación de las escalas pronósticas de mortalidad en pacientes oncológicos en la UCI?
Pregunta de investigación modelo PIRD
| P (Población) | Pacientes con diagnóstico de cáncer que ingresen a la UCI |
| I (Prueba índice) | Escalas pronósticas (SOFA, APACHE, SAPS, MPM, ICMM) |
| R (Prueba de referencia) | Mortalidad hospitalaria observada |
| D (Diagnóstico de interés) | Discriminación y calibración de las escalas pronosticas de mortalidad |
Se seleccionaron estudios con pacientes mayores de 18 años con diagnóstico activo de cáncer sin discriminar estadio, que fueron admitidos a UCI, excluyendo pacientes embarazadas. En cuanto a los tipos de estudios, se incluyeron cohortes retrospectivas y prospectivas. No hubo restricción de idioma. Pero se excluyeron aquellos que no contenían información sobre el desempeño de más de un modelo pronóstico de mortalidad.
Estrategia de búsquedaSe realizó una búsqueda sistemática de la literatura, sin restricción de idioma, en octubre de 2022, en las bases de datos virtuales: PubMed, Scopus, Biblioteca virtual en salud (BVS) y Medrxiv. Se utilizaron los términos MesH discriminados por los componentes de la pregunta de investigación: «Neoplasms», «Oncology», «Critical Illness», «Intensive Care Units», «Mortality», «Mortality Prediction», «Hospital Mortality», «APACHE», «Simplified Acute Physiology Score», «Organ Dysfunction Scores», «Prognostic Score», «Outcome prediction» y «Predictive models» (tabla 2). Adicionalmente, se aplicó una estrategia de búsqueda en bola de nieve, que permitió incluir 2 artículos relevantes que cumplían criterios de selección. Al final, se incluyeron 12 estudios para la revisión sistemática. Esta revisión fue registrada en PROSPERO (CRD42023441046 - disponible en https://www.crd.york.ac.uk/prospero/#recordDetails).
Estrategia de búsqueda
| Población (P) | Prueba índice (I) | Prueba de referencia (R) | Diagnóstico(D) | |||
|---|---|---|---|---|---|---|
| «Neoplasms» | AND | «Organ dysfunction scores» | AND | «Mortality» | AND | «Hospital mortality» |
| OR | OR | OR | OR | |||
| «Solid neoplasms» | «APACHE» | «Mortality prediction» | «Mortality» | |||
| OR | OR | |||||
| «Critical illness» | «Simplified acute physiology score» | |||||
| OR | OR | |||||
| «intensive care unit» | «Dysfunction scores» | |||||
| OR | OR | |||||
| «Oncology» | Prognostic score | |||||
| OR | ||||||
| «Outcome prediction» | ||||||
| OR «Predictive models» |
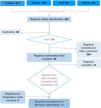
Los artículos de la búsqueda inicial fueron evaluados de manera independiente y cegada por 4 investigadores, primero por el título y el resumen de la publicación, luego los escogidos fueron revisados en texto completo y se les aplicaron los criterios de inclusión y exclusión. En la totalidad de los estudios no hubo una discriminación especificada por prueba índice y modelo de referencia. Por lo tanto, la mortalidad observada fue considerada como la prueba de referencia para la comparación y las pruebas índices fueron las escalas evaluadas (fig. 1).
Extracción de los datosDos autores de forma independiente extrajeron la información de los estudios en el programa Excel; el instrumento fue construido en consenso por los investigadores, con las variables de interés, organizada cronológicamente por fecha de publicación. Los estudios fueron analizados por número de pacientes y tipo de cáncer (sólido, enfermedad avanzada y hematológico), y para estandarización del reporte de datos fueron expresados en porcentajes (tabla 3). Se obtuvo los valores de discriminación y calibración de cada escala, y con base en los datos de mortalidad observada y predicha, se calculó la razón estandarizada de mortalidad (SMR) (tabla 4).
Características de los estudios incluidos en la revisión sistemática
| Estudio [ref.] | Año de publicación | Diseño del estudio | Escalas pronósticas de mortalidad | Número de pacientes incluidos (n=%) | Sólido/Hematológico/Metastásico; n (%) |
|---|---|---|---|---|---|
| Sculier6 | 2000 | Cohorte prospectiva | SAPS-IIAPACHE II | 261 | Sólido 200 (77)Metastásico 124 (62)Hematológico 61 (23) |
| Schellongowski7 | 2004 | Cohorte prospectiva | APACHE IISAPS-IIICMM | 242 | Sólido 108 (45)Hematológico 134 (55) |
| Berghmans8 | 2004 | Cohorte prospectiva | APACHE IISAPS-IIICMM | 247 | Sólido 76 (30,7)Metastásico 123 (49,7)Hematológico 48 (19,5) |
| Soares9 | 2004 | Cohorte prospectiva | SAPS-IIAPACHE IIIMPM IIICMMAPACHE II | 1257 | Sólido 1116 (88,8)Hematológico 141 (11,2) |
| Park10 | 2009 | Cohorte prospectiva | APACHE IISAPS-II | 7227 | Solido 7227 (100) |
| Soares11 | 2010 | Cohorte prospectiva | ICMMMPM IIISAPS-IISAPS-III | 717 | Sólido 473 (66)Metastásico 194 (27)Hematológico 50 (7) |
| Kopterides12 | 2011 | Cohorte prospectiva | APACHE IISAPS-IISOFA | 126 | Sólido 90 (71,4)Hematológico 36 (28,6) |
| Xing13 | 2015 | Cohorte retrospectiva | SAPS-IIIAPACHE IIAPACHE IV | 981 | Sólido 929 (94,7)Metastásico 52 (5,3) |
| Rojas14 | 2018 | Cohorte retrospectiva | APACHE IVMPM II | 283 | No reportado |
| Pérez15 | 2019 | Cohorte retrospectiva | SOFAAPACHE IIICMM | 132 | Sólido 132 (100) |
| Siddiqui16 | 2020 | Cohorte prospectiva | APACHE IVSAPS-IIIMPM IIICMM | 431 | Sólido 269(62,4)Metastásico 61 (14,2)Hematológico 101 (23,4) |
| Martos-Benítez17 | 2020 | Cohorte prospectiva | APACHE IIAPACHE II--CCPSAPS-IIISAPS-III-CSA | 414 | Sólido 393 (94,9)Hematológico 21(5,1) |
APACHE: evaluación fisiológica aguda y evaluación crónica de salud; ICMM: modelo de mortalidad para cáncer en la UCI; MPM: modelo de predicción de mortalidad; SAPS: puntuación fisiológica simplificada aguda; SOFA: evaluación secuencial de fallo orgánico.
Se muestra el año de publicación de cada artículo, tipo de estudio, escala pronóstica de mortalidad evaluada, número de la muestra, tipo de cáncer (Sólido/Hematológico/Metastásico.
Desempeño predictivo general de modelos pronósticos en pacientes de UCI con cáncer
| Estudio [ref.] | Discriminación ROC (IC95%) | Calibración bondad de ajuste Hosmer-Lemeshow (Ĉ, H) - Valor de p | Mortalidad predicha (%) | Mortalidad hospitalaria observada (%) | SMR |
|---|---|---|---|---|---|
| Sculier6 | SAPS-II 0,67APACHE II 0,60 | SAPS-II<0,001APACHE II<0,001 | SAPS-II 26,1APACHE II 26,5 | 33 | SAPS-II 1,26APACHE II 1,25 |
| Schellongowski7 | APACHE II 0,77SAPS-II 0,82 (0,77-0,87)ICMM 0,69 (0,63-0,76) | (Ĉ)APACHE II 0,058SAPS-II 0,066ICMM 0,115 | ICMM 42 | 44 | ICMM 1,05 |
| Berghmans8 | APACHE II 0,65SAPS-II 0,72ICMM 0,79 | (H)APACHE II<0,001SAPS-II<0,001ICMM 0,06 | APACHE II 32SAPS-II 24ICMM 28 | 34 | APACHE II 1,06SAPS-II 1,41ICMM 1,21 |
| Soares9 | SAPS-II 0,81 (0,78-0,85)APACHE III 0,81 (0,77-0,84)MPM II 24 0,79 (0,75-0,83)ICMM 0,79 (0,75-0,83)APACHE II 0,75 (0,71-0,79)MPM II 0 0,72 (0,68–0,77) | - | SAPS-II 47,9APACHE III 42,6MPM II 24 47,7ICMM 78,7APACHE II 38,2MPM II 0 25,0 | 58,7 | SAPS- II 1,23APACHE III 1,38MPM II 24 1,56ICMM 0,75APACHE II 1,54MPM II 0 2,35 |
| Park10 | APACHE II 0,63 (0,61-0,65)SAPS-II 0,65 (0,63-0,67) | (Ĉ)APACHE II<0,001SAPS-II<0,001 | APACHE II 13,6SAPS-II 9,8 | 11 | APACHE II 0,81SAPS-II 1,12 |
| Soares11 | ICMM 0,79 (0,76-0,83)MPM III 0,71 (0,67-0,75)SAPS-II 0,84 (0,81-0,87)SAPS-III 0,84 (0,81-0,87) | ICMM 0,128MPM III 0,076SAPS-II 0,007SAPS-III 0,045 | ICMM 63,1MPM II 9,1SAPS-II 20,4SAPS-III 23,6 | 30 | ICMM 0,48MPM III 3,41SAPS-II 1,49SAPS-III 1,29 |
| Kopterides12 | APACHE II 0,90 (0,84-0,95)SAPS-II 0,87 (0,80-0,93)SOFA 0,83 (0,75-0,89) | APACHE II 0,17SAPS-II 0,14SOFA 0,22 | APACHE II 44,8SAPS-II 41,3SOFA 38,0 | 46,8 | APACHE II 1,09SAPS-II 1,13SOFA 1,23 |
| Xing13 | SAPS-III 0,94 (0,91-0,98)APACHE II 0,86 (0,80-0,92)APACHE IV 0,87 (0,81-0,93) | (Ĉ)SAPS-III 0,759APACHE II 0,900APACHE IV 0,878 | SAPS-III 3APACHE II 6,2APACHE IV 3,8 | 4,5 | SAPS-III 1,50APACHE II 0,72APACHE IV 1,17 |
| Rojas14 | APACHE IV 0,955 (0,93-0,97)MPM II 0,787 (0,73-0,84) | (Ĉ)APACHE IV 0,398MPM II 0,991 | - | 29,6 | - |
| Pérez15 | SOFA 0,77 (1,14-1,48)APACHE II 0,79 (1,14-1,48)ICMM 0,79 (1,02–1,07) | SOFA 0,229APACHE II 0,922ICMM 0,363 | SOFA 5,6 APACHE II 15,9 ICMM 41,4 | 19,7 | SOFA 3,47APACHE II 1,23ICMM 0,47 |
| Siddiqui16 | APACHE IV 0,73 (0,68-0,77)SAPS-III 0,70 (0,65-0,75)MPM0 0,67 (0,61-0,72)ICMM 0,67 (0,61- 0,71) | (Ĉ)APACHE IV 0,723SAPS-III 0,319MPM0 0,274ICMM 0,275 | APACHE IV 30,1SAPS-III 36,6MPM0 29,5ICMM 49,2 | 41,1 | APACHE IV 1,36SAPS-III 1,12MPM0 1,38ICMM 0,83 |
| Martos-Benítez17 | APACHE II 0,96 (0,94-0,98)APACHE II-CCP 0,98 (0,96–0,99)SAPS-III 0,91 (0,87-0,94)SAPS-III-CSA 0,95 (0,93-0,98) | (Ĉ)APACHE II 0,183APACHE II-CCP 0,272SAPS-III 0,003SAPS-III-CSA 0,082 | APACHE II 27,5APACHE II-CCP 31,6SAPS-III 30,1SAPS-III-CSA 38,2 | 32,6 | APACHE II 1,18APACHE II-CCP 1,03SAPS-III 1,08SAPS-III-CSA 0,85 |
APACHE: evaluación fisiológica aguda y evaluación crónica de salud; ICMM: modelo de mortalidad para cáncer en la UCI; MPM: modelo de predicción de mortalidad; ROC: curva de operación del receptor; SAPS: puntuación fisiológica simplificada aguda; SMR: razón estandarizada de mortalidad; SOFA: evaluación secuencial de fallo orgánico; -: no proporcionado.
Se muestran las áreas bajo la curva ROC, el valor p correspondiente a la bondad de ajuste de Hosmer-Lemeshow para las estadísticas H o Ĉ, y las SMR para los modelos individuales de predicción de mortalidad.
La validez externa se evaluó mediante el análisis de la población a estudio, la generalización y el error aleatorio, mientras que la validez interna se estimó con la determinación de los sesgos de información, selección y confusión. La evaluación de la calidad metodológica y el riesgo de sesgo de los estudios primarios incluidos en la revisión sistemática fueron realizados mediante la aplicación por pares de la herramienta QUADAS-2 (Quality Assessment of Diagnostic-Accuracy Studies) (fig. 2), herramienta específica para la evaluación de la calidad de estudios de pruebas diagnósticas. Según criterio de los autores, se consideró un estudio de buena calidad si el riesgo de sesgo era menor del 25%, de moderada calidad entre 25-50% y baja calidad si el riesgo superaba el 50%.
Evaluación de la calidad metodológica de los estudios incluidos, utilizando lista de chequeo QUADAS-2. a: Gráfico de riesgo de sesgo y aplicabilidad: juicio de los autores con relación a cada dominio y presentado como porcentaje en todos los estudios incluidos. b: Riesgo de sesgo: juicio de los autores acerca de cada dominio para cada estudio.
Se encontraron diferencias importantes entre los estudios, con gran variabilidad en el número de pacientes incluidos, en la dirección del tiempo, en la clasificación del tipo de cáncer, así como en las escalas de mortalidad evaluadas. Por ello, desde esta fase de la revisión se previó que los estudios eran demasiado heterogéneos para poder combinarlos en un metaanálisis y se decidió llevar a cabo solo la revisión sistemática de la literatura de tipo cualitativo. La síntesis narrativa se llevó a cabo mediante una evaluación de las características operativas de las escalas de mortalidad y resultados más significativos.
ResultadosSe identificaron 424 artículos con la estrategia de búsqueda, 36 fueron excluidos por duplicidad y 364 por título y resumen, 24 estudios fueron evaluados a texto completo y 14 fueron excluidos por criterios de población (pacientes no oncológicos, menores de edad y de hospitalización general), por prueba índice (estudios que validaron solo una escala), por prueba de referencia (estudios que no documentaran mortalidad predicha) y por desenlace (que no describieran la calibración y discriminación). Se incluyeron 2 artículos adicionales por la estrategia complementaria de bola de nieve, completando 12 estudios para la revisión sistemática (fig. 1).
Se identificaron 7 modelos de predicción: modelo de mortalidad para cáncer en la UCI (ICMM), modelo de predicción de mortalidad (MPM), evaluación secuencial de fallo orgánico (SOFA), puntuación fisiológica simplificada aguda ii (SAPS-II), Puntuación fisiológica simplificada aguda iii (SAPS-III), Evaluación fisiológica aguda y evaluación crónica de salud ii (APACHE II) y Evaluación fisiológica aguda y evaluación crónica de salud iv (APACHE IV). De los 12 artículos, 9 fueron de cohorte prospectiva y 3 de cohorte retrospectiva. En la mayoría de los estudios se incluyeron pacientes con tumores sólidos, enfermedad avanzada y cáncer hematológico.
Evaluación de la calidadLa evaluación metodológica de los estudios incluidos en la revisión se presenta en la figura 2. De manera general, los estudios mostraron buena calidad metodológica y el riesgo de sesgo observado fue bajo. El principal problema de sesgo en la evaluación estuvo representado en la aplicación de la prueba índice, dado que en la mayoría no se especificaron puntos de corte para la interpretación de la discriminación y calibración. Los estudios con la mejor calidad metodológica fueron los de Schellongowski et al.7 y Kopterides et al.12, mientras que los de baja calidad metodológica correspondieron a Pérez Pérez et al.15, Rojas Ruiz et al.14 y Xing et al.13. Los 7 artículos restantes, Sculier et al.6, Berghmans et al.8, Soares et al. (2004)9, Park et al.10, Soares et al. (2010)11, Siddiqui et al.16, Martos-Benítez et al.17, fueron de calidad moderada. Se encontró de manera consistente en todos los estudios una buena aplicabilidad.
Evaluación de la discriminación y calibraciónLos estudios evaluaron la capacidad predictiva de las escalas mediante la discriminación del área bajo la curva (AUC), y la calibración utilizando la bondad de ajuste de Hosmer-Lemeshow H o Ĉ interpretados con el valor de p. La discriminación mide la probabilidad de que un paciente que falleció tuviera una probabilidad predicha más alta de morir que un paciente que sobrevivió. Un AUC de 0,5 indica que no hay diferencias entre aplicar o no la escala, una AUC=1 indica que el modelo es perfecto, un AUC>0,8 indica que el modelo es apropiado, un AUC entre 0,6 y 0,8 indica que el modelo es moderado, y un AUC<0,6 indica que el modelo es deficiente.
La calibración compara entre las probabilidades de mortalidad predicha y mortalidad observada. Los estudios seleccionados utilizaron la prueba de Hosmer-Lemeshow H o Ĉ, y se evaluó mediante el valor de p, donde un valor de p<0,05 indica una diferencia significativa entre la mortalidad observada y la mortalidad predicha, mientras que un valor de p>0,05 sugiere una mayor aproximación a la realidad.
Se utilizó la SMR para comparar la mortalidad observada con la predicha. Una SMR=1 indica que el modelo es perfecto, una SMR<1 implica que el modelo sobrestima la mortalidad, mientras que una SMR>1 indica que el modelo subestima la mortalidad (tabla 4).
Análisis de escalas pronósticasAPACHE II. Fue evaluado en 9 de los estudios6–10,12,13,15,17 de los cuales 7 fueron de cohorte prospectiva6–10,12,17 y 2 retrospectivos13,15. El número de pacientes osciló entre 126 y 5767, correspondiente a los estudios de Kopterides et al.12 y Park et al. (2009)10. Se incluyeron pacientes con tumores sólidos, enfermedad avanzada y cáncer hematológico. Se evidenció de baja hasta buena discriminación con AUC entre 0,60 y 0,96, Sculier et al. (2000)6 y Martos-Benítez (2020)17. La mayoría de los estudios demostraron mala calibración con SMR (>1) entre 1,06-1,54, que resultó en una subestimación uniforme del riesgo de mortalidad. En 2 estudios se reportó SMR<1, que corresponden a los estudios más grandes, Park et al. (2009)10 y Xing et al (2015)13, respectivamente.
APACHE III. Esta escala no se tuvo en cuenta para las conclusiones de la revisión dado que fue evaluado solo en el estudio de Soares et al. (2004)9, un estudio de cohorte observacional prospectiva, con un total de 542 pacientes. Se incluyeron pacientes con tumores sólidos y cáncer hematológico. Se reportó una buena discriminación con AUC de 0,81. Se evidenció una calibración con una SMR de 1,38, indicativo de subestimación de la mortalidad.
APACHE IV. Fue evaluado en 3 estudios13–15, 2 estudios fueron de cohorte observacional prospectiva13,14 y uno retrospectivo16. El número de pacientes fue de 283 a 981, en los estudios de Rojas Ruiz et al. (2018)14 y Xing et al. (2015)13. Se incluyeron pacientes con tumores sólidos, enfermedad avanzada y cáncer hematológico. Se reportó una AUC de moderada y buena discriminación, entre 0,73 y 0,95. Se reportó calibración con una SMR de 1,17 a 1,36, que resultó en subestimación de la mortalidad.
No se encuentran diferencias significativas que indiquen un mejor rendimiento pronóstico entre las diferentes versiones del APACHE II, III y IV. Los 3 modelos pueden subestimar la mortalidad en pacientes oncológicos.
SOFA. Fue evaluado en 2 estudios12,15, uno prospectivo12 y otro retrospectivo15. Se incluyeron en promedio 129 pacientes, de los cuales más del 94% presentaban tumor sólido. El estudio de Kopterides et al. (2011)12 demostró una buena capacidad de discriminación con un AUC de 0,83 y el estudio de Pérez Pérez et al. (2019)15 una discriminación moderada con un AUC de 0,77. Ambos estudios presentaron una baja calibración con un valor p<0,22. Los 2 estudios demostraron una subestimación de la mortalidad con una SMR>1,23.
SAPS II. Fue evaluado en 7 artículos de manera prospectiva6–12, 4 de ellos con menos de 500 pacientes6–8,12 y los otros 3 con más de 5009–11. Analizaron pacientes con cáncer sólido y hematológico. Cuatro de ellos mostraron una buena discriminación, con valores de AUC>0,87,9,11,12 y 3 estudios una discriminación moderada, con AUC<0,726,8,10; en 4 estudios se reportó una baja calibración con valor de p<0,056,8,10,11, mientras que 2 tuvieron un valor de p>0,057,12 y un artículo no proporcionó esta información9. Casi todos los estudios reportaron una SMR>1,1, con la excepción del estudio de Schellongowski et al. (2003)7, que no reportó esta información, resultando en una subestimación de la mortalidad.
SAPS III. Fue evaluado en 4 artículos11,13,16,17, 3 prospectivos11,16,17 y uno retrospectivo13, con una muestra que osciló entre 414 y 981 pacientes, y un predominio mayor al 50% de tumores sólidos. En 3 estudios11,13,17 se evidenció una buena discriminación con AUC de 0,84; 0,91 y 0,95 respectivamente, mientras que un estudio tuvo una capacidad de discriminación moderada con un AUC de 0,7 16; 2 de los artículos obtuvieron una baja calibración11,17 con un valor de p<0,05 y los otros 2 presentaron una buena calibración con un valor de p>0,05. En los 4 estudios se evidenció una subestimación de la mortalidad con SMR entre 1,08 y 1,50.
SAPS III–CSA. El estudio de Martos-Benítez et al. (2020)17, una cohorte prospectiva con un total de 414 pacientes, en su mayoría con cáncer sólido (94,9%), evalúo el SAPS III por países de América central y Suramérica (SAPS III-CSA). Este estudio demostró una buena discriminación con AUC de 0,95 y una buena calibración por un valor de p>0,05. Se sobrestimó la mortalidad con una SMR de 0,85.
ICMM. Fue evaluado en 6 estudios7,8,9,11,15,16, de los cuales 5 fueron prospectivos y uno retrospectivo 15. El número de pacientes osciló entre 132 y 1257, entre los estudios de Pérez Pérez et al. (2019)15 y Soares et al. (2010)11 respectivamente. La población incluía pacientes con tumores sólidos, enfermedad avanzada y cáncer hematológico, excepto el estudio de Pérez Pérez et al. (2019)15, que solo incluyó tumores sólidos. En 4 artículos9,11,15,16 se reportaron SMR<1 entre 0,47 y 0,83 indicativas de una sobrestimación de la mortalidad y en 2 subestimaron la mortalidad7,8. El estudio de Schellongowski et al. (2004)7 fue el que demostró mejor calibración con una SMR de 1,05.
MPM II. MPM II registrado al ingreso y a las 24h fue evaluado en 3 estudios9,14,16 todos prospectivos. El número de pacientes osciló entre 283 y 1257, entre los estudios de Rojas Ruiz (2018)14 y Soares et al. (2004)9, respectivamente. Se incluyeron pacientes con tumores sólidos, enfermedad avanzada y cáncer hematológico. Se evidenció moderada discriminación con un AUC de 0,67 y 0,79, en los estudios de Siddiqui et al. (2020)16 y Soares et al. (2004)9, respectivamente. En los 3 estudios la SMR fue>1, indicativo de una subestimación de la mortalidad.
MPM III. Este modelo solo fue evaluado en un estudio, el de Soares et al (2010)11. Fue una cohorte prospectiva, que incluyó 717 pacientes con tumores sólidos y cáncer hematológico. Se reportó una moderada discriminación con una AUC de 0,71. Se reportó sobrestimación de la mortalidad con una SMR de 3,41.
DiscusiónLos pacientes oncológicos en la UCI tienen un alto riesgo de sufrir desenlaces desfavorables. La predicción precisa del riesgo de mortalidad en esta población puede ayudar a mejorar la planificación de las intervenciones y los resultados. Si bien existe una gran cantidad de estudios sobre la predicción del riesgo en la UCI, los estudios específicos para pacientes oncológicos son menos frecuentes18.
La mayoría de las escalas pronósticas incluidas en esta revisión que son utilizadas para predecir mortalidad de pacientes críticos con cáncer se han validado en su concepción original en población general19, mientras que 2 de las escalas (ICMM y MPM II) han sido completamente validadas para pacientes con cáncer7,20. Las escalas pronósticas para población general tienen mayor evidencia clínica disponible y son las más utilizadas en la práctica rutinaria.
Esta revisión sistemática evalúa la evidencia publicada en los últimos años sobre el desempeño pronóstico de las escalas de mortalidad en pacientes oncológicos en la UCI. Los resultados de la revisión muestran que la mayoría de los modelos pronósticos no son precisos en esta población. La mayoría de las escalas generales, como APACHE II, APACHE IV, SOFA, SAPS-II, SAPS-III e ICMM, tienden a subestimar el riesgo de mortalidad, mientras que el MPM II puede sobrestimarlo. El estudio de den Boer del 2005 mostró un comportamiento similar para los modelos generales que de forma consistente subestimaban la mortalidad21.
De todos los modelos, el APACHE II fue el que tuvo el mejor valor de SMR más cercano a 1, lo que indica una mejor capacidad de predicción. Considerando la heterogeneidad en todos los estudios, este modelo podría tener una ventaja adicional debido a su familiaridad y uso frecuente en las unidades polivalentes. Los modelos pronósticos específicos para cáncer no fueron superiores a los modelos generales. Sus resultados de predicción fueron heterogéneos: el ICMM subestimó la mortalidad (SMR<1), mientras que el MPM II la sobrestimó (SMR>1).
Parece que las escalas pronósticas diseñadas específicamente para pacientes con cáncer no parecieran ofrecer beneficios adicionales en términos de predicción y discriminación. Además, hay menos evidencia publicada disponible sobre su aplicación y rendimiento, sin embargo, en el estudio de den Boer los modelos específicos mostraron mejor discriminación y calibración21.
La aplicabilidad en general de todos los modelos pronósticos en pacientes con neoplasias hematológicas se ve limitada por la sobrerrepresentación de neoplasias sólidas en los estudios que los evalúan. Esta limitación tiene 2 causas principales: primero, sesgos en las mediciones: los modelos de predicción incluyen parámetros como el recuento leucocitario y plaquetario, que son muy prevalentes en pacientes con neoplasias hematológicas, independientemente de su estado crítico. Esto puede generar sesgos en las mediciones y afectar la precisión de los modelos. Segundo, las diferencias en las características clínicas: los pacientes con neoplasias hematológicas tienen características diferentes a los pacientes con neoplasias sólidas. Presentan mayor frecuencia de exposición a quimioterapia intrahospitalaria, sepsis y neutropenia febril, mientras que los pacientes con tumores sólidos ingresan a la UCI principalmente para el manejo postoperatorio. Estas diferencias en las causas de ingreso a la UCI pueden afectar el rendimiento de las escalas de predicción.
El estudio presenta algunas limitaciones que deben ser consideradas al interpretar sus resultados. En primer lugar, la cantidad de estudios incluidos en la revisión fue limitada, lo que puede afectar la validez externa de los resultados. Es decir, los resultados no pueden ser generalizados a toda la población de pacientes con cáncer. En segundo lugar, los estudios mostraron una gran variabilidad, no solo en la forma en que se calculó la mortalidad hospitalaria, sino en características como el número de pacientes, el tipo de neoplasia, la línea temporal. Esto dificulta la comparación de los resultados entre diferentes estudios. Finalmente, la mortalidad hospitalaria observada en cada cohorte fluctuó entre 4,5 y 58,7%. Esta gran variabilidad dificulta la comparación de los resultados y la realización de un metaanálisis de medidas de frecuencia.
Las posibles causas de esta heterogeneidad incluyen la naturaleza observacional de los estudios, lo que significa que es altamente probable que no se controlaron todas las variables que podrían afectar la mortalidad hospitalaria y la variabilidad en las características de los estudios en cuanto al número de pacientes incluidos, el tipo de neoplasia subyacente y la escala validada.
Los resultados deben ser interpretados y aplicados de manera cautelosa. Las escalas de predicción sirven como una herramienta que provee información al clínico y pueden guiar la asignación de recursos y el grado de monitorización requerido, sin embargo, no reemplazan el juicio clínico y no deberían utilizarse como barreras para el ingreso a la UCI en pacientes que requieran de atención crítica. En resumen, las limitaciones del estudio deben ser consideradas al interpretar sus resultados y se necesitan más estudios con metodologías más homogéneas para obtener resultados más precisos y generalizables.
ConclusiónA pesar del aumento de pacientes con cáncer en UCI y la existencia de modelos específicos para predecir su mortalidad, aún no hay un modelo definitivo superior al resto. Se recomienda utilizar los modelos disponibles, con preferencia en aquellos con los que se tenga mayor experiencia, conociendo sus limitaciones. La heterogeneidad de la población y la falta de consistencia en los estudios limitan su utilidad. Se necesitan nuevos instrumentos o estudios de validación a gran escala para mejorar la precisión de las herramientas disponibles, considerando las características únicas de los pacientes con cáncer. Mientras tanto, se recomienda usar los modelos con cautela y complementar la predicción con otros factores clínicos relevantes.
FinanciaciónEste proyecto no tuvo financiación por una institución externa o patrocinador.
Conflicto de interesesLos autores expresan no presentar conflicto de intereses en el proceso de concepción del estudio.