La hiponatremia es el trastorno electrolítico más prevalente en las Unidades de Cuidados Intensivos. Se asocia a un aumento de la morbilidad, mortalidad y estancia hospitalaria. La mayoría de los estudios publicados hasta el momento son observacionales, retrospectivos y no incluyen pacientes críticos, lo que dificulta la extracción de conclusiones sólidas. Además, debido a la escasa evidencia científica de calidad, incluso las recomendaciones realizadas por distintas sociedades científicas recientemente publicadas difieren en aspectos importantes como son el diagnóstico o el tratamiento de la hiponatremia.
Los mecanismos etiopatogénicos en los pacientes críticos suelen ser complejos. Sin embargo, hay que profundizar en ellos para llegar al diagnóstico más probable y a la pauta de tratamiento más adecuada. Todo ello, ha motivado la realización de esta revisión práctica sobre aspectos útiles en el abordaje de la hiponatremia en las Unidades de Cuidados intensivos, con el objetivo de homogeneizar el manejo de esta entidad y disponer de un algoritmo diagnóstico a nivel nacional.
Hyponatremia is the most prevalent electrolyte disorder in Intensive Care Units. It is associated with an increase in morbidity, mortality and hospital stay. The majority of the published studies are observational, retrospective and do not include critical patients; hence it is difficult to draw definitive conclusions.
Moreover, the lack of clinical evidence has led to important dissimilarities in the recommendations coming from different scientific societies.
Finally, etiopathogenic mechanisms leading to hyponatremia in the critical care patient are complex and often combined, and an intensive analysis is clearly needed. A study was therefore made to review all clinical aspects about hyponatremia management in the critical care setting. The aim was to develop a Spanish nationwide algorithm to standardize hyponatremia diagnosis and treatment in the critical care patient.
La hiponatremia (HN) es el trastorno electrolítico más prevalente en las Unidades de Cuidados Intensivos, por lo que parece razonable la realización de un documento que exprese de forma práctica el abordaje de la hiponatremia en el paciente crítico. Hasta el momento se han publicado dos guías importantes1,2, pero algunas recomendaciones de las mismas no son aplicables al paciente crítico por el tipo de patología y la gravedad del paciente (p.ej. restricción hídrica en pacientes neurocríticos)3. Además presentan puntos controvertidos sobre todo en lo referente al tratamiento, ya que las guías americanas indican vaptanes para el manejo de HN euvolémicas e hipervolémicas mientras que las europeas no los indican en ningún caso4.
Por dicho motivo, el propósito del presente trabajo es realizar una revisión práctica sobre aspectos útiles en el abordaje de la hiponatremia en las UCI españolas con el objetivo de aclarar, homogeneizar y disponer de un algoritmo común en el manejo de esta entidad.
Metodología para la realización de este documentoLa elaboración de este documento fue propuesto por los coordinadores del mismo y desarrollado por un grupo de especialistas en medicina intensiva españoles, elegidos por los coordinadores, con experiencia en el manejo de pacientes críticos en diferentes escenarios (neurocríticos, cardiacos, posquirúrgicos, hepáticos y pluripatológicos), e integrantes de diferentes grupos de trabajo dentro de la Sociedad Española de Medicina Intensiva y Unidades Coronarias (SEMICYUC), en colaboración con Otsuka Pharmaceutical. El documento obtuvo el aval científico de la SEMICYUC.
La realización de este documento se hizo de acuerdo a tres fases y reuniones. En la primera reunión se presentaron las preguntas elaboradas por los coordinadores a los miembros del grupo de especialistas conformado para este propósito. Se discutieron y se consensuaron entre todos y se asignaron entre los participantes. Se acordó que cada pregunta fuese revisada por dos expertos y se distribuyó la bibliografía tras una búsqueda global inicial realizada por los coordinadores. Esta búsqueda consistió en una revisión de la literatura científica disponible (en inglés y en español) en PubMed desde el 1 de enero de 2000 hasta el 31 de diciembre de 2017 que incluyera estudios observacionales (prospectivos y retrospectivos), ensayos clínicos, metaanálisis y revisiones. Inicialmente se excluyeron aquellos que no fueron realizados en humanos. Los términos utilizados para la búsqueda bibliográfica fueron hiponatremia «and»: algorithm, classification, critical care, diagnosis, differential diagnosis, etiology, euvolemia, heart failure, hypervolemia, hypovolemia, incidence, liver cirrhosis, neurocritical care, physiopathology, prognosis, recommendations, syndrome of inappropriate ADH (antidiuretichormone secretion), surgery, symptoms, treatment, vasopressin, vaptans, wasting salt syndrome.
Posteriormente, y a criterio de cada experto, se seleccionaron y añadieron referencias adicionales a partir de estos artículos o tras una segunda búsqueda bibliográfica si lo consideraban necesario.
En una segunda reunión se expuso la respuesta, se definieron los conceptos clave relacionados con cada pregunta y se realizaron los cambios oportunos consensuados entre todos los expertos. En la última reunión se discutió la redacción y extensión del borrador, que ha sido revisado y aprobado por todos los firmantes.
Por tanto, las conclusiones y consejos prácticos de este documento se basan en gran medida en la experiencia y las opiniones de los autores, basándose en una revisión de la literatura actual.
Definición de hiponatremiaLa HN se define como la concentración plasmática de sodio ([Na+]p) inferior a 135 mEq/l5. Sin embargo, el umbral de riesgo para iniciar tratamiento dependerá de la patología de base. En este sentido en el paciente neurocrítico se considera una [Na+]p < 140 mEq/l6, en el paciente con insuficiencia hepática una [Na+]p < 130 mEq/l7 y en el paciente con insuficiencia cardiaca una [Na+]p < 130 mEq/l8.
Es importante tener en cuenta que el diagnóstico clínico en el paciente crítico es más difícil que en otros escenarios por los tratamientos previos y la patología de base. Además, la HN en estos pacientes puede cursar con manifestaciones clínicas similares a las causas que ocasionan la hiponatremia9.
Incidencia y pronóstico de la hiponatremia en el paciente críticoEn pacientes hospitalizados la HN presenta una incidencia próxima al 30% (si se considera < 135 mEq/l)10 pero es difícil precisar su impacto en la UCI por la escasez de estudios realizados con este objetivo, oscilando entre un 12 y 34% según las series revisadas (tabla S1 del material suplementario). Aunque existen estudios que evalúan la asociación entre HN y estancia hospitalaria, calidad de vida o mortalidad, por la calidad de los mismos, no se puede establecer si existe o no una relación causal (tabla S1 del material suplementario). Se proponen diferentes hipótesis para explicar esta relación, como que la elevada mortalidad en pacientes hospitalizados con HN podría reflejar más la gravedad de la enfermedad de base que ser un efecto directo de la propia hiponatremia, pues pacientes con cifras de sodio extremadamente bajas presentan menor mortalidad11. Otra hipótesis descrita es que cifras plasmáticas de sodio muy bajas se detectan antes y por tanto se tratan precozmente mientras que natremias en rango moderado podrían ser consideradas como no importantes y de esta manera retrasar el inicio del tratamiento que podría agravar la morbimortalidad12.
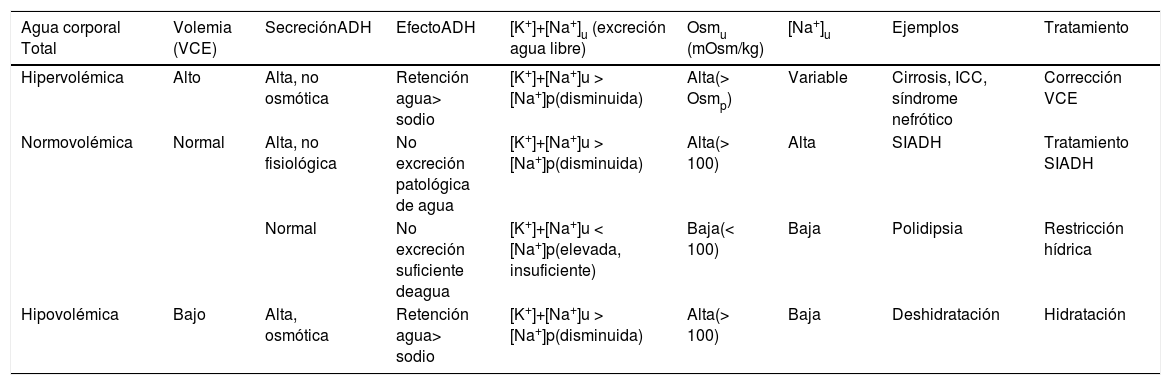
Fisiopatología de la hiponatremiaDesde el punto de vista fisiopatológico, incrementos sutiles de la Osmp (1-2%) serán detectados por los osmorreceptores hipotalámicos que estimularán el centro de la sed y sintetizarán hormona antidiurética o vasopresina-arginina (ADH)5. La ADH actuará a nivel del túbulo colector y a través de las acuaporinas tipo 2 (AQ2) se reabsorbe agua que normalizará la Osmp (280-296 mOsm/kg)13 y concentrará la orina. Existen otros estímulos más potentes que la Osmp que liberarán ADH (la disminución del volumen circulante efectivo [VCE], el estrés, el dolor, las náuseas o fármacos14). De esta manera una orina diluida (osmolalidad < 100 mOsm/kg) con potasio y sodio urinarios bajos ([Na++K+]u < [Na+]p) indicará inhibición de la ADH15. La determinación simultánea de la concentración plasmática y urinaria de Na+, K+ y osmolalidad, así como la estimación del agua corporal total y de la volemia son elementos claves para conocer la etiología de la HN. En la tabla 1 se resume de manera orientativa los escenarios clínicos más habituales y el comportamiento de los parámetros que ayudan a diferenciarlos aun cuando en algunos casos pueden diferir a los descritos (diuréticos) o no ser interpretables (insuficiencia renal).
Interpretación de los valores analíticos en hiponatremia hipotónica (Osmp < 280 mOsm/kg)
| Agua corporal Total | Volemia (VCE) | SecreciónADH | EfectoADH | [K+]+[Na+]u (excreción agua libre) | Osmu (mOsm/kg) | [Na+]u | Ejemplos | Tratamiento |
|---|---|---|---|---|---|---|---|---|
| Hipervolémica | Alto | Alta, no osmótica | Retención agua> sodio | [K+]+[Na+]u > [Na+]p(disminuida) | Alta(> Osmp) | Variable | Cirrosis, ICC, síndrome nefrótico | Corrección VCE |
| Normovolémica | Normal | Alta, no fisiológica | No excreción patológica de agua | [K+]+[Na+]u > [Na+]p(disminuida) | Alta(> 100) | Alta | SIADH | Tratamiento SIADH |
| Normal | No excreción suficiente deagua | [K+]+[Na+]u < [Na+]p(elevada, insuficiente) | Baja(< 100) | Baja | Polidipsia | Restricción hídrica | ||
| Hipovolémica | Bajo | Alta, osmótica | Retención agua> sodio | [K+]+[Na+]u > [Na+]p(disminuida) | Alta(> 100) | Baja | Deshidratación | Hidratación |
ADH: hormona antidiurética; ICC: insuficiencia cardiaca congestiva; [K+]+[Na+]u: suma de concentración de sodio y potasio urinarios; [Na+]u: concentración de sodio urinario; Osmp: osmolalidad plasmática; Osmu: osmolalidad urinaria; SIADH: síndrome de secreción indadecuada de ADH; VCE: volumen circulante efectivo.
La HN aguda puede provocar edema cerebral debido al gradiente osmótico generado por la hipoosmolalidad que provoca la entrada de agua en las células gliales16. Existen mecanismos de adaptación cerebral a la HN (salida de iones inorgánicos [K+ y Cl−]17 gracias a las bombas Na-K-ATPasa18 y de metabolitos osmóticos) que se desarrollan si se produce en más de 48h19–21 y que disminuirán el edema cerebral22. Existen situaciones con peor adaptación a la HN23 como es el caso de mujeres fértiles y pacientes con hipoxemia pues los estrógenos y la hipoxemia bloquean las bombas Na-K-ATPasa impidiendo la salida de agua desde el espacio intracelular24.
Por otra parte, establecidos los mecanismos de adaptación cerebral, la corrección rápida de la HN producirá un ambiente extracelular hipertónico15 que puede ocasionar deshidratación celular y lesión neuronal estructural25,26, que conocemos como síndrome de desmielinización osmótica cerebral (SDO), cuyas consecuencias pueden ir desde un déficit de atención hasta coma y muerte27,28. Factores que favorecen su desarrollo son la malnutrición, hipokalemia, alcoholismo, cirrosis y cifras muy bajas de natremia entre otros1,29.
Conceptos prácticos del paciente crítico con hiponatremia1.a pregunta. ¿Cómo se clasifica la hiponatremia?Consejos prácticos- •
La hiponatremia se puede clasificar según la natremia, tonicidad, estado de volemia, sintomatología y/o velocidad de instauración.
- •
Se considera importante individualizar el umbral de riesgo de la [Na+]p de acuerdo al contexto clínico para iniciar tratamiento.
- •
Es preferible asumir como crónica cualquier hiponatremia si desconocemos la velocidad de instauración.
Debido a la complejidad del paciente crítico con hiponatremia, la clasificación de la misma debería realizarse en base a varios conceptos, siendo los más utilizados, la natremia30, tonicidad13, estado de volemia31,32, sintomatología24,33 y/o velocidad de instauración22,34 (tabla 2).
Clasificación de la hiponatremia según varios criterios
| Según la concentración plasmática de sodio | ||
|---|---|---|
| Natremia | [Na+]p (mEq/l) | Técnicas de análisis |
| Ligera | 134-130 | Se recomienda para la medición de [Na+]p:• medición directa.• Siempre la misma técnica.• Electrodo de flujo selectivo de iones |
| Moderada | 129-125 | |
| Grave | < 125 | |
| Según la tonicidad | ||||
|---|---|---|---|---|
| Tonicidad | Osmp (mOsm/kg) | Grado osmolalidad | Ejemplo | Se recomienda medir la Osmp en lugar de calcularla |
| Hipotónica | < 280 | Hipoosmolar | SIADH | |
| Isotónica | 280-290 | Isoosmolar | Hiperlipidemia | |
| Hiperproteinemia | ||||
| Hipertónica | > 290 | Hiperosmolar | Hiperglucemia | |
| Manitol | ||||
| Según la sintomatología | |
|---|---|
| Grados de gravedad | Síntomas |
| Leve | No hay alteración del nivel de conciencia: cefalea, astenia, debilidad, déficit atención, alteraciones de memoria o marcha, bradipsiquia |
| Moderada | Alteración del nivel de conciencia: náuseas, vómitos, desorientación, delirium, confusión, somnolencia, dificultad en el destete |
| Grave | Disfunción neurológica: estupor, convulsiones, coma, herniación cerebral, muerte, edema pulmonar no cardiogénico |
| Según la velocidad de instauración | |||
|---|---|---|---|
| Tiempo instauración | Síntomas asociados | En caso de desconocimiento, se recomienda asumir la hiponatremia como crónica, ya que el tratamiento será menos agresivo para evitar el riesgo de síndrome de desmielinización osmótica | |
| Aguda | < 48 h | Síntomas neurológicos más frecuentes (mayor edema cerebral) | |
| Crónica | > 48 h | Déficits de atención, alteración del equilibrio, osteoporosis y fracturas óseas, caídas | |
Se debe descartar la pseudohiponatremia o HN isotónica35, la cual se debe a un artefacto del laboratorio ante concentraciones altas de lípidos o proteínas en sangre al detectar un aumento relativo en la fase sólida del plasma que se evita mediante el uso de técnicas directas de flujo selectivo de iones35. Por otra parte, cuando el plasma contiene partículas osmóticamente activas (hiperglucemia, manitol, sorbitol o contrastes) que aumentan la tonicidad plasmática, se produce salida de agua del espacio intracelular disminuyendo la [Na+]p. Se trata de una HN hipertónica y se conoce como HN translocacional36. Es importante detectar estos escenarios pues solo se precisa tratamiento específico ante una HN hipotónica o hipoosmolar.
Una de las clasificaciones más importantes se basa en la presencia o no de síntomas.
La tendencia actual es considerar que toda HN tiene síntomas pero que pueden pasar inadvertidos por ser muy sutiles o estar enmascarados por los del proceso de base, especialmente en ancianos, en los que se ha observado que tienen mayor incidencia de caídas, osteoporosis, déficits de atención, fracturas e inestabilidad en la marcha37. Sin embargo, en el paciente crítico, sigue siendo práctico considerar las HN como asintomáticas o sintomáticas, de acuerdo a la presencia o no de síntomas neurológicos que son los que determinarán la urgencia del tratamiento.
El umbral de riesgo para iniciar tratamiento de la hiponatremia depende de la enfermedad de base y del contexto clínico, siendo más estrictos en pacientes neurocríticos3,38,39. Si no se conoce el tiempo de instauración y no existen síntomas neurológicos graves atribuibles a la misma, es preferible asumirla como crónica para minimizar el riesgo de SDO24,40.
2.a pregunta. ¿Cuál es la relevancia de la valoración de la volemia en el paciente crítico hiponatrémico?Consejos prácticos- •
Intentar realizar una valoración aproximada y precisa de la volemia del paciente con hiponatremia para alcanzar un diagnóstico etiológico correcto.
- •
Realizar un uso combinado de diferentes métodos para la evaluación de la volemia y aproximación al diagnóstico diferencial de hiponatremia.
- •
Evitar utilizar solo criterios clínicos para evaluar el agua corporal total y el VCE en el paciente crítico, especialmente para diferenciar entre el paciente normo- vs. hipovolémico.
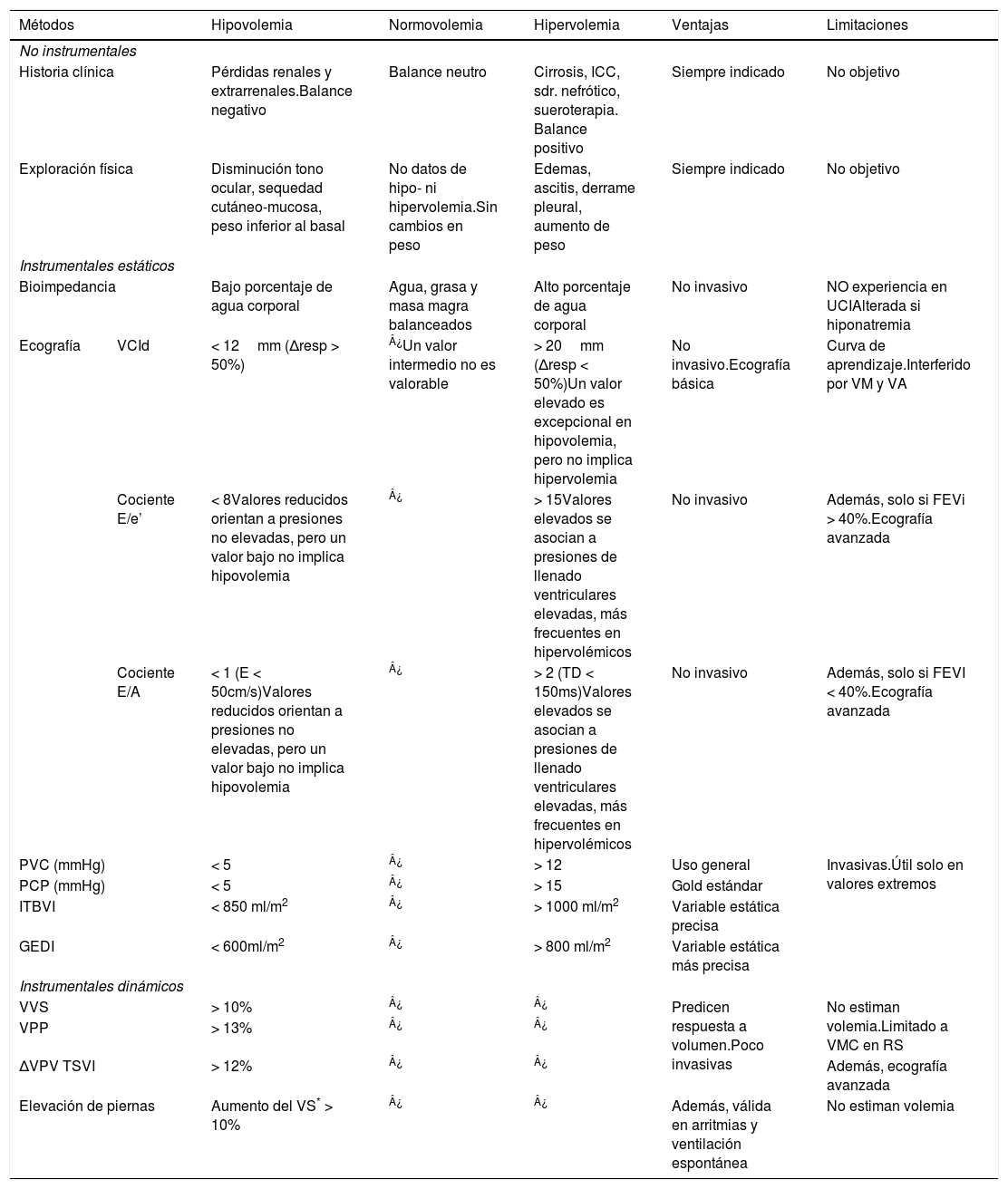
Los pacientes con HN pueden presentar hipo-, normo- o hipervolemia31. En el paciente crítico, la valoración exacta del estado de la volemia y del agua corporal es muy compleja, y no son suficientes los parámetros analíticos o clínicos32 pues pueden coexistir varias causas de HN, y factores específicos que alteran la exploración. Para tener una visión global y evitar potenciales errores, es recomendable una evaluación comprensiva y no solo paramétrica de la volemia, teniendo en consideración la clínica, la evolución temporal y los estimadores de volemia. Tradicionalmente, el volumen extracelular se ha utilizado como el reflejo del VCE y ha sido el parámetro valorado en primer lugar para hacer una aproximación fisiopatológica9. Sin embargo, el VCE es el que condiciona los mecanismos que favorecen el desarrollo de HN y por tanto la clave para el diagnóstico correcto. En este documento utilizaremos los términos de VCE (volemia) vs. agua corporal total para disminuir la ambigüedad. La estimación del VCE no es fácil41–44 y precisa la evaluación de aspectos clínicos y métodos instrumentales (tabla 3). Esta estimación es más compleja cuando coexisten estados edematosos con un VCE bajo e ineficaz (insuficiencia cardiaca congestiva, síndrome nefrótico o cirrosis) ya que en estos escenarios se estimula la secreción no osmótica de ADH y el sistema renina angiotensina aldosterona45 con la consiguiente disminución en la excreción de agua libre y aparición de HN46. En la tabla 3 se detallan los métodos disponibles para evaluar la volemia efectiva aunque somos conscientes de la dificultad que entraña. Si bien la historia clínica es esencial, en casos dudosos podemos utilizar la monitorización hemodinámica para complementar el diagnóstico, aunque debe aplicarse con cautela en el contexto de la HN.
Métodos de estimación del estado de hidratación en el paciente crítico
| Métodos | Hipovolemia | Normovolemia | Hipervolemia | Ventajas | Limitaciones | |
|---|---|---|---|---|---|---|
| No instrumentales | ||||||
| Historia clínica | Pérdidas renales y extrarrenales.Balance negativo | Balance neutro | Cirrosis, ICC, sdr. nefrótico, sueroterapia. Balance positivo | Siempre indicado | No objetivo | |
| Exploración física | Disminución tono ocular, sequedad cutáneo-mucosa, peso inferior al basal | No datos de hipo- ni hipervolemia.Sin cambios en peso | Edemas, ascitis, derrame pleural, aumento de peso | Siempre indicado | No objetivo | |
| Instrumentales estáticos | ||||||
| Bioimpedancia | Bajo porcentaje de agua corporal | Agua, grasa y masa magra balanceados | Alto porcentaje de agua corporal | No invasivo | NO experiencia en UCIAlterada si hiponatremia | |
| Ecografía | VCId | < 12mm (Δresp > 50%) | ¿Un valor intermedio no es valorable | > 20mm (Δresp < 50%)Un valor elevado es excepcional en hipovolemia, pero no implica hipervolemia | No invasivo.Ecografía básica | Curva de aprendizaje.Interferido por VM y VA |
| Cociente E/e’ | < 8Valores reducidos orientan a presiones no elevadas, pero un valor bajo no implica hipovolemia | ¿ | > 15Valores elevados se asocian a presiones de llenado ventriculares elevadas, más frecuentes en hipervolémicos | No invasivo | Además, solo si FEVi > 40%.Ecografía avanzada | |
| Cociente E/A | < 1 (E < 50cm/s)Valores reducidos orientan a presiones no elevadas, pero un valor bajo no implica hipovolemia | ¿ | > 2 (TD < 150ms)Valores elevados se asocian a presiones de llenado ventriculares elevadas, más frecuentes en hipervolémicos | No invasivo | Además, solo si FEVI < 40%.Ecografía avanzada | |
| PVC (mmHg) | < 5 | ¿ | > 12 | Uso general | Invasivas.Útil solo en valores extremos | |
| PCP (mmHg) | < 5 | ¿ | > 15 | Gold estándar | ||
| ITBVI | < 850 ml/m2 | ¿ | > 1000 ml/m2 | Variable estática precisa | ||
| GEDI | < 600ml/m2 | ¿ | > 800 ml/m2 | Variable estática más precisa | ||
| Instrumentales dinámicos | ||||||
| VVS | > 10% | ¿ | ¿ | Predicen respuesta a volumen.Poco invasivas | No estiman volemia.Limitado a VMC en RS | |
| VPP | > 13% | ¿ | ¿ | |||
| ΔVPV TSVI | > 12% | ¿ | ¿ | Además, ecografía avanzada | ||
| Elevación de piernas | Aumento del VS* > 10% | ¿ | ¿ | Además, válida en arritmias y ventilación espontánea | No estiman volemia | |
GEDI: Global End Diastolic Volume Index; ITBVI: Intrathoracic Blood Volume Index; mmHg: milímetros de mercurio; PCP: presión capilar pulmonar; PVC: presión venosa central; Δresp: variación respiratoria; RS: ritmo sinusal; TD: tiempo de desaceleración de flujo de llenado ventricular izquierdo; VA: ventana acústica; VCId: diámetro de vena cava inferior; VM: ventilación mecánica; VMC: ventilación mecánica controlada; VPP: variación de presión de pulso; VS: volumen sistólico; ΔVPV TSVI: variación del pico de velocidad de flujo del tracto de salida del ventrículo izquierdo;VVS: volumen de variación sistólica.
Objetivos generales del tratamiento de HN
- •
Adecuar el tratamiento de la HN a la gravedad de los síntomas, al tiempo de evolución, a la causa y a la fisiopatología de la misma.
- •
Realizar un tratamiento individualizado en base al riesgo de sobrecorrección vs. riesgo de edema cerebral.
- •
Iniciar un tratamiento precoz si la HN es aguda o grave.
- •
Evitar la corrección inadecuadamente rápida de la natremia ya que puede producir daño neurológico estructural.
- •
Evitar el uso de fórmulas de corrección de HN, por alto riesgo de sobrecorrección.
Objetivos específicos del tratamiento. Monitorización de HN
- •
Optimizar la oxigenación y corregir los niveles de potasio forman parte del plan terapéutico de la hiponatremia.
- •
Evitar el uso de fluidos hipotónicos ante una HN grave o sintomática.
- •
Utilizar suero salino hipertónico (SSH) al 3% cuando los síntomas son graves y ajustar su administración al peso del paciente (0,5 a 2ml/kg) según la velocidad de corrección deseada.
- •
Seguir un esquema de tratamiento y monitorización que combine el aumento de natremia y el tiempo ideal de corrección.
- •
Monitorizar el tratamiento de la HN con datos de Na+ en sangre y orina.
En el tratamiento de la HN es fundamental tener en cuenta objetivos generales, considerando cada caso, con el fin de evitar un retraso en el manejo o una corrección excesivamente rápida21,34,47–49.
La individualización, permitirá plantear un esquema de tratamiento a corto-medio plazo que combine de forma adecuada los incrementos de natremia y el tiempo ideal de corrección (tabla 4). De la misma manera, la monitorización del paciente crítico con HN ha de ser apropiado a los planes terapéuticos establecidos.
Tratamiento de la hiponatremia
| Manejode hiponatremia | Objetivo | Incremento de Na+ ideal | Incremento de Na+ máximo | Ritmo recomendado de aumento [Na+]p | Monitorización |
|---|---|---|---|---|---|
| Aguda grave | Control de síntomas neurológicos | 6 mmol/l en 6h8 mmol/l en 24h | 8 mmol/l en 24h(general)12 mmol/l en 24h(neurocríticos)6 mmol/l en 24h(riesgo SDO) | 2h: 0,5-2 mmol/l6h: 2-5 mmol/l24h: 6-8 mmol/l48h: 12-14 mmol/l | [Na+], [K+] plasma y orina c/ 2 h en las primeras 6 h.[Na+], [K+] plasma y orina c/ 4 h hasta las primeras 24hDiuresis horaria |
| Aguda no grave | Corrección de [Na+] a > 120 mmol/l | 6-8 mmol/l cada 24h | 8 mmol/l en 24h | 24h: 6-8 mmol/l48h: 12-14 mmol/l | [Na+], [K+] plasma y orina c/ 8 h.Diuresis c/ 8 h. |
| Crónica | Corrección de [Na+] a > 120 mmol/l | 4-6 mmol/l cada 24h | 6 mmol/l en 24 h | 24h: 4-6 mmol/l48h: 12 mmol/l | [Na+], [K+] plasma y orina c/ 8 h.Diuresis c/ 8 h. |
h: h; mmol/l: milimoles por litro; K+: potasio; Na+: sodio; p: plasmática; SDO: síndrome de desmielinización osmótica.
Consideramos que la hipoxemia y la hipokalemia deben tenerse en cuenta en el plan terapéutico ya que pacientes con hiponatremia e hipoxemia tienen peor pronóstico24, pues la hipoxemia puede alterar la extrusión de solutos al bloquear la bomba Na-K-ATPasa y retrasar la resolución del edema cerebral50. De la misma manera se han reportado casos de SDO con correcciones lentas de la natremia en pacientes con hipopotasemia, especulando que la concentración reducida de la Na-K-ATPasa en la membrana endotelial en la hipopotasemia puede predisponer a la lesión de las neuronas por el estrés osmótico asociado a la corrección de la natremia51,52.
En cuanto al tratamiento específico, se puede utilizar la infusión de SSH 3% en bolos o en perfusión6,45,53.
El uso de fórmulas para el cálculo de corrección de la natremia, aunque es práctica común, puede ser peligroso por alto riesgo de sobrecorrección o aporte de grandes cantidades de volumen que sería prohibitivo en pacientes con insuficiencia cardiaca54. Estas fórmulas consideran al paciente como un sistema cerrado e ignoran la respuesta renal del paciente a dicha infusión pudiendo ser inexactas55.
4.a pregunta. En el paciente hiponatrémico ¿cuál es el tratamiento más adecuado según el tipo de hiponatremia?Consejos prácticos- •
Utilizar SSH 3% en la encefalopatía hiponatrémica, independientemente de la causa.
- •
Emplear SS 0,9% en la HN hipovolémica, con vigilancia estricta de la acuaresis para evitar la sobrecorrección.
- •
Tratar la causa desencadenante de la HN hipervolémica.
- •
Se puede utilizar vaptanes en HN hipervolémicas refractarias a tratamientos de primera línea.
- •
No utilizar vaptanes en HN graves o hipovolémicas.
- •
Se pueden usar los diuréticos como terapia adyuvante en HN hipervolémicas y normovolémicas.
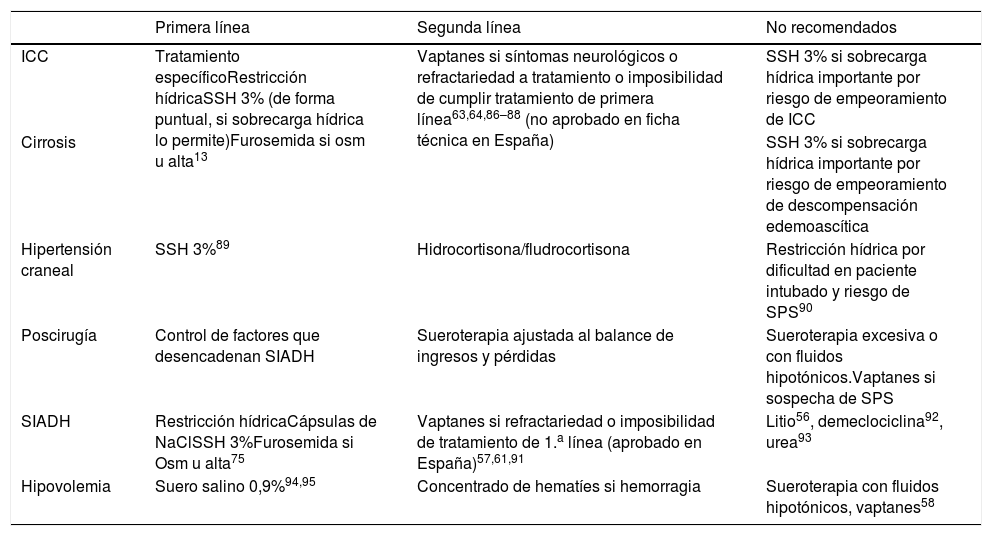
Para la corrección de la HN contamos con la restricción hídrica (RH), cápsulas de ClNa, suero salino (normal o hipertónico)21, diuréticos (furosemida), urea, vaptanes y fludrocortisona1,2,9,56. La elección de un tratamiento u otro se realizará según la etiología y fisiopatología, el ritmo de corrección deseado y las comorbilidades asociadas (tabla 5). Los diuréticos de asa pueden ser útiles como coadyuvantes a los tratamientos iniciados en HN euvolémicas o hipervolémicas56.
Tratamiento de la hiponatremia según la patología asociada
| Primera línea | Segunda línea | No recomendados | |
|---|---|---|---|
| ICC | Tratamiento específicoRestricción hídricaSSH 3% (de forma puntual, si sobrecarga hídrica lo permite)Furosemida si osm u alta13 | Vaptanes si síntomas neurológicos o refractariedad a tratamiento o imposibilidad de cumplir tratamiento de primera línea63,64,86–88 (no aprobado en ficha técnica en España) | SSH 3% si sobrecarga hídrica importante por riesgo de empeoramiento de ICC |
| Cirrosis | SSH 3% si sobrecarga hídrica importante por riesgo de empeoramiento de descompensación edemoascítica | ||
| Hipertensión craneal | SSH 3%89 | Hidrocortisona/fludrocortisona | Restricción hídrica por dificultad en paciente intubado y riesgo de SPS90 |
| Poscirugía | Control de factores que desencadenan SIADH | Sueroterapia ajustada al balance de ingresos y pérdidas | Sueroterapia excesiva o con fluidos hipotónicos.Vaptanes si sospecha de SPS |
| SIADH | Restricción hídricaCápsulas de NaClSSH 3%Furosemida si Osm u alta75 | Vaptanes si refractariedad o imposibilidad de tratamiento de 1.a línea (aprobado en España)57,61,91 | Litio56, demeclociclina92, urea93 |
| Hipovolemia | Suero salino 0,9%94,95 | Concentrado de hematíes si hemorragia | Sueroterapia con fluidos hipotónicos, vaptanes58 |
ICC: insuficiencia cardiaca congestiva; NaCl: cloruro de sodio; Osm u: osmolalidad urinaria; SIADH: síndrome de secreción inadecuada de hormona antidiurética; SPS: síndrome pierde sal; SSH 3%: suero salino hipertónico al 3%.
Los vaptanes, antagonistas del receptor V2, aumentan la excreción de agua libre, disminuyendo la Osmu y aumentando la natremia57. En 2006, dos ensayos clínicos aleatorizados conocidos como Study of Ascending Levels of Tolvaptan in hyponatremia (SALT-1 y SALT-2) compararon la eficacia del tolvaptan frente a placebo en 225 y 223 pacientes respectivamente con hiponatremias euvolémicas e hipervolémicas, siendo en ambas cohortes al menos el 50% de las hiponatremias graves. Demostraron un incremento en la concentración sérica de sodio desde el inicio hasta el día 4 de tratamiento y desde el inicio hasta el día 30 en todos los pacientes tratados con una dosis inicial diaria de 15mg que podía aumentarse en función del incremento del sodio sérico observado58. En España, el tolvaptan solo está aprobado para el síndrome de secreción inadecuada de ADH (SIADH)59 refractario a las medidas de primera línea, a pesar de la escasa evidencia de las mismas, o cuando no es posible llevarlas a término60. Se recomienda iniciar el tratamiento en el ámbito hospitalario y no aplicar simultáneamente RH ni aportar SSH 3% por riesgo de sobrecorrección. Por la misma razón, en pacientes con alteraciones en el mecanismo de la sed (intubados o sedados), hay que asegurar el aporte de fluidos.
Consideramos que en pacientes críticos podría ser beneficioso disminuir la dosis inicial a 7,5mg. En algunos casos, se ha valorado la administración de una dosis única y decidir posteriormente si se repite o se establece un tratamiento continuado (recomendación fuera de ficha técnica)61. Si la corrección es demasiado rápida será necesario suspender el fármaco o disminuir la dosis. Como efectos secundarios se han descrito sed, polaquiuria, deshidratación o hipotensión ortostática58.
La hiponatremia hipervolémica que suele ocurrir en pacientes con insuficiencia cardiaca, cirrosis hepática y síndrome nefrótico precisa tratamiento específico de la enfermedad de base que ayudará entre otras cosas a aumentar el aclaramiento de agua libre y con ello mejorará la HN. Sin embargo, existen algunos pacientes refractarios a dichas medidas y a pesar de que en nuestro país en este tipo de hiponatremias no tienen indicación los vaptanes, en ocasiones y fuera de ficha técnica podrían ser utilizados. En este sentido, en pacientes con insuficiencia cardiaca la administración conjunta de tolvaptan y el tratamiento estándar de la insuficiencia cardiaca incluyendo diuréticos de asa, mejoró a corto plazo la situación clínica global y la hiponatremia aunque no demostró beneficio en la mortalidad62,63. De la misma manera, pacientes con cirrosis hepática descompensada y ascitis refractaria tuvieron buena respuesta al tolvaptan, con aumento del volumen urinario y de la natremia y con mejoría de la ascitis64.
Las hiponatremias hipovolémicas se caracterizan por depleción de volumen extracelular y el aporte de suero salino al 0,9% es suficiente para su corrección65. Los vaptanes no estarían indicados en este tipo de HN ni tampoco en las HN agudas sintomáticas. Estas últimas requieren tratamiento urgente que incremente la natremia y la indicación en este contexto es el SSH 3%, ya que aunque no existen datos en la literatura que apoye el uso de vaptanes en este tipo de HN, el inicio de acción del tolvaptan se produce a las 2 h y por lo tanto no tendríamos el efecto inmediato que buscamos.
El tolvaptan tampoco tiene indicación en pacientes con hipotiroidismo o insuficiencia suprarrenal66.
5.a pregunta. ¿Es importante un estudio de causas de síndrome de secreción inadecuada de hormona antidiurética secundario en el paciente crítico?Consejos prácticos- •
Estudiar las causas que puedan desencadenar un SIADH secundario, y considerar que el SIADH primario es un diagnóstico de exclusión.
- •
Para poder realizar el diagnóstico de SIADH es necesario que se cumplan los siguientes criterios: [Na+]p < 135 mEq/l, Osmp < 275 mOsm/kg, Osmu > 100 mOsm/kg, [Na+]u > 30 mmol/l con aporte de Na+ adecuado, filtrado glomerular > 60ml/min, función tiroidea y suprarrenal normal, euvolemia, ausencia de diuréticos y ausencia de estímulos fisiológicos de ADH (cirugía, dolor, afectación torácica, pulmonar o cerebral).
- •
El diagnóstico de SIADH sin un despistaje correcto de causa secundaria puede llevar a un diagnóstico erróneo y un tratamiento inadecuado.
El SIADH se produce por liberación no fisiológica de ADH (en la pituitaria o ectópica) o por mayor actividad de la misma debida a un trastorno genético en sus receptores. La ADH disminuye la excreción renal de agua libre con excreción de Na+ normal, provocando una HN hipoosmolar euvolémica. Entre las causas de SIADH, destacan neoplasias, enfermedades del SNC, patología pulmonar, fármacos y drogas, causas transitorias y genéticas (mutación del gen del receptor V2).
Aunque los criterios diagnósticos del SIADH están claramente definidos desde hace años, es importante recordar que se trata de un diagnóstico de exclusión y que el primer paso es confirmar que existe normovolemia lo que resulta muy difícil en el paciente crítico. El segundo paso es comprobar que se cumplen todos los criterios bioquímicos validados y sabemos que en la práctica diaria no se realiza. Un estudio reciente italiano ha reportado que menos de la mitad de los médicos encuestados usaron dichos parámetros para realizar el diagnóstico67. Además se ha visto que en pacientes con hemorragia subaracnoidea el 70% de las HN normovolémicas son por SIADH y el 10% por déficit de cortisol68, de ahí la importancia de recordar que debemos disponer de todos los criterios para un diagnóstico correcto pues el tratamiento será diferente.
6.a pregunta. En el paciente con SIADH ¿cuál es el tratamiento más adecuado para corregir la hiponatremia?Consejos prácticos- •
Evitar la utilización de RH, urea, litio o demeclociclina en el tratamiento del SIADH.
- •
Se puede utilizar los vaptanes en el tratamiento del SIADH cuando la restricción hídrica no sea factible y no presente síntomas neurológicos graves.
- •
Se debe controlar la natremia a las 6-8h de la administración de los vaptanes, para ajustar las siguientes dosis.
El tratamiento del SIADH debe iniciarse controlando los estímulos fisiológicos que liberan ADH. La RH y el aporte de solutos (cápsulas de ClNa, proteínas) se plantearán en pacientes con síntomas leves o de instauración crónica56 y la administración de SSH al 3% en casos de síntomas graves e instauración aguda69.
La restricción hídrica sigue estando como primera línea de tratamiento en las guías recientemente publicadas en el manejo de HN por SIADH, a pesar de la ausencia reconocida de ensayos controlados aleatorios que demuestren su eficacia o seguridad. Los resultados de un registro de hiponatremia mostraron que la restricción de líquidos no era mejor que ningún tratamiento en pacientes con SIADH70. En el paciente crítico además, es difícil de aplicar pues es imprescindible la administración de fluidos, antibióticos intravenosos o soporte nutricional. Asimismo, suele requerir varios días de cumplimiento para que sea eficaz, es mal tolerada y no es eficaz en todos los pacientes. Las guías americanas1 documentan una serie de parámetros que pueden predecir una pobre respuesta a la RH y son: una Osmu alta (> 500 mOsm/kg), una diuresis < 1500ml /día [Na+ + K+]u > [Na+]p y un ritmo de corrección de la natremia lento (< 2 mEq/l en 24-48h)13.
A pesar que de manera repetida se ha propuesto la urea como tratamiento de la HN por SIADH, la evidencia que sustenta esta práctica dista mucho de ser convincente pues los estudios son escasos y heterogéneos, no aleatorizados, con dosis e intervalos de administración variables y utilizada en HN crónicas71. De la misma manera, la corrección que produce tampoco es predecible y puede asociarse a deshidratación o sobrecorrección, aumentar la urea plasmática y en la actualidad no disponemos de experiencia con su manejo, por lo que no podemos recomendar su uso. Lo mismo sucede con el litio o demeclociclina, pues la respuesta es variable, no predecible y presenta alto riesgo de toxicidad renal. Una revisión sistemática reciente no encontró ninguna evidencia sobre seguridad y eficacia72 y solo un 3% de los médicos la utilizan en el SIADH70 por lo que tampoco podemos recomendar su uso73.
Los diuréticos de asa en el SIADH aunque pueden ser útiles a corto plazo si la Osmu es elevada (preferiblemente > 400 mOsm/kg) al incrementar el aclaramiento de agua libre por la nefrona, no disponemos de estudios aleatorizados que apoyen su uso. Podrían utilizarse en pacientes con SIADH transitorios (secundarios a neumonías o por fármacos que se puedan suspender)60.
Los vaptanes, antagonistas de los receptores V2, parecen el tratamiento lógico del SIADH ya que al unirse a dichos receptores no se insertan las AQ2 en el túbulo colector aumentando el aclaramiento de agua libre o acuaresis. Los estudios SALT58 han demostrado la efectividad del tolvaptan en incrementar la natremia en una cohorte de pacientes mixta (SIADH, HN hipervolémicas) respecto al placebo incluso al mes de tratamiento. Suelen incrementar la natremia entre 5-7 mEq/l a las 24 h siguientes de su administración aunque el efecto es variable. En este sentido, las guías europeas no indican su uso en ningún tipo de HN, justificando entre otras cosas que los ensayos clínicos aleatorizados realizados han sido esponsorizados por la industria. Si bien esto es una consideración seria en la medicina basada en la evidencia, es mejor basarse en estudios bien diseñados que en series de casos a nuestro entender. Sería valioso disponer de estudios que compararan los vaptanes con las medidas consideradas de primera línea. Según nuestro criterio, los vaptanes no estarían indicados en una HN con síntomas neurológicos graves, por su respuesta impredecible y no suficientemente rápida.
7.a pregunta. En el paciente hiponatrémico ¿cómo diferenciar un síndrome de secreción inadecuada de ADH, síndrome pierde sal e insuficiencia suprarrenal? (tabla S2 del material suplementario).Consejos prácticos- •
Es importante realizar el diagnóstico diferencial entre SIADH y síndrome pierde sal (SPS) ya que el tratamiento para cada entidad es contrario (restricción de agua libre vs. sueroterapia).
- •
Evaluar la volemia y el ritmo de diuresis para diferenciar entre SIADH y SPS, no obstante, ambos síndromes pueden formar parte de un desorden mixto y su presentación depende de la intensidad de cada mecanismo.
- •
Evitar la carga de fluidos y la restricción hídrica como método diferenciador entre SIADH vs. SPS, pues puede ser contraproducente para la evolución clínica del paciente.
- •
Determinar el cortisol basal para el diagnóstico de insuficiencia suprarrenal (ISR). Ante valores inapropiadamente bajos, es beneficioso realizar el test de estimulación de ACTH para diferenciar entre primaria o secundaria.
- •
Administrar SS 0,9% y glucosa endovenosa si hay hipoglucemia en el paciente con HN secundaria a ISR.
- •
Aportar tratamiento sustitutivo con hidrocortisona (dosis de estrés o mantenimiento) y fludrocortisona (tras confirmación diagnóstica) además de asegurar medidas frente a la hiperpotasemia en los pacientes con HN secundarias a ISR.
- •
Es importante monitorizar el sodio en sangre y orina, la Osmu y el ritmo de diuresis tras iniciar tratamiento con glucocorticoides, ya que pueden provocar una acuaresis amplia con riesgo de sobrecorrección.
- •
La presencia de HN secundaria a hipotiroidismo es muy poco frecuente y solo puede considerarse como causa de HN si la gravedad del cuadro es importante.
En el SPS de origen cerebral, la HN es hipoosmolar hipovolémica por la disfunción neurológica secundaria al daño cerebral. En la actualidad no está clara su definición60, su diagnóstico es excepcional68 y existen dudas sobre el mecanismo fisiopatogénico74. La natriuresis origina un descenso del VCE que estimulará la ADH75. Una alteración en el túbulo proximal favorece la excreción de ácido úrico, Na+ y fósforo76. Habitualmente, cursa con hipouricemia, pero no será un buen marcador para diferenciar SIADH de SPS. No obstante, corregida la HN, la excreción fraccional de ácido úrico puede ayudar a diferenciarlos pues en el SPS continuará elevada (> 12%). El tratamiento se basa en el aporte de fluidos para normalizar el VCE76.
La ISR se produce por un déficit en la síntesis de hormonas en las glándulas adrenales. En casos graves, la producción de cortisol y aldosterona puede no cubrir las demandas (estrés) y resultar en HN. En ocasiones, la patología neurológica (TCE o neurocirugía) origina una alteración en la liberación de ACTH y secundariamente de cortisol (ISR secundaria)68.
8.a pregunta. ¿Cómo tratar la hiponatremia en pacientes sometidos a técnicas de depuración renal?Consejos prácticos- •
No recomendamos las técnicas de depuración extrarrenal (TDE) para la corrección de HN.
- •
Las TDE son un factor de riesgo de corrección rápida de la hiponatremia.
- •
Sugerimos no usar citrato como anticoagulante si el paciente presenta hiponatremia grave.
- •
Para evitar una corrección rápida de la natremia en un paciente con HN grave que necesite TDE por cualquier otra causa consideramos útiles las siguientes aportaciones:
- ∘
Aplicar técnicas continuas de depuración extrarrenal (TCDE) en lugar de hemodiálisis intermitente.
- ∘
Añadir agua a las soluciones comerciales usadas en TCDE para ajustar a la natremia del paciente. Utilizar la dosis más baja de aclaramiento.
- ∘
Monitorización estrecha de la natremia durante la realización de TCDE.
La enfermedad renal supone entre el 2 y el 12% de las causas de HN. En aquellos casos que requieren TDE y presentan HN, aun cuando la uremia elevada atenúa los efectos de la elevación rápida de la [Na+]p, se puede provocar una sobrecorrección determinada por la técnica (dependiendo de la dosis aplicada y el sodio de los fluidos). Una alternativa para prevenirla es añadir agua estéril en las bolsas de diálisis para mantener el sodio en las soluciones entre 6-8 mEq/l por encima de la [Na+]p deseada77–79 (tabla 6) y aplicar una dosis baja y prolongada en el tiempo80.
Dosis de agua a añadir a las bolsas de 5 L de baño de intercambio de TCDE
| Agua a añadir (ml) | [Na+] objetivo final (mEq/l) | Bicarbonato objetivo final (mEq/l) |
|---|---|---|
| 150 | 136 | 34 |
| 250 | 133 | 33 |
| 500 | 127 | 32 |
| 750 | 122 | 30 |
| 1000 | 117 | 29 |
| 1250 | 112 | 28 |
mEq/l: miliequivalentes por litro; ml:ml; Na+: sodio.
Fuente: Yessayan et al.79.
La generalización del uso de citrato como anticoagulante para las TCDE podría suponer una fuente adicional de problemas en el manejo de la hiponatremia, ya que la hipernatremia es una complicación descrita con su uso. Además los sistemas automatizados usados actualmente, aunque permiten un uso fácil y seguro del citrato, exigen una concentración específica de iones en las soluciones empleadas, no debiendo estas ser manipuladas. Por tanto, aunque no existe evidencia publicada a este respecto, las bases fisiológicas y el modo de aplicación del citrato hacen imposible asegurar un ascenso lento o controlado de la natremia por lo que hasta disponer de más datos sugerimos no utilizar citrato como anticoagulante si existe hiponatremia grave.
9.a pregunta. Si durante el tratamiento de la hiponatremia se produce sobrecorrección ¿cómo manejar la misma?Consejos prácticos- •
Disminuir la [Na+]p ante una sobrecorrección para evitar el SDO cerebral.
- •
Utilizar SG 5% para disminuir la natremia si existe hipercorrección.
- •
Usar desmopresina en casos de incremento excesivo de Na+p.
- •
Se debe controlar el ritmo de corrección especialmente cuando existan factores favorecedores de hipercorrección: hipovolemia, hipoxemia, bebedores de cerveza, náuseas, vómitos, dolor, tiazidas o inhibidores de la recaptación de serotonina, insuficiencia suprarrenal o TCDE entre otros.
La monitorización de la Osmu y del volumen urinario puede ayudar a predecir el riesgo de sobrecorrección81,82. En caso de sobrepasar los límites planeados, y a pesar de la escasa evidencia disponible, las guías recomiendan disminuir la [Na+]p de nuevo mediante el uso de agua por vía enteral, suero glucosado 5% (3ml/kg/h)47 y/o desmopresina (2-4μg/iv)83 para evitar el SDO. La desmopresina provoca la reabsorción de agua a nivel del túbulo colector disminuyendo la natremia y ha demostrado su efectividad aunque en estudios retrospectivos y series de casos84,85.
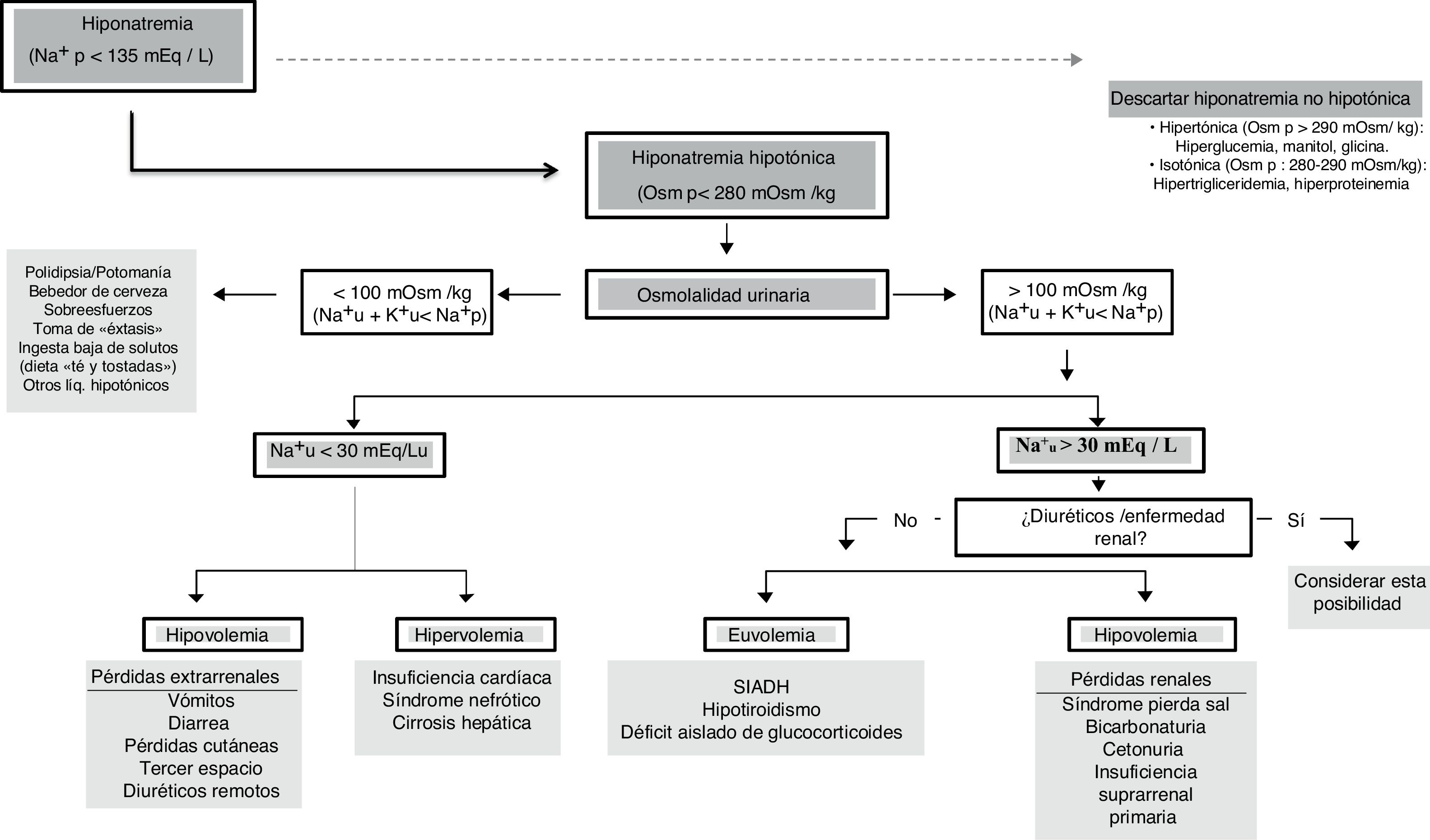
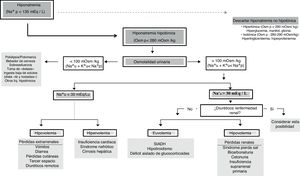
Algoritmo adoptado para el diagnóstico de la hiponatremiaEl objetivo final del presente panel de expertos ha sido adoptar un algoritmo diagnóstico que pueda ser útil para pacientes críticos (fig. 1).
Ante un [Na+]p < 135 mEq/l debemos confirmar una verdadera HN (Osmp < 280 mOsm/kg). En este punto, si el paciente presenta síntomas graves se tratará de una urgencia y habrá que tratarla. Posteriormente se evaluará la Osmu y si es < 100 mOsm/kg debemos descartar aporte elevado de soluciones hipotónicas o ingesta insuficiente de sodio o proteínas (potomanía, bebedor de cerveza, toma de éxtasis acompañado de agua, dietas hipoproteicas). Un [K++Na+]u < [Na+]p informa que la excreción de agua libre está preservada. Si la Osmu es > 100 mOsm/kg o [K++Na+]u > [Na+]p la excreción de agua libre puede estar disminuida y valoraremos el [Na+] urinario ya que si es > 30mEq/l deberemos descartar alteración renal o ingesta de diuréticos y si < 30mEq/l podemos asumir que el riñón compensa un VCE bajo.
Debemos evaluar la volemia pues los diuréticos, el SPS, o la insuficiencia suprarrenal cursan con volemia disminuida y el SIADH, hipotiroidismo o déficit de glucocorticoides con normovolemia. El agua corporal total puede orientar ya que si es baja debemos descartar pérdidas extrarrenales de agua y sodio y si está elevada (edemas) es preciso descartar insuficiencia cardiaca congestiva, síndrome nefrótico o cirrosis.
ConclusionesLa hiponatremia es frecuente en las UCI y en este entorno, la detección de signos y síntomas que provoca se encuentran con frecuencia enmascarados por los de la enfermedad que justificó el ingreso o por las características propias de nuestros pacientes (p. ej. sedación) lo que dificulta la evaluación crítica de su impacto. Por otra parte, los mecanismos etiopatogénicos en estos pacientes suelen ser complejos ya que en ocasiones la propia enfermedad de base se asocia a la génesis de la misma pero en otras ocasiones está integrada dentro de la respuesta fisiopatológica a la agresión dificultando su corrección.
La natremia depende del balance entre ingresos y pérdidas de sodio y agua, aspectos que en nuestros pacientes dependen en muchas ocasiones de nuestras decisiones terapéuticas.
El umbral para definir la hiponatremia dependerá de las características clínicas y estas influirán en la necesidad de corrección y la velocidad a la que podemos realizarla.
La HN produce disfunción neurológica aguda por edema cerebral pero la corrección rápida puede condicionar daño estructural neuronal (SDO) por lo que el tratamiento debe adecuarse a la gravedad de los síntomas, tiempo de evolución y causa, evaluando de forma individualizada el riesgo de sobrecorrección.
Aspectos poco relacionados aparentemente con la HN y que forman parte importante de nuestra práctica clínica, como puede ser la aplicación de TCDE, pueden influir de forma inesperada en la evolución de la HN o su corrección.
Los algoritmos disminuyen la variabilidad en la práctica clínica pero los disponibles para el manejo de la HN no son específicos del paciente crítico, lo que hace deseable adoptar algoritmos como el que proponemos, aunque debemos enfatizar que cualquier algoritmo debe complementarse con el conocimiento del intensivista experimentado.
La principal limitación de este documento es que la búsqueda bibliográfica no fue sistemática y por lo tanto no es reproducible, ya que de la búsqueda inicial realizada se seleccionaron y añadieron publicaciones de acuerdo al criterio individual de los miembros del grupo de expertos. Por otro lado, las recomendaciones de consenso de este documento se basan en gran medida en la experiencia y las opiniones de los autores, sin una base científica de alta calidad, debido al déficit de ensayos clínicos y estudios controlados que permitieran realizar recomendaciones basadas en evidencia para la mayoría de las actitudes terapéuticas descritas. Por tanto, los consejos prácticos realizados en este documento carecen de un sistema reglado de gradación de evidencia, aunque consideramos que pueden ser útiles para la práctica clínica habitual, ya que se han realizado y consensuado por médicos con gran experiencia en pacientes con hiponatremia ingresados en la unidad de críticos.
Por otro lado, las reuniones necesarias para la realización del proyecto fueron auspiciadas por Otsuka Pharmaceutical, pero en todo momento permanecieron al margen de nuestras aportaciones y recomendaciones finales.
El documento y el algoritmo resultantes de este proyecto pretenden clarificar y disminuir la variabilidad en el manejo de estos pacientes, así como permitir en un futuro no muy lejano, evaluar el impacto específico de la hiponatremia en nuestros pacientes. Esperamos que este documento impulse la elaboración de registros de HN en las UCI españolas para disponer de un mejor conocimiento de esta entidad en los pacientes críticos de nuestro país.
FinanciaciónPara la realización del documento se ha contado con el soporte económico de Otsuka Pharmaceutical quienes han sufragado los traslados de los miembros del panel y los gastos derivados de las reuniones, así como todos los miembros del panel declaran haber recibido honorarios por su participación, aunque no en relación con el desarrollo del manuscrito, cuyo contenido editorial reside exclusivamente en los autores del mismo.
Conflicto de interesesLos miembros del panel declaran los siguientes conflictos de intereses:
M.J. Broch Porcar ha recibido honorarios por conferencias de Otsuka Pharmaceutical y Fresenius y por participar en simposio organizado por Otsuka Pharmaceutical.
J.M. Domínguez-Roldán ha recibido honorarios por conferencias de Integra Neurosciences, Otsuka Pharmaceutical y Masimo Corporation, así como por participar en simposio organizado por Otsuka Pharmaceutical.
B. Rodríguez Cubillo declara no tener ningún conflicto de intereses.
L. Álvarez Rocha ha recibido honorarios por docencia de Pfizer y Otsuka Pharmaceutical.
M.A. Ballesteros Sanz ha recibido honorarios por docencia de Otsuka Pharmaceutical y Astellas.
M. Cervera Montes ha recibido honorarios por conferencias y docencia de Nestlé, Abbot Nutrition, Fresenius Kabi, Pfizer, Philips y Covidien.
M. Chico Fernández ha recibido honorarios por docencia de MSD, Octapharma, Behring y Otsuka Pharmaceutical y ha participado en el ensayo NOSTRA de GmpVasopharma.
J.H. de Gea García ha recibido honorarios por docencia de Otsuka Pharmaceutical y Astra Zeneca.
P. Enríquez Giraudo declara no tener ningún conflicto de intereses.
A. García de Lorenzo y Mateos declara no tener ningún conflicto de intereses.
R. Gómez López ha recibido honorarios por conferencias de Astra Zeneca y Pfizer, por consultoría científica de Cardiolife, Maquet, AstraZeneca y Otsuka Pharmaceutical.
R. Guerrero Pavón declara no tener ningún conflicto de intereses.
F. López Sánchez declara no tener ningún conflicto de intereses.
J.A. Llompart-Pou ha recibido honorarios por conferencias de Otsuka pharmaceutical.
S. Lubillo Montenegro ha recibido honorarios por conferencias de Integra Neurosciences hasta junio de 2014.
Z. Molina Collado declara no tener ningún conflicto de intereses.
P. Ramírez Galleymore ha recibido honorarios por conferencias de Pfizer, MSD, OtsukaPharmaceutical y Novartis y por participar en simposio de Otsuka Pharmaceutical.
M. Riveiro Vilaboa declara no tener ningún conflicto de intereses.
A. Sánchez Corral declara no tener ningún conflicto de intereses.
M.E. Herrera-Gutiérrez ha recibido honorarios por conferencias de Baxter, Fresenius y Otsuka Pharmaceutical.
Al Dr. Alberto Tejedor por su colaboración y aportaciones.