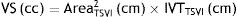Editado por: Ana Ochagavía - Hospital Universitario de Bellvitge. L'Hospitalet de Llobregat. Barcelona. Spain.
Última actualización: Febrero 2024
Más datosLa complejidad de los procedimientos quirúrgicos, así como la comorbilidad de los pacientes sometidos a cirugía cardiaca, van en aumento. La detección y el tratamiento precoz de las complicaciones posquirúrgicas son parte del éxito en la reducción de la morbimortalidad. La introducción de la técnica ecográfica ha sido fundamental en la valoración cardiopulmonar, hemodinámica y etiológica del paciente crítico, aportando información inmediata, fiable y a veces concluyente, permitiendo aclarar muchas situaciones clínicas sin respuesta terapéutica aceptable, por lo que se trata de una herramienta diagnóstica esencial. En este capítulo nos centraremos, fundamentalmente, en la valoración funcional y hemodinámica, y en la detección de las complicaciones cardiológicas más frecuentes en el postoperatorio de cirugía cardiaca.
Surgical complexity as well as comorbidities in patients undergoing cardiac surgery is increasing. Early detection and management of post-surgical complications are key points to reduce morbidity and mortality. Ultrasound technique plays a main rol in cardiopulmonary, hemodynamic and etiological assessment of the critically ill, providing immediate, reliable and, sometimes, conclusive information, clarifying many clinical situations with an inappropriate therapeutic response. For all these reasons ultrasound is an essential diagnostic tool. In this chapter we will focus, mainly, on functional and hemodynamic assessment and on the detection of most common cardiological complications in the postoperative period after cardiac surgery.
La complejidad de los procedimientos quirúrgicos, así como la comorbilidad de los pacientes sometidos a cirugía cardiaca (CC), van en aumento. La detección y el tratamiento precoz de las complicaciones posquirúrgicas son parte del éxito en la reducción de la morbimortalidad.
Los principales problemas de gravedad que pueden presentarse en el postoperatorio cardiaco inmediato (POI) son la inestabilidad hemodinámica, la insuficiencia respiratoria grave y/o los estados de bajo gasto cardiaco (GC). El abordaje inadecuado o tardío puede llevar a un síndrome de disfunción multiorgánica, principal causa de estancia prolongada y morbimortalidad.
La integración de la información proporcionada en relación con la técnica quirúrgica realizada, las incidencias perioperatorias acaecidas, los estudios de imagen prequirúrgicos, junto con la información clínica, semiológica, analítica y hemodinámica en el momento de la evaluación, deben ayudarnos a dar respuesta de la causa etiológica, determinar el perfil hemodinámico que presenta y cuál es el componente principal que lo genera, y así poder seleccionar el tratamiento inicial y valorar el grado de respuesta a la decisión tomada.
La introducción de la técnica ecográfica1 (ecografía cardiológica transtorácica [ETT], ecografía transesofágica [ETE] y ecografía pulmonar [EP]) ha sido fundamental en la valoración cardiopulmonar, hemodinámica y etiológica del paciente crítico, aportando información inmediata, fiable y a veces concluyente, permitiendo aclarar muchas situaciones clínicas sin respuesta terapéutica aceptable.
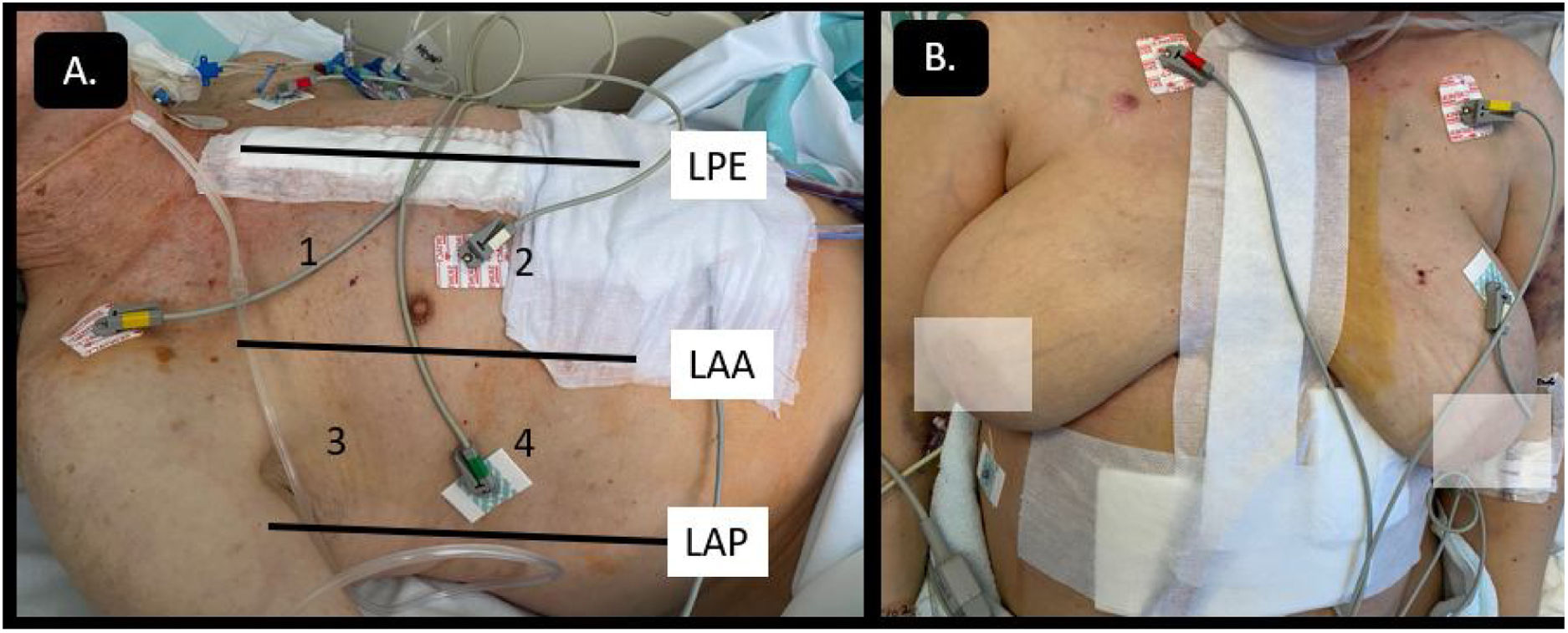
El postoperado de cirugía cardiaca (PC) presenta ciertas dificultades técnicas relacionadas con la limitación para la movilización del paciente: presencia de apósitos, drenajes, imposibilidad de utilizar la vía subxifoidea, dolor posquirúrgico, intubación, soporte ventilatorio, etc. (fig. 1). Son limitaciones técnicas que dificultan la adquisición de imágenes, que, junto con la presencia frecuente de coágulos loculados o de derrame pericárdico-pleural, podrían dificultar la interpretación del estudio ecográfico, precisando, en ocasiones, la combinación de otras técnicas para una adecuada evaluación.
Dado que la valoración respiratoria es tratada en otro capítulo de esta serie, nos centraremos especialmente en la evaluación de las complicaciones cardiovasculares más frecuentes detectadas en el POI2.
Proyecciones más útilesEstudio cardiológicoEstá condicionado en ocasiones por las dificultades técnicas, y por ello no debe descartarse el ETE cuando el riesgo de un retraso en el diagnostico implica un empeoramiento del pronóstico. El examen debe abordar el mayor número de ventanas posibles y utilizar transductores con menor frecuencia para conseguir mayor penetración, en especial en pacientes obesos. Y si la situación clínica lo permite, inclinar ligeramente el paciente hacia la izquierda.
La ventana paraesternal y la ventana apical 4 cámaras y 2 cámaras nos dan un examen completo del ventrículo izquierdo (VI), así como los ejes transversales de la válvula aórtica y mitral, que permiten determinar insuficiencia residual o fugas paravalvulares al poderse alinear de manera correcta. El acceso subxifoideo permite una visión global de las cavidades derechas, del tamaño del ventrículo derecho (VD), de la función tricuspídea y del tamaño de la vena cava inferior; sin embargo, está muy condicionado por la salida de los drenajes mediastínicos y esternales.
Estudio pulmonarDadas las limitaciones anatómicas comentadas, parece práctico realizar un estudio modificado propuesto por Volpicelli3,4 (fig. 1A). Para completar la información sobre este apartado, se remite al lector a los capítulos 3 y 4 de esta serie.
Función ventricular izquierda y derechaLa evaluación de la función del VI es uno de los parámetros más importantes del estudio ecocardiográfico en la mayoría de los casos por las implicaciones pronósticas, diagnósticas y terapéuticas. Evaluación con importantes limitaciones, dado que no existe ninguna medida simple que nos informe del estado funcional del corazón, precisando completar el estudio mediante diferentes modalidades ecocardiográficas.
Los factores que determinan la función del VI son la precarga, la poscarga, la contractilidad intrínseca, el tamaño ventricular, la frecuencia de la contracción, la uniformidad eléctrica y la mecánica de la contracción (sinergia e interdependencia ventricular), y la capacidad de relajación (lusitropismo)5.
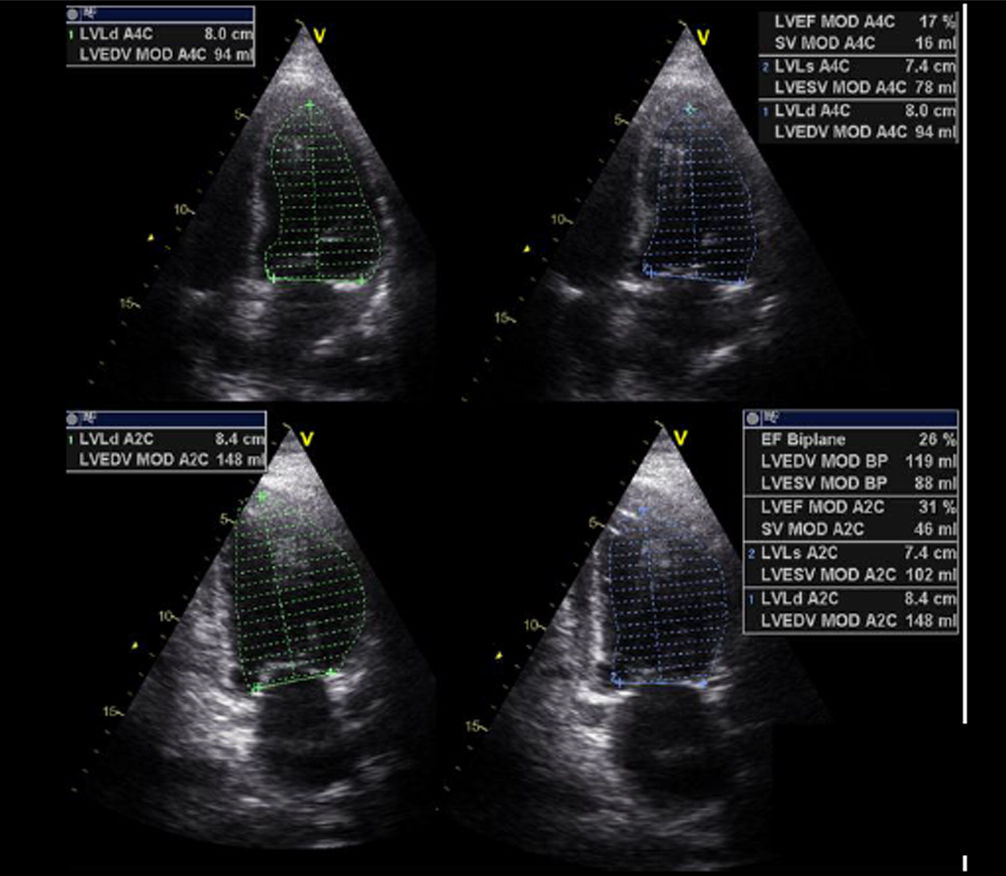
El parámetro ecocardiográfico más utilizado en la práctica clínica es la fracción de eyección del VI (FEVI), a pesar de que, en ocasiones, no refleja adecuadamente la función ventricular, precisando completar el estudio con el análisis de los diámetros, los volúmenes, la geometría, la masa y el grosor parietal, la contractilidad segmentaria, el estudio de función diastólica y la estimación de presiones de llenado, aspectos que se alejan del objetivo contemplado en este capítulo (tabla 1)6-10. En cuanto a la valoración de la función del VD, revisado en otro capítulo de esta serie, la excursión sistólica del plano del anillo tricuspídeo (TAPSE) y la velocidad máxima de la onda sistólica (onda St’)7,11,12 son los parámetros más utilizados por su fácil estimación y su escasa variabilidad interindividual. Asimismo, es un parámetro que depende de la precarga y la poscarga13, y no debe utilizarse en caso de implante de anillo o prótesis a nivel tricuspídeo o calcificación anular severa.
Valoración de la función sistólica ventricular
| FUNCIÓN SISTÓLICA GLOBAL | ||
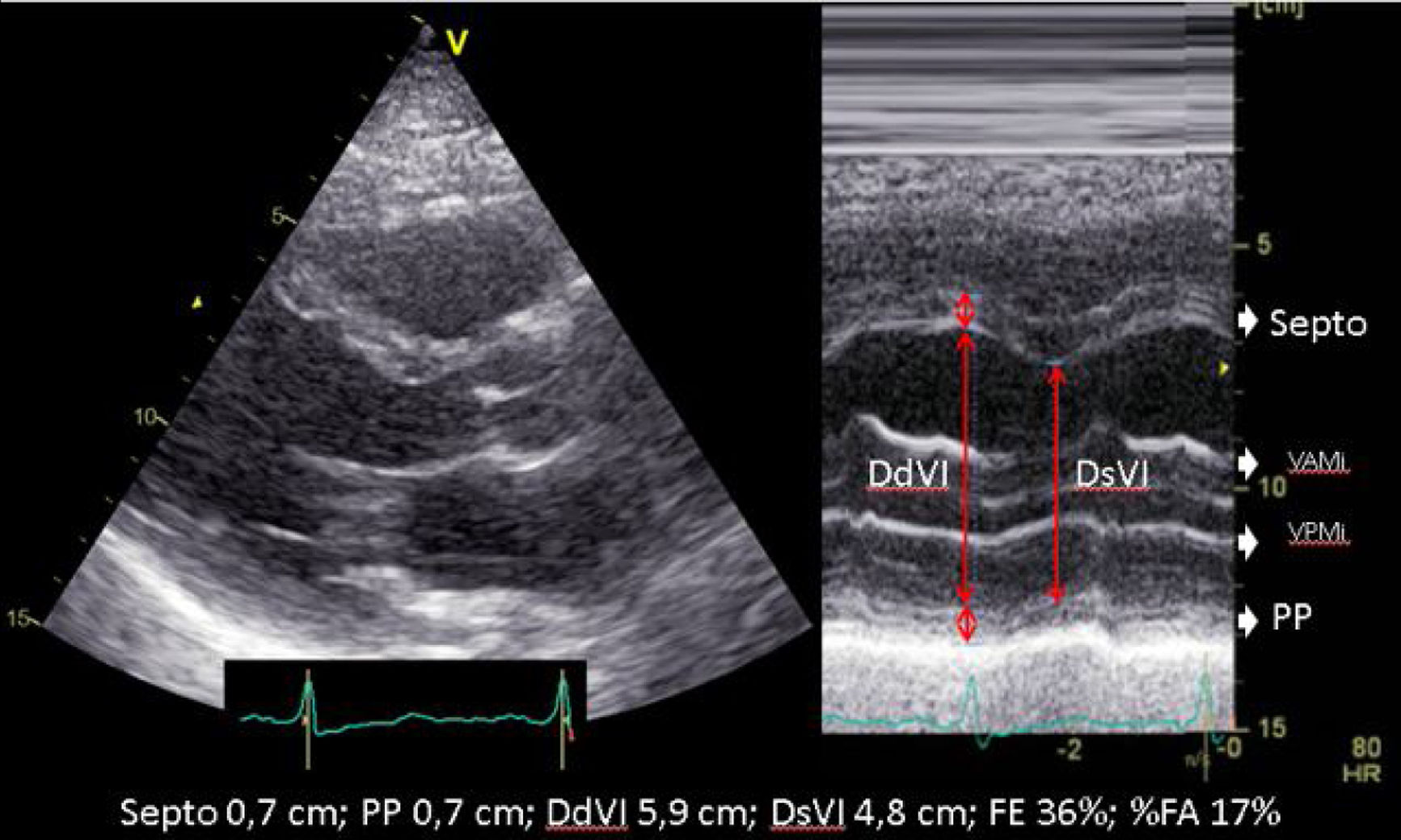
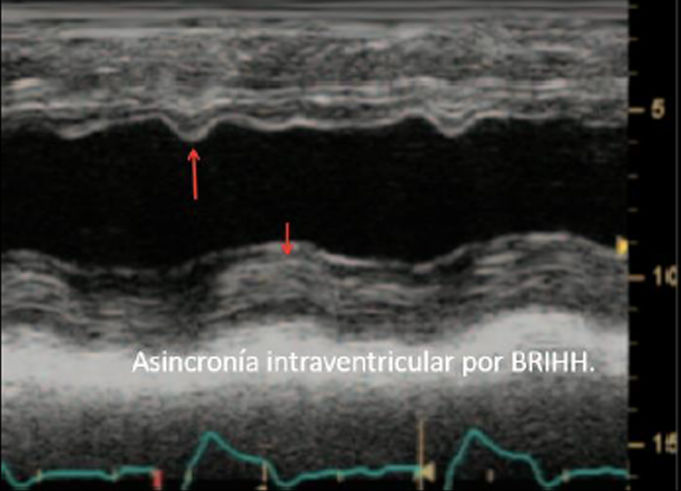
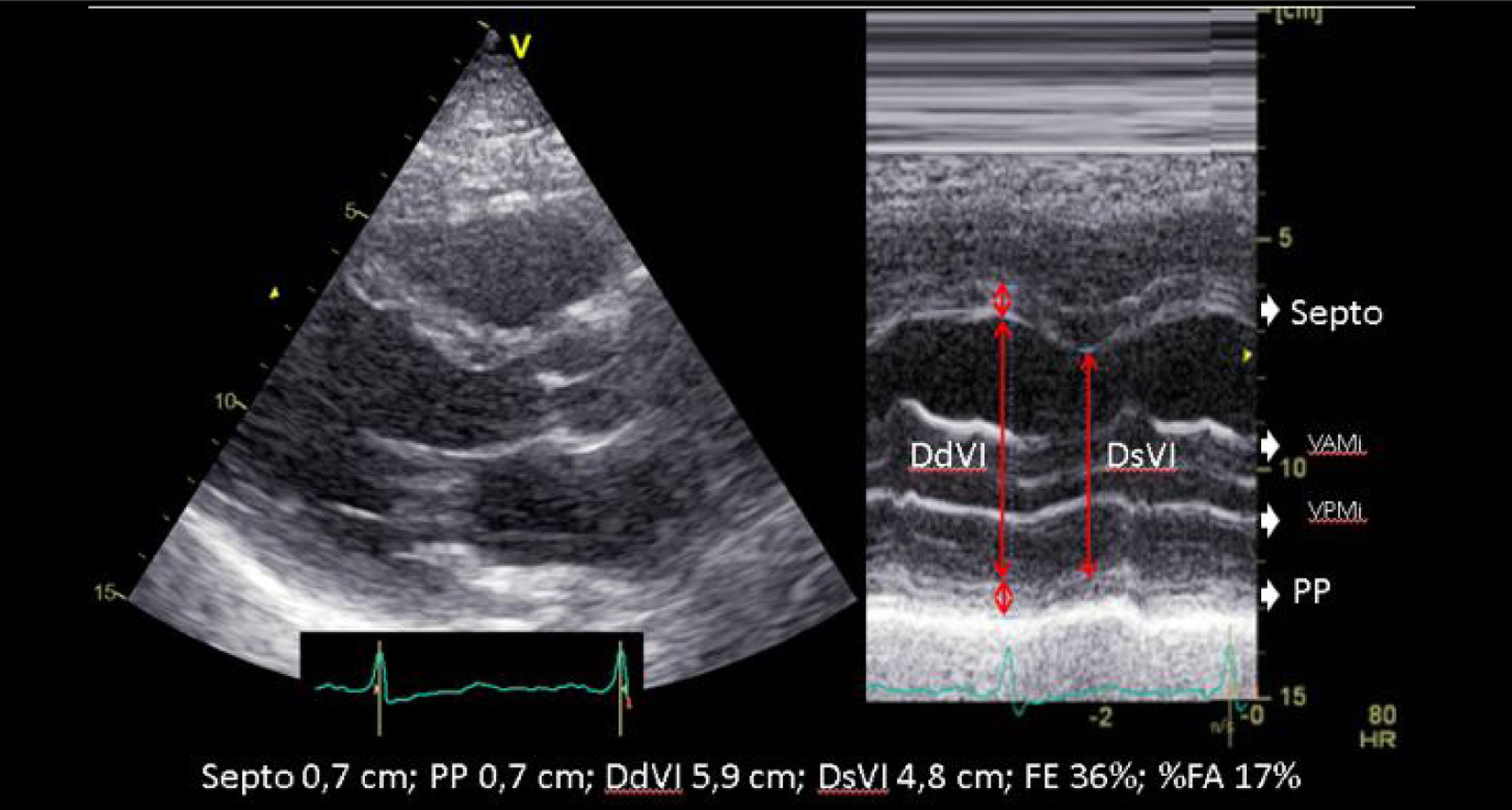
| La estimación visual constituye el método más utilizado en la valoración de la función sistólica. Si bien este método en el caso de observadores expertos tiene aceptable correlación con la determinada por ventriculografía, su precisión disminuye con la menor experiencia y en el caso de ventrículos de morfología anormal, con contracción no homogénea, alteraciones segmentarias de la contractilidad o en presencia de asincronía. | ||
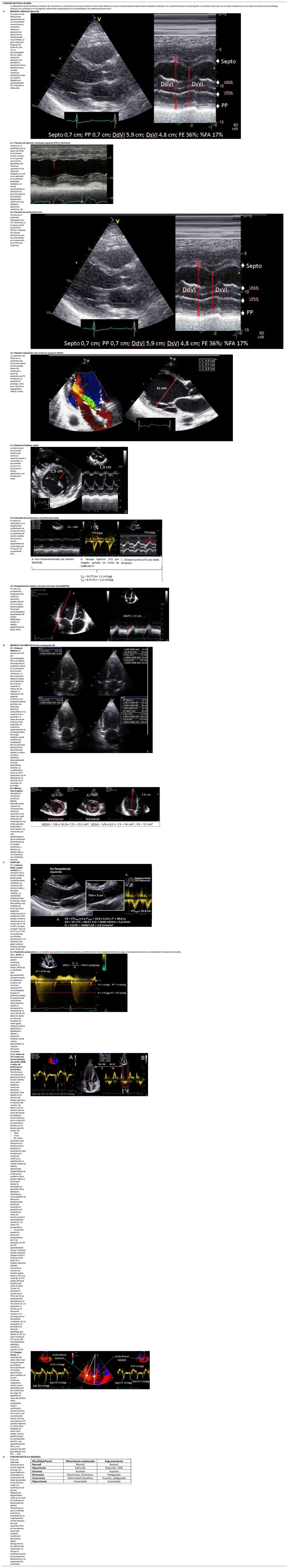
| A. | MEDIDAS LINEALES (Modo-M) | |
| En presencia de alteraciones segmentarias de la contractilidad, necrosis previa, ventrículos esféricos o presencia de asincronía su utilidad queda muy limitada. La gran resolución temporal del modo M, junto con la ecocardiografía 2D con mejor resolución espacial, nos permitirá la evaluación de los diámetros de la cavidad ventricular realizando cortes en modo-M dirigidos por ecocardiografía 2D. Evitando la oblicuidad. | ||
| A.1. Fracción de eyección ventricular izquierda (FEVI) (Teichholz) | ||
| Aunque es un parámetro que se sigue utilizando en la práctica clínica, se basa en el supuesto que la forma geométrica del ventrículo izquierdo es fija (elipsoide alargado), lo cual no es aplicable en numerosas patologías cardiacas, no siendo recomendada su utilización en caso de trastorno de motilidad segmentaria, ventrículos muy dilatados, asincronía ventricular, etc. | ||
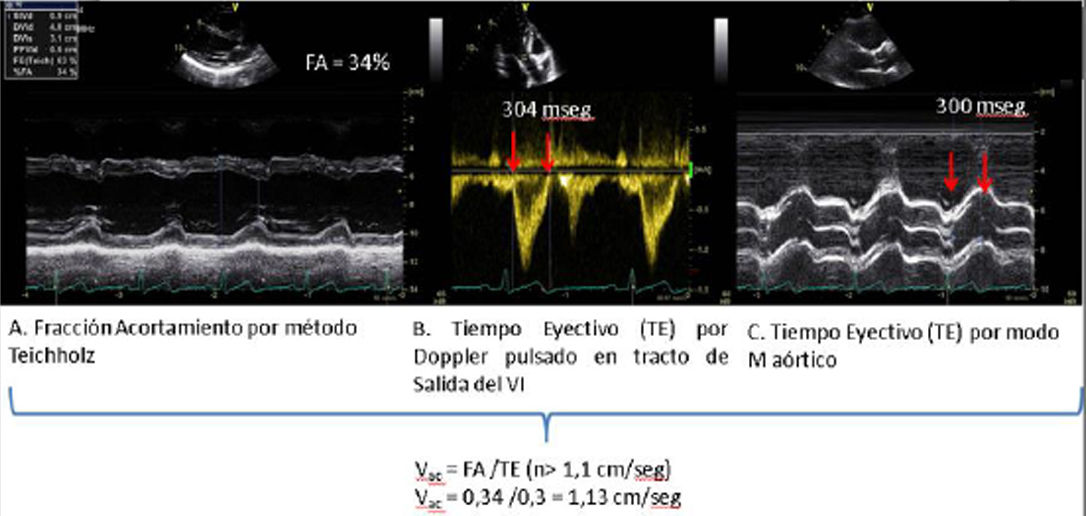
| A.2. Fracción de acortamiento (FA) | ||
| Se trata de un parámetro subrogado de la FE (Teichholz) en la que se valora los DtTDVI y DtTSVI. Presenta las mismas limitaciones que las comentadas en la estimación de la FEVI por Teichholz. | ||
| A.3. Diámetro telesistólico del ventrículo izquierdo (DtSVI) | ||
| La valoración del DtSVI es un parámetro que nos puede alertar de una posible disfunción ventricular a pesar de presentar una FE normal por un aumento de precarga, como es el caso de la regurgitación aórtica y mitral. | ||
| A.4. Distancia E-tabique septal | ||
| La disminución de la función sistólica del ventrículo izquierdo tiende a aumentarlo, lo que también ocurre en la insuficiencia aórtica significativa y en la estenosis mitral. | ||
| A.5 Velocidad de acortamiento circunferencial media | ||
| Al valorar la velocidad y no la magnitud del acortamiento se ha descrito como un parámetro de función sistólica más precoz y menos dependiente de la precarga que la fracción de acortamiento (FA). | ||
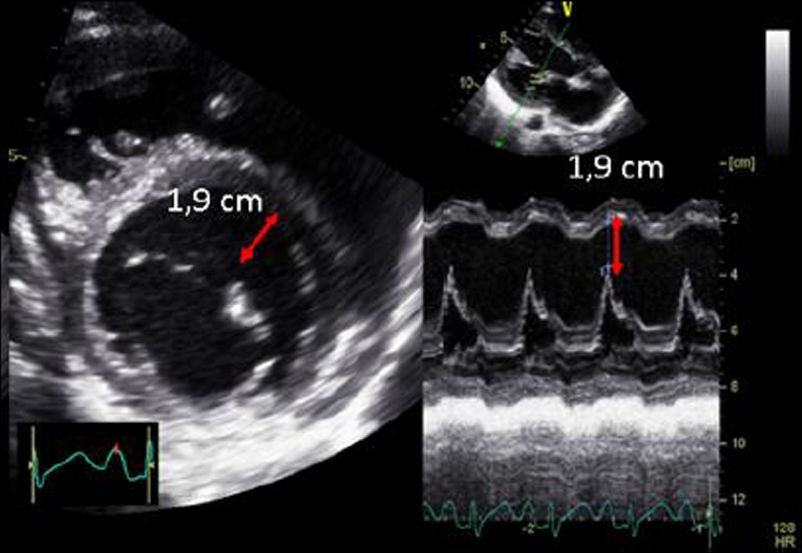
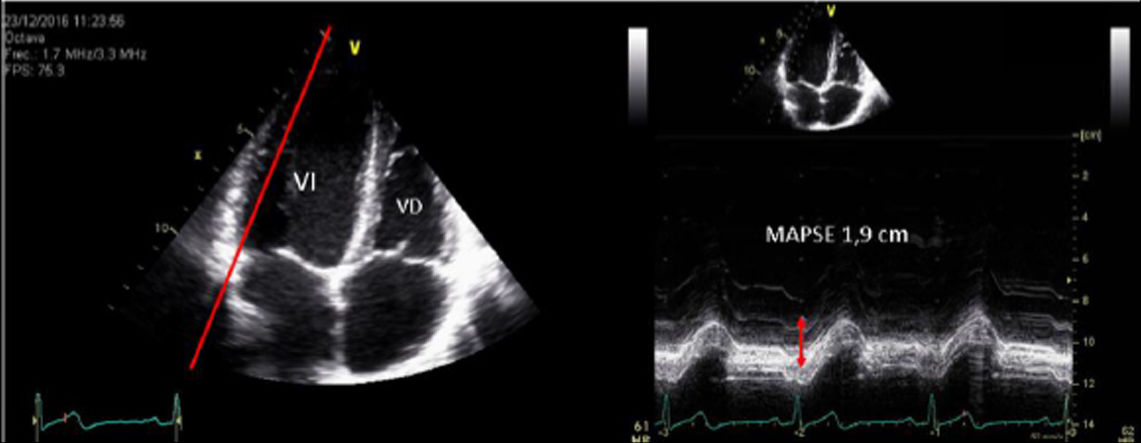
| A.6. Desplazamiento sistólico del plano del anillo mitral (MAPSE) | ||
| El índice de acortamiento longitudinal del ventrículo izquierdo y guarda relación con la función sistólica global. Parámetro ecocardiográfico dependiente del ángulo, debiéndose realizar un registro perpendicular al plano mitral. | ||
| B. | MEDIDAS VOLUMÉTRICAS (Ecocardiografía 2D) | |
| B.1. Simpson biplanar. El cálculo de la FE por ecocardiografía 2D es el método más aplicado en la práctica clínica en la valoración de la función ventricular. La gran resolución espacial supera las limitaciones de la técnica modo-M, la mejora de los equipos, la adquisición del segundo armónico y los ecopotenciadores permiten una adecuada definición endocárdica en la mayoría de los pacientes. A pesar de que es la técnica más extendida, en ocasiones, especialmente en el postoperatorio de cirugía cardiaca, puede entrañar una complejidad técnica adicional derivada de la dificultad para obtener un plano correcto o identificar adecuadamente el borde endocárdico. Además, su cuantificación, como en otros parámetros, se ve afectada por la situación de la precarga y la poscarga. | ||
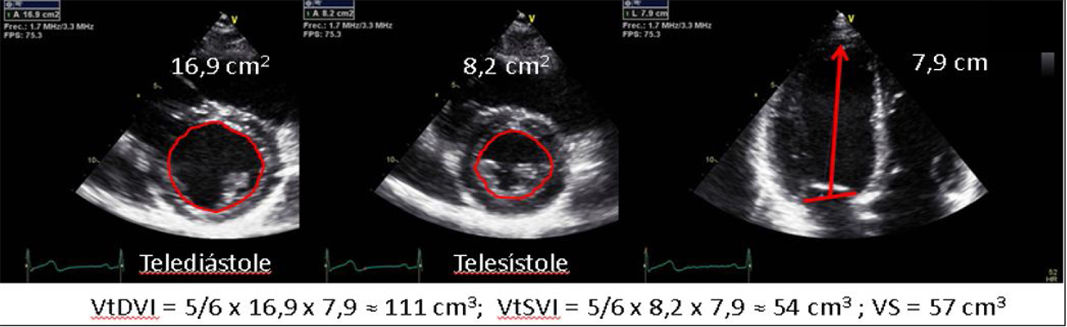
| B.2. Método área-longitud. Aplicable en ventrículos simétricos. Método alternativo para calcular los volúmenes del ventrículo izquierdo en los casos con mala definición del endocardio en los cortes apicales (sobre todo a nivel lateral). Los volúmenes son más representativos de las auténticas dimensiones de la cavidad ventricular, y, además, se adapta mejor a los ventrículos con morfología anormal. | ||
| C. | DOPPLER | |
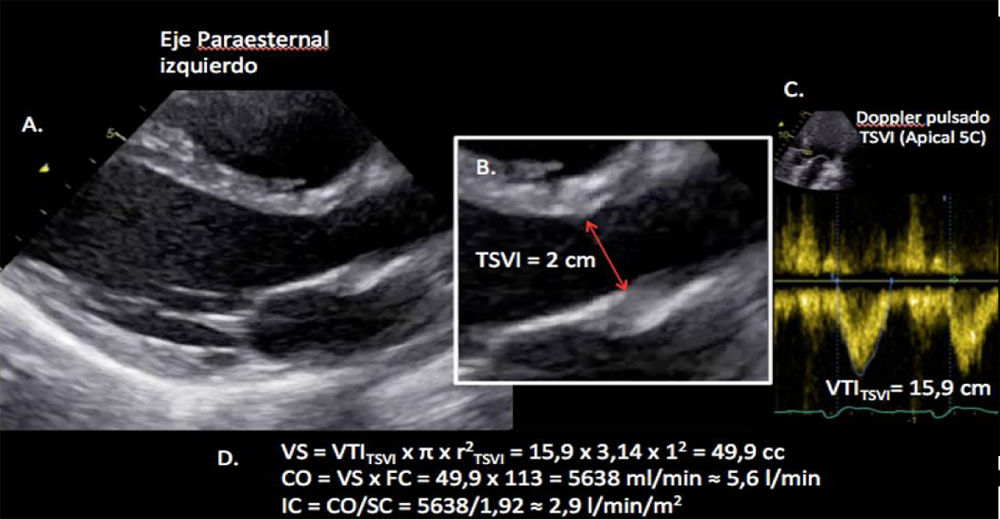
| C.1. Volumen latido y gasto cardiaco. La valoración de la función sistólica global puede complementarse mediante una valoración del volumen latido y del gasto cardiaco. La variabilidad interobservador es elevada, sobre todo debido a las medidas del tracto de salida: pequeñas variaciones en la medida del TSVI pueden conllevar variaciones en el cálculo del VL de un 20%. Aunque el propio valor de la VTI en el TSVI nos puede dar una primera aproximación a la valoración del gasto cardiaco (valores normales entre 18-22 cm). | ||
| C.2. Parámetros preeyectivos. Los métodos que estudian el periodo preeyectivo, por definición son más independientes de la carga y más relacionados con la contractilidad intrínseca del miocardio. | ||
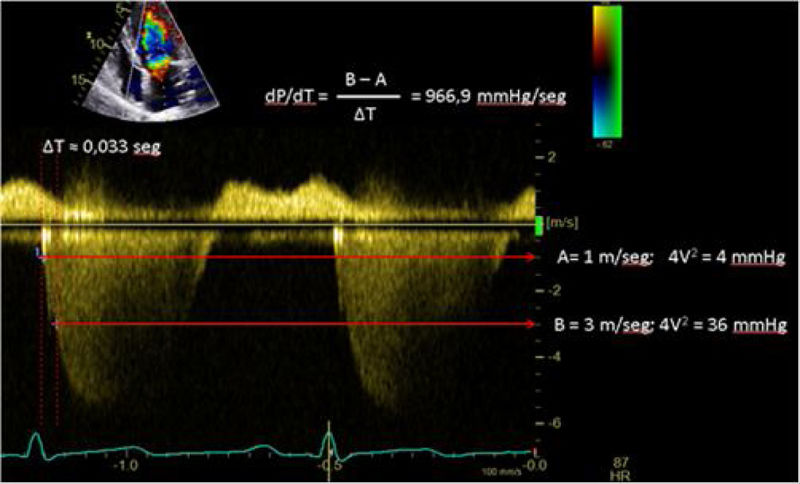
| C.2.1. dP/dt. La derivada de la presión ventricular respecto al tiempo (dP/dt) es un parámetro más frecuentemente utilizado durante el cateterismo cardiaco del ventrículo izquierdo.Por ecocardiografía, aunque no podemos medirlo, en presencia de insuficiencia mitral podemos estimar la derivada de la velocidad de su curva (dV/dt). No debe ser usado en casos de insuficiencia mitral aguda, estenosis aórtica significativa o hipertensión arterial o asincronía evidente, donde valores descendidos no implican disfunción miocárdica. | ||
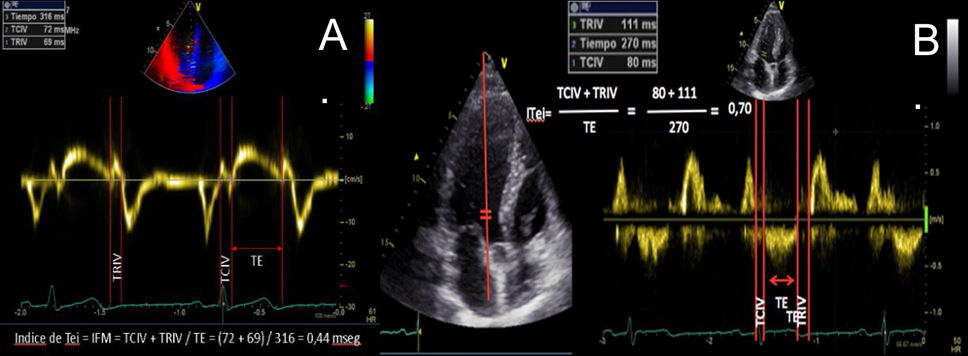
| C.2.2. Índice de Tei o índice de funcionamiento miocárdico (IFM) o índice de performance miocárdico. Permite hacer una estimación global tanto de la función sistólica como de la diastólica ventricular (derecha o izquierda). Está basado en la relación del trabajo eyectivo y no eyectivo del corazón. Se define como la relación entre la suma del tiempo de relajación isovolumétrica y de la contracción isovolumétrica, dividido por el tiempo eyectivo (índice Tei =TRIV +TCIV) /TE). Índice pronóstico poco utilizado en la práctica clínica, tendiendo a aumentar en caso de disfunción ventricular sistólica y/o diastólica.Es un método simple de obtener, reproducible, independiente de la frecuencia cardíaca y de la presión arterial, y es útil para estimar la severidad y el pronóstico de la afectación miocárdica y como predictor de disfunción postoperatoria ventricular izquierda en pacientes con insuficiencia mitral con fracción eyectiva aparentemente normal (4). Un índice Tei preoperatorio >0,5 permite predecir la disfunción postoperatoria del VI en pacientes con IM con FE aparentemente normal. Podemos medirlo mediante Doppler tisular a nivel del anillo mitral (A) o Doppler espectral pulsado, colocando el volumen de muestra amplio entre el TSVI y la mitral (B). El DTI puede utilizarse también para medir el índice Tei del VD, teniendo en cuenta que el TRIV del VD es prácticamente inexistente en el VD normal. Es un parámetro no influido por la frecuencia cardiaca ni la precarga que ha demostrado correlación con la severidad y el pronóstico de diversas patologías que afectan al VD. Su valor normal por DTI es de 0,39, considerándose patológico cuando es superior a 0,55. | ||
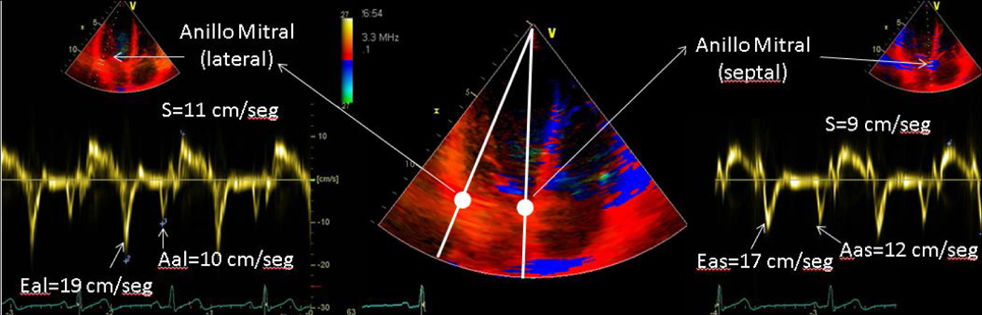
| C.3. Doppler tisular. La velocidad del anillo mitral o del miocardio basal por Doppler tisular puede ser una simple aproximación para cuantificar la función ventricular longitudinal, siendo menos dependiente de las condiciones de carga. No aplicable en casos de prótesis mitral, anuloplastia mitral o calcificación severa del anillo. Una onda S con una velocidad inferior a 8 cm/s calculado por DTI pulsado espectral en varios sitios alrededor de anillo mitral (septal, lateral y posterior) tiene una sensibilidad del 94%, una especificidad del 93% y una precisión del 94% para detectar una FE <40%. | ||
| D. | FUNCIÓN SISTÓLICA REGIONAL | |
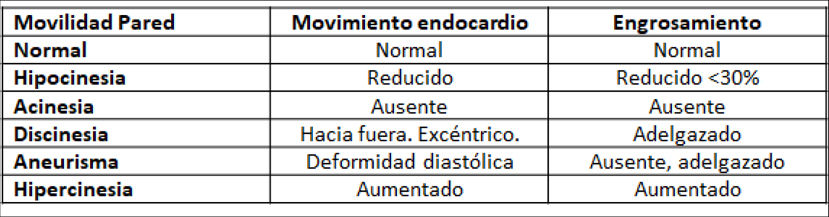
| Para una adecuada valoración de la función regional se exige una buena definición endocárdica, la visualización de todas las paredes en los diversos cortes y la confirmación de que las alteraciones segmentarias vistas en un corte se confirman en otra proyección distinta. Situaciones en que la motilidad anormal se acompaña de un engrosamiento normal (bloqueo de rama izquierda, ritmo de marcapasos, poscirugía cardiaca, constricción pericárdica) deben distinguirse de las alteraciones isquémicas, en las que la motilidad anormal se acompaña de alteraciones en el engrosamiento miocárdico. | ||
Se recomienda que la valoración funcional sistólica del VD se realice por cambio en el área fraccional (FAC), al que se le puede sumar como parámetros complementarios el TAPSE y la onda St’14.
Cuando existen dificultades para objetivar cuantitativamente la FEVI, la estimación visual constituye el método más utilizado en la valoración de la función sistólica. Si bien este método, en el caso de observadores expertos, tiene aceptable correlación con la determinada por ventriculografía, su precisión disminuye con la menor experiencia y, en el caso de ventrículos de morfología anormal, con contracción no homogénea, alteraciones segmentarias de la contractilidad o en presencia de asincronía15.
Valoración hemodinámica guiada por ecografíaLa ecocardiografía ha ganado especial relevancia por su accesibilidad a pie de cama, su ausencia de invasividad (en el caso de la ETT) y su capacidad para aportar información anatómica y funcional16.
El proceso de reanimación hemodinámica tiene como principal objetivo lograr una adecuada presión de perfusión tisular que permita restablecer el adecuado aporte de oxígeno a las células. Para ello, además de optimizar la hemoglobina y la oxigenación sanguínea, es indispensable optimizar el GC. Esta optimización debe realizarse guiada por objetivos y monitorizando la respuesta terapéutica para evitar o, al menos, minimizar los efectos deletéreos de dichas medidas. La ecocardiografía aporta información relevante sobre el GC y sus determinantes, y permite valorar la respuesta a las medidas terapéuticas implementadas.
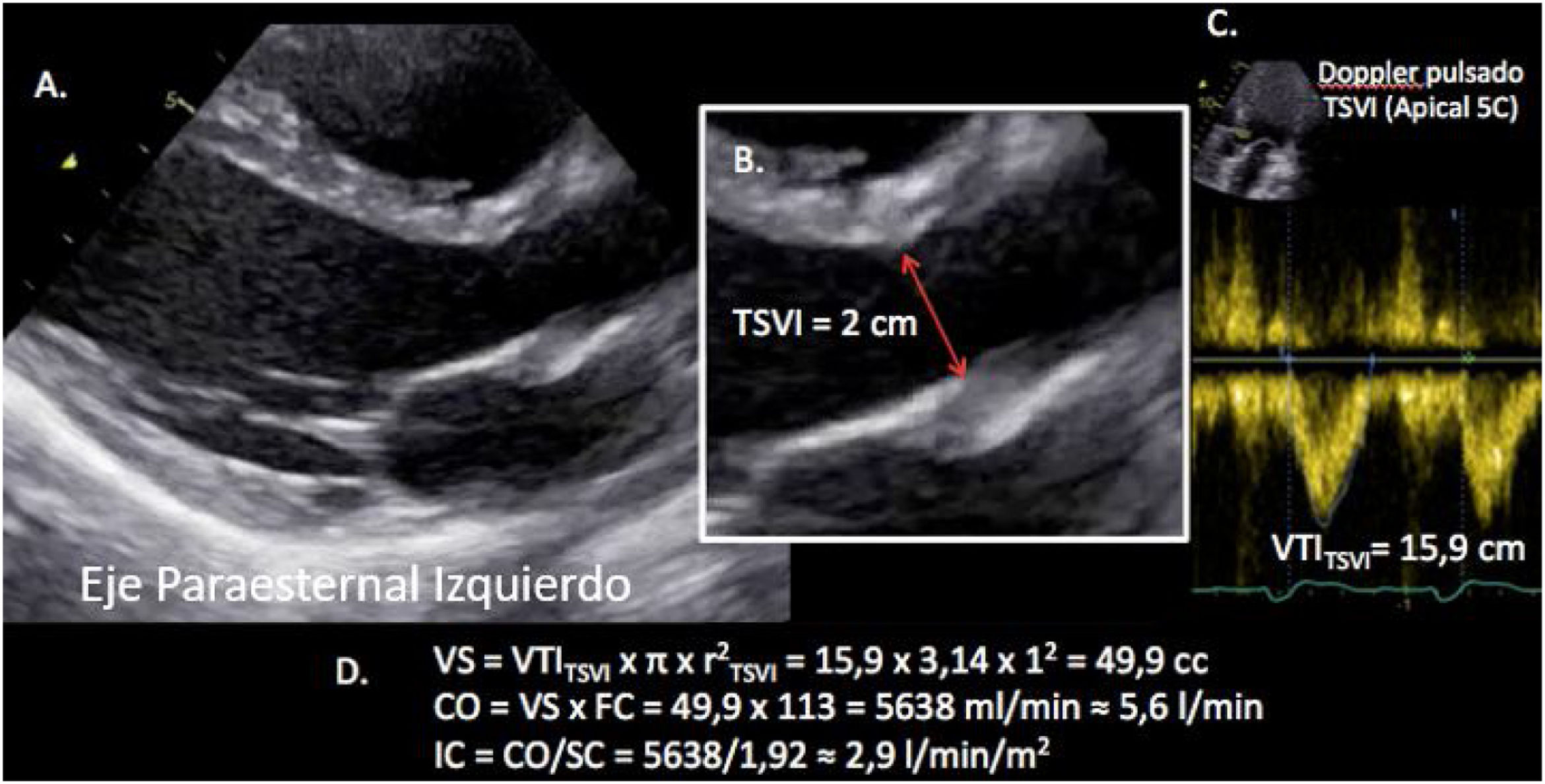
Valoración del volumen sistólico (fig. 2)Se puede realizar por medio de la integral velocidad-tiempo (IVT) y el diámetro del tracto de salida del ventrículo izquierdo (TSVI).
Estimación del volumen sistólico (VS) y del gasto cardiaco (CO) a través de la integral de velocidad (VTI) y radio (r) del tracto de salida del ventrículo izquierdo (TSVI). A) Paraesternal izquierdo ventrículo izquierdo en sístole. B) Zoom TSVI. C) Doppler pulsado TSVI 5C apical. D) Cálculos.
Un IVTTSVI<11cm se correlaciona con un índice cardiaco <2 l/min17,18.
Optimización de la precargaUn aporte excesivo de fluidos puede provocar complicaciones, estimándose que hasta el 50% de los pacientes que reciben fluidos no van a experimentar un aumento del volumen sistólico (VS), por lo que, previo a la administración de volumen, es necesario identificar a aquellos pacientes que se beneficiarán del mismo. Por ello, además de los hallazgos clínicos y analíticos de hipoperfusión que indiquen la necesidad de iniciar medidas de reanimación, es necesario identificar a aquellos pacientes que mejorarán su VS tras la administración de volumen. La ecografía permite, mediante diversas estimaciones, como el índice de colapsabilidad de la vena cava inferior, identificar a los pacientes respondedores.
Como guía para la administración de volumen, históricamente se han utilizado diversas presiones, como la presión venosa central (PVC) o la presión de llenado de la aurícula derecha. Aunque su validez se ve limitada por alteraciones de la función ventricular, como la disfunción diastólica o el aturdimiento miocárdico postoperatorio, los valores extremos pueden orientar la toma de decisiones. Un aumento de la PVC sugiere sobrecarga de volumen, que se correlaciona con un aumento de las complicaciones. Al valorar, mediante Doppler pulsado, el flujo venoso hepático, un componente diastólico mayor que el sistólico es sugestivo de congestión venosa, que, en caso de ser severa, puede dar lugar, incluso, a la inversión de las ondas19.
Otra variable que podemos utilizar es la presión de llenado de la aurícula derecha. Presenta buena correlación con la relación E/e’ tricuspídea. Valores >6 pueden ser indicativos de presiones elevadas. Sin embargo, en el PC no existe consenso de la utilidad de este parámetro20.
Debido a las limitaciones descritas de los parámetros estáticos, la tendencia actual es estimar variables dinámicas que permitan identificar a los pacientes en situación de precarga-dependencia. En la tabla 218 se recogen diversos parámetros dinámicos y los requisitos que se deben cumplir para que su interpretación sea válida.
Parámetros ecocardiográficos dinámicos de respuesta a volumen
| Parámetro | Cálculoa | Respondedores | Requisitos |
|---|---|---|---|
| ΔIVTTSVI | IVTmax – IVTmin(IVTmax+IVTmin)/2 | >12% | VM con Vt ≥ 8 ml/kg/h, ausencia de esfuerzo inspiratorio, adecuada función del VD, ritmo sinusal y tórax cerrado. Ausencia de cirugía valvular aórtica o patología valvular |
| Índice de colapso de la VCS | Ømax esp – Ømin inspØmax esp | >36% | |
| Distensibilidad de la VCI | Ømax insp – Ømin espØmax insp | >18% | |
| ΔØ VCI | Ømax – Ømin(Ømax+Ømin)/2 | >12% | VM con Vt ≥ 8 ml/kg/h, ausencia de esfuerzo inspiratorio, adecuada función del VD, ritmo sinusal y tórax cerrado |
esp: en espiración; insp: en inspiración; IVT: integral velocidad-tiempo; TSVI: tracto de salida del ventrículo izquierdo; max: máximo; min: mínimo; VCI: vena cava inferior; VCS: vena cava superior; VD: ventrículo derecho; VM: ventilación mecánica; Vt: volumen tidal; Ø diámetro.
Como se puede comprobar, en el PC, muchas de estas determinaciones pierden fiabilidad al no cumplirse los requisitos necesarios para su correcta interpretación, como la presencia de esfuerzos respiratorios, la disfunción del VD o la aparición de arritmias. Además de los parámetros descritos en la tabla, pueden ser de utilidad otras maniobras, como la elevación pasiva de piernas, que se considera positiva cuando se produce un aumento del GC >10% tras la misma (estimación limitada en caso de presencia de aumento de la presión intraabdominal o hipovolemia extrema) o el test de oclusión espiratoria, que también permite identificar a los respondedores18.
Valoración de la función respiratoria guiada por ecografíaEl PC presenta un alto riesgo de desarrollar insuficiencia respiratoria tras la intervención quirúrgica debido a una disminución de la reserva respiratoria causada por factores inflamatorios secundarios a la circulación extracorpórea, factores mecánicos y hemodinámicos21,22.
Se asocia a una elevada morbimortalidad23, siendo necesaria la optimización de los cuidados respiratorios perioperatorios para mejorar los resultados tras la CC.
Es conocido que el rendimiento diagnóstico de la ecografía pulmonar supera al de la radiografía de tórax en el diagnóstico de consolidación pulmonar, colapso pulmonar, derrame pleural, edema pulmonar y neumotórax24, siendo de gran ayuda en la evaluación etiológica y en la valoración funcional diafragmática25.
Dadas las limitaciones de espacio, y dado que este punto es tratado en otro capítulo de esta serie, remitimos al lector a los capítulos números 3 y 4 de esta serie.
Valoración de las complicaciones más frecuentes en el PCFactores determinantes como una disfunción ventricular preexistente, patología valvular asociada, hipertrofia del VI o hipertrofia basal septal, enfermedad vascular pulmonar/hipertensión pulmonar (HTP) o arritmias pueden condicionar no solo una correcta valoración, sino una adecuada interpretación de los hallazgos ecocardiográficos.
Disfunción miocárdica y bajo GC postoperatorioAdemás de la disfunción ventricular precedente, la función miocárdica puede verse significativamente comprometida debido a varios factores, en particular cuando ha habido tiempos de bomba alargados. La información del estudio ecocardiográfico intraoperatorio tiene que completarse con la valoración constante en el postoperatorio, siendo el estudio ecocardiográfico imprescindible, ya que descarta otras causas de bajo gasto, como el sangrado y/o la vasoplejía tras circulación extracorpórea.
La disfunción del VD poscirugía se ha estudiado durante décadas, siendo su etiología múltiple. La incidencia es variable, dependiendo de la definición y de los métodos de evaluación utilizados, pudiendo ser predecible en caso de HTP previa o embolismo aéreo.
La disminución de los índices de función sistólica tradicionales del VD (TAPSE, St’ de la pared lateral del VD) es bien conocida; sin embargo, la etiología no está esclarecida. Una de las hipótesis de este fenómeno es la vulnerabilidad del VD a la pobre protección durante la circulación extracorpórea, cambios geométricos del VD asociados al movimiento paradójico del septum interventricular o adhesión en el postoperatorio del VD a la pared torácica que condiciona una disminución del acortamiento longitudinal del VD. Después de la pericardiotomía el patrón de contractilidad del VD cambia, hay una disminución del acortamiento longitudinal y un aumento del acortamiento transversal. Se debe tener en cuenta que muchos de los parámetros ecocardiográficos no son aplicables en la valoración de la función del VD tras cirugía de la válvula tricúspide, recomendándose la valoración funcional por cambio en el FAC26.
La disfunción del VI puede ser predecible debido a una disfunción previa o tiempos prolongados de cardioplejía y/o de circulación extracorpórea. Hay pacientes especialmente susceptibles, como aquellos que presentan una hipertrofia significativa del VI y/o isquemia coronaria.
De manera práctica, es más relevante la tendencia del volumen sistólico calculada por el Doppler pulsado del TSVI que la FEVI.
Valoración de la volemia y gradiente dinámico (Video 1 en material suplementario)La valoración de la volemia a través de los ultrasonidos resulta compleja y requiere su integración con la exploración clínica. En el PC no son aplicables algunos conceptos clásicos de respuesta a volumen por la alta incidencia de arritmias, disfunción ventricular, HTP, cor pulmonale crónico, enfermedades vasculares y reemplazo valvular. Sin embargo, la ecocardiografía aporta un valor añadido a otros dispositivos, especialmente en la valoración de área telediastólica ventricular, la variación del flujo Doppler transmitral y del TSVI, así como la colapsabilidad de la vena cava inferior (tabla 2).
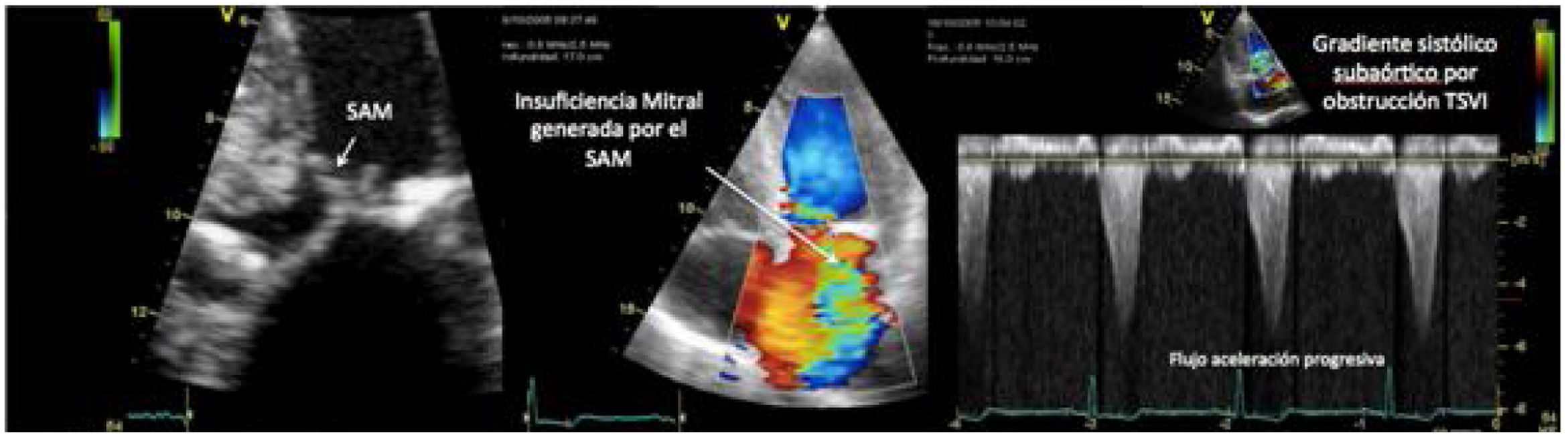
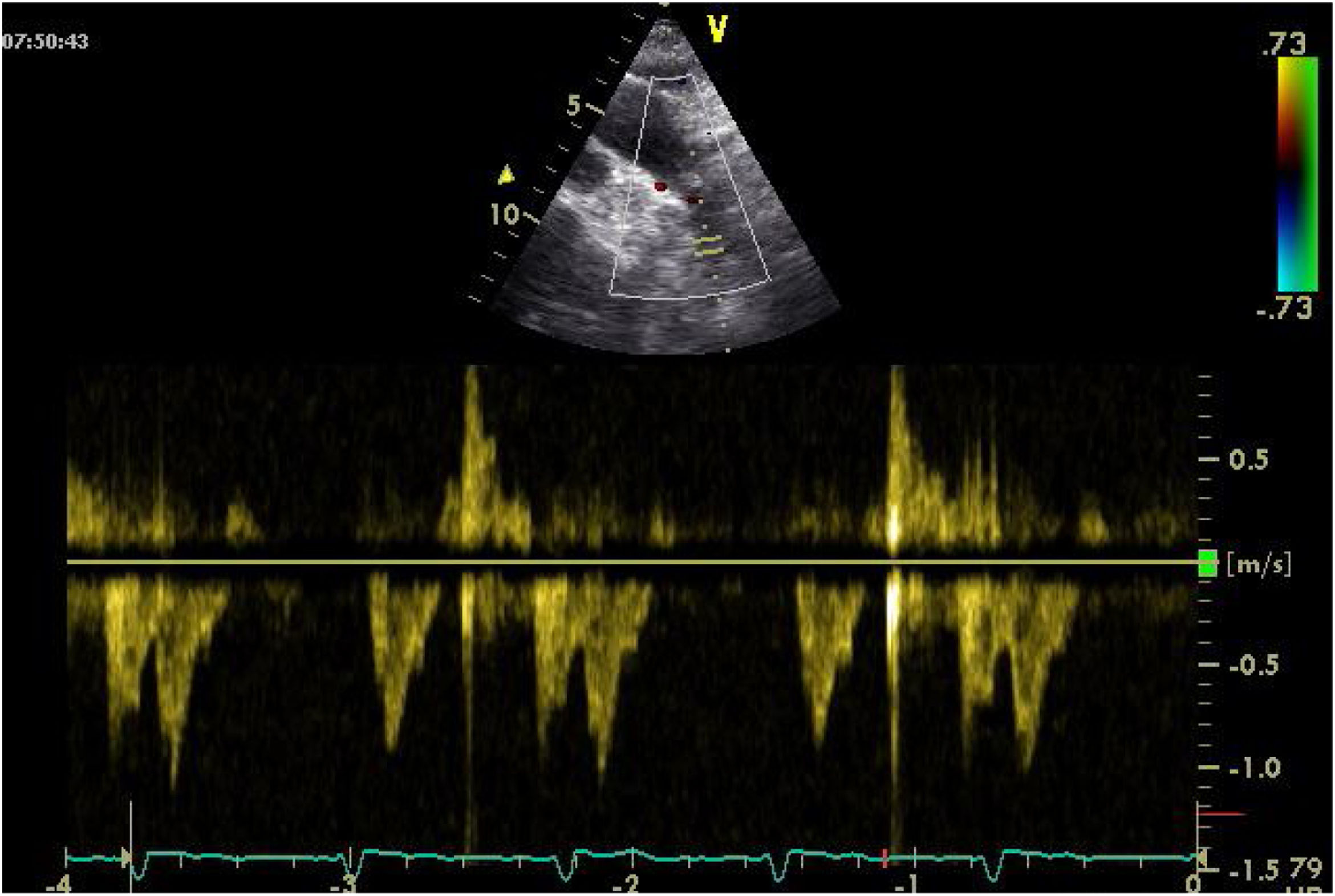
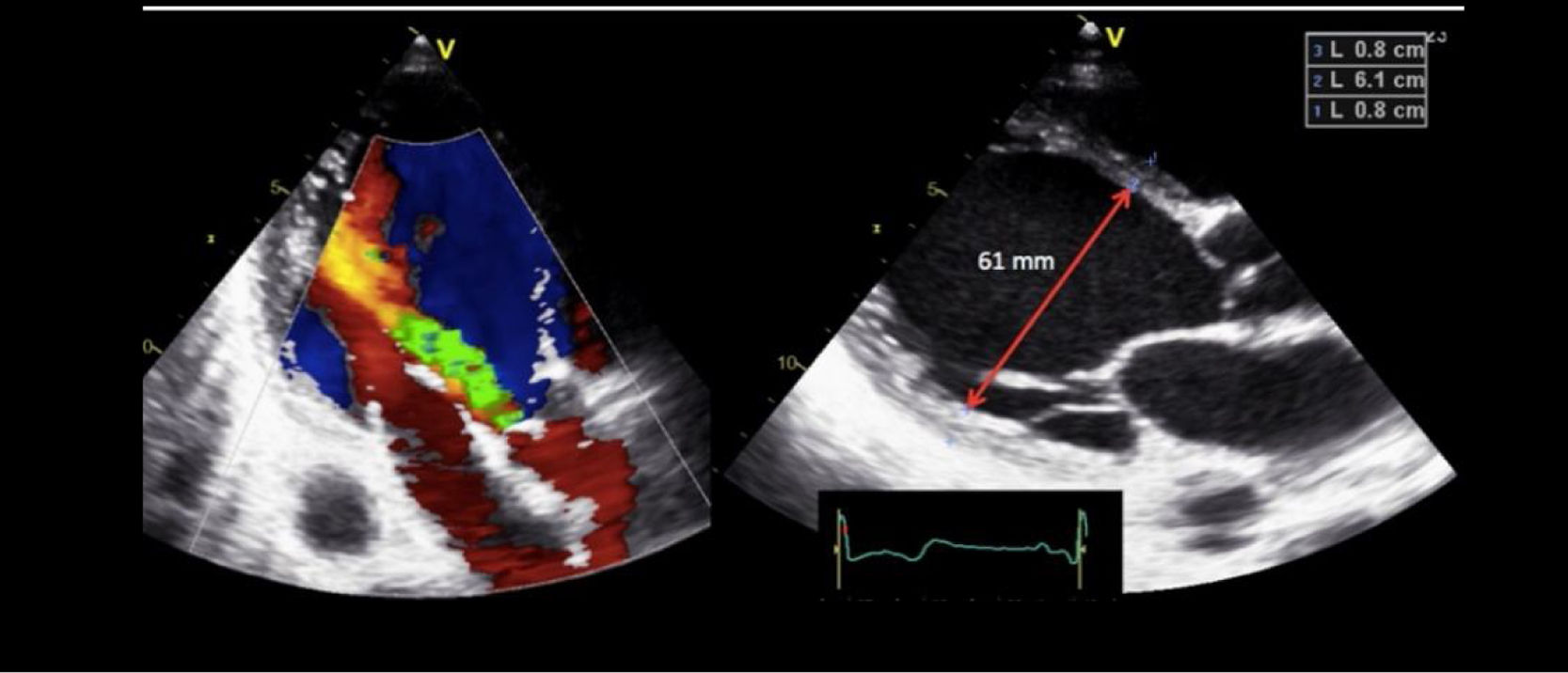
Uno de los cuadros clínicos más difíciles de manejar en el PC es la insuficiencia mitral que se produce por un movimiento anómalo de la valva anterior (SAM), generando un gradiente de presión en el TSVI o mesoventricular, arrastrando y succionando la valva anterior mitral (fig. 3). Debe sospecharse en casos con hipertrofia concéntrica, miectomía o implante de prótesis mitral con postes grandes que se dirigen hacia el TSVI, estados de hipovolemia y/o necesidad de soporte vasoactivo ascendente sin respuesta tensional apropiada.
PC de bypass coronario en paciente con hipertrofia del VI concéntrica: obstrucción dinámica TSVI por exceso de soporte inotrópico e hipovolemia postoperatoria, generando insuficiencia mitral severa por movimiento septal anterior (SAM). Obsérvese el flujo de aceleración progresiva por Doppler continuo.
La ecocardiografía es de gran utilidad en la evaluación del tamaño del derrame pericárdico (DP) y el grado de compromiso hemodinámico. En ocasiones un plano transtorácico 4 cámaras puede ser suficiente para su estudio y un subxifoideo eje largo si los apósitos lo permiten.
La edad avanzada, la necesidad de cirugía emergente en pacientes con tratamiento anticoagulante o antiagregante previo, la cirugía de la raíz aórtica, una cirugía compleja o un mal control del anticoagulante en el periodo perioperatorio son factores de riesgo.
El diagnóstico del taponamiento es clínico, convirtiéndose en un reto en el PC. Al estar el pericardio abierto, con drenajes tanto en el espacio retroesternal como en el retropericárdico, dificulta notablemente su diagnóstico con ecocardiografía transtorácica. En el POI suelen ser loculados, asimétricos, localizados a nivel posterior en el surco auriculoventricular y la pared lateral del VD, frecuentemente asociados a factores que alteran los hallazgos clínicos y ecocardiográficos clásicos de taponamiento, como la presencia de soporte ventilatorio mecánico, HTP o disfunción VD previa.
En estas circunstancias, la espera de las manifestaciones clínicas y ecocardiográficas clásicas de taponamiento generalmente se traduce en un retraso en el tratamiento quirúrgico o en la instauración de un tratamiento inadecuado.
En contraste, los derrames pericárdicos que se producen 72horas después de la cirugía cardíaca generalmente son más grandes y muestran datos clásicos de taponamiento cardíaco.
La localización posterior del DP puede obligar a hacer un estudio transesofágico, donde se pueden observar pequeños derrames loculados que producen colapso auricular (ventana medio esofágica 4 cámaras y 2 cámaras).
Disfunción protésica (Video 3 en material suplementario)En una primera aproximación mediante la ETT tenemos que prestar especial atención al aspecto, a la apertura y al cierre de las valvas u oclusores, a la presencia de calcificaciones en las valvas o a una densidad ecográfica anómala adherida al anillo de sutura, el oclusor, las valvas, los stents o la caja; y el movimiento de balanceo anormal durante el ciclo cardíaco, siendo necesario completarlo con ETE para una adecuada evaluación.
- •
El engrosamiento de la raíz aórtica debido a la presencia de hematoma o edema tras el implante de la prótesis puede confundirse con la presencia de un absceso perianular27.
- •
El movimiento de balanceo de una prótesis es un signo de dehiscencia en la posición aórtica. Para la posición mitral, cuando no se ha extirpado toda la válvula nativa, puede observarse un incremento del movimiento de una prótesis normal. El diagnóstico diferencial se basará en la presencia de un chorro de regurgitación28.
- •
La aparición de fuga paravalvular siempre constituye un fenómeno patológico29,30, siendo más frecuente en reintervenciones valvulares, pacientes añosos, desbridamiento de calcio del anillo y reconstrucciones aórticas o mitrales. La proporción de circunferencia del anillo afectada determina la gravedad de la fuga paravalvular y puede ser un signo de endocarditis en una etapa más tardía.
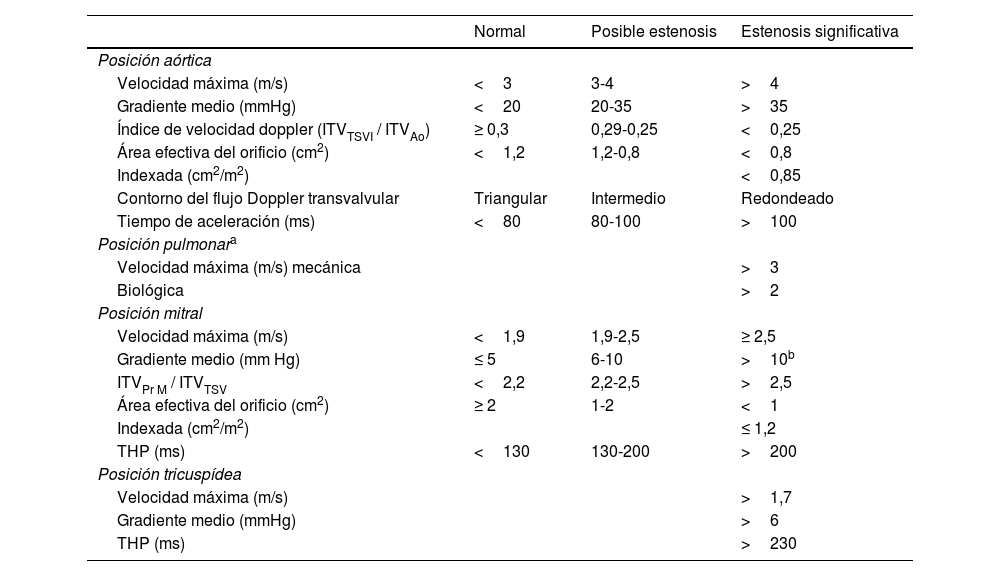
Todas las válvulas protésicas generan un cierto grado de obstrucción comparadas con las nativas, dependiendo del diseño, del tamaño y de la posición anular (intra/supra) de las misma, asemejando una estenosis. Es recomendable consultar los gradientes esperados para el diámetro y modelo de prótesis (Apéndices 1 y 2)31-35. Por ello, puede ser difícil diferenciar la obstrucción hemodinámica de una disfunción leve patológica y del desacoplamiento prótesis-paciente (DPP) o mismatch (tabla 3, fig. 4, Video 4 en material suplementario)36.
- •
Podemos observar gradientes elevados en válvulas normofuncionantes de pequeño tamaño, en estados hiperdinámicos o de aumento del VS, fenómenos de recuperación de presión posvalvular, en el DPP y en la estenosis.
- •
En presencia de disfunción de VI podemos encontrar gradientes bajos con una estenosis significativa.
- •
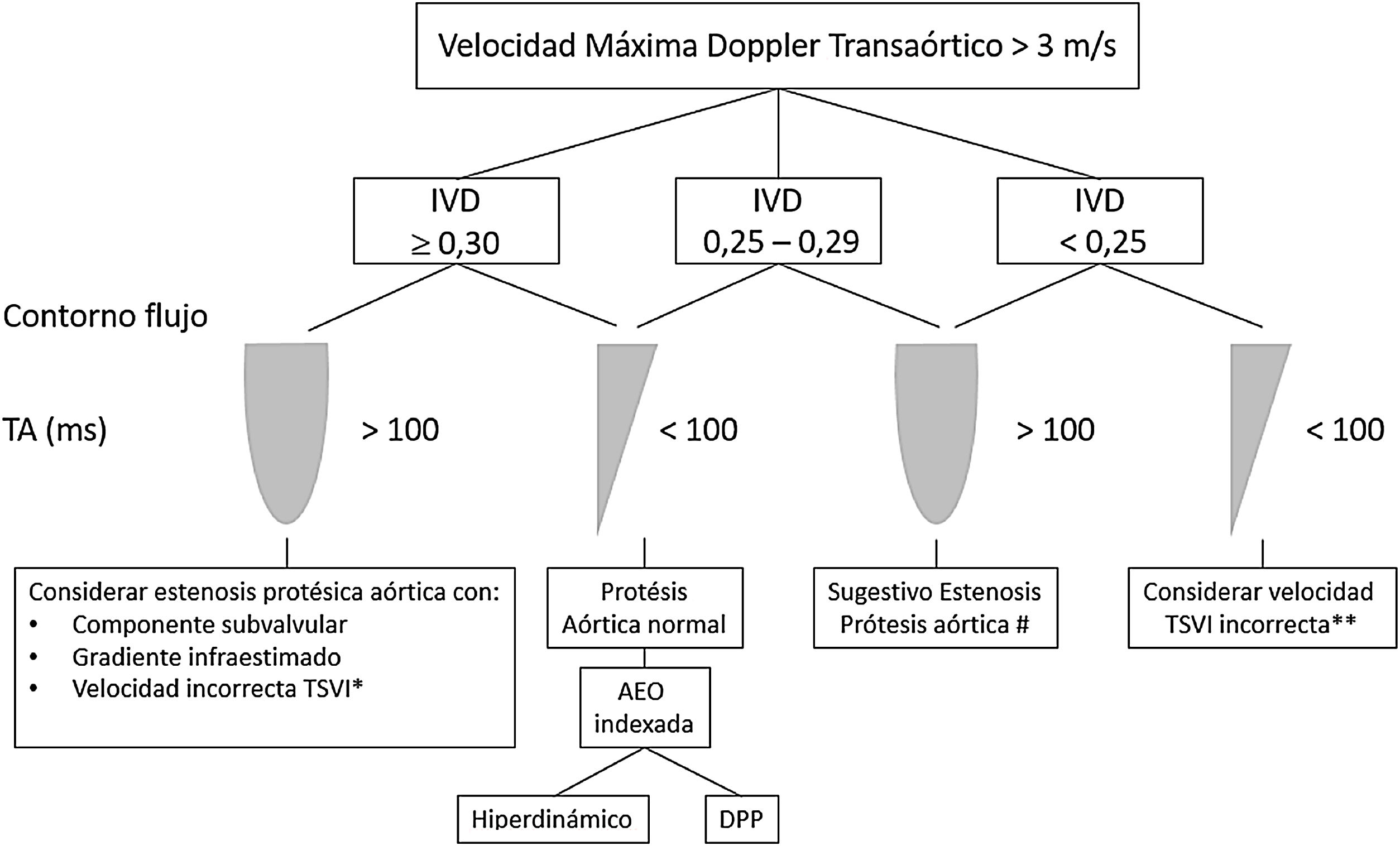
En posición aórtica, la morfología triangular del contorno de la velocidad Doppler, con un tiempo de aceleración corto, nos informa de normofunción. Conforme avanza la obstrucción, la morfología de la velocidad Doppler se volverá más redonda, alcanzando el flujo máximo más tardío (fig. 4).
- •
En posición mitral, junto con un gradiente medio elevado, encontraremos un tiempo de hemipresión alargado.
- •
Además de los gradientes valvulares, resulta esencial obtener parámetros flujo-independientes de la función valvular protésica, tales como el área orificial efectiva (AOE) y el índice de velocidad Doppler (IVD) o índice de funcionalismo no dimensional (tabla 3). El valor de IVD obtenido en la fase precoz del postoperatorio puede servir de valor control o «huella valvular» para futuros estudios. Siempre y cuando la función de la prótesis valvular sea normal, el IVD permanecerá constante incluso ante cambios en el volumen sistólico.
- •
La valoración conjunta de los parámetros descritos establecerá el grado de obstrucción protésica (tabla 337).
Parámetros Doppler de función protésica aórtica, pulmonar, mitral y tricupídea
| Normal | Posible estenosis | Estenosis significativa | |
|---|---|---|---|
| Posición aórtica | |||
| Velocidad máxima (m/s) | <3 | 3-4 | >4 |
| Gradiente medio (mmHg) | <20 | 20-35 | >35 |
| Índice de velocidad doppler (ITVTSVI / ITVAo) | ≥ 0,3 | 0,29-0,25 | <0,25 |
| Área efectiva del orificio (cm2) | <1,2 | 1,2-0,8 | <0,8 |
| Indexada (cm2/m2) | <0,85 | ||
| Contorno del flujo Doppler transvalvular | Triangular | Intermedio | Redondeado |
| Tiempo de aceleración (ms) | <80 | 80-100 | >100 |
| Posición pulmonara | |||
| Velocidad máxima (m/s) mecánica | >3 | ||
| Biológica | >2 | ||
| Posición mitral | |||
| Velocidad máxima (m/s) | <1,9 | 1,9-2,5 | ≥ 2,5 |
| Gradiente medio (mm Hg) | ≤ 5 | 6-10 | >10b |
| ITVPr M / ITVTSV | <2,2 | 2,2-2,5 | >2,5 |
| Área efectiva del orificio (cm2) | ≥ 2 | 1-2 | <1 |
| Indexada (cm2/m2) | ≤ 1,2 | ||
| THP (ms) | <130 | 130-200 | >200 |
| Posición tricuspídea | |||
| Velocidad máxima (m/s) | >1,7 | ||
| Gradiente medio (mmHg) | >6 | ||
| THP (ms) | >230 | ||
ITVAo: integral tiempo-velocidad prótesis aórtica (doppler continuo); ITVPr M: integral tiempo-velocidad prótesis mitral (Doppler continuo); ITVTSVI: integral tiempo-velocidad del tracto de salida del VI (Doppler pulsado); THP: tiempo de hemipresión.
* Volumen de muestra del Doppler pulsado muy cercano a la prótesis.
** Volumen de muestra del Doppler pulsado alejado (apical) de la prótesis.
# Estenosis confirmada adicionalmente por el valor de AEO en comparación con los valores de referencia si se conocen el tipo y el tamaño de la válvula.
AEO: área efectiva del orificio; AEO indexada: AEO dividida por la superficie corporal; DPP: desacoplamiento prótesis-paciente; DTSVI: diámetro TSVI; ITV: integral velocidad tiempo; IVD: índice de velocidad Doppler o índice de funcionalismo adimensional; TA: tiempo de aceleración; TSVI: tracto de salida del ventrículo izquierdo.
Modificado de Zoghbi et al.36.
La ecocardiografía Doppler (ED), en especial la ETE, inicialmente nos proporcionará la información necesaria en la toma de decisión (necesidad de un dispositivo, y tipo o tipos de dispositivos a implantar), así como en la identificación de patología que contraindique o dificulte el implante (patología valvular aórtica, presencia de foramen oval permeable, trombosis, disección, patología vascular arterial, miocardiopatía hipertrófica, etc.).
Una vez decidido el tipo de dispositivo a implantar, será de gran ayuda en el proceso de inserción, de posicionamiento exacto de cánulas, de detección de complicaciones, de evaluación de la eficacia del dispositivo implantado y en el destete.
Balón de contrapulsación intraaórtica (BIAC) (fig. 5)- •
Comprobar la presencia de la guía en la aorta descendente y asegurar que la sonda esté a 2-5cm de la arteria subclavia izquierda. Si no es posible visualizar la subclavia, se puede tomar como referencia el borde inferior del arco aórtico.
- •
Es importante visualizar las guías durante todo el proceso. Las vistas transesofágicas bicaval y bicaval modificada proporcionan una adecuada visualización de la vena cava inferior, de la vena cava superior, de la válvula tricúspide y de la aurícula derecha38.
- •
La posición apropiada de la cánula puede determinarse por ETT o ETE cuando se requiera (Video 5 en material suplementario).
- •
Permite determinar la causa de flujos inadecuados, que son frecuentes durante el soporte con ECMO.
- •
La ETE puede usarse para visualizar la guía para la cánula de retorno en la aorta abdominal superior y evitar una mala posición de la cánula en alguna rama vascular39. La ubicación óptima de la cánula de drenaje venoso a través de la vena femoral es en la aurícula derecha.
- •
Es esencial la monitorización ETT/ETE del diámetro de cavidades para asegurar un adecuado vaciamiento de los ventrículos, así como de la apertura de la válvula aórtica. El aumento de la poscarga propiciado por el ECMO-VA periférico junto con la disfunción VI severa puede propiciar el cierre de la válvula aórtica y se podría generar la coagulación de cavidades intracardiacas.
- •
La monitorización de la función biventricular permite una detección temprana de mejora, que deberá evaluarse modulando los flujos de ECMO. Si hay recuperación, la contractilidad ventricular estará aumentada, o se mantendrá sin dilatación del VD y sin deterioro del volumen latido evaluado por integral tiempo velocidad (ITV) a nivel del TSVI.
La ecografía tiene un papel importante en la evaluación previa, durante el implante y en el seguimiento posterior.
Consideraciones previas:
- •
La posibilidad de shunt derecha-izquierda a través de un foramen oval permeable obliga a descartarlo antes del implante y corregirlo si se detecta.
- •
Igualmente se deben descartar la insuficiencia aórtica moderada o severa, la estenosis mitral severa y la presencia de trombos intracavitarios.
- •
La insuficiencia tricuspídea (IT) favorecerá el fallo del VD tras iniciar asistencia izquierda.
Tras el implante de la asistencia, la ETT/ETE permite la valoración de:
- •
Función ventricular derecha. Fracaso de VD tras asistencia izquierda, que aparece hasta en el 20-25% de casos y necesitará, en el 10-15%, implantar asistencia derecha.
- •
Mal funcionamiento por trombosis en el dispositivo. En caso de trombosis evidente con ETT es suficiente, pero en pocas ocasiones hay evidencia directa de la formación del trombo. La sospecha debe plantearse en caso de dilatación del VI, incremento de la insuficiencia mitral y la frecuencia de apertura de la válvula aórtica.
En un dispositivo de asistencia ventricular con funcionamiento normal, al incrementar las revoluciones por minuto en su flujo, el diámetro ventricular izquierdo, la apertura valvular aórtica y la insuficiencia mitral disminuyen, mientras que el tiempo de desaceleración transmitral se incrementa. Cuando ocurre lo contrario, se debe sospechar trombosis del dispositivo.
- •
Mal funcionamiento por succión. Cualquier situación que disminuya la precarga puede ocasionar efecto de succión. El dispositivo de asistencia ventricular genera una descompresión en el VI dilatado, generando una succión negativa en la cánula de entrada en el ápex cardíaco, que puede causar un movimiento septal hacia la izquierda. Una reducción en la precarga puede conllevar un bajo llenado del ventrículo asistido, aproximándose estructuras cardiacas normales a la cánula posicionada en el ápex cardiaco y pudiendo causar obstrucción de la cánula por succión de estructuras cardiacas adyacentes (trabéculas, músculo papilar, septo), con caída del GC y aparición de arritmias40.
- •
Destete. La valoración de la recuperación miocárdica se basa en criterios hemodinámicos y ecocardiográficos (FEVI >40-45% con un diámetro telediastólico <45-60mm).
- •
Valoración ecovascular del eje iliofemoral previa a su colocación percutánea.
- •
Evaluación del posicionamiento correcto del catéter Impella: debe realizarse siempre que se activen alarmas de posición, se observen flujos inferiores a los esperados o signos de hemólisis (tabla 4).
Tabla 4.Evaluación del posicionamiento del catéter Impella
• Área de entrada del catéter 3,5 cm por debajo del anillo de la válvula aórtica• Zona de salida del catéter muy por encima de la válvula aórtica• Catéter en ángulo hacia el vértice del VI lejos de la pared del corazón y sin enrollarse ni bloquear la válvula mitral• Patrón de mosaico por Doppler color denso de turbulencia por encima de la válvula aórtica cerca del área de salida del catéter - •
Valoración de la precarga, función ventricular.
El trasplante ortotópico es la implantación más común, y la técnica quirúrgica puede ser biatrial o bicaval. Para la evaluación ecocardiográfica se debe tener en cuenta que el corazón del donante es de tamaño normal y el espacio que dejó el del receptor es más grande y tiende a girar en sentido horario y localizarse más medialmente en el mediastino. En la tabla 5 se resumen las consideraciones generales en la evaluación del corazón trasplantado44 (Video 7 en material suplementario).
Consideraciones generales en la evaluación del corazón trasplantado en el postoperatorio inmediato
| • La función sistólica del VI se mantiene dentro de la normalidad en el postrasplante inmediato no complicado• El tamaño y la función del VD se alteran en la fase inicial, con IT y reducción de TAPSE• La FAC, que valora tanto la contracción longitudinal como la radial, suele mantener valores normales en el paciente no complicado, por lo que es un parámetro más útil en la estimación de la función sistólica del VD que el TAPSE o la S’ del anillo tricuspídeo• La IT es frecuente, sobre todo en pacientes con HTP previa• En la fase inicial es característico un patrón diastólico restrictivo, y con velocidad de E’ mitral y tricúspide disminuidas• El hallazgo de derrame pericárdico es frecuente, favorecido por la diferencia de tamaños entre el corazón explantado y el injerto• Durante el primer mes se aprecia aumento del grosor de la pared y de la masa del VI por infiltrado de células inflamatorias y edema (Video 6)• Las alteraciones descritas se van normalizando al paso del tiempo (1 a 3 meses) de no existir otros condicionantes |
Teniendo en cuenta estas consideraciones, la ecocardiografía nos ayudará a excluir las causas más comunes de inestabilidad hemodinámica que pueden presentarse en cualquier postoperado de CC descritas previamente. Y una vez descartadas, debemos centrar nuestra atención en las complicaciones más específicas del trasplante cardiaco:
Disfunción primaria del injerto- •
La insuficiencia temprana del injerto es la principal causa de muerte en los primeros 30días tras el trasplante cardíaco.
- •
Debe sospecharse cuando se observa disfunción biventricular o del VD (menos frecuente la afectación aislada del VI), acompañada de bajo GC, hipotensión y presiones de llenado elevadas en las primeras 24horas postrasplante.
La ecocardiografía nos ayudará en la detección temprana de fallo del VD, en la optimización de las medidas terapéuticas destinadas a reducir la poscarga del VD y en la evaluación funcional en el evolutivo.
- •
El fallo del VD es una complicación bien conocida tras el trasplante cardiaco, y representa el 50% de las complicaciones cardiacas y el 19% de las muertes tempranas45.
- •
Dada la elevada frecuencia de disfunción del VD y la morbilidad asociada, su protección debe iniciarse en el quirófano y continuarse en el postoperatorio durante varios días, independientemente de que se manifieste o no la disfunción.
- •
La presencia de HTP pretrasplante en receptores de órganos cardíacos aumenta el riesgo de HTP postrasplante y deterioro de la función VD en el corazón del donante.
- •
La estenosis posquirúrgica en la anastomosis de la arteria pulmonar puede contribuir o ser causa principal del fracaso del VD.
Puede presentarse de forma silente o de forma hiperaguda. Una FEVI normal no excluye el rechazo agudo. El ETT es la técnica complementaria o alternativa para la monitorización del rechazo asintomático o sospecha clínica de rechazo.
Debemos sospecharlo en caso de:
- •
Detección de disminución de la FEVI, así como un incremento de los volúmenes sistólicos del VD junto con parámetros de función sistólica del VD disminuidos.
- •
Persistencia de un patrón diastólico restrictivo junto con velocidades E’ mitral y tricuspídea disminuidas.
Artículo no financiado.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Video 1. Gradiente dinámico en el POI tras revascularización coronaria en paciente con hipertrofia ventricular izquierda concéntrica previa.
Video 2. A) Derrame pericárdico con colapso diastólico precoz y sistólico de aurícula derecha de presentación tardía. B)Derrame pleural y hematoma organizado precoz en PC.
Video 3. Disfunción protésica.
Video 4. Prótesis mecánica St. Jude n.° 19 en posición aórtica con gradientes elevados para el modelo y el tipo de prótesis.
Video 5. Configuración más frecuente femoroyugular: 1. Posición de la cánula de drenaje femoral a nivel intrahepático de la cava inferior o próxima a la unión a la aurícula derecha. 2. La distancia entre la cánula de drenaje y la de retorno debe estar entre 7 y 10cm (evita la recirculación).
Video 6. Valoración del posicionamiento del dispositivo Impella.
Video 7. Disfunción biventricular postrasplante cardiaco.