En los pacientes ingresados en la UCI, la descontaminación digestiva selectiva se asocia con una reducción absoluta de la mortalidad hospitalaria del 7% y una reducción relativa del 60% en la colonización adquirida en la UCI por microorganismos gramnegativos resistentes a antibióticos.
In critically ill patients, selective decontamination of the digestive tract is associated with an absolute reduction of 7% in hospital mortality and a relative reduction of 60% in ICU-acquired colonisation with Gram negative resistant.
Artículo: De Jonge E, Schultz MJ, Spanjaard L, Bossuyt PMM, Vroom MB, Dankert J et al. Effects of selective decontamination of digestive tract on mortality and acquisition of resistant bacteria in intensive care: a randomised controlled trial. Lancet 2003;362:1011-6.
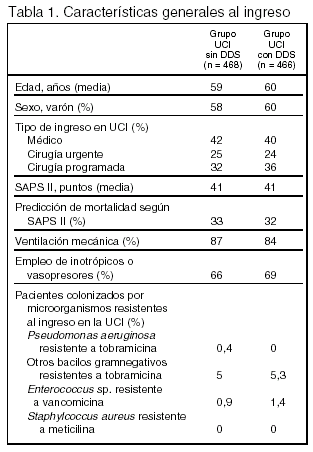
Antecedentes: la descontaminación digestiva selectiva (DDS) es una maniobra extensamente evaluada en ensayos clínicos realizados en enfermos críticos, cuyo efecto global es la reducción (65%) de la infección respiratoria y de la mortalidad (20%). Sin embargo, su uso no se ha generalizado. Una de las razones aducidas para no usarla ha sido el temor al desarrollo de resistencia de los microorganismos a los antimicrobianos utilizados.
La resistencia de los bacilos gramnegativos a los antimicrobianos utilizados no ha sido demostrada a pesar del uso de la DDS durante más de 15 años1. Incluso la DDS se ha demostrado eficaz en el control de brotes causados por bacilos gramnegativos multirresistentes2.
Los antimicrobianos tradicionalmente utilizados (cefotaxima parenteral, y tobramicina, colistina y anfotericina tópicas) no tienen efecto en los microorganismos grampositivos resistentes, Staphylococcus aureus meticilina resistente y Enterococcus sp. vancomicina resistente. Esta circunstancia puede explicar por qué en algunos ensayos clínicos se ha observado un incremento de la colonización/infección por esos microorganismos3. Este potencial efecto adverso se ha controlado en algunos ensayos clínicos mediante la adición de vancomicina tópica4.
Objetivo:: evaluar el efecto sobre la mortalidad y la adquisición de bacterias resistentes a antibióticos en los pacientes que ingresan en una unidad de cuidados intensivos (UCI) con DDS o sin ella.
Diseño: ensayo clínico con asignación aleatoria.
Lugar: 2 UCI medicoquirúrgicas de un hospital en Amsterdam. Ambas recibieron el mismo tipo de pacientes y el tratamiento estándar fue el mismo en las 2 unidades. Durante los 2 años previos al estudio, la gravedad de los pacientes ingresados y la mortalidad fueron similares en las 2 unidades.
Período de estudio: septiembre de 1999 a diciembre de 2001.
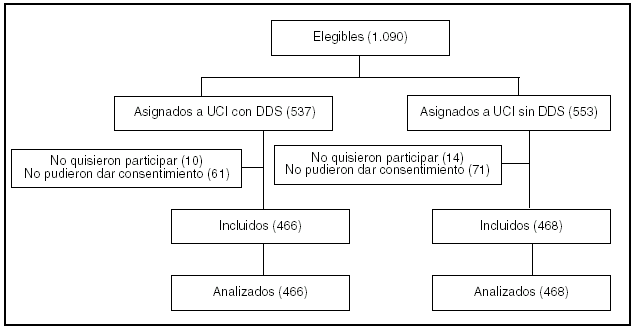
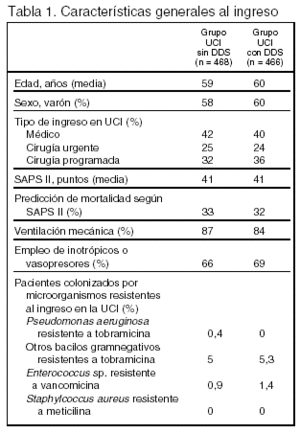
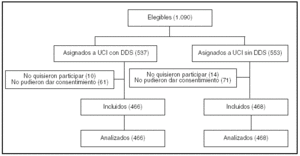
Pacientes (tabla 1, figura 1)
Figura 1.
Criterios de inclusión: 1. Edad > 18 años. 2. Expectativa de duración de la ventilación mecánica ≥ 48 h o estancia prevista ≥ 72 h, o ambos.
Criterios de exclusión: 1. Ingreso en UCI en los 3 meses anteriores. 2. Hipersensibilidad conocida a la medicación del estudio. 3. Embarazo. 4. Muerte inminente. 5. Participación en otro estudio de investigación.
Intervenciones que se comparan:
Grupo DDS: administración, 4 veces al día y hasta el alta de la UCI, de: 1. 0,5 g de una pasta que contiene polimixina E al 2%, tobramicina al 2% y anfotericina B al 2% aplicada en la cavidad bucal y en la piel que rodea al traqueostoma en los pacientes con traqueostomía; 2. solución que contiene 100 mg de polimixina E, 80 mg de tobramicina y 500 mg de anfotericina B administrada a través de la sonda nasogástrica. Además, los pacientes con asas intestinales ciegas (p. ej. después de una colostomía) fueron tratados de 2 a 4 veces al día con supositorios que contenían 42 mg de anfotericina B, 42 mg de polimixina E y 64 mg de tobramicina.
A todos los pacientes se les administró 1 g de cefotaxima por vía intravenosa cada 6 h durante los primeros 4 días.
A los pacientes en los que se cultivó en el esputo en más de 2 ocasiones hongos o bacilos entéricos aerobios gramnegativos se les administró nebulización con 5 mg de anfotericina B o con 80 mg de polimixina E, respectivamente 4 veces al día hasta que se negativizaron los cultivos.
Grupo control: tratamiento estándar.
Al ingreso y 2 veces por semana se obtuvieron muestras de frotis rectal, frotis orofaríngeo y esputo para cultivo en ambos grupos.
Asignación aleatoria: los enfermos fueron asignados a una UCI con DDS o a una UCI sin DDS.
Este diseño es justificado por los autores para evitar la colonización cruzada entre pacientes que reciben DDS y pacientes que no la reciben.
La asignación aleatoria se mantuvo oculta.
Enmascaramiento: no.
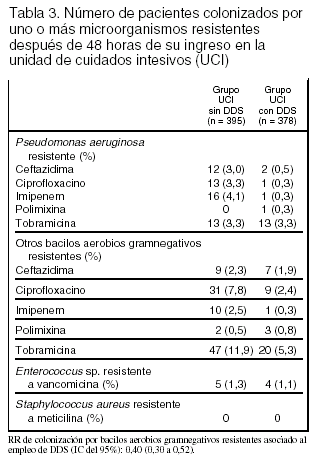
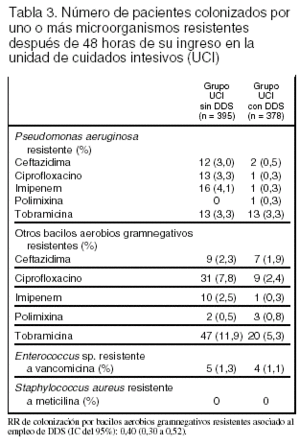
Desenlaces principales: 1. Colonización por bacterias resistentes a antibióticos aparecida en las siguientes 48 h tras el ingreso en la UCI. 2. Mortalidad hospitalaria.
Análisis por intención de tratar: sí.
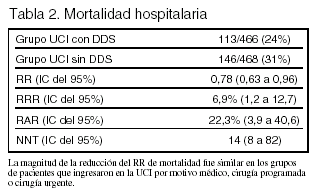
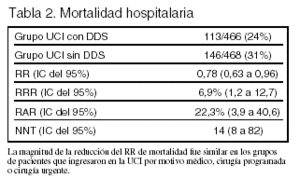
Resultados principales (tablas 2 y 3): la mortalidad fue del 15% en la UCI con DDS y del 23% en la UCI sin DDS; RR 0,65 (0,49 a 0,85). La mediana de la estancia en la UCI fue de 6,8 días en el grupo DDS y de 8,5 días en el grupo control (p < 0,0001).
Información sobre costes: el coste total de los antibióticos fue un 11% menor en la unidad con DDS que en la unidad control. El coste por 1.000 pacientes de la DDS fue de 26.195 A. El coste de antibióticos por vía parenteral por 1.000 pacientes fue de 120.123 A en la unidad con DDS y de 161.293 A en la unidad control.
Financiación del estudio: no consta.
Conclusiones de los autores: en las UCI que tengan baja prevalencia de Enterococcus sp. resistente a vancomicina y S. aureus resistente a meticilina, el empleo de DDS puede disminuir la mortalidad en la UCI y la mortalidad hospitalaria, así como la colonización por bacilos aeróbicos gramnegativos resistentes a antibióticos.
Conclusiones de los revisores: las conclusiones de los autores están en consonancia con los resultados. El efecto sobre la mortalidad en la UCI y en el hospital es congruente con los metaanálisis publicados. No obstante, dado que el estudio no fue ciego, no se puede excluir categóricamente la posibilidad de que la reducción de la mortalidad en la UCI con DDS se deba parcialmente a otras diferencias en el tratamiento de los pacientes. La contribución principal de este estudio se centra en la estimación del impacto de la administración de DDS en la aparición de resistencia de los microorganismos a los antibióticos utilizados. La asignación aleatoria a 2 UCI similares, que se diferencian en administrar DDS o no, permite estimar el efecto de esta maniobra evitando la colonización cruzada entre enfermos que reciben DDS y los que no la reciben. El período de estudio, 27 meses, se estima suficiente para "permitir" la expresión de la resistencia a los antimicrobianos. Este estudio demuestra que no hay aumento de resistencia cuando se utiliza DDS durante un tiempo prolongado. Además muestra una disminución en la resistencia de los microorganismos gramnegativos aerobios, salvo de Pseudomonas aeruginosa resistente a tobramicina, que es similar en ambas UCI. Dado que ambas UCI tienen baja prevalencia de Enterococcus sp. resistente a vancomicina y ausencia de S. aureus resistente a meticilina, queda por dilucidar el efecto de la DDS sobre las UCI con alta prevalencia de estos microorganismos, ya que los antimicrobianos utilizados en este ensayo clínico no son eficaces para erradicar cocos grampositivos resistentes.
Glosario
NNT (número necesario para tratar): es el número de pacientes que hay que tratar para prevenir un efecto adverso (100/RAR) o para que ocurra un efecto beneficioso (100/IAB).
RAR (reducción absoluta del riesgo): es la diferencia entre el riesgo de que ocurra un hecho adverso en el grupo control menos el riesgo en el grupo tratado expresada en porcentaje. Se calcula (Rc Rt) x 100.
RR (riesgo relativo): es el cociente entre el riesgo de que ocurra un suceso en el grupo tratado dividido por el riesgo de que ocurra el suceso en el grupo control (habitualmente placebo).
RRR (reducción relativa del riesgo): es la reducción proporcional en el riesgo de que ocurra un hecho adverso (p. ej., muerte) expresada en porcentaje. Se calcula (1 RR) x 100.