INTRODUCCIÓN
La enfermedad de Still del adulto (ESA) variante de la forma sistémica juvenil de la artritis reumatoidea es una enfermedad inflamatoria de etiología desconocida, presentación rara (0,16 casos por 100.000 habitantes y año) y caracterizada por fiebre alta, artritis, leucocitosis neutrofílica y exantema evanescente1,2. En ocasiones, la ESA puede presentarse en forma de síndrome de respuesta inflamatoria sistémica grave con shock3,4, síndrome de distrés respiratorio agudo (SDRA)3-6 y coagulación intravascular diseminada3,4. En estos casos tan graves, unos valores de ferritina por encima de 3.000 ng/ml (normal < 365 ng/ml) son de especial valor para establecer el diagnóstico3,5,7 y para decidir la administración de altas dosis de corticoides, los cuales pueden causar una espectacular mejoría clínica3-5. Se presenta el caso de un paciente con una ESA complicada con un síndrome de respuesta inflamatoria sistémica (shock, SDRA, fracaso renal agudo y coagulación intravascular diseminada) que tuvo valores de ferritina por encima de 15.000 ng/ml y que falleció tras la administración de altas dosis de corticoides.
OBSERVACIÓN CLÍNICA
Se trata de un varón de 41 años que ingresó en el hospital por fiebre y monoartritis. Tres semanas antes había comenzado con picos febriles diarios de hasta 39 °C y de predominio vespertino, odinofagia, gonalgia derecha y deterioro progresivo del estado general. Al ingreso en el servicio de medicina interna presentaba una presión arterial de 120/70 mmHg, una temperatura de 38,2 °C y signos inflamatorios en la rodilla derecha. La exploración neurológica y cardiopulmonar fue normal. No se palparon adenopatías ni organomegalias. En la analítica inicial destacó: leucocitos, 31.600/μl (con un 95% de neutrófilos); hemoglobina, 10,5 g/dl; plaquetas, 541.000/μl y velocidad de sedimentación globular, 121 mm/h. La tinción de Gram y el cultivo del líquido de la artrocentesis fueron negativos. Los anticuerpos antinucleares (ANA), anti-ADN y anticitoplasma de los neutrófilos (ANCA) fueron negativos; las cifras de complemento e inmunoglobulinas G, A y M fueron normales y el factor reumatoide fue menor de 20 U/dl. La ferritina plasmática fue de 15.260 ng/ml. Todos los hemocultivos, urocultivos y un amplio estudio serológico microbiano (incluyendo el virus de la inmunodeficiencia humana) fueron negativos. Un ecocardiograma demostró ausencia de derrame pericárdico y de vegetaciones valvulares. Inicialmente fue tratado con indometacina y ceftriaxona. Luego recibió tratamiento con cloxacilina, pero tras administrar la primera dosis presentó un exantema macular eritematoso en el tórax y las extremidades que se atribuyó a una posible reacción alérgica. Al undécimo día de ingreso el paciente fue trasladado a la unidad de cuidados intensivos (UCI) por hipotensión arterial resistente a la administración de fluidos.
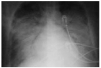
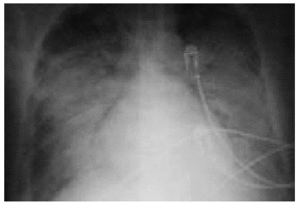
Al ingreso en la UCI el paciente estaba consciente, sudoroso y con mala perfusión periférica. Sus constantes vitales fueron: frecuencia respiratoria de 37 respiraciones/min, frecuencia cardíaca de 130 lat/min, presión arterial de 85/40 mmHg, presión venosa central de 9 cmH2O y temperatura de 36,8 °C. Hubo estertores pulmonares bilaterales y normalidad de los tonos cardíacos. Se apreciaron unas lesiones purpúricas en el dorso de los pies y la cara anterior de las extremidades inferiores. La analítica sanguínea puso de manifiesto: leucocitos, 27.100/μl (con un 95% de neutrófilos); hemoglobina, 7,7 g/dl; plaquetas, 146.000/μl; bilirrubina total, 1,5 mg/dl; creatinina, 1,2 mg/dl; lactatodeshidrogenasa, 2.195 U/l; aspartato aminotransferasa, 145 U/l; alanina aminotransferasa, 310 U/l; tiempo de protrombina, 22,6 s (27%); tiempo de tromboplastina parcial activada, 45,8 s y test de Coombs directo negativo. La gasometría arterial con FiO2 0,5 reveló: pH, 7,34; PCO2, 18,4 mmHg; PO2, 81 mmHg y bicarbonato, 10 mmol/l. La radiografía de tórax mostró un patrón alveolar bilateral y ausencia de cardiomegalia (fig. 1). Una ecografía abdominal sólo reveló barro biliar vesicular. Una extensión de sangre periférica descartó anomalías morfológicas en las 3 series. El paciente precisó ventilación mecánica con FiO2 de 1 y PEEP de 15 cmH2O por la aparición de un SDRA. Se administraron ceftriaxona, teicoplanina, noradrenalina, bicarbonato sódico, concentrados de hematíes, plasma y furosemida. Tras revisar la historia clínica se estableció el diagnóstico de ESA basándonos en una hiperferritinemia mayor de 15.000 ng/ml y en la presencia de fiebre elevada, leucocitosis con granulocitosis, exantema evanescente, odinofagia, elevación de las transaminasas y negatividad de cultivos y pruebas reumatológicas; también recibió 1 g diario de metilprednisolona durante 3 días. Seguidamente, el paciente presentó una coagulación intravascular diseminada (trombopenia de 52.000/μl, esquistocitos y tiempo de protrombina y tromboplastina parcial activada de 17,7 y 60 seg, respectivamente), un fallo renal agudo (creatinina, 4,1 mg/dl) que requirió hemodiálisis y, finalmente, falleció al quinto día de estancia en UCI por insuficiencia respiratoria.
Figura 1. Radiografía de tórax en la que se observan infiltrados alveolares bilaterales y derrame pleural derecho.
COMENTARIO
La ESA es una entidad infrecuente que describió George Still para denominar a los pacientes adultos que presentaban ciertas similitudes con los criterios clínicos clásicos de la forma sistémica de la artritis crónica juvenil1. Su etiología es desconocida, aunque se han postulado diversos factores infecciosos y genéticos asociados.
El diagnóstico de la ESA se basa en la presencia de unos criterios mayores y menores, establecidos por Yamaguchi et al2 en 1992 (tabla 1). Así, cuando se reúnen 5 criterios (con al menos 2 mayores) puede afirmarse que existe una ESA, siempre que se excluya la presencia de sepsis, tumores malignos y vasculitis sistémicas. La determinación de la ferritina plasmática es fundamental como marcador diagnóstico y como indicador de la actividad de la ESA. Así, un estudio de Otha et al8 puso de manifiesto que un 69% de los pacientes con ESA tenían valores de ferritina sérica de hasta 5 veces el nivel superior de la normalidad. Además, Akritidis et al9 observaron que la normalización de la ferritina sérica se producía en el primer mes de tratamiento y sugirieron que dicha respuesta se relacionaba con los valores de ferritina, de modo que los pacientes con aumento moderado responderían al tratamiento con antiinflamatorios no esteroideos, mientras que los enfermos con valores extremadamente altos de ferritina (> 10.000 ng/ml) requerirían el empleo de cor-ticoides. A diferencia de la hiperferritinemia de la hemocromatosis y de los procesos inflamatorios agudos y crónicos, en la ESA el porcentaje de ferritina glucosilada está disminuido5,6. Así, la capacidad diagnóstica de la combinación de ferritina glucosilada ¾ 20% con valores de ferritina superiores al límite superior de la normalidad o mayores de 5 veces su valor normal posee una sensibilidad del 70,5 y 43,2% y una especificidad del 83,2 y 92,9%, respectivamente6.
La causa de la elevación de la ferritina en la ESA no está clara3, pero se postula que puede ser debida a la liberación de ferritina desde hepatocitos dañados o desde histiocitos activados que hubieran fagocitado eritrocitos durante una crisis hemofagocítica. También se ha implicado a las citocinas y a las prostaglandinas en la fisiopatología celular de la hiperferritinemia, pues el ambiente proinflamatorio provoca un aumento de la síntesis del ARN mensajero de la ferritina hepatocitaria.
El paciente descrito tuvo una ESA complicada con shock, SDRA, fracaso renal agudo y coagulación intravascular diseminada. Ocasionalmente se han descrito casos similares de ESA asociados a SDRA con shock y coagulación intravascular diseminada3,4 o asociados a SDRA aislado5. Sólo en 2 ocasiones3,5 y en el presente caso, el diagnóstico de ESA se confirmó con hiperferritinemias mayores de 15.000 ng/ml. Aunque cifras de ferritina tan elevadas también se producen en el síndrome hemofagocítico, éste no se asocia a artritis y suele mostrar pancitopenia10. Además de los síntomas y signos descritos por Yamaguchi et al2, la ESA puede producir pleuritis, pericarditis, neumonitis y afección neurológica3. Como en nuestro caso, Iglesias et al3 presentaron un paciente con ESA asociada a un síndrome de respuesta inflamatoria sistémica que simulaba un shock séptico.
Aunque la administración intravenosa de metilprednisolona a altas dosis puede producir una mejoría espectacular en este tipo de pacientes3-5, nuestro enfermo falleció con este tratamiento. Algunos autores, como Hirohata et al6 y Pedersen4, han asociado ciclofosfamida y azatioprina más sulfasalazina, respectivamente, con el fin de mejorar los resultados.
En conclusión, la ESA debe ser incluida entre las causas de shock con fallo multiorgánico. Puesto que el médico intensivista puede resistirse a utilizar altas dosis de corticoides sistémicos ante una mera sospecha clínica, especialmente si la ESA simula un cuadro séptico, la determinación de la ferritina plasmática permite confirmar el diagnóstico.