INTRODUCCION
La historia natural de la pancreatitis aguda (PA) es variable, y abarca desde una pancreatitis leve con una rápida curación y restitutio ad integrum, has ta una pancreatitis necrosante grave con sepsis, síndrome de distrés respiratorio, fracaso renal y, finalmente, fallo multiorgánico y fallecimiento del paciente. Aproximadamente un 80% de los pacientes desarrolla una enfermedad leve, mientras que el restante 20% presenta una enfermedad grave, de los cuales fallece aproximadamente una cuarta parte.
Aunque la tasa de mortalidad ha descendido de forma significativa en la última década, debido fundamentalmente a la mejoría de la monitorización y terapia intensivas, sigue siendo fundamental establecer el pronóstico de gravedad de la PA de forma temprana. Ello es debido a que la pancreatitis grave generalmente adopta un curso evolutivo de mal pronóstico, que sólo puede evitarse mediante la instauración temprana de monitorización y tratamiento intensivos, así como de la realización de técnicas de diagnóstico por la imagen, como la tomografía axial computarizada (TAC). Por el contrario, la pancreatitis leve no requerirá tratamiento intensivo ni técnicas de diagnóstico adicionales de alto coste. La clasificación de la PA de acuerdo con su gravedad es, por tanto, necesaria para un tratamiento óptimo de la enfermedad.
Los factores que permitirán estratificar el riesgo en la PA pueden ser divididos en tres apartados: La integración de diferentes marcadores clínicos y analíticos en sistemas de puntuación multifactoriales, las técnicas de imagen y los marcadores bioquímicos de inflamación y necrosis.
SISTEMAS DE PUNTUACION MULTIFACTORIALES
Se ha investigado el papel de numerosos factores clínicos y analíticos en la predicción de la gravedad de la PA. Clásicamente se ha observado que la presencia de edad avanzada, fiebre, taquipnea, tetania, masa abdominal palpable, íleo paralítico persistente, obesidad, shock y signos hemorrágicos (Cullen y Grey-Turner) tienen valor pronóstico, pero sólo algunos de ellos pueden ser cuantificados, y su precisión es baja (39-64%) en la predicción de la gravedad de la enfermedad pancreática1-3. Diferentes parámetros analíticos (hematócrito, leucocitos, factores de coagulación, glucemia, urea, calcio, amilasa, transaminasas, presión arterial de O2, déficit de bases, lactato-deshidrogenasa) también se han evaluado en este sentido, pero su eficacia es escasa cuando se valoran aisladamente. No obstante, su valor pronóstico aumenta cuando son integrados en sistemas de puntuación multifactoriales4.
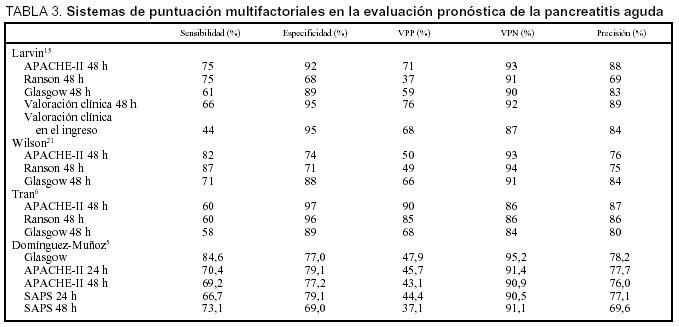
Los sistemas pronósticos más utilizados son los criterios de Ranson, Glasgow y el APACHE-II (Acute Physiology and Chronic Health Evaluation [evaluación crónica y fisiológica de la salud]), los cuales han demostrado su utilidad en varios estudios clínicos. El SAPS (Simplified Acute Physiology Score [sistema de puntuación para la evaluación fisiológica aguda simplificada]), el MOSF (Multi-Organ System Failure [sistema de evaluación del fallo multiorgánico]), el SPC (Simplified Prognostic Criteria [criterios pronósticos simplificados]) y el MRC (sistema del Medical Research Council) aún no han sido estudiados exhaustivamente5-7.
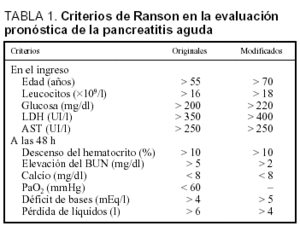
Criterios de Ranson y Glasgow
Los criterios de Ranson fueron descritos inicialmente para los pacientes alcohólicos y posteriormente se extendió su aplicación a la PA de origen biliar (tabla 1). Cinco de los criterios se determinan en el momento del ingreso (que reflejan la intensidad del proceso inflamatorio, excepto la edad) y seis de ellos a las 48 h del mismo (hacen relación a las complicaciones sistémicas)8-12. En un análisis de 450 pacientes con PA se observó que la existencia de dos factores se asociaba con baja mortalidad, la cual aumenta de forma paralela al incrementar el número de factores de riesgo (el 0,9% con uno o dos, el 16% cuando existen tres o cuatro, el 40% con cinco o seis y el 100% si existen siete o más factores de riesgo)8. Los pacientes con más de tres criterios de Ranson tenían una incidencia más alta de necrosis pancreática13, mientras que el número de criterios era mayor en aquellos enfermos que desarrollaban PA necrosante con necrosis estéril y evolución fatal que en aquellos que sobrevivían. En una revisión de siete estudios incluyendo más de 700 pacientes con PA, la presencia de tres o más criterios de Ranson predijo la existencia de PA grave, con una sensibilidad del 72% (40-88%), especificidad del 76% (43-99%), valor predictivo positivo del 51% (31-95%) y negativo del 99% (74-94%)14. El estudio más amplio en que se evaluaron los criterios de Ranson a las 48 h, es un análisis prospectivo analizando 290 episodios de PA, en el que se obtienen una sensibilidad del 75%, una especificidad del 68%, un valor predictivo positivo del 37% y un valor predictivo negativo del 91%. Cuando se compararon con los criterios de Ranson al ingreso se observó que presentaban una mejor sensibilidad (el 75 frente al 44%), una menor especificidad (el 68 frente al 95%) y un menor valor predictivo positivo (el 37 frente al 68%)15.
Los criterios de Glasgow son similares a los de Ranson, y pueden ser valorados también a las 48 h (tabla 2)1,2,16. Steinberg14 analizó seis estudios que emplearon los criterios de Glasgow para predecir la gravedad de la PA, obteniéndose una sensibilidad en el 63% (56-85%), una especificidad del 84% (79-89%), un valor predictivo positivo del 52% (39-71%) y negativo del 89% (85-94%). El estudio prospectivo más extenso proporcionó una sensibilidad y especificidad del 61 y el 89%, respectivamente15.
Las limitaciones más importantes de los criterios de Ranson y Glasgow derivan por un lado, de su bajo valor predictivo positivo, y por otro de la necesidad de esperar 48 h desde el ingreso para su definición completa, período clave para la instauración adecuada del tratamiento en la PA. Asimismo, incluye numerosos parámetros y valores a determinar, éstos pueden ser influenciados parcialmente por las medidas terapéuticas instauradas y no permiten un seguimiento del paciente más allá de las 48 h, ya que han sido definidos sólo para la fase inicial de la PA6,17-19. Todo esto hace que estos criterios no deban seguir siendo empleados en la clasificación pronóstica de la PA en la práctica clínica.
Sistema APACHE-II
El sistema más reciente y complejo usado para predecir la gravedad de la PA es la puntuación APACHE, que mide 12 variables, la edad de los pacientes y el estado de salud de los mismos20. La última modificación efectuada en este índice es la inclusión del porcentaje de grasa corporal. La principal característica diferenciadora de esta escala es que valora el estado del paciente en un momento determinado de su ingreso, no sólo durante las 48 h iniciales.
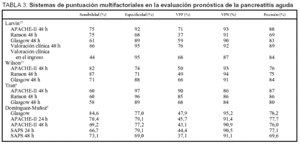
Varios estudios sugieren que el APACHE-II es superior a los criterios de Ranson y Glasgow en la evaluación pronóstica de la PA21. La existencia de una puntuación superior a 9 en APACHE-II proporcionó una sensibilidad del 75%, una especificidad del 92%, un valor predictivo positivo del 71% y negativo del 93%15. Aunque otros estudios contradi-cen los resultados anteriores6,13, en general un APACHE-II al ingreso igual o inferior a 7 predice una PA de curso leve, mientras que puntuaciones de 8 o superiores predicen cursos más graves. A las 48 h del ingreso, la precisión del APACHE-II es similar a la obtenida con los criterios de Ranson y Glasgow22,23. Diversos estudios han comparado estos tres índices para predecir la gravedad de una PA, cuyos resultados se resumen en la tabla 3. El bajo valor predictivo positivo del APACHE-II sigue siendo su principal limitación en la predicción de gravedad de la PA, pero en la actualidad es el método de evaluación pronóstica aplicado en numerosos centros y ensayos clínicos.
Debido a la complejidad del APACHE-II se ha empleado un sistema menos complejo, el SAPS, pero su sensibilidad es menor3,5. El MOSF evalúa la disfunción observada durante el mismo día en los sistemas cardiovascular, pulmonar, renal, neurológico, hematológico, hepático y gastrointestinal. La gravedad de la PA se incrementa con el número de órganos y sistemas afectos, y prácticamente todos los pacientes sufren un curso grave de la PA si el MOSF es superior a 4 o mayor, y se obtiene una precisión diagnóstica del 88% en el ingreso y del 90% en la evaluación efectuada a las 48 h6. Este sistema podría sustituir en un futuro cercano al APACHE-II en la evaluación pronóstica de la PA.
TOMOGRAFIA AXIAL COMPUTARIZADA
Las complicaciones locales y sistémicas influyen notablemente en la gravedad de la PA, siendo la infección del tejido pancreático necrosado una causa importante de morbilidad y mortalidad. Así, la existencia de necrosis pancreática se asoció con un incremento de complicaciones el (82 frente al 6%) y de la tasa de mortalidad (el 23 frente al 0%)24. Varios estudios demuestran que la necrosis pancreática predice gravedad con una sensibilidad del 79-83%, pero con una especificidad baja, del 42-65%25,26. De esta forma, la constatación de la existencia de necrosis pancreática en la PA podría constituirse en una forma de predecir la gravedad de la misma27.
En la actualidad, la TAC dinámica con contraste es el patrón oro en la identificación y la cuantificación de la necrosis pancreática28-30. No obstante, todavía es controvertido el valor de la TAC como predictor de la infección del tejido necrosado, a pesar de la evidencia de que la extensión de la necrosis se correlaciona con el riesgo de sepsis de origen pancreático31-32. Por tanto, la utilidad clínica de la TAC en la PA será la constatación de necrosis en aquellos pacientes que a priori presentan criterios clínicos y/o bioquímicos de PA grave, con el fin de iniciar la administración de antibióticos profilácticos.
MARCADORES BIOQUIMICOS
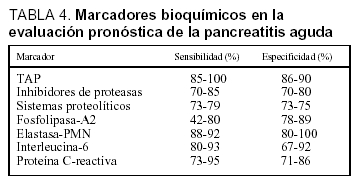
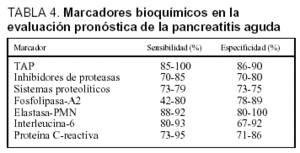
La utilidad de diversos marcadores bioquímicos para la determinación del pronóstico de la PA ha sido recientemente estudiada. Comparados con las clasificaciones multifactoriales previamente analizadas, los marcadores bioquímicos presentan las ventajas de su realización temprana, incluso en el momento mismo del ingreso. Además permiten una monitorización continua del curso clínico de la enfermedad pancreática y facilitan su obtención, limitada exclusivamente a la disponibilidad de su determinación en el laboratorio. Los parámetros bioquímicos para la evaluación pronóstica de la PA se pueden clasificar en marcadores de necrosis, marcadores de activación proteásica y marcadores de respuesta inflamatoria. La eficacia de los diferentes marcadores en la evaluación pronóstica de la PA se resume en la tabla 433.
Marcadores de necrosis
La methemalbúmina es un complejo formado por albúmina y hematina formada tras la hidrólisis de la hemoglobina mediada por proteasas. La presencia de methemalbúmina circulante es indicadora de pancreatitis necrosante con una especificidad alta, pero sensibilidad limitada1,34, siendo su valor pronóstico similar a los sistemas de puntuación clásicos35. Por otra parte, el aumento de los niveles séricos de ribonucleasa pancreática es indicativo de muerte celular, ya que se trata de una enzima esencialmente intracelular36,37. Al igual que la methemalbúmina, su sensibilidad es baja como marcador de pancreatitis necrosante, lo que limita su utilidad clínica.
Marcadores de activación de las proteasas
El péptido de activación del tripsinógeno (TAP) se genera durante la activación intrapancreática patológica del tripsinógeno, de modo que la activación de una mólecula de tripsinógeno da lugar a una molécula de tripsina y una molécula de TAP. Este se libera a la cavidad peritoneal y a la circulación sistémica, siendo eliminado por vía renal y excretado por la orina, donde puede ser cuantificado. Se ha observado que la presencia de una alta concentración de TAP en líquido peritoneal indica necrosis pancreática con una precisión similar a la TAC38, mientras que valores elevados de TAP en orina se observan de forma temprana en pacientes con enfermedad pancreática grave. Así, la concentración de TAP urinario superior a 2 nmol/l indica PA grave con una precisión del 85-90%39, pero sólo permite diferenciar pancreatitis leve de grave en las primeras 12 h de la enfermedad. En un análisis posterior se confirma la alta eficacia de la concentración urinaria de TAP superior a 10 nmol/l en la evaluación pronóstica de la PA, pero sólo en las primeras 24 h de la enfermedad40. En un reciente estudio multicéntrico la concentración urinaria de TAP superior a 35 nmol/l identificó PA grave con una sensibilidad del 58%, una especificidad del 73%, un valor predictivo positivo del 39% y un valor predictivo negativo del 86% a las 24 h del ingreso, mientras que estos valores eran respectivamente del 83, el 72, el 44 y el 94% a las 48 h del mismo41. La discrepancia entre los resultados publicados y la necesidad para su determinación de técnicas de enzimoinmunoanálisis limita la aplicabilidad clínica de este marcador.
El péptido activador de la profosfolipasa A2 tipo I (PROP) se libera durante la activación de este enzima como consecuencia de la actividad de los granulocitos, y parece estar en relación con el desarrollo de insuficiencia respiratoria aguda en el seno de la PA42. En asociación con el TAP, la determinación de PROP podría constituirse en un marcador de gravedad de la PA, con la limitación que supone el precisar de técnicas de enzimoinmunoensayo. No obstante, son necesarios estudios clínicos más amplios para determinar la verdadera utilidad de este test.
La proteína páncreas-específica humana (hPASP) se ha identificado como una procarboxipeptidasa B localizada en el citoplasma de las células pancreáticas normales, y sus valores sanguíneos se elevan en el curso de la PA43. Al igual que otra enzima pancreática, la hidrolasa ester-carboxílica (CEH), los valores más elevados se obtienen en la PA necrosante, por lo que podrían tener valor a la hora de discernir entre una PA de curso leve o grave44-46.
De forma reciente se ha evaluado la utilidad de la determinación del péptido activador de la carboxipeptidasa B (CAPAP) en la predicción temprana de la gravedad de la PA. Los valores urinarios y séricos de CAPAP se correlacionaron con la gravedad de la pancreatitis. Concretamente, el CAPAP urinario demostró un valor predictivo positivo del 69%, un valor predictivo negativo del 98% y una precisión global del 90%47,48. No obstante, estos resultados precisan de ulteriores estudios para su confirmación.
Marcadores de respuesta inflamatoria
Antiproteasas
Las proteasas activadas en el seno de la cascada inflamatoria pancreática son inhibidas por antiproteasas circulantes, fundamentalmente la a2-macroglobulina (AMG). Esta proteína es, por tanto, consumida en la PA, y más intensamente si la enfermedad sigue un curso grave. Así, un descenso de la AMG sérica de más de 25 mg/dl en las primeras 48 h de la enfermedad indica PA grave con una precisión del 70-80%49. Dado que los valores séricos de AMG son un reflejo del equilibrio proteasas-antiproteasas, su determinación seriada podría ser útil en la monitorización del curso evolutivo de la PA. Una eficacia similar se observa en la determinación sérica del α1-proteasa-inhibidor (API)49-51.
Sistemas proteolíticos
En el proceso inflamatorio que tiene lugar en la PA se produce una activación de diferentes sistemas proteolíticos, que incluyen complemento, coagulación, fibrinolisis y calicreína-cinina. El consumo de factores de estos sistemas es más intenso en la PA grave. Así, se han encontrado valores bajos de C3, C4, antitrombina-III, péptido-C, inhibidor del activador del plasminógeno, inhibidor de α2-plasmina, precalicreína y cininógeno en pacientes con enfermedad grave49,52-57. No obstante, su precisión como factores pronósticos es limitada o no ha sido todavía debidamente evaluada.
Respuesta inflamatoria mediada por células
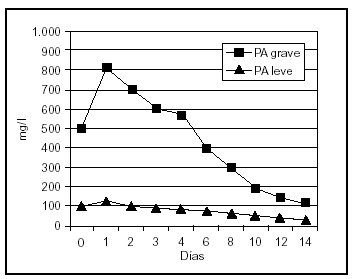
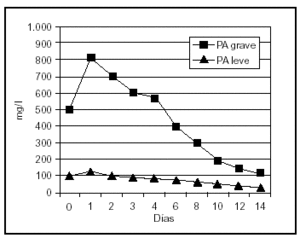
Uno de los fenómenos iniciales en la patogenia de la PA es la infiltración del intersticio pancreático de neutrófilos y macrófagos activados, que liberan una gran cantidad de sustancias mediadoras de la inflamación. La elastasa, liberada por los polimorfonucleares neutrófilos, es la más relevante desde el punto de vista clínico. Las concentraciones de elastasa polimorfonuclear (PMN) se elevan muy inicialmente en aquellos pacientes que desarrollarán una PA grave58,59 (fig. 1). La sensibilidad y la especificidad de este test son superiores al 90%, con un valor predictivo positivo de casi el 80% en el momento del ingreso y el 97% a las 24 h, y un valor predictivo negativo de aproximadamente del 98%, proporcionando una precisión superior al 90% en la evaluación pronóstica temprana de esta enfermedad 58,60.
Figura 1. Niveles plasmáticos de elastasa-PMN en pancreatitis aguda leve y grave.
La medición de los valores circulantes de interleucina-6 presenta también un elevado grado de precisión en la evaluación pronóstica de la PA61-64, y se correlaciona con los valores plasmáticos de elastasa-(PMN)61,65. La fosfolipasa A2 es un marcador de actividad fagocítica en los procesos necroinflamatorios, y se ha visto involucrada en la fisiopatología de la PA grave, sobre todo en el desarrollo de necrosis pancreática e insuficiencia respiratoria. Sus concentraciones circulantes se correlacionan con la gravedad de la enfermedad pancreática, con una precisión de aproximadamente el 80%61,66,67. La necesidad de un enzimoinmunoensayo para su determinación dificulta su empleo en la práctica clínica diaria, sobre todo como parámetro de obtención urgente.
Reactantes de fase aguda
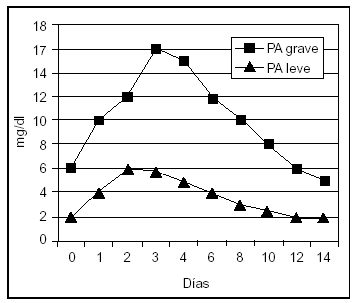
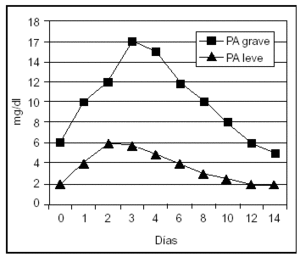
La proteína C-reactiva (PCR) es un reactante de fase aguda cuya síntesis hepática es estimulada fundamentalmente por la IL-6. Por tanto, su aparición en suero es posterior a la de los mediadores sintetizados por neutrófilos y macrófagos, y su incremento es mayor en aquellos pacientes con PA grave. En un estudio, el análisis de la PCR presentaba un resultado superior al análisis de los criterios de Ranson y Glasgow en la predicción de PA grave, con una sensibilidad y una especificidad del 83 y el 85%, respectivamente. De esta forma, su utilidad en la evaluación pronóstica de la PA es similar a la elastasa-PMN y a la IL-6, pero menos temprana, alcanzando su mayor valor a las 48-72 h del inicio de la enfermedad, lo que constituye su mayor limitación49,52,53,61-63,68,69 (fig. 2).
Figura 2. Valores séricos de proteína C reactiva en pancreatitis aguda leve y grave.
En estudios recientes, se ha encontrado que los valores plasmáticos de procalcitonina (PCT) se encuentran más elevados en pacientes con PA grave70, fundamentalmente en aquellos con infección de la necrosis pancreática71. En este sentido, la cuantificación de PCT podría desempeñar un papel diagnóstico, previo a la punción-aspiración con aguja fina (PAAF) ante la sospecha de infección de la necrosis pancreática.
CONCLUSIONES
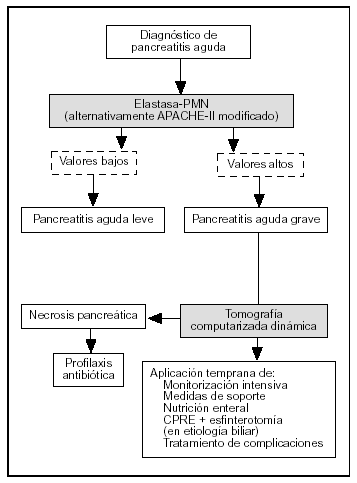
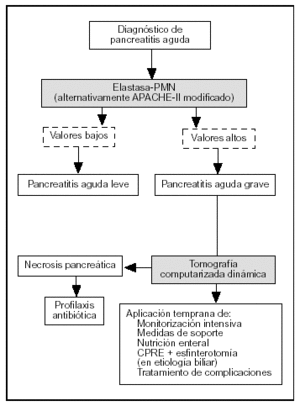
El TAP, la elastasa-PMN y la PCR son los marcadores más precisos en la evaluación pronóstica de la PA. El TAP tiene el inconveniente de ser útil sólo en las primeras 24 h de la enfermedad y, al igual que la IL-6, de precisar técnicas de inmunoensayo para su determinación analítica. La PCR tiene la limitación de que alcanza sus valores máximos a las 72-96 h después del comienzo de la enfermedad. La elastasa-PMN es, de esta forma, el parámetro con valor pronóstico más útil. Sus concentraciones circulantes se elevan antes de que la gravedad de la enfermedad se haga clínicamente evidente y si se alcanzan determinados valores (> 250 mg/l) es imperativa una monitorización intensiva de las constantes vitales y tratamiento de soporte, que incluye una adecuada reposición hidroelectrolítica y la instauración temprana de nutrición enteral con dietas inmunomoduladoras mediante sonda nasoyeyunal. Asimismo, es necesario realizar una TAC dinámica en las primeras 48-72 h del comienzo del cuadro clínico, con el fin de detectar necrosis pancreática. Si se confirma la presencia de necrosis, está indicado el inicio temprano de profilaxis de infección del tejido necrótico con imipenem. Por el contrario, valores inferiores de elastasa-PMN requerirán solamente una evaluación clínica cuidadosa, sin posteriores técnicas de ima-gen72 (fig. 3).
Figura 3. Algoritmo para el tratamiento de la pancreatitis aguda según la evaluación pronóstica.