Comparación de la ventilación mecánica invasiva (VMI) frente a la no invasiva (VMNI) en pacientes hematológicos que desarrollaron insuficiencia respiratoria aguda (IRA).
DiseñoEstudio observacional retrospectivo desde 2001 y hasta diciembre de 2011.
ÁmbitoUnidad de cuidados intensivos (UCI) médico-quirúrgica de un hospital de tercer nivel.
PacientesAquellos con patología hematológica con IRA y que precisaron ventilación mecánica (VM), tanto VMI como VMNI.
Variables de interésNúmero de infeccciones y fracaso de órganos, duración de VM y estancias en la unidad y hospitalaria, así como mortalidad en UCI, hospitalaria y a los 90 días. En el subgrupo de VMNI se comparó éxito y fracaso en cuanto a las variables mencionadas.
ResultadosSe incluyeron 41 pacientes que precisaron VM, 35 con VMNI y 6 con VMI. La mortalidad en UCI fue superior en VMI (100 vs. 37% en VMNI, p=0,006). El porcentaje de intubación en VMNI fue del 40%. El grupo fracaso de VMNI presentó mayor tasa de complicaciones, mayor duración de la VM, mayor estancia en UCI, así como de mortalidad en UCI y hospitalaria que el grupo que no precisó intubación. El análisis multivariante de mortalidad en el grupo VMNI estaba relacionada con el fracaso de la VMNI (OR 13 [IC 95% 1,33–77,96], p=0,008) y el desarrollo de síndrome de distrés respiratorio del adulto (OR 10 [IC 95% 1,95–89,22], p=0,03).
ConclusiónLa utilización de VMNI redujo la mortalidad en comparación con la VMI. El fracaso de la VMNI llevó aparejada una mayor tasa de complicaciones.
A comparison was made between invasive mechanical ventilation (IMV) and noninvasive positive pressure ventilation (NPPV) in haematological patients with acute respiratory failure.
DesignA retrospective observational study was made from 2001 to December 2011.
SettingA clinical-surgical intensive care unit (ICU) in a tertiary hospital.
PatientsPatients with hematological malignancies suffering acute respiratory failure (ARF) and requiring mechanical ventilation in the form of either IMV or NPPV.
Variables of interestAnalysis of infection and organ failure rates, duration of mechanical ventilation and ICU and hospital stays, as well as ICU, hospital and mortality after 90 days. The same variables were analyzed in the comparison between NPPV success and failure.
ResultsForty-one patients were included, of which 35 required IMV and 6 NPPV. ICU mortality was higher in the IMV group (100% vs 37% in NPPV, P=.006). The intubation rate in NPPV was 40%. Compared with successful NPPV, failure in the NPPV group involved more complications, a longer duration of mechanical ventilation and ICU stay, and greater ICU and hospital mortality. Multivariate analysis of mortality in the NPPV group identified NPPV failure (OR 13 [95%CI 1.33–77.96], P=.008) and progression to acute respiratory distress syndrome (OR 10 [95%CI 1.95–89.22], P=.03) as prognostic factors.
ConclusionThe use of NPPV reduced mortality compared with IMV. NPPV failure was associated with more complications.
El pronóstico de la enfermedad hematológica ha experimentado una mejoría en las últimas décadas1,2. A pesar de ello, los pacientes que requieren ingreso en la unidad de cuidados intensivos (UCI) presentan una mortalidad elevada1–5. La causa principal de ingreso en UCI es el desarrollo de una insuficiencia respiratoria aguda (IRA), que precisa soporte ventilatorio en ocasiones1–7, debido a la aparición de infiltrados pulmonares tanto infecciosos como no infecciosos8. Por contra, se ha identificado que la ventilación mecánica, y especialmente la ventilación mecánica invasiva (VMI), es uno de los factores de riesgo relacionados con la mortalidad en UCI1,2.
El desarrollo de la ventilación mecánica no invasiva (VMNI) como técnica de soporte ventilatorio ha supuesto un gran avance en el soporte ventilatorio para el paciente crítico. La VMNI aporta una serie de beneficios9,10 puesto que reduce de la necesidad de intubación orotraqueal gracias al descanso de la carga muscular generada por la patología respiratoria que ha ocasionado la IRA, a la vez que mejora la oxigenación y consigue una eliminación del anhídrido carbónico, y como consecuencia directa, se consigue disminuir la incidencia de neumonía asociada a la ventilación mecánica y de la estancia en UCI y hospitalaria, máxime en pacientes inmunodeprimidos. Pese a estos beneficios reportados, y aun con trabajos que refrenan el éxito de dicha técnica6,10–13, la utilización de la VMNI sigue siendo menor de lo esperada, en favor de la VMI, que sigue siendo el gold standard en soporte ventilatorio en estos pacientes5.
El objetivo de nuestro estudio fue analizar la incidencia de IRA en pacientes hematológicos ingresados en UCI que precisaron ventilación mecánica, tanto invasiva como no invasiva, con el ánimo de comprobar si la VMNI era superior a la VMI en cuanto al desarrollo de infeccciones, de fracaso de órganos, duración del tiempo de ventilación mecánica y estancias en la unidad, en el hospital, así como de mortalidad en UCI, hospitalaria y a los 90 días. Asimismo se analizó la incidencia de fracaso de la VMNI, comparando las mismas variables entre grupo éxito vs. fracaso, así como los factores relacionados con la mortalidad en el grupo VMNI.
Material y métodosSe realizó un estudio observacional retrospectivo, cuyo protocolo de estudio fue aprobado por el Comité Ético de Investigación Clínica Hospitalaria. Fueron incluidos todos los pacientes hematológicos con IRA que ingresaron en la UCI entre enero de 2001 y hasta diciembre 2011 y que precisaron soporte ventilatorio. Las patologías hematológicas incluidas fueron: leucemia aguda (linfoblástica o mielocítica), linfoma no hodgkiniano, mieloma múltiple, leucemia crónica, y enfermedad de Hodgkin, principalmente. Los pacientes habían recibido tratamiento quimioterápico, corticoideo o trasplante de precursores hematopoyéticos. La neutropenia fue considerada cuando el recuento de leucocitos fue inferior a 1.000/mm3.
Se definió IRA cuando la frecuencia respiratoria (FR) era >30 rpm, presión parcial de oxígeno (paO2) <60mmHg o presión parcial de anhídrido carbónico (paCO2) >45mmHg. La neumonía comunitaria fue considerada como infección del tracto respiratorio inferior con presencia de opacidades en la radiografía de tórax, signos y síntomas de infección respiratoria como fiebre, tos, dolor pleurítico, leucocitosis o leucopenia y presencia o ausencia de secreciones14. Los cuadros hipoxémicos fueron etiquetados como lesión pulmonar aguda (LPA) o síndrome de distrés respiratorio del adulto (SDRA), en función de los siguientes criterios15: infiltrado bilateral, presión de enclavamiento pulmonar menor de 18mmHg, paO2/FiO2 <300 (LPA) o paO2/FiO2 <200 (SDRA). Para el estudio microbiológico se determinaron antígenos solubles en orina, y se obtuvo muestra de sangre periférica para hemocultivos y serología de neumonías, y por último, en aquellos casos en que fue posible, recogida de esputo para cultivo y realización de prueba de Gram. Además se realizó aspirado nasofaríngeo para determinación del nuevo virus de influenza H1N1, que se hace de manera rutinaria desde 2009 a todas las neumonías con patrón radiológico intersticial. Se recogieron muestras invasivas no broncoscópicas (lavado broncoalveolar y broncoaspirado) una vez los enfermos eran intubados. El criterio de sepsis y shock séptico se estableció de acuerdo con la definición establecida en literatura16.
Monitorización y variables analizadasAl ingreso del paciente se procedía a monitorización hemodinámica invasiva mediante canalización de catéter arterial y vía venosa central. La monitorización respiratoria se realizó mediante saturación transcutánea de oxígeno (SatcO2), a través de pulsioxímetro Oxisensor Nellcor II D-25 (Nellcor® Puritan Bennet Inc., Decasanton, CA, EE. UU.) y mediante muestras sanguíneas arteriales para determinaciones gasométrícas, procesadas en cooxímetro ABL560 (Radiometer Medical A/S®, Copenhagen, Dinamarca).
A su ingreso y durante su estancia en la unidad se recogieron datos de filiación, diagnóstico, sistemas de estimación de gravedad a través del Simplified Acute Physiology Score (SAPS) 2 y fallo orgánico mediante el Sequential Organ Failure Assessment (SOFA). Así mismo se registraron las correspondientes variables hemodinámicas, respiratorias, gasométricas y bioquímicas. Durante su evolución se registró la estancia en UCI y hospitalaria, y la duración de la ventilación mecánica. Se recogieron las complicaciones que se produjeron a lo largo de la estancia en la unidad como: intubación orotraqueal, barotrauma, infecciones nosocomiales, necesidad de traqueotomía y mortalidad (UCI, hospitalaria y a los 90 días del ingreso). Asimismo se recogió la tasa de disfunción orgánica según escala Marshall17 que contempla el fracaso renal agudo (con o sin hemofiltración), el cardiovascular, el hematológico, el neurológico y el hepático
Soporte ventilatorio no invasivoSe empleó el respirador9BiPAP Vision (Respironics Inc®, Pennsylvania, EE. UU.) conectado a mascarilla orofacial o Total face® (Respironics Inc®, Pennsylvania, EE. UU.) con sistema de humidificación activa MR850 (Fischer and Payckel Healtcare ltd, Nueva Zelanda). Tras explicar la técnica al paciente, se ajustaba la mascarilla y se aumentaba progresivamente la presión espiratoria al final de la espiración (PEEP) y la presión de soporte por encima de PEEP (PS), hasta conseguir un volumen corriente (Vt) de 10-15ml/kg y una FR de 25-28rpm de tal manera que en la primera hora de soporte se alcanzase un mínimo de PS: 10-15cmH2O y una PEEP: 5-6cmH2O. La concentración de oxígeno se ajustó hasta conseguir una SatcO2 >94%. Una vez el paciente experimentase mejoría clínica y/o gasométrica, se procedería a la retirada progresiva del ventilador hasta la completa desconexión de la VMNI. Las modificaciones de FiO2 y niveles de PS/PEEP fueron realizadas según criterio del médico responsable. Se consideró fracaso de la VMNI cuando se presentaban alguno de los siguientes criterios9: persistencia del trabajo respiratorio, de la hipoxemia, deterioro cognitivo y asincronía con el respirador.
Soporte ventilatorio invasivoSe procedió a la sedación del paciente (midazolam o propofol asociado a morfina) y posterior intubación orotraqueal con conexión al respirador. Parámetros iniciales: ventilación controlada/asistida por volumen (CMV/a), Vt: 6-8ml/kg, flujo 60l/min, FR: 12-14rpm, FiO2 para conseguir SatcO2 de 94-96%, PEEP mínima de 5cmH2O. La evolución del proceso respiratorio a SDRA obligó a la modificación de los parámetros ventilatorios18: Vt<6ml/kg, presión meseta <35cmH2O, PEEP progresivas y FiO2 lo más baja posible, con el objetivo de conseguir una SactO2>94%. Tras recuperación, se procedía al destete y posterior extubación mediante prueba de respiración espontánea. Las modificaciones de los parámetros ventilatorios y destete fueron efectuados por el médico responsable. El paciente se consideraba que había superado la prueba de respiración si, durante 2h, no presentaba deterioro hemodinámico o respiratorio, siendo considerado como apto para ser extubado y siempre a criterio médico.
La duración de ventilación mecánica incluyó el tiempo (en días) de ventilación mecánica y el tiempo de weaning. Se definió estancia hospitalaria como toda la estancia del paciente en UCI y el hospital. La aplicación de VMI o VMNI, así como el resto de medidas de soporte (fármacos vasoactivos, antibioterapia, terapia de sustitución renal, transfusión de hemoderivados, soporte nutricional) quedaban bajo la responsabilidad del médico asistente en el momento del ingreso, en colaboración con el servicio de hematología.
Dadas las características del estudio no fue preciso la solicitud de consentimiento informado al paciente y/o familia.
Análisis estadísticoSe empleó el paquete SPSS 18.0 para el análisis estadístico. Las variables cuantitativas fueron analizadas por métodos paramétricos mediante T-Student o no paramétricos mediante U-Mann Whitney, según análisis de normalidad por el test de Kolmogorov-Smirnov. Para las variables cualitativas se utilizó la prueba del Chi cuadrado con el test exacto de Fischer (de 2 colas) cuando el número de casos era inferior a 5. Significación estadística si p<0,05. Se realizó análisis multivariante mediante modelo de regresión logística para determinar factores relacionados con la mortalidad en el grupo VMNI, decidiéndose no incluir el grupo VMI en el análisis, para evitar un sesgo al incluir un grupo de pacientes que a su ingreso mostraban diferencias significativas con respecto al grupo VMNI. Las variables fueron incluidas en el modelo por método enter con punto de corte de 0,1. La capacidad predictiva del modelo se estableció a través del test de Hosmer-Lemeshow, el valor predictivo positivo, el valor predictivo negativo, exactitud diagnóstica y el análisis bajo la curva de característica operativa del receptor (ROC).
ResultadosDurante el periodo de estudio se ingresaron 132 pacientes con patología hematológica de un total de 11.501 pacientes ingresados, siendo en 41 (31%) casos preciso el soporte ventilatorio, 35 (85%) fueron ventilados con VMNI y 6 (15%) con VMI. La muestra de pacientes (tabla 1) estaba constituida principalmente por 26 (63%) hombres, con una edad media de 56±6 años, un SOFA de 7±3 y un SAPS 2 de 63±18. Al comparar ambos grupos, se pudo constatar que, al ingreso, el grupo VMI presentaba una situación de más fallo de órganos estimada por escala de SOFA (9±4 vs. 7±2 en VMNI, p=0,025), y peor pronóstico medido por SAPS 2 (66±17 vs. 52±14 en VMNI, p=0,047). En cambio, el retraso hasta su ingreso en UCI fue menor en el grupo de VMNI (3 [1-15] vs. 26 [4-43] en VMI, p=0,033). La mayoría de los pacientes procedía de planta, donde se había aplicado el sistema de presión positiva continua en la vía aérea (CPAP), en algunas ocasiones, como paso previo a su ingreso en la unidad. Coincidieron ambos grupos en que la comorbilidad más frecuente era la hipertensión arterial, la patología predominante fue la leucemia aguda, y la causa de IRA fue la neumonía, sin existir diferencias significativas. El porcentaje de neutropenia fue mayor en el grupo VMI (83 vs. 26% en VMNI, p=0,018). La comparación de los parámetros fisiológicos en situación basal destacó que el grupo VMI presentaba más acidosis metabólica por el exceso de bases (−9±7 vs. −2±6 en VMNI, p=0,013), plaquetopenia (14.500 [11.000-21.000] vs 96.000 [29.000-239.000] en VMNI, p=0,001), leucopenia (35 [20-100] vs. 7.210 [670-14.445] en VMNI, p=0,003), coagulopatía por el índice de QUICK (51 [21 – 65] vs. 70 [52-81] en VMNI, p=0,05) y fallo hepático estimado por la bilirrubina (5 [3,12-5,00] vs. 1 [0,79-1,55] en VMNI, p=0,022) que el grupo VMNI.
Características demográficas, comorbilidades y causa de insuficiencia respiratoria aguda
| Variables | Global(n=41) | VMNI(n=35) | VMNI éxito(n=21) | VMNI fracaso(n=14) | VMIc(n=6) | p* |
| Sexo, hombre (n=26), n (%) | 26 (63) | 22 (63) | 13 | 9 | 4 (67) | 1,000 |
| Edada,años | 56±6 | 58±14 | 59±12 | 57±20 | 50±12 | 0,280 |
| SOFAa | 7±3 | 7±2 | 7±2 | 7±3 | 9±4 | 0,025 |
| SAPS 2a | 63±18 | 52±14 | 53±17 | 50±11 | 66±17 | 0,047 |
| SAPS 2 (%) | 54±26 | 49±25 | 51±28 | 48±20 | 73±29 | 0,054 |
| Tiempo hasta ingreso en UCIb | 3 (1-15) | 3 (1-15) | 3 (1-15) | 4 (1-16) | 26 (4-43) | 0,033 |
| CPAP previa a ingreso, n(%) | 10 (24) | 8 (23) | 3 (14) | 5 (35) | 2 (33) | 0,622 |
| Procedencia de pacientes, n(%) | 0,071 | |||||
| Planta médica o quirúrgica | 33 (80) | 28 (80) | 17 (80) | 11 (78) | 5 (83) | |
| Urgencias | 6 (15) | 6 (17) | 3 (14) | 3 (12) | 0 | |
| Quirófano | 1 (2) | 0 | 0 | 0 | 1 (17) | |
| Otra UCI | 1 (2) | 1 (3) | 1 (6) | 0 | 0 | |
| Comorbilidades, n(%) | ||||||
| Hipertension arterial | 17 (41) | 16 (46) | 12 (57) | 4 (28) | 1 (17) | 0,382 |
| EPOC | 6 (15) | 6 (17) | 5 (24) | 1 (7) | 0 | 0,567 |
| Insuficiencia cardíaca congestiva | 4 (10) | 4 (11) | 3 (14) | 1 (7) | 0 | 1.000 |
| Diabetes mellitus | 4 (10) | 4 (11) | 4 (19) | 0 | 0 | 1.000 |
| Cáncer previod | 4 (10) | 3 (8) | 2 (9) | 1 (7) | 1 (17) | 0,483 |
| Tabaquismo | 3 (7) | 3 (8) | 2 (9) | 1(7) | 0 | 0,683 |
| Insuficiencia renal crónica | 1 (2) | 0 | 0 | 0 | 1 (17) | 0,146 |
| Neutropenia, n (%) | 14 (34) | 9 (26) | 5 (24) | 4 (28) | 5 (83) | 0,013 |
| Tipo de enfermedad hematológica | 0,608 | |||||
| Leucemia aguda, n (%) | 18 (44) | 13 (37) | 7 (33) | 6 (43) | 5 (83) | |
| Linfoma no hodgkiniano, n (%) | 9 (22) | 9 (26) | 7 (33) | 2 (14) | 0 | |
| Mieloma múltiple, n (%) | 8 (19) | 7 (20) | 5 (24) | 2 (14) | 1 (17) | |
| Otrose, n(%) | 6 (15) | 6 (17) | 2 (10) | 4 (29) | 0 | |
| Causa de insuficiencia respiratoria aguda, n(%) | ||||||
| Neumoníaf | 16 (39) | 15 (43) | 8 (38) | 7 (50) | 1 (17) | |
| Sepsisg | 16 (39) | 12 (33) | 7 (33) | 5 (35) | 4 (66) | |
| IRA origen pulmonarh | 6 (14) | 6 (17) | 5 (24) | 1 (7,5) | 0 | |
| Edema agudo de pulmón | 1 (2) | 1 (3,3) | 1 (5) | 0 | 0 | |
| IRA posoperatoria | 1 (2) | 1 (3,3) | 0 | 1 (7,5) | 0 | |
| TRALI | 1 (2) | 0 | 0 | 0 | 1 (17) | |
CPAP: presión positiva continua en la vía aérea; EPOC: enfermedad pulmonar obstructiva crónica; IRA: insuficiencia respiratoria aguda; SAPS 2: Simplified Acute Physiology Score (rango entre 0 a 56); SOFA: Sequential Organ Failure Assessment; TRALI: lesión pulmonar aguda relacionada con la transfusión sanguínea; UCI: unidad de cuidados intensivos; VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva.
Causas de intubación: intervención quirúrgica urgente (2 casos), intubación urgente en planta por fatiga respiratoria (2 casos), hipoxemia grave (un caso) y deterioro del nivel de conciencia (un caso).
Aplasia medular (un caso), enfermedad de Castleman tipo hialino-vascular (un caso), leucemia cronica (2 casos), enfermedad de Hodgkin (2 casos).
Causas de sepsis: bacteriemia (5 casos en VMNI y un caso en VMI), foco desconocido (4 casos en VMNI), urológico (un caso en VMNI), infecciones de hemoderivados (un caso en VMNI), partes blandas (2 casos en VMI), otorrinolaringológico (uno en VMI), abdominal (un caso en VMNI).
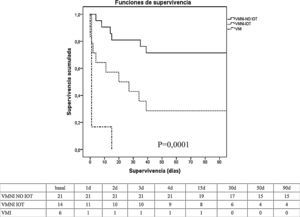
En cuanto a la evolución (tabla 2), no hubo diferencias significativas entre la VMI y la VMNI con respecto al porcentaje de infecciones, tasa de fracaso de órganos, duración de ventilación mecánica, y estancia en UCI y hospitalaria. La mortalidad en UCI y hospitalaria (tabla 2 y fig. 1) fue significativamente superior en el grupo de VMI (100 vs. 37% en VMNI, p=0,006) y (100 vs. 46% en VMNI, p=0,023), respectivamente.
Comparación de tasa de complicaciones, duración de la ventilación y estancia entre VMNI (tanto éxito como fracaso) y VMI
| VMNI (n=35) | p** | VMI (n=6) | p* | |||
| GlobalVMNI(n=35) | ÉxitoVMNI(n=21) | FracasoVMNI(n=14) | ||||
| NAV, n (%) | 2 (5) | 0 | 2 (14) | 0,153 | 0 | 1.000 |
| Infección urinaria, n (%) | 3 (8) | 1 (5) | 2 (14) | 0,551 | 1 (17) | 0,483 |
| Bacteriemia, n (%) | 13 (36) | 7 (33) | 6 (43) | 0,724 | 3 (50) | 0,662 |
| Bacteriemia primaria | 3 | 2 | 1 | 1 | ||
| Bacteriemia por catéter | 5 | 2 | 3 | 0 | ||
| Bacteriemia secundariaa | 5 | 3 | 2 | 2 | ||
| Fracaso orgánico, n(%) | ||||||
| Cardiovascular | 22 (63) | 8 (38) | 14 (100) | 0,0001 | 6 (100) | 0,152 |
| Hematológico | 21 (60) | 12 (57) | 9 (64) | 0,737 | 5 (83) | 0,388 |
| SDRA | 18 (51) | 8 (38) | 10 (71) | 0,086 | 4 (67) | 0,688 |
| Renal | 13 (37) | 5 (24) | 8 (57) | 0,075 | 5 (83) | 0,070 |
| Hepático | 8 (23) | 3 (14) | 5 (36) | 0,221 | 3 (50) | 0,316 |
| Neurológico | 4 (11) | 2 (9) | 2 (14) | 1.000 | 2 (33) | 0,169 |
| Parada cardíaca, n (%) | 3 (8) | 0 | 3 (21) | 0,056 | 2 (33) | 0,148 |
| Barotrauma, n (%) | 2 (6) | 0 | 2 (14) | 0,153 | 0 | 1.000 |
| Traqueostomía, n (%) | 2 (6) | 0 | 2 (14) | 0,153 | 0 | 1.000 |
| Duración ventilación mecánicab, días | 8±9 | 4±3 | 13±12 | 0,016 | 3±6 | 0,269 |
| Estancia UCIb, días | 11±11 | 7±4 | 18±15 | 0,025 | 5±10 | 0,190 |
| Estancia Hospitalariab, días | 34±19 | 33±19 | 32±21 | 0,800 | 26±26 | 0,554 |
| Mortalidad UCI, n (%) | 13 (37) | 3 (14) | 10 (71) | 0,001 | 6 (100) | 0,006 |
| Causas de muerte | ||||||
| Fracaso multiorgánico | 9 | 2 | 7 | 5 | ||
| Parada cardíaca | 2 | 0 | 2 | 0 | ||
| Hemorragía cerebral | 1 | 1 | 0 | 1 | ||
| Hypoxemia refractaria | 1 | 0 | 1 | 0 | ||
| Mortalidad Hospitalaria, n (%) | 16 (46) | 6 (28) | 10 (71) | 0,018 | 6 (100) | 0,023 |
SDRA: síndrome de distrés respiratorio del adulto; UCI: unidad de cuidados intensivos; VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva; NAV: neumonía asociada a la ventilación mecánica.
Análisis de mortalidad tipo Kaplan-Meier (test long rank) entre el grupo VMNI (éxito y fracaso) y el grupo VMI a los 90 días. Tabla, número de pacientes que están vivos durante este periodo de tiempo.
VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva; VMNI IOT: ventilación no invasiva intubados; VMNI-NO IOT: ventilación no invasiva no intubados.
Dentro del grupo de VMNI, la comparación de éxito frente al fracaso no mostró diferencias significativas en cuanto a las características demográficas, comorbilidades y causa de insuficiencia respiratoria (tabla 1). La comparación de las variables fisiológicas mostró diferencias entre el grupo de éxito frente al grupo fracaso de la VMNI en el nivel de paO2 (82 [59-126] vs. 58 [41-76], p<0,005), bicarbonato (24±6 vs. 19±5, p<0,005), déficit de exceso de bases (0±6 vs. −5±4, p<0,005), y hemoglobina en sangre (9±1 vs. 10±2, p<0,005). El porcentaje de intubación se situó en un 40% (tabla 2), lo que llevó aparejada una mayor tasa de disfunción orgánica en este grupo, destacando la cardiovascular con necesidad de soporte vasoactivo (100 vs. 38% en el grupo de éxito de VMNI, p=0,0001). No se observaron diferencias significativas en la tasa de infecciones, en cambio, se apreció una menor duración de la ventilación mecánica, estancia en UCI y mortalidad tanto en UCI como hospitalaria en el grupo de éxito de VMNI. La mortalidad a los 90 días fue significativamente inferior (p=0,001) en el grupo de éxito de VMNI frente al grupo de fracaso de VMNI y el grupo VMI (fig. 1).
El análisis multivariante de todas las variables relacionadas de manera significativa en la mortalidad del grupo VMNI (tabla 3), estableció que el fracaso de la VMNI (OR 13 [IC 95% 1,95-89,22], p=0,008) y el desarrollo de SDRA (OR 10 [IC 95% 1,33-77,9], p=0,03) estaban relacionados con la mortalidad en el grupo VMNI. El valor predictivo positivo del modelo fue del 100% y el valor predictivo negativo fue del 59%, con una exactitud diagnóstica del 74%. El área bajo la curva ROC fue del 0,88 (IC 95% 0,773-0,993). El test de Hosmer-Lemeshow con 4 grados de libertad no resultó significativo (p=0,525).
Análisis multivariante de factores relacionados con mortalidad en el grupo VMNI
| VMNI supervivientes (n=22) | VMNI no supervivientes (n=13) | p | Odds ratio | IC 95% | p | |
| Acidosis metabólica basal, n (%) | 8 (36) | 6 (46) | 0,236 | |||
| Fracaso VMNI, n (%) | 4 (18) | 10 (77) | 0,001 | 13,2 | 1,33 – 77,96 | 0,008 |
| Fallo hemodinámico, n (%) | 11 (50) | 11 (84) | 0,07 | |||
| Fallo hepático, n (%) | 2 (9) | 6 (46) | 0,032 | |||
| SDRA, n (%) | 7 (32) | 11 (85) | 0,005 | 10,2 | 1,95 – 89,22 | 0,025 |
| PCR, n (%) | 0 | 3 (23) | 0,04 |
IC 95%: intervalo de confianza al 95%; PCR: parada cardiorrespiratoria; SDRA: síndrome de distrés respiratorio del adulto; VMNI: ventilación mecánica no invasiva.
Este estudio retrospectivo puso de manifiesto que el paciente hematológico ingresado en UCI y sometido a ventilación mecánica por IRA presentó una menor mortalidad que en otras series3,5,7, y que el empleo de la VMNI ha sido una pieza clave en las medidas de soporte, puesto que influyó en la reducción de la mortalidad de dichos pacientes.
Es de destacar que en nuestra serie se empleó como medida de soporte ventilatorio la VMNI, ya que es práctica habitual en nuestra unidad realizar un intento antes de plantear la VMI. Este proceder se ha trasladado, también, a la planta de hospitalización, en la medida que un porcentaje de los pacientes ingresados recibieron soporte ventilatorio con CPAP, como paso previo a su ingreso en la unidad. Un estudio aleatorizado19 demostró que el empleo en sala de hematología de CPAP frente a oxigenoterapia en pacientes con IRA reducía la evolución a SDRA, la necesidad de ingreso en UCI y de soporte ventilatorio invasivo. Pese a dichos resultados19, la aplicación de CPAP en nuestra pequeña muestra fue mayor en el grupo en el que fracasó la VMNI, lo que no redundó en beneficio alguno. En nuestra serie solo fueron intubados desde el primer momento aquellos pacientes en situación de disfunción multiorgánica estimada por escala SOFA, la cual fue superior al grupo VMNI, aunque no todos los valores alcanzaron la significación estadística. Esta mayor gravedad podría justificar los malos resultados obtenidos en el grupo VMI, dado que fallecieron todos en UCI durante las primeras horas, y en su mayoría en situación de fracaso multiorgánico, porcentaje mayor del esperado por SAPS 2. Diversos autores5,7 inciden en el valor predictivo del fracaso multiorgánico en la mortalidad, pero no debemos olvidar que la mayoría de ellos a su ingreso, al menos en nuestra serie, ya mostraban disfunción de varios órganos. En este sentido, nuestros datos coinciden con un estudio multicéntrico español20, que analizó las medidas de soporte ventilatorio en pacientes hematológicos, donde el nivel de SOFA era superior en aquellos pacientes que fueron sometidos directamente a VMI frente al grupo de VMNI, y el SOFA respiratorio inicial era similar entre los grupos VMI y VMNI (éxito y fracaso), aunque en el grupo de fracaso de VMNI empeoró de manera significativa con respecto a los otros a lo largo de los días.
En nuestra opinión, la VMNI ha sido un factor determinante en la reducción de mortalidad, puesto que, como se pudo comprobar, el número de complicaciones e infecciones era no significativamente superior en el grupo VMI (principalmente por la breve estancia en UCI causada por una mortalidad precoz), pero todas ellas en conjunto, junto a una situación de disfunción orgánica ya al ingreso, probablemente, influyeron en el resultado final que se pudo apreciar. Es por ello que estos resultados nos reafirman en una actitud en la que primaría la utilización, siempre que sea posible, de la VMNI como terapia inicial de soporte ventilatorio, de acuerdo con la mayoría de los trabajos publicados2,20–22, otorgándole un nivel alto de evidencia23. A pesar de ello, estudios recientes5,20,22 siguen registrando una mayor utilización de la VMI frente a la VMNI, aunque estos mismos estudios20,22 han demostrado que la VMNI redujo de manera sustancial la mortalidad frente a la VMI. Otra razón que pudo motivar que nuestros resultados sean comparables a los publicados en diversos trabajos6,11–13,22,24 es la estrecha colaboración entre el servicio de hematología y nuestro servicio, lo que ha permitido una actuación más precoz sobre las numerosas complicaciones que estos pacientes suelen presentar, y que son difícilmente asumibles en una planta de hospitalización. El principal argumento que motivó este marco de colaboración entre nuestros servicios fue la aparición en nuestro arsenal terapéutico de la VMNI. La elevada mortalidad relacionada con la necesidad de VMI1,2,6 generaba reticencias para el ingreso de dichos pacientes en nuestra unidad, dada la importante carga asistencial que generaban (soporte respiratorio, vasoactivo y renal en muchos casos, junto con medidas aislamiento) con un resultado ominoso. Pero la introducción de la VMNI y la publicación de trabajos6,11–13 que refrendaban el uso de la misma en pacientes inmunodeprimidos produjo un cambio sustancial en la política de ingreso. El segundo argumento se fundamentó en la rapidez y gravedad de la disfunción orgánica de estos pacientes, lo cual haría fútil su ingreso en la UCI ya en situación de fracaso multiorgánico, siendo por ello prioritaria una actuación precoz con un ingreso en UCI precoz. En esta misma línea, algunos trabajos25 plantean el beneficio que supone, en términos de mortalidad, el ingreso del paciente oncohematológico en UCI con una política de ingresos menos restrictiva, junto al hecho de que el retraso de ingreso en UCI se relaciona de manera directa con la mortalidad, abogando por un ingreso precoz4.
Dentro de este escenario favorable para la VMNI, se sigue suscitando la duda de por qué su infrautilización. La razón que lo podría justificar sería la alta incidencia de SDRA al ingreso o durante su estancia en la UCI, y la controvertida indicación de la VMNI en el SDRA10,26,27. Diversos estudios28,29 han demostrado que la VMNI en pacientes hipoxémicos era más eficaz que la oxigenoterapia, con especial interés en la LPA o el SDRA30–32 registrando un porcentaje de fracaso de la VMNI en paciente con LPA entre un 4.832 y un 70%31, y en pacientes con SDRA entre un 4629 y un 51%32. En el análisis multivariante28,33 se identificó que el desarrollo de SDRA se comportaba como factor predictor del fracaso de la VMNI, pudiendo ser la razón por la que no exista una clara recomendación para el empleo de la VMNI en el contexto del SDRA9,10,25 y lo que llevase probablemente a una utilización escasa de la VMNI en pacientes hematológicos con hipoxemia grave, aunque, por contra, está ampliamente demostrada la relación entre VMI y mortalidad en este grupo de pacientes3,5,20–22. En este sentido, en un estudio observacional multicéntrico22 de una serie de 1.302 pacientes hematológicos con IRA, se pudo comprobar que el empleo de la VMNI era inferior frente a VMI (21 vs. 79%). El grupo no invasivo presentaba más neutropenia (16,8 vs. 10%, p<0,002) y más hipoxemia que el grupo invasivo. Por el contrario, el grupo VMI estaba más grave por la escala APACHE y con un peor nivel de conciencia, lo que pudo justificar un empleo inicial de la VMI. También se objetivó una diferencia significativa en la utilización de la VMNI frente a VMI en pacientes con LPA (21 vs. 11%, p=0,0001), valor que no alcanzó significación estadística en pacientes con SDRA. Los resultados mostraron que el grupo de VMNI presentó menor duración de ventilación mecánica y estancia en UCI, así como menor mortalidad tanto en UCI como en el hospital, pero estos resultados no se vieron reproducidos en el subgrupo de pacientes con LPA o SDRA. Otro estudio observacional6 mostró que la mortalidad a los 30 días del grupo VMNI era significactivamente inferior a la VMI (43,7 vs. 70,8%, p=0,008).
Analizando el grupo de VMNI se pudo demostrar que el fracaso de la VMNI se asoció a una mayor tasa de complicaciones. Estos resultados coinciden con los obtenidos por otros autores20,22,24,30, donde el fracaso de la VMNI aumentó ostensiblemente el porcentaje de complicaciones, de estancias, y por añadidura, de mortalidad. En semejanza con otros estudios20,22,27,28 pudimos constatar que la mortalidad se asociaba al fracaso de la VMNI y el desarrollo de SDRA, junto a otras variables20,22 como la edad, el shock séptico, el coma, la coagulopatía o una puntuación SAPS 2 elevada, que no fueron analizados en nuestra serie. Dada la extraordinaria influencia negativa del fracaso de la VMNI en el resultado de mortalidad, parece lógico determinar qué factores influyen en el fracaso. En este sentido, diversos estudios24,28 encontraron como predictores de fracaso de la VMNI el retraso en la instauración del soporte ventilatorio, el desarrollo de SDRA y la necesidad de soporte vasoactivo y renal. En otro estudio en una cohorte de pacientes con SDRA30 se vio que la gravedad medida por SAPS 2>34 y ausencia de mejoría de oxigenación (paO2/FiO2<175) a los 60 min de iniciar la VMNI eran predictores de fracaso. De todos ellos se podría resumir que ante el retraso de inicio de la VMNI en un paciente hipoxémico y con escasa respuesta clínica y gasométrica tras una hora, probablemente la VMNI fracasaría, siendo precisa la intubación.
Las limitaciones de nuestro estudio se centran en las características retrospectivas del mismo, el realizarse en un solo centro, donde, además, la VMNI es una práctica rutinaria en el paciente con IRA hipoxémica.
Con los malos resultados que se obtuvieron en el grupo de VMI no se quiere descartar el empleo de la misma, sino que se quieren mostrar los beneficios de la VMNI en pacientes de extrema gravedad, con un mal pronóstico y con disfunción multiorgánica. La práctica habitual de empleo de la VMNI, y el riesgo asociado a la intubación en especial en estos pacientes, hizo que los pocos pacientes que fueron incluidos en el grupo de VMI directa estuvieran en una situación en la que la VMNI estaba literalmente contraindicada. Por ello, proponer un estudio prospectivo en el cual se plantease comparar la VMNI frente a la VMI con una base3,5,7 que demuestra la mortalidad asociada a la VMI, sumado a trabajos6,22 que muestran los buenos resultados cosechados con la VMNI, resultaría muy cuestionable. Por tanto, en función de nuestros resultados, podríamos recomendar el uso de la VMNI como primera medida de soporte ventilatorio en el paciente hematológico con IRA, no debiendo considerar los criterios clásicos de indicación de VMNI10,26,27, ni tampoco considerar el SDRA o la disfunción multiorgánica como criterios de exclusión, puesto que la mayoría de estos pacientes ya presentan a su ingreso en la unidad disfunción de uno o más órganos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.