Analizar los resultados de la implantación de un programa de donación Maastricht II en una ciudad de 200.000 habitantes. Inicialmente solo donación pulmonar y tras 9 meses se amplió a donación renal.
DiseñoEstudio observacional prospectivo de octubre de 2012 a diciembre de 2013.
ÁmbitoUCI del Hospital Universitario Marqués de Valdecilla y área metropolitana de Santander.
PoblaciónPacientes<55 años fallecidos por parada cardiaca extrahospitalaria.
IntervenciónLa asistencia extrahospitalaria fue con cardiocompresor mecánico (LUCAS II). El diagnóstico de muerte, la asistencia y preservación de los injertos a donar se realizó íntegramente en la UCI.
ResultadosSe recibieron un total de 14 llamadas, descartándose 3. De los 11 potenciales donantes, 7 fueron donantes utilizados con edad mediana de 39,5 años (rango: 32-48). Se realizaron 5 trasplantes unipulmonares, 4 trasplantes renales, además de córneas y tejidos. Los donantes no válidos se debieron a problemas técnicos. No hubo negativas. La supervivencia de los trasplantados pulmonares fue 100% al mes y 80% al año. Todos los trasplantados renales presentaban creatinina al mes<2mg/dl. El tiempo parada-preservación renal fue 80 minutos (rango intercuartílico: 71-89) y el tiempo parada-preservación pulmonar fue 84 minutos (rango intercuartílico: 77-94).
ConclusionesUn programa Maastricht II en una ciudad pequeña es viable tanto para órganos abdominales como torácicos. La potencialidad es mejorable al incrementar la edad de valoración y disponer de cardiocompresores mecánicos en todas las ambulancias. El tratamiento íntegro del donante en la UCI reduce los tiempos de isquemia caliente mejorando los resultados postrasplante.
To study the results of a non-controlled cardiac death (Maastricht type II) donor program in a city of 200,000 inhabitants. The study was initially focused on lung donation and was extended to kidney donation after 9 months.
DesignA prospective observational study was conducted between October 2012 and December 2013.
SettingThe Intensive Care Unit of Marqués de Valdecilla University Hospital in Santander (Spain), and surrounding areas.
PopulationsPatients (< 55 years) who died of out-of-hospital cardiac arrest.
InterventionsAll out-of-hospital cardiac arrests were treated with mechanical cardiac compression (LUCAS II). The diagnosis of death and organ preservation were performed in the ICU.
ResultsA total of 14 calls were received, of which three were discarded. Of the 11 potential donors, 7 were effective donors with a median age of 39.5 years (range: 32-48). A total of 5 single lung transplants and four kidney transplants were performed. In addition, corneas and tissues were harvested. The non-valid donors were rejected mainly due to technical problems. There were no donation refusals on the part of the patient relatives. The lung transplant patient survival rate was 100% after one month and 80% after one year. One month after transplantation, the kidney recipients had a serum creatinine concentration of<2mg/dl. The interval from cardiac arrest to renal preservation was 80minutes (range: 71-89), and the interval from cardiac arrest to lung preservation was 84minutes (range: 77-94).
ConclusionsA Maastricht type II donation program in a small city is viable for both abdominal and thoracic organs. The program was initially very cautious, but its potential is easily improvable by increasing donor and by equipping mobile ICU ambulances with mechanical cardiac compression systems. Full management of the donor in the ICU, avoiding the emergency department or operating rooms, reduces the warm ischemia time, thereby improving transplant outcomes.
La donación en muerte encefálica ha sido la vía más extendida para la obtención de órganos. En España, el 90% de los donantes son personas cuyo fallecimiento se ha diagnosticado por criterios neurológicos1. Sin embargo, ese tipo de donación se ha visto reducida por factores epidemiológicos, como el descenso en la siniestralidad vial, el descenso de accidentes laborales, la mejora en el tratamiento de los factores de riesgo cerebrovascular y el incremento de la actividad de nuevas estrategias de tratamiento neuroquirúrgico como la craniectomía descomprensiva.
Por este motivo, es preciso el uso de nuevas estrategias que permitan ampliar el pool de donantes de órganos, como la donación en asistolia.
La donación en asistolia, tipo II de Maastricht (tabla 1), presenta una elevada complejidad logística con la participación simultánea de muchos profesionales, así como una gran cualificación de los profesionales que intervienen debido a la premura de tiempo en la toma de decisiones2. Tradicionalmente, este tipo de donación ha estado circunscrita a ciudades de gran tamaño poblacional (superiores a los 500.000 habitantes), y muy recientemente programas como Granada y Alicante han demostrado que es viable en ciudades de pequeño o mediano tamaño3.
Tipos de donación en asistolia según los criterios establecidos en Maastricht (modificación de Madrid 2011)
| No controlada | Tipo I | Fallecido fuera del hospital. Incluye víctimas de una muerte súbita, traumática o no, acontecida fuera del hospital que, por razones obvias, no son resucitadas |
| Tipo II | Resucitación infructuosa. Incluye pacientes que sufren una parada cardiaca y son sometidos a maniobras de reanimación que resultan no exitosas.En esta categoría se diferencian dos subcategorías:II. a. ExtrahospitalariaLa parada cardiaca ocurre en el ámbito extrahospitalario y es atendida por el servicio de emergencias extrahospitalario, quien traslada al paciente al hospital con maniobras de cardiocompresión y soporte ventilatorio.II. b. IntrahospitalariaLa parada cardiaca ocurre en el ámbito intrahospitalario, siendo presenciada por el personal sanitario, con inicio inmediato de maniobras de reanimación | |
| Controlada | Tipo III | A la espera de paro cardiaco. Incluye pacientes a los que se aplica limitación del tratamiento de soporte vital* tras el acuerdo entre el equipo sanitario y este con los familiares o representantes del enfermo |
| Tipo IV | Paro cardiaco en muerte encefálica. Incluye pacientes que sufren una parada cardiaca mientras se establece el diagnóstico de muerte encefálica o después de haber establecido dicho diagnóstico, pero antes de que sean llevados a quirófano. Es probable que primero se trate de restablecer la actividad cardiaca pero, cuando no se consigue, puede modificarse el proceso al de donación en asistolia |
Los injertos obtenidos por los programas Maastricht II, son fundamentalmente riñones y en menor medida injertos hepáticos; hasta la fecha solo los programas del Hospital San Carlos y Doce de Octubre habían conseguido extraer y que se trasplanten los injertos pulmonares4.
Recientemente, nuestro grupo ha diseñado e implementado un programa de asistolia tipo II de Maastricht realizado en Santander y alrededores (225.000 habitantes). Este programa presenta como característica diferencial que todo el procedimiento diagnóstico y de preservación de los injertos se realiza en la Unidad de Cuidados Intensivos (UCI), lo que permite acortar los tiempos de isquemia caliente de los injertos, facilita y simplifica la toma de decisiones y permite un ahorro de costes dado que el programa se fundamenta en el uso de recursos humanos de personal que está de guardia física en el propio hospital, realizando labores asistenciales diferentes de la Coordinación de Trasplantes. Este programa, único en España, al desarrollarse íntegramente en la UCI se ha desarrollado con éxito en la obtención de injertos pulmonares y renales. Se presentan los resultados preliminares del primer año.
Pacientes y métodosEstudio prospectivo de la actividad del programa de donación en asistolia no controlada (Maastricht II) asistido en el Servicio de Medicina Intensiva del Hospital Universitario Marqués de Valdecilla de Santander, durante el periodo de octubre de 2012 a diciembre de 2013.
Se registró la actividad del programa incluyendo número de activaciones (donantes potenciales), número de donantes eficaces y utilizados, datos demográficos de los donantes, tiempos extrahospitalarios e intrahospitalarios, causas de pérdidas de injerto y evolución posterior de los pacientes trasplantados. Las variables se describen como valor absoluto o porcentaje o como media o mediana y rango intercuartil (IQR P25-P75). Los datos referidos a las series nacionales se describen como media y desviación estándar.
Características del programaEn octubre de 2012 se inició un programa de donación en asistolia exclusivamente pulmonar Maastricht II en la ciudad de Santander y después de los 9 meses iniciales, se amplió a donación abdominal renal.
El programa solo se planteó para paradas cardiacas extrahospitalarias. El área de influencia es la ciudad de Santander (177.123 habitantes en enero de 2013) y un área metropolitana de 50.000 habitantes5.
El programa solo aceptaba donantes a los que se mantuviera con un cardiocompresor mecánico (modelo LUCAS II®); solamente 2 de las 4 UVI móviles de nuestra comunidad autónoma disponen de este material.
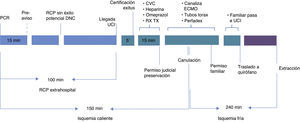
La cadena asistencial de este tipo de pacientes presenta dos fases claramente separadas: la fase extrahospitalaria y la fase hospitalaria (fig. 1).
En la fase extrahospitalaria tienen lugar las siguientes actuaciones:
- 1.
Determinación de la hora de la parada cardiorrespiratoria a partir del testimonio de los testigos.
- 2.
Transcurridos un mínimo de 30 minutos desde el inicio de las maniobras de SVA sin conseguir recuperación de latido eficaz, el equipo del 061 se pone en contacto con el Coordinador de trasplantes y realizan una evaluación conjunta, de acuerdo con los criterios iniciales de inclusión in situ (tabla 2). Tras decidir su viabilidad, se procede a la activación del protocolo de donación en asistolia («código 9»), que solo puede ser activado por el Coordinador de Trasplantes. En este punto se decide si inicialmente se plantea la donación renal, pulmonar o ambas.
Tabla 2.Los criterios de activación tras evaluación in situ del potencial donante en asistolia no controlada
Criterios de activación de potencial donante después de maniobras de RCPA infructuosas Edad entre 9 y 55 años Ausencia de lesiones torácicas que comporten sangrado masivo, total exanguinación Aspecto externo normal (excluir indigentes, sospecha de prácticas de riesgo, venopunciones, muerte en prostíbulos, etc…) Tiempo desde la parada cardiaca hasta el inicio se soporte vital avanzado inferior a 15 minutos Tiempo desde el inicio de la parada cardiaca hasta la llegada a la UCI del Hospital Marqués de Valdecilla inferior a 100 minutos RCPA: reanimación cardiopulmonar avanzada.
- 3.
Traslado al hospital del potencial donante con ventilación mecánica y masaje cardiaco con cardiocompresor externo LUCAS II®.
- 4.
En el traslado se realiza hemostasia de las lesiones sangrantes. Desde este momento no se administran drogas ni fluidos, aunque se conservan las vías canalizadas.
- 5.
Por parte del Coordinador de trasplantes, la activación del programa implica su traslado inmediato a la UCI del Hospital Marqués de Valdecilla y la activación del equipo de respuesta rápida (Coordinadora de enfermería de trasplantes, el médico intensivista de guardia de la UCI y 2 enfermeras del equipo de trasplantes).
En caso de valorarse la donación renal se avisa al cirujano cardiovascular de guardia y a la enfermera perfusionista.
La fase hospitalaria tiene lugar íntegramente en la Unidad de Cuidados Intensivos y se caracteriza por los siguientes pasos:
- 1.
A la llegada a UCI sin parar en Urgencias, el médico intensivista y su equipo se responsabilizan del paciente, asumen el traslado y posteriormente desconectan el respirador y el cardiocompresor.
- 2.
Tras 5 minutos sin pulso y/o ausencia de trazado de electrocardiograma se acredita la muerte por asistolia por parte del intensivista de guardia. Durante esos 5 minutos se hace la radiografía de tórax. A partir de este momento, el Coordinador de Trasplantes lidera el proceso y se responsabiliza de todas las decisiones, pruebas y tratamiento que afecten al cadáver.
- 3.
Se reinicia masaje cardiaco y ventilación hasta la obtención del permiso judicial para la preservación.
- 4.
En este periodo se canaliza acceso vascular central (vena yugular si se plantea donación renal; vena femoral si solo se plantea donación pulmonar), se extraen muestras sanguíneas y se administra la siguiente medicación intravenosa: heparina sódica (a dosis 1.000 unidades/kg si hay donación renal, u 800 unidades/kg si es solo donación pulmonar), 250ml de bicarbonato un molar y 80mg de omeprazol. En las muestras sanguíneas se solicita hemograma, bioquímica, coagulación, gasometría venosa, grupo sanguíneo y serologías.
- 5.
Tras 15 minutos en espera del permiso judicial o menos si este llega antes, se actúa según los objetivos de la posible donación. Es el propio Coordinador Médico de Trasplantes quien en base a los criterios de idoneidad del donante, decide la estrategia a seguir lo que condiciona las actuaciones siguientes (tabla 3):
- a.
Donación solo pulmonar (hasta julio de 2013): tras el diagnóstico de muerte se coloca de forma rápida un drenaje torácico en cada tórax (2.° espacio intercostal anterior), se para la ventilación mecánica y se rellenan los drenajes con Perfadex® a 4°C; el tubo orotraqueal queda al aire.
- b.
Donación solo renal (desde julio de 2013): el equipo de cirugía cardiovascular efectúa la canulación de arteria y vena femoral y conexión a sistema de circulación extracorpórea (ECMO). En el momento de conexión al sistema de oxigenación, se parará el cardiocompresor y el respirador. En la femoral contralateral se canula un catéter fogarty que aísle la aorta torácica de la abdominal.
- c.
Donación renal y pulmonar (desde julio de 2013): entrada en ECMO igual, y posteriormente se para la ventilación y se colocan de forma rápida un drenaje torácico en cada tórax (2.° espacio intercostal anterior). Se rellenan los drenajes con Perfadex® a 4°C; el tubo orotraqueal queda al aire.
Tabla 3.Valoración de posible donación renal o pulmonar
Donación riñón Donación pulmón Edad 9 y 55 años. < 50 años Características deintubación orotraqueal No limita Debe haber sido «limpia»’ Antecedente detraumatismo torácico No contraindica Contraindica Anomalías RX TX No contraindica Contraindica Presencia desecreciones respiratorias No contraindica Su presencia contraindica RX TX: radiografía de tórax.
- a.
- 6.
Sondaje vesical y nasogástrico. Se recogen muestras biológicas (orina, jugo gástrico, y sangre para enviar al Juzgado).
- 7.
Fin del proceso de UCI. Se deja al paciente sin cardiocompresor y con el tubo traqueal al aire.
En nuestro programa se efectúa preservación abdominal en normotermia (36°C) en caso de donación solo renal (nECMO), pero si la donación prevista es torácica y abdominal la preservación abdominal será en hipotermia (4°C).
De manera paralela se inician las gestiones para localizar a la familia, y alcanzado este punto se les informa del desenlace fatal así como de la posibilidad de donación. Los familiares ven a su ser querido en la UCI y pueden despedirse de él si así lo desean. Posteriormente, el paciente es trasladado a quirófano para la extracción.
El programa lleva implícito una evaluación continua del proceso, de tal manera que la aparición de incidencias o el rebasamiento de los límites de tiempo establecidos (fig. 1), conlleva suspender el proceso y descartar al paciente como donante.
La puesta en marcha de este programa de asistolia se ha realizado de acuerdo a los principios del Documento de Consenso de donación en asistolia6. La legislación española protege, ampara y da absoluta cobertura al desarrollo de estos programas de asistolia7.
ResultadosDurante estos 14 meses iniciales de desarrollo del programa de donación en asistolia Maastricht II, se recibieron 14 activaciones del código asistolia (es decir 14 donantes potenciales), efectuándose traslado al hospital de 11 donantes potenciales. Inicialmente se descartaron telefónicamente a 3 potenciales donantes al no cumplir los criterios de activación: edades por encima del umbral (dos casos) y un caso judicial complejo. La tabla 4 recoge las características de los potenciales donantes incluidos en la serie.
Características de los pacientes incluidos en la serie
| Caso | Edad | Género | Hora | Cancelación | Enfoque | Descarte | Resultado |
|---|---|---|---|---|---|---|---|
| 1 | 30 | Varón | 10:09 | No | Pulmonar | Un trasp. unipulmonar | |
| 2 | 48 | Varón | 13:03 | No | Pulmonar | Un trasp. unipulmonar | |
| 3 | 37 | Varón | 20:52 | No | Pulmonar | Perforación pulmonar iatrogénica al preservar | |
| 4 | 48 | Varón | 13:18 | No | pulmonar | Dos trasp. unipulmonares | |
| 5 | 19 | Mujer | 18:25 | Sí: pulso traslado | Pulmonar | ||
| 6 | 45 | Mujer | 19:30 | Sí: pulso agónico UCI | Pulmonar | ||
| 7 | 61 | Varón | 14:17 | Sí: descarte telef (edad) | |||
| 8 | 59 | Mujer | 11:25 | Sí: Descarte telef (edad) | |||
| 9 | 54 | Varón | 12:48 | No | Renal | Problemas en canulación (ECMO) | |
| 10 | 35 | Varón | 17:41 | No | Pulmonar | Un trasp. unipulmonar | |
| 11 | 45 | Varón | 12:12 | No | Pulmonar y renal | Problemas al canular (ECMO) Perforación pulmonar iatrogénica al preservar. | |
| 12 | 36 | Varón | 20:53 | No | Pulmonar y renal | Dos trasplantes renales.Se descarta pulmón por aspiración | |
| 13 | 35 | Varón | 17:52 | Sí: descarte telef (caso complejo judicial) | |||
| 14 | 23 | Varón | 13:57 | No | Pulmonar y renal | Dos trasplantes renales.Pulmones válidos, no se trasplantan por problemas receptor |
Todas las activaciones del código de asistolia se produjeron entre las 08.00 horas y las 22.00 horas.
Del conjunto de los 14 potenciales donantes, hubo un predominio de varones (78%), la mediana de edad fue de 41 años (IQR 33,7 - 48) y en el 67,7% de los casos, la parada cardiorrespiratoria ocurrió en la vía pública.
Los 11 donantes elegibles presentaron una mediana de edad de 39,5 años (IQR 32 - 48) y todos ellos eran varones. Se planteó (decisión tomada a nivel extrahospitalario) solo donación pulmonar en 7 casos, solo donación renal en un caso y donación simultánea pulmonar-renal en 3 casos. Finalmente de esos 11 donantes elegibles, 2 se descartaron a la llegada a la UCI pues presentaron pulso agónico y se continuaron los protocolos de reanimación cardiopulmonar.
Entre los 9 donantes restantes, en 2 no se llegó a trasplantar ningún órgano porque hubo lesión de órganos por iatrogenia en la preservación (perforación pulmonar o problemas en la canulación de la ECMO).
Finalmente de los 7 donantes eficaces, 5 fueron donantes pulmonares, efectuándose 5 trasplantes unipulmonares (2 en nuestro centro y 3 en el Complejo hospitalario de A Coruña) y dos fueron donantes renales, realizándose 4 trasplantes renales (todos en nuestro centro).
Entre los 7 donantes eficaces, se desestimaron algunos injertos para trasplante, aunque inicialmente se considerara la donación pulmonar y renal. A nivel de injertos pulmonares se descartaron por problemas técnicos durante la colocación de tubos torácicos al producirse perforaciones iatrogénicas de pulmón (dos casos), otro caso fue descartado por aspiración broncopulmonar objetivada en la UCI, y en un donante se extrajeron los pulmones, pero finalmente no fueron implantados por problemas con el receptor.
Las causas de desestimar la donación renal cuando inicialmente se había planteado fueron los problemas técnicos relacionados con la canulación vascular para la preservación con sistemas ECMO (2 casos). Además de la obtención de órganos sólidos, fue factible la obtención de tejidos y córneas (un total de 18 injertos corneales).
Se efectuaron 11 entrevistas, y no hubo ninguna negativa familiar. Igualmente la comunicación con el binomio jueces-médicos forenses no presentó incidencias.
El tiempo (mediana) parada cardiaca-preservación renal (con ECMO o nECMO) fue 80 minutos (IQR:71-89) y el tiempo (mediana) parada-preservación pulmonar fue de 84 minutos (IQR: 77-94), claramente inferior a los referidos por otros grupos.
El tiempo intrahospitalario (mediana) desde llegada a la UCI hasta preservación exclusivamente pulmonar fue de 27 minutos (rango:17-35), y el tiempo intrahospitalario desde llegada a UCI hasta colocación de ECMO fue de 37 minutos (rango:29-45)
En las tablas 5 y 6 se presentan las características de los receptores pulmones y renales.
Características de los pacientes trasplantados pulmonares
| Sexo | Edad (años) | Indicación | Tipo | Situación al mes | Situación al año | |
|---|---|---|---|---|---|---|
| Caso 1 | Varón | 57 | Fibrosis 2.a RT por linfoma Hodgkin | Unipulmonar | Vivo | Fallecido |
| Caso 2 | Varón | 64 | EPOC | Unipulmonar | Vivo | Vivo |
| Caso 3 | Varón | 63 | EPOC | Unipulmonar | Vivo | Vivo |
| Caso 4 | Varón | 66 | EPOC | Unipulmonar | Vivo | Vivo |
| Caso 5 | Varón | 62 | Deficit α1 antitripsina | Unipulmonar | Vivo | Vivo |
EPOC: enfermedad pulmonar obstructiva crónica.
Características de los pacientes trasplantados renales
| Sexo | Edad (años) | T. isq. caliente (min) | DRI | N.° sesiones diálisis | Creatinina sérica (mg/dl) | ||||
|---|---|---|---|---|---|---|---|---|---|
| 7.° día | 1.° m. | 3.° m. | 6.° m. | ||||||
| Caso 1 | Varón | 34 | 380 | Sí | 5 | 2,4 | 1,8 | 1,7 | 1,4 |
| Caso 2 | Varón | 38 | 1030 | Sí | 1 | 11,4 | 1,5 | 1,4 | 1,4 |
| Caso 3 | Varón | 45 | 265 | No | 0 | 5,1 | 1,5 | 1,5 | 1,5 |
| Caso 4 | Varón | 59 | 1430 | Sí | 5 | 5,9 | 0,9 | 2,1 | 2,1 |
DRI: disfunción retrasada del injerto; m: meses; min.: minutos; RT: radioterapia; T.isq. caliente: tiempo de isquemia caliente.
Los resultados presentados en este trabajo confirman que un programa de donación en asistolia no controlada (Maastricht tipo II) es factible en una ciudad de tamaño mediano, tanto para órganos abdominales como para injertos pulmonares. En nuestro país, se han desarrollado iniciativas similares; así el Hospital Virgen de la Nieves, comenzó un programa de donación Maastricht II, pero con un área poblacional mayor y enfocado en la donación abdominal8. La característica más peculiar, y que nos diferencia del resto de programas nacionales o internacionales es que tanto el diagnóstico de muerte, como la preservación abdominal y torácica se realiza íntegramente en la propia UCI.
En nuestra experiencia esta diferencia aporta grandes ventajas. Así, la centralización de todos los procesos evita los traslados intrahospitalarios, muy dificultosos en un paciente/cadáver multimonitorizado y con un cardiocompresor mecánico, reduciendo la isquemia caliente de los injertos, y con ello mejorando el pronóstico de los receptores. Los tiempos de isquemia caliente de nuestro programa son notablemente inferiores a los publicados en otras series9 siendo esta reducción debida fundamentalmente a una disminución muy importante de la fase intrahospitalaria, que es la que se puede acortar con una buena gestión de los recursos humanos y materiales.
Otra de las ventajas de nuestro programa es que la atención a las familias de un fallecido de estas características es más natural en la UCI que en un quirófano. La atención en la UCI, lugar donde las familias comprenden la extrema gravedad, facilita la asimilación por parte de las mismas de todo lo acontecido y predispone a la aceptación de la donación una vez han asumido el desenlace fatal. De esta forma se evitan traslados engorrosos y cambios de vestimenta de familiares en el acceso a un quirófano. En nuestra experiencia no hubo ninguna negativa familiar.
Otro de los aspectos positivos de centralizar todo el proceso en la UCI es que ante un contratiempo del Coordinador de Trasplantes al acudir ante una llamada, el médico intensivista puede ejercer de Coordinador inicialmente, dado que está siempre de presencia física y conoce el proceso. Este aspecto es muy importante en ciudades pequeñas donde es muy difícil adquirir experiencia en estos procedimientos, pues solo se producen ocasionalmente.
El apoyo del intensivista a todo el proceso se ve reflejado en la preservación pulmonar. El equipo de trasplante pulmonar de nuestro centro está localizado y se decidió que la preservación pulmonar fuera realizada por quien estuviera presente; es decir si el cirujano torácico está presente la preservación la realizan ambos (cirujano torácico e intensivista); si no llega a tiempo este proceso es realizado por el intensivista de guardia (adjunto y residente o con el propio coordinador de trasplantes), no habiendo en este procedimiento egocentrismos que ralenticen el proceso. Asimismo, que el Coordinador de Trasplantes sea un intensivista del centro hospitalario facilita la integración de todo el proceso.
La ampliación del programa a la extracción renal no supuso ningún inconveniente, dado que el programa de ECMO, tanto venovenosa como arteriovenosa, estaba plenamente instaurado, y es frecuente su colocación en la UCI a pacientes respiratorios, como puente al trasplante cardiaco o pulmonar o en el postoperatorio de estos tipos de trasplante10,11.
Uno de los aspectos más controvertidos para instaurar un programa de donación en asistolia Maastricht II ha sido el tamaño poblacional mínimo para garantizar la viabilidad del programa. Se estableció el umbral de una población de 500.000 habitantes, pero se han llevado a cabo experiencias con poblaciones ligeramente inferiores presentando resultados prometedores, como la desarrollada en Granada8. Es evidente, que a mayor tamaño poblacional, mayor número de potenciales donantes. Sin embargo, nuestra actividad inicial demuestra que es factible obtener 8-10 donantes por año, que en nuestra CC. AA. supondrían entre 13 y 16 donantes por millón de población. Otro de los aspectos que permitirán aumentar la potencialidad del programa es incrementar la edad de valoración hasta los 60 años, y tal y como hacen otros programas del país9, y disponer de cardiocompresores mecánicos en todas las UCI móviles que atienden a la población alejada de Santander, lo que implicará un incremento del área poblacional.
Una peculiaridad de este tipo de donación en una ciudad pequeña es el menor número de profesionales no sanitarios, que forman parte del programa. Así, en Santander solo hay 6 juzgados de instrucción, y por tanto la autorización judicial para la preservación y posteriormente la extracción recae en uno de estos 6 jueces. Antes de iniciar nuestro programa, todos y cada uno de los jueces de instrucción, así como el Juez Decano de Santander fueron informados personalmente de las características de este programa, realizándose una sesión informativa. Esta misma situación se dio con los médicos forenses de nuestra comunidad autónoma. El médico forense y el Juez de Guardia son advertidos por el Coordinador de Trasplantes de la existencia de un potencial donante en asistolia, mientras este se desplaza al hospital. Esta cercanía en el trato a los profesionales del mundo judicial facilita la colaboración y permite reducir las negativas judiciales. En nuestro programa no hemos tenido ninguna negativa judicial para la preservación y/o extracción. Asimismo, todos los permisos para la extracción se han concedido de forma afirmativa (en menos de 5 minutos), sin precisar los 15 minutos de silencio administrativo que permite la legislación; de esta forma se reducen aún más los tiempos de isquemia caliente.
La escasez de órganos es un problema general para todos los programas de trasplante, pero especialmente para el trasplante pulmonar donde solamente se obtienen los pulmones en el 15% de los donantes de órganos12,13. Por este motivo las estrategias de tratamiento específico del donante multiorgánico14,15, el uso de donantes añosos16,17 o la donación en asistolia18,19 son estrategias fundamentales para incrementar el pool de injertos disponibles20.
Los resultados funcionales de los pacientes trasplantados son muy buenos, a pesar de la curva de aprendizaje que todo nuestro equipo ha tenido en la preservación de injertos en asistolia. Todos los trasplantados de pulmón están vivos, salvo el primer paciente, presentando una supervivencia comparable a las series nacionales4,21. Asimismo, se debe reseñar que los 5 receptores eran pacientes muy mayores (tabla 5) y con mayor morbilidad de lo habitual, hecho que contrasta con la edad media del receptor pulmonar en España es 48,2 (desviación estándar 14,7) años21 y con nuestra propia serie local de trasplantados pulmonares22.
En el caso de los trasplantados renales el pronóstico también fue excelente (tabla 6), todos los injertos están normofuncionantes y con buenas cifras de creatinina.
Creemos que nuestro programa tiene un importante área de mejora, dado que hemos tenido diversos problemas de iatrogenia pulmonar, en forma de perforación pulmonar, y de problemas de canulación de ECMO, producto de la urgencia por reducir los tiempos de isquemia. Estos errores técnicos, producto de la curva de aprendizaje, han mermado el número de injertos disponibles (tabla 4).
Las potencialidades del programa de donación en asistolia es nuestro país no están establecidas y experiencias como la de Granada, Alicante y la nuestra avalan las posibilidades de centros ubicados en áreas con población menor. Cada programa debe adaptarse a las posibilidades con las que cuenta, pero en todos los casos, es imprescindible la correcta coordinación de todos los equipos implicados, para afrontar las dificultades técnicas y organizativas que entraña la puesta en marcha de iniciativas como estas. Esa complejidad logística de los programa de donación Maastricht tipo II, implican el desarrollo de nuevas estrategias que intenten reducirla; iniciativas como la efectuada en nuestro hospital sacan a la luz el papel de las Unidades de Medicina Intensiva en este tipo de actividades y las posibilidades de ciudades medianas, pues se logran reducir los tiempos de isquemia caliente al evitar traslados entre servicios dentro del hospital y al ser las distancias menores, se reducen los tiempos extrahospitalarios.
Este trabajo, y nuestro programa de asistolia presenta diversas limitaciones, como la casuística que es muy reducida y dificulta adquirir la experiencia precisa a todos los intervinientes. Asimismo, es complicado iniciar un programa de asistolia pulmonar en centros que no dispongan de trasplante pulmonar, dado el escaso tiempo de isquemia que toleran los pulmones. No está aclarado cuál es el mejor método para combinar preservación abdominal, donde la normotermia parece ser lo más recomendado, y la pulmonar donde se precisa hipotermia.
ConclusionesUn programa Maastricht II en una ciudad pequeña es viable tanto para órganos abdominales como torácicos. El inicio del programa ha sido muy cauteloso, siendo la potencialidad de este programa fácilmente mejorable al incrementar la edad de valoración hasta los 60 años y disponer de cardiocompresores mecánicos en todas las UVI móviles. El desarrollo de todo el procedimiento que engloba el diagnóstico de muerte, la preservación de los injertos y la entrevista familiar en la UCI, evitando la Urgencia y los quirófanos reduce los tiempos de isquemia caliente mejorando los resultados postrasplante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los equipos de trasplante pulmonar, trasplante renal, servicio de Cirugía Cardiovascular y al equipo de enfermeras y perfusionistas del Hospital Universitario Marqués de Valdecilla por su apoyo entusiasta a este programa de donación.