El efecto niebla o fogging effect se define como la desaparición o atenuación transitoria del área hipodensa correspondiente a un accidente cerebrovascular (ACVA) isquémico en su fase subaguda1. Este cambio de densidad en el territorio que ha sufrido el cese del flujo sanguíneo, ha sido motivo de estudio durante años. Su repercusión clínica puede llevar desde la infraestimación del verdadero tamaño del infarto, al error de diagnóstico cuando el paciente se presenta de forma tardía, tras el inicio de los síntomas. En el contexto de la hemorragia subaracnoidea aneurismática (HSA), el infarto cerebral se ha descrito con una incidencia del 25-40%, habitualmente relacionado con la evolución desfavorable del vasoespasmo2. Sin embargo, el infarto puede aparecer también asociado a la lesión cerebral inicial producida por la rotura del aneurisma —fundamentalmente en HSA de mal grado clínico—, o como complicación del tratamiento precoz del mismo3.
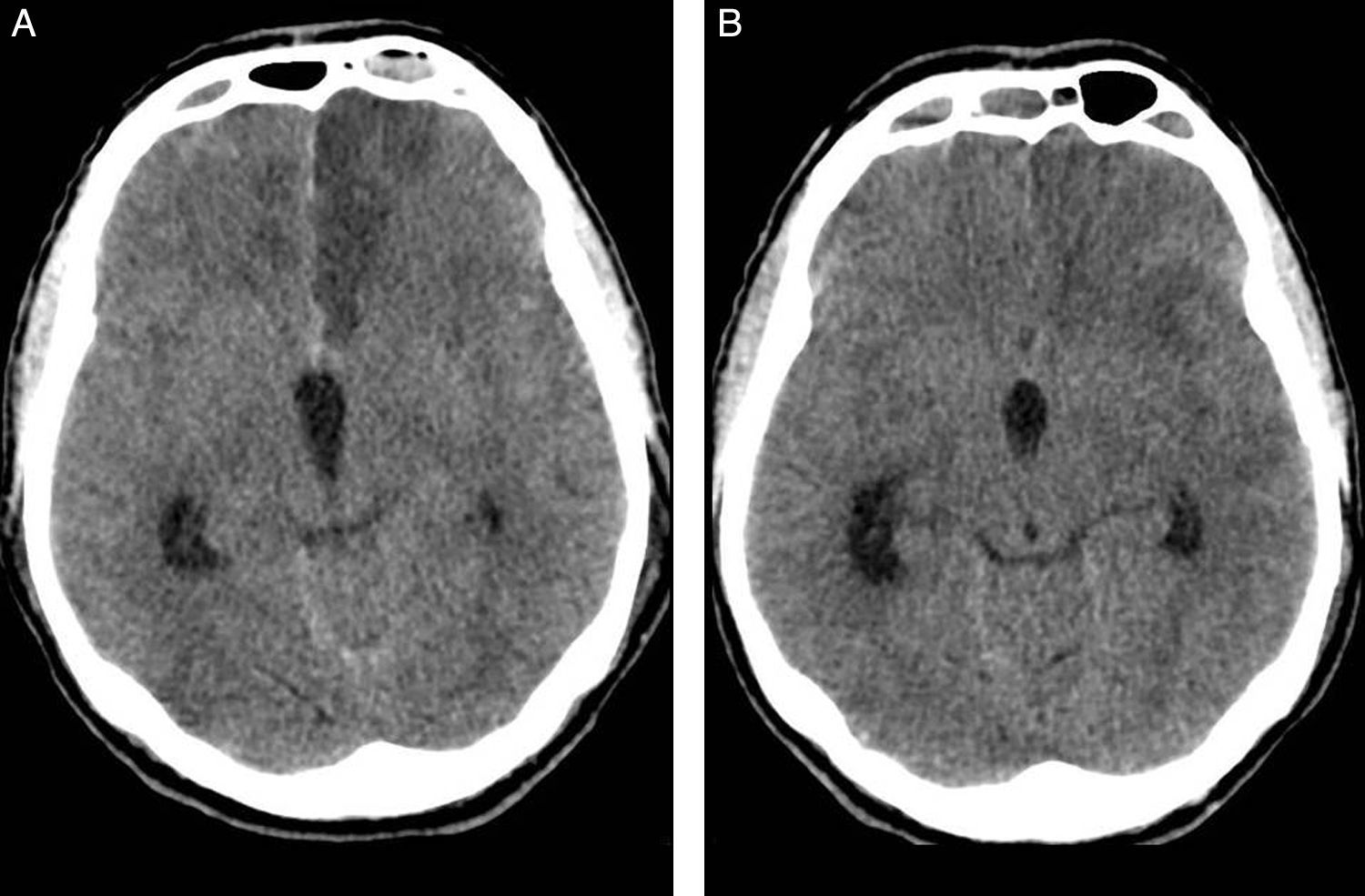
Presentamos el caso de un varón de 51 años, fumador y con antecedente de hipertensión arterial, que sufre episodio brusco de bajo nivel de consciencia con puntuación de 6 en la escala de coma de Glasgow. En la tomografía axial computarizada (TAC), se objetiva HSA de predominio en cisternas de la base, cisura interhemisférica y datos de hidrocefalia aguda. La arteriografía cerebral muestra lesión aneurismática del complejo comunicante anterior, consiguiéndose cierre endovascular del saco aneurismático. Como incidencia en la comprobación final, se observa defecto de repleción en el origen de la arteria cerebral anterior (ACA) izquierda, en relación con suelta de trombo desde el cuello del aneurisma. Los intentos de repermeabilización resultan fallidos, con resultado de oclusión. La TAC a las 24h posprocedimiento evidencia hipodensidad córtico-subcortical compatible con infarto isquémico agudo en dicho territorio (fig. 1).
(A) TAC sin contraste a las 24 horas postembolización del aneurisma. Hipodensidad cortico-subcortical en territorio de ACA izquierda consecuencia de la complicación embolígena. (B) TAC sin contraste preangioplastia para tratamiento del vasoespasmo cerebral en el día 12° de HSA. Desaparición de la hipodensidad en territorio tributario de ACA izquierda (fogging effect).
El paciente evoluciona con criterios sonográficos de vasoespasmo cerebral, alcanzando velocidades medias de 242cm/s el día 12.° del sangrado. La TAC, previa arteriografía para angioplastia cerebral, muestra desaparición de la hipodensidad frontal izquierda. Con el hallazgo de vasoespasmo angiográfico moderado de arteria cerebral media (ACM) izquierda, grave en ACM derecha, y vasoespasmo segmentario moderado de ambas arterias cerebrales anteriores (ACA), se realiza angioplastia con balón en ambos segmentos M1, con buen resultado. El estudio radiológico vuelve a mostrar a las 8 semanas de evolución, una lesión isquémica establecida en territorio tributario de la ACA izquierda.
El diagnóstico del ACVA es puramente clínico, sin embargo las técnicas de neuroimagen juegan un papel indiscutible permitiendo no solo descartar el origen hemorrágico, sino establecer la topografía, extensión e incluso el origen vascular del defecto de perfusión cerebral. La TAC sin contraste es la prueba de imagen de primera elección, por su amplia disponibilidad y rapidez de realización. No obstante, hasta el 60% de los estudios son normales dentro de las primeras 6h, por lo que se ha sugerido complementar con técnicas avanzadas (perfusión, angio-TAC) o resonancia magnética nuclear (RMN) con técnicas multimodales (difusión DWI, perfusión MRP, angio-RMN) en centros donde estén disponibles, y siempre que no conlleve retrasos inaceptables en la decisión de tratamiento. A pesar del indudable atractivo que supone disponer de una aproximación diagnóstica más precisa, y una mejor adecuación de la actitud terapéutica, su realización, en ocasiones, resulta complicada en los pacientes críticos.
La indicación de prueba de neuroimagen en la fase hiperaguda del ACVA está bien establecida. Sin embargo, no existen recomendaciones estandarizadas para el seguimiento en el periodo subagudo. Es entre la segunda y tercera semana, donde se describe el fogging effect, pudiendo el examen radiológico mostrarse normal, tanto en la TAC como en la RMN. La administración de contraste podría ayudar a poner de manifiesto el área infartada, aunque sin una correlación clínica adecuada, podría llevar a diagnósticos erróneos. Becker et al. realizaron las primeras descripciones de este fenómeno radiológico en 1979, correlacionándolo con el estado de resorción de la clasificación de Spatz's. Series posteriores realizadas con TAC han estimado incidencias de hasta un 40-50%, siendo similares a las obtenidas con RMN. Los estudios realizados con esta última modalidad, principalmente en secuencias T2, aunque también descritas en DWI, T1 y FLAIR, han apuntado a un inicio algo más precoz con una media de inicio a los 10 días4. Se ha sugerido la posibilidad de una evolución clínica más favorable, sin embargo esta asociación no ha podido ser establecida con posterioridad5. Un estudio de imagen de seguimiento a los 3 meses, mostraría la sustitución final del tejido necrótico por líquido cefalorraquídeo, permitiendo determinar el tamaño final del infarto.
Se han descrito varias teorías en la patogénesis del «efecto niebla»: neoformación de capilares, mínima transformación hemorrágica, infiltración de macrófagos o incluso disminución del contenido en agua del área infartada. Estas hipótesis han sido apoyadas por estudios radiológicos y modelos animales6. El fogging effect recientemente, ha sido igualmente relacionado con el concepto «perfusión de lujo» y «recanalización fútil»7.
Consideramos que este fenómeno radiológico tiene especial interés en el contexto del infarto precoz de la HSA (primeras 72h). Su fase subaguda coincidiría con el periodo de mayor riesgo de vasoespasmo cerebral, donde una atenuación o desaparición de la hipodensidad inicial podría infraestimar el territorio infartado. El incremento brusco de la presión intracraneal en el momento de la rotura del aneurisma puede originar situaciones de isquemia cerebral global por hipoperfusión, así como ACVA en territorios generalmente distales al aneurisma roto que no puede ser justificados por vasoespasmo. Este infarto precoz se ha relacionado con activación plaquetaria y trombosis secundaria a la exposición del colágeno endotelial8. Existen datos poco homogéneos en cuanto a la incidencia real del infarto precoz, en gran parte debido a si se consideran los relacionados con el procedimiento de exclusión endovascular o quirúrgico del aneurisma. Los estudios realizados con TAC muestran incidencias variables del 25-30%, que contrastan con la aportada por la RMN, donde se describe hasta en un 66-85%9,10.
Pacientes con bajo nivel de consciencia en los que el examen clínico se encuentra limitado para detectar déficit neurológico tardío asociado a vasoespasmo, podrían beneficiarse de seguimiento con DTC y realización de arteriografía cerebral —incluso seriada—, para su manejo. Aunque no existe consenso sobre determinados aspectos técnicos de la angioplastia con balón, existe acuerdo en cuanto a los vasos que se benefician de dilatación mecánica: arteria carótida interna intradural, segmento M1 de ACM, segmento A1 de ACA, segmento P1 de ACP, arteria vertebral intradural y arteria basilar. Vasos de menor diámetro o más distales deberían tratarse con infusión de agentes vasodilatadores.
Conocer y saber interpretar los cambios radiológicos producidos por el efecto fogging en el infarto precoz de la HSA, resulta esencial cuando se deciden actitudes terapéuticas —no exentas de complicaciones—, encaminadas a salvar territorio vascular en riesgo evitando, en ocasiones, una angioplastia fútil.
FinanciaciónNo se ha recibido financiación para la elaboración del trabajo.
Conflicto de interesesLos autores declaran no presentar ningún conflicto de intereses.