El ácido valproico (AV) es un fármaco de amplio espectro, usado en el tratamiento de la epilepsia, como estabilizador del ánimo y como profilaxis de la migraña. Las manifestaciones clínicas de la intoxicación grave por AV pueden determinar depresión del sistema nervioso central, hipotensión, alteraciones hidroelectrolíticas, del equilibrio ácido-base, hiperamoniemia, coma y la muerte1.
No existe un antídoto específico. Informes anecdóticos describen la eficacia de la naloxona y la L-carnitina, pero los datos son insuficientes para establecer conclusiones firmes. Aunque los métodos de depuración extracorpórea se han utilizado para mejorar la eliminación del fármaco, las indicaciones y la eficacia de estos métodos no se han determinado completamente. Se han descrito varias técnicas extracorpóreas en el tratamiento de la intoxicación, pero ninguna ha prevalecido como terapia de elección2. A continuación, presentamos un caso clínico a propósito del problema.
Mujer de 48 años, con antecedentes de depresión y reacción paranoide. Es traída a urgencias tras intento autolítico con 300mg de olanzapina y comprimidos de AV en cantidad desconocida. A su llegada al hospital se encuentra somnolienta, con leve disartria. Opioides y anfetaminas negativos en orina. Valorada por psiquiatría, deciden mantenerla en observación para seriar niveles de AV (primera determinación 49mcg/ml). A las 24h de observación hospitalaria se avisa a la Unidad de Cuidados Intensivos por empeoramiento del nivel de conciencia sin respuesta al tratamiento con naloxona ni flumazenil. En la exploración destaca TA: 80/60mmHg; FC: 100lpm; FR: 20rpm; Sat 92% con reservorio de O2; temperatura: 36°C; GCS: 3. Se procede a intubación orotraqueal y ventilación mecánica para preservar la vía aérea. Se realiza TC craneal urgente que descarta edema cerebral u otras alteraciones significativas, ingresando posteriormente en la Unidad de Cuidados Intensivos. En la primera analítica realizada en dicha unidad destaca AV de 595mcg/ml, amonio 281mcg/dl, lactato 4,9mmol/l y Na 152mEq/l.
Dada la situación clínica se avisa al servicio de Nefrología para iniciar técnica de depuración extracorpórea, siendo instaurada la hemoperfusión (HP) con carbón activado (26h postingestión), obteniéndose la siguiente evolución de los parámetros analíticos (tabla 1).
Evolución de parámetros bioquímicos y hematológicos tras sesión de HP durante 4h
| Hora | AV(mcg/ml) | Na(mEq/l) | K(mEq/l) | Cr(mg/dl) | Cl(mEq/l) | Ca(mg/dl) | pH | CO2(mmHg) | HCO3(mmol/l) | Lactato(mmol/l) | Amonio(mcg/ml) | Úrico(mg/dl) | Plaquetas(*103) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 595 | 152 | 3,9 | 0,7 | 120 | 8,9 | 7,44 | 32 | 21 | 4,9 | 281 | 298 | |
| 9 | 199 | 153 | 3,1 | 0,5 | 118 | 6,8 | 7,49 | 22 | 16,5 | ||||
| 12 | 165 | 154 | 3 | 0,5 | 117 | 7,9 | 7,54 | 21 | 17,8 | 480 | |||
| 23 | 151 | 154 | 3,1 | 0,6 | 117 | 8,7 | 7,42 | 40 | 25 | 183 | 4,2 | 72 | |
| 36 | 131 | 147 | 3,3 | 0,5 | 113 | – | 7,55 | 22 | 19,6 | 1 | 66 | ||
| 70 | 75 | 144 | 3,1 | 0,4 | 116 | – | 7,55 | 22 | 19 | 28 | 64 | ||
| 94 | 141 | 4,3 | 0,4 | 111 | – | 7,41 | 35 | 21 | 86 |
AV: ácido valproico; HP: hemoperfusión.
Hora 0: desde el inicio de la HP.
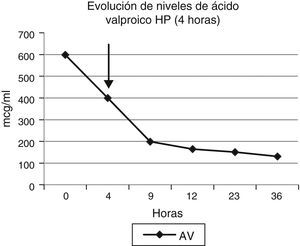
Se procedió a realizar una única sesión de HP con carbón activado, en un tiempo de 4h, obteniéndose niveles fuera del rango de toxicidad en las primeras 24h del tratamiento (de 595 a 151 a las 23h) (fig. 1). Posteriormente se mantuvo sueroterapia hasta alcanzar niveles en rango terapéutico (75mcg/ml). Pudo ser extubada a las 72h.
La intoxicación voluntaria por AV, como intento autolítico, es un problema clínico relativamente común3. Tras su administración oral se absorbe rápidamente, observándose el pico plasmático máximo entre 1-4h. El AV se une fuertemente a las proteínas (90-95%) y su volumen de distribución aparente es 0,1-0,5l/kg, siendo su eliminación fundamentalmente hepática, con eliminación también renal de los metabolitos hepáticos. La semivida del AV es de 8-21h, pero después de una sobredosis puede prolongarse hasta 30h4.
Entre las alteraciones observadas en la intoxicación por AV se encuentra la hiperamoniemia, el aumento del acido láctico y alteraciones electrolíticas tales como hipernatremia, hipocalcemia e hipopotasemia. Se ha comunicado además trombocitopenia y leucopenia1,5. En nuestro caso con intoxicación grave, se objetivaron todas estas alteraciones, excepto leucopenia. Puede haber fracaso renal agudo por hipotensión o rabdomiólisis. Otros hallazgos clínicos incluyen la hipotermia y la taquicardia. En la mayoría de los casos publicados, el periodo de recuperación está entre las primeras 24-48h6.
La hiperamoniemia es causada por la reducción de la captación de glutamato celular y la activación de los receptores de N-metil-D-aspartato. Puede ocurrir sin insuficiencia hepática, debida a un aumento de la producción renal y el bloqueo del metabolismo hepático, pudiendo ser el responsable del coma. En nuestro caso, no hubo otros datos de hepatotoxicidad más que la hiperamoniemia, con estudio de enzimas hepáticas normales. Por otra parte, algunos datos sugieren que la deficiencia de carnitina puede contribuir a la encefalopatía hiperamonémica. Se ha recomendado la L-carnitina para el tratamiento de la hiperamoniemia. Sin embargo, el mecanismo exacto de este tratamiento es desconocido7,8.
Este caso es consistente con publicaciones anteriores en las que la hipernatremia se observó con mayor frecuencia en los pacientes con concentraciones pico de AV por encima de 450mcg/ml4.
También se observó hipocalcemia. Se ha propuesto que metabolitos del AV puedan actuar como aniones que se unen al calcio sérico, disminuyendo las concentraciones de calcio iónico9. La trombocitopenia es debida a la supresión de la médula ósea. Se produce normalmente cuando las concentraciones están por encima de 450mcg/ml10.
Las técnicas extracorpóreas se deben considerar considerando los niveles plasmáticos del fármaco (>300mcg/ml), así como la situación neurológica y hemodinámica del paciente. Con niveles superiores a 300mcg/ml se incrementa la fracción libre del fármaco y solo el 35% se encuentra unido a proteínas, lo que permite que una mayor fracción del fármaco se encuentre potencialmente accesible para su eliminación renal y extracorpórea2,4. Con la hemodiálisis se consigue aclarar eficazmente el fármaco no unido a proteínas, además de la corrección de las alteraciones hidroelectrolíticas. Con la HP, el carbón del cartucho compite por el fármaco con las proteínas plasmáticas, permitiendo remover el fármaco unido a proteínas1.
Los datos disponibles sobre la eliminación del AV con técnicas extracorpóreas son limitados, existiendo algunos casos publicados que sugieren el aumento del aclaramiento del AV y de su eliminación con disminución de la semivida del fármaco de hasta unas 10h tras el uso de HP1. En nuestro caso, la HP precoz con carbón activado resultó efectiva para disminuir con rapidez los niveles de AV. Sin embargo, se necesitan estudios adicionales en grupos más amplios de pacientes para validar la eficacia de esta técnica de depuración.
Con nuestro trabajo concluimos que la HP debe ser considerada en los casos de intoxicación aguda con AV en los que esté indicado el empleo de técnicas extracorpóreas.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses.