La hemorragia masiva obstétrica es una de las causas principales de morbimortalidad materna en el mundo. Entre otras definiciones, se conoce como la pérdida>2.500ml de sangre y se asocia a ingreso en unidades de pacientes críticos y a histerectomía. Los cambios fisiológicos del embarazo permiten una hemorragia cuantiosa antes de objetivar una caída de la hemoglobina y/o el hematocrito. Dentro de los cambios fisiológicos del embarazo, existe una hipercoagulabilidad asociada a la gestante. Algunas comorbilidades asociadas al embarazo pueden contribuir a la aparición de una hemorragia catastrófica con una coagulopatía de consumo, que hace la situación aún más grave. La optimización, la preparación, el uso racional de recursos y la protocolización de actuaciones son útiles para mejorar los resultados en estas pacientes. El uso de protocolos basados en point of care con test viscoelásticos está demostrando utilidad. Si se produce una hipofibrinogenemia durante la hemorragia, la administración precoz de fibrinógeno puede ser muy útil. Para corregir eficazmente la coagulopatía pueden ser necesarios otros factores de la coagulación, además de fibrinógeno, durante la reposición en la hemorragia posparto. Se recomienda la realización de una histerectomía si las medidas médicas y quirúrgicas se han mostrado ineficaces.
Massive obstetric hemorrhage is a major cause of maternal mortality and morbidity worldwide. It is defined (among others) as the loss of>2,500ml of blood, and is associated to a need for admission to critical care and/or hysterectomy. The relative hemodilution and high cardiac output found in normal pregnancy allows substantial bleeding before a drop in hemoglobin and/or hematocrit can be identified. Some comorbidities associated with pregnancy can contribute to the occurrence of catastrophic bleeding with consumption coagulopathy, which makes the situation even worse. Optimization, preparation, rational use of resources and protocolization of actions are often useful to improve outcomes in patients with postpartum hemorrhage. Using massive obstetric hemorrhage protocols is useful for facilitating rapid transfusion if needed, and can also be cost-effective. If hypofibrinogenemia during the bleeding episode is identified, early fibrinogen administration can be very useful. Other coagulation factors in addition to fibrinogen may be necessary during postpartum hemorrhage replacement measures in order to effectively correct coagulopathy. A hysterectomy is recommended if the medical and surgical measures prove ineffective.
La hemorragia masiva obstétrica (HMO) es una de las causas principales de morbimortalidad materna en el mundo, especialmente en los países en vías de desarrollo, si bien en los países desarrollados es causa de preocupación creciente. La atonía uterina es una causa cada vez más frecuente de HMO, lo que unido al creciente número de cesáreas, implicadas en la aparición de más casos de acretismo placentario, hace que la incidencia de HMO esté en aumento. Además, existen algunas causas de HMO que se cursan con una coagulopatía muy grave y precisan de una reposición de hemoderivados realmente decidida y adecuada1–3.
Aunque el conocimiento de la HMO es cada vez mayor, las investigaciones se han realizado fundamentalmente en pacientes con hemorragia masiva asociada a trauma, siendo pocos los estudios enfocados en la hemorragia posparto. Sin embargo, las pacientes obstétricas difieren notablemente de los pacientes traumatizados, sobre todo en que estos son con frecuencia varones, por los cambios fisiológicos del embarazo, además de que los mecanismos responsables de la hemorragia son totalmente distintos, razones que explican que el enfoque terapéutico pudiera ser diferente.
Recientemente, se han publicado varias guías clínicas que tratan la hemorragia masiva y que prestan una especial atención a la HMO4–6.
En este trabajo abordaremos la HMO en particular, comenzando por su definición y repasando los cambios fisiológicos y hemostáticos en la gestante que ayudan a comprender mejor la fisiopatología de la HMO. En cuanto al tratamiento, se describirán las medidas desde el punto de vista médico, el papel del fibrinógeno en este contexto, así como la indicación de transfundir con protocolos basados en la experiencia o guiados por pruebas viscoelásticas. Finalmente, se harán unas recomendaciones y se expondrán unos puntos clave que ayuden al lector a resumir y sistematizar el tratamiento de la HMO.
Definición de hemorragia obstétricaLa hemorragia es fisiológica tras el parto. Sin embargo, cuando esta excede una cierta cantidad, se considera patológica. Es difícil definir de forma clara la hemorragia obstétrica. Existen numerosas definiciones (tabla 1)7–10.
Resumen de las principales definiciones de hemorragia obstétrica
| Guías clínicas | Definición |
|---|---|
| Australianas, 20088 | Pérdida sanguínea>500ml tras parto y 750ml tras cesárea |
| Austriacas, 20084 | Pérdida sanguínea de 500-1.000ml y signos de shock hipovolémico o sangrado>1.000ml |
| Alemanas, 20084 | Pérdida sanguínea>500ml tras parto Grave: pérdida>1.000ml en 24h |
| RCOG Reino Unido, 200910 | Primaria: pérdida estimada>500-1.000ml sin signos de shock Grave: pérdida estimada>1.000ml o signos de shock |
| WHO9 | Pérdida>500ml en 24h tras el parto Grave: pérdida>1.000ml en 24h |
RCOG: Royal College of Obstetricians and Gynaecologists; WHO: World Health Organization.
La cuantificación de la hemorragia es particularmente difícil durante el parto y/o la cesárea debido a que la sangre se mezcla con otros fluidos. Además, cuando ocurre una atonía posparto puede existir una gran cantidad de sangre retenida en el útero, bien si el parto ha sido por cesárea, bien si se ha tratado de un parto eutócico1,2.
Los signos clínicos clásicos (taquicardia e hipotensión) son engañosos en la gestante debido al notable incremento del volumen plasmático, y pueden no manifestarse hasta que la hemorragia no ha sido muy cuantiosa.
La hemodilución relativa y el elevado gasto cardiaco, propios del embarazo normal, permiten que ocurra una pérdida hemática cuantiosa antes de que se pueda objetivar una caída en los valores de hemoglobina y/o hematocrito1,2.
Es una hemorragia anormal aquella que supera los 500ml tras un parto vaginal y los 1.000ml tras una cesárea. Estas cantidades se superan en 1:20 partos o cesáreas, respectivamente11.
La HMO se define como la pérdida>2.500ml de sangre y se asocia a una morbilidad significativa, a la necesidad de ingreso en unidades de pacientes críticos y a la realización de una histerectomía obstétrica. Otras definiciones incluyen: una caída de la concentración de hemoglobina≥4g/dl, la necesidad de transfusión de 5 o más unidades de concentrado de hematíes (CH), o la necesidad de tratar una coagulopatía o realizar un procedimiento invasivo para su tratamiento12–14.
La tasa de HMO es 6:10.000 partos, mientras la tasa de mortalidad dentro de estas es de 1:1.200 HMO. La tasa global de mortalidad por hemorragia obstétrica es de 0,39 por 100.000 maternidades, siendo en la actualidad la tercera causa de mortalidad materna directa en el Reino Unido11.
Problemas específicos de la paciente obstétricaCambios fisiológicos del embarazoEl aumento de la masa eritrocitaria en un 20-30%, junto con el incremento del volumen plasmático en un 50%, hacen que la gestante presente una anemia fisiológica dilucional.
Existe un estado hipercoagulable propio del embarazo, con un aumento de la concentración plasmática de casi todos los factores de la coagulación (fibrinógeno y factores vii, viii y ix), mientras el sistema fibrinolítico disminuye su actividad. El plasminógeno está aumentado, pero su actividad está disminuida debido al incremento del inhibidor del plasminógeno tipo ii. (tabla 2). Existe, asimismo, una hiperfibrinogenemia fisiológica propia del embarazo.
Cambios fisiológicos del embarazo (hematológicos)
| Factores aumentados | I, VII, IX, XII | ↑↑↑ |
| Factores inalterados | II, V | = = = |
| Factores disminuidos | XI, XIII | ↓↓↓ |
| Otros parámetros | TP ↑ 20%, aPTT ↑ 20%, plaquetas ↓, fibrinopéptido A↑ AT III ↓ PDF ↑ PAI 2 ↑ Plasminógeno ↑ Proteínas C y S ↓ TEG®/ROTEM®: hipercoagulable Masa eritrocitaria (20%) ↑ Volumen plasmático (50%) ↑↑ |
aPTT: tiempo parcial de tromboplastina activado; AT III: antitrombina iii;PAI 2: inhibidor del plasminógeno tipo ii; TEG®/ROTEM®: pruebas viscoelásticas (tromboelastografía/tromboelastometría); TP: tiempo de protrombina.
Los anticoagulantes naturales, tales como la proteína S, sufren un descenso, contribuyendo al estado protrombótico, con un aumento de la fibrinólisis, especialmente en el útero, en el momento de la separación placentaria.
Existe una trombocitopenia gestacional fisiológica, sin traducción clínica en forma de aumento de la tendencia hemorrágica15.
Estos cambios dan como resultado un acortamiento del tiempo de protrombina (TP) y del tiempo parcial de tromboplastina activado (aPTT), además de un aumento de parámetros tromboelastográficos: máxima firmeza del coágulo y máxima amplitud16,17.
Algunas comorbilidades asociadas al embarazo pueden contribuir a la aparición de una hemorragia catastrófica con una coagulopatía de consumo3.
Monitorización de la hemostasia y fisiopatología de la coagulopatía (tabla 3)Los test rutinarios de coagulación son los métodos más frecuentes de monitorización de la hemostasia en una HMO. Estas pruebas son muy lentas en una situación tan dinámica como es un episodio de HMO. Además, la sensibilidad de estas (TP, aPTT) puede no ser la más adecuada. Si se usa el nivel de fibrinógeno plasmático, debería ser valorado por el método de Clauss16–18.
Pruebas viscoelásticas disponibles
| Prueba | Test | Información |
|---|---|---|
| ROT EM® | INTEM EXTEM FIBTEM APTEM HEPTEM | Factores de coagulación, polimerización de la fibrina. Sensible al exceso de heparina Factores de coagulación, polimerización de la fibrina y fibrinólisis Valora la contribución del fibrinógeno a la fortaleza del coágulo Valora el estado de fibrinólisis Valora la corrección del exceso de heparina |
| TEG® | Kaolín Kaolín heparinasa Fibrinógeno funcional | Factores de coagulación, polimerización de la fibrina y fibrinólisis Valora la corrección del exceso de heparina Contribución del fibrinógeno a la firmeza del coágulo |
El uso del sistema de point of care usando tromboelastografía (TEG, Haemonetics, Braintree, MA, EE. UU.) o tromboelastometría (ROTEM, TEM GmbH, Múnich, Alemania) es poco frecuente en las salas de parto hoy en día. Los test viscoelásticos, TEG/ROTEM, son un método que valora las propiedades viscoelásticas de la coagulación de forma global (modelo celular de la coagulación). Presentan los resultados gráficamente, permitiendo valorar la formacio¿n y la lisis del coágulo en menos de 10min. Pueden realizarse a pie de cama (point of care) y aportan ventajas comparándolos con los test convencionales de la coagulación (rapidez en la obtencio¿n de resultados, favoreciendo la toma de decisiones clínicas precoces, permitiendo además una valoración global de la coagulación en una muestra de sangre total), lo que facilita una reposición agresiva y decidida en la HMO. Las pacientes obstétricas presentan con frecuencia y de manera precoz alteraciones graves de la coagulación, que deben tratarse de forma individualizada. La TEG/ROTEM permite la administración individualizada de hemocomponentes (plasma fresco y plaquetas) y de concentrados de factores de coagulacio¿n cuando sean necesarios y en la cantidad adecuada6.
El tipo, la gravedad y la incidencia de coagulopatía son distintos en función de la etiología de la hemorragia. Así pues, en caso de atonía y desgarros del canal genital la coagulopatía predominante es la dilucional. Por el contrario, si la hemorragia se debe a un desprendimiento de placenta (abruptio) se inicia rápidamente una coagulopatía de consumo, caracterizada por un desarrollo rápido de hipofibrinogenemia y trombocitopenia incluso con unas pérdidas iniciales de sangre relativamente escasas15,16.
El consumo de factores no siempre cumple los criterios de coagulopatía de consumo. La coagulopatía de consumo auténtica se ve en la embolia de líquido amniótico, en algunos casos de preeclampsia grave o síndrome HELLP y en el desprendimiento placentario grave (abruptio placentae). Estas mujeres llegarán a tener unos niveles críticos de fibrinógeno plasmático rápidamente. La activación local de la coagulación (en el lecho placentario) y del sistema fibrinolítico también contribuye a la rápida instauración de la coagulopatía por consumo3,15.
Los cambios en la coagulación observados en el embarazo con el uso de ROTEM consisten en una objetivación de la hipercoagulabilidad19, que puede confirmarse tanto con TEG como con ROTEM20,21. Esto se traduce en unos tiempos de coagulación (CT de ROTEM o r de TEG) más cortos y en firmezas del coágulo (máxima firmeza del coágulo del ROTEM y máxima amplitud del TEG) más amplias. Por tanto, los dinteles para instaurar tratamiento pueden ser distintos a los de otros pacientes críticos16,22,23.
Hay una buena correlación entre los parámetros estándares de coagulación y los valores de ROTEM cuando se evalúan ambas variables en el periodo del posparto inmediato22,24,25.
De la misma forma, se ha encontrado correlación entre el ROTEM FIBTEM y la concentración de fibrinógeno22.
Parece que el ROTEM FIBTEM A5 (disponible en 10min) puede usarse de forma equivalente a la medición de fibrinógeno por el método de Clauss, si bien no mide los mismos parámetros. Grosso modo, FIBTEM de 15mm equivale a un fibrinógeno Clauss de alrededor de 3g/l; si es de 10mm equivale a 2g/l, y si es de 6mm la equivalencia es con 1g/l de fibrinógeno26.
Hoy día no hay estudios amplios con ROTEM y HMO, aunque si se dispusiera de ellos, su uso podría guiar la reposición de forma rápida y directa y ayudar a diferenciar si la hemorragia se está viendo agravada por una hemostasia alterada.
Tratamiento médicoEl correcto reconocimiento de una HMO es vital, tal como ocurre en otras hemorragias masivas, ya que el retraso se acompaña de acidosis metabólica, hipotermia, coagulopatía y anemia, combinación que puede ser letal. Se recomienda, con un elevado grado de evidencia, la corrección de estos factores en la hemorragia masiva5.
La comunicación y el trabajo en equipo: durante todo el tiempo que dure el episodio de HMO debe mantenerse la vigilancia y documentar perfectamente las observaciones y los tiempos. Es importante la comunicación a otros miembros del equipo de las sospechas fundadas precozmente.
El tratamiento de la HMO comienza con medidas generales y de primera línea: intervenciones manuales y farmacológicas, que deben llevarse a cabo de forma precoz, decidida y en menos de 30min.
Medidas generales y reanimación con líquidos intravenososLa corrección de la hipovolemia mediante la administración iv de cristaloides y/o coloides es prioritaria ante cualquier tipo de hemorragia aguda.
Una vez que se superan los 1.000ml de hemorragia estimada y esta continúa, se recomienda tener 2 vías venosas periféricas de grueso calibre canalizadas, y comenzar con la administración de cristaloides calentados, así como enviar una muestra al Banco de Sangre para la realización de grupo y escrutinio de anticuerpos irregulares.
La reanimación con líquidos iv debe comenzar con rapidez y no confiarse a un simple resultado de hemoglobina. Esta solo sirve para ver cuál es el punto de partida.
La discusión respecto a la estrategia más adecuada para la reposición de la volemia puede ser muy prolija4.
El volumen máximo a infundir debería limitarse y no exceder de 3,5l (hasta 2l de cristaloides calentados tan rápido como sea posible), ampliable a otros 1.500ml mientras se espera a que llegue la sangre compatible27, sin olvidar que la administración excesiva de líquidos lleva de forma inexorable a una coagulopatía dilucional.
Los cristaloides más empleados son: la solución salina isotónica al 0,9%, la solución de Ringer y otras soluciones «balanceadas», como la de Hartmann (Ringer lactato). Habitualmente solo el 25% del volumen administrado permanece en el espacio intravascular. Son baratas, no alteran la hemostasia ni la función renal, y hay una gran experiencia en su empleo.
Los coloides tienen un mayor efecto sobre el volumen intravascular, pero pueden inhibir la agregación plaquetaria e interactuar con la medición correcta de los niveles de fibrinógeno28. Los coloides disponibles son los hidroxietil-almidones, las gelatinas y la albúmina humana. La infusión de albúmina al 5% produce una expansión plasmática del 75% del volumen infundido. Las gelatinas, dado su bajo peso molecular, tienen una vida media intravascular corta (2-3h) y su capacidad expansora es limitada (70-80%). Los hidroxietil-almidones al 6% tienen una vida intravascular media más larga (6-8h) y una mayor capacidad expansora (80-120%). Los hidroxietil-almidones son, en la actualidad, los coloides más usados para la expansión de volumen6.
En cualquier caso, si se usa una gran cantidad de líquidos iv, se recomienda calentarlos29.
La identificación de la causa de la hemorragia es también importante, ya que puede condicionar el tratamiento de manera fundamental. La regla de las 4 T es fácil de memorizar y ampliamente utilizada en HMO (Tono, Trauma, Tejido, Trombina)30.
Medidas de primera líneaLa atonía uterina es la causa más frecuente de HMO y las medidas de primera línea más utilizadas son: extracción de fragmentos retenidos de placenta, masaje uterino y compresión bimanual. La optimización, la preparación, el uso racional de recursos y la protocolización de actuaciones suelen ser útiles para mejorar los resultados en las pacientes con HMO30.
La oxitocina es el fármaco más utilizado en la HMO. La dosis recomendada es variable entre las distintas instituciones, pero es conveniente destacar que además de resultar útil para tratar la atonía uterina su uso se asocia, especialmente cuando se administra en bolo, a vasodilatación periférica, aumento del gasto cardiaco, vasodilatación, taquicardia e hipotensión arterial. Se ha documentado en alguna ocasión la aparición de casos de isquemia miocárdica asociada a su uso. Se debe evitar la administración rápida de oxitocina para prevenir la aparición de efectos secundarios, especialmente hipotensión grave. Si el tono uterino no es adecuado, se pueden añadir 10-20 unidades adicionales de oxitocina a una infusión de 1.000ml de suero31.
Medidas de segunda líneaLos alcaloides ergóticos se usan cuando la oxitocina no es efectiva (segunda línea); 0,2mg de metilergonovina intramuscular provocan una contracción uterina tetánica. Estos fármacos causan una vasoconstricción intensa debida a una estimulación adrenérgica profunda. Están contraindicados en pacientes con hipertensión, preeclampsia, cardiopatía isquémica o hipertensión pulmonar32.
Si la metilergonovina no es eficaz, o está contraindicada, el siguiente fármaco disponible es la prostaglandina F2α o carbaprost. Este fármaco se inyecta por vía intramuscular (250mg) y se repite cada 15-30min, hasta alcanzar una dosis máxima de 2g. Está contraindicado su uso en mujeres asmáticas, ya que puede provoca broncoespasmo32.
En caso de persistencia de la hemorragia, se indican los tratamientos de segunda línea. La histerectomía debe ser un recurso de último lugar y se debe reservar para casos extremos de HMO incoercible y refractaria a otras medidas13.
Fibrinógeno y hemorragia pospartoComo ya se ha mencionado, se recomienda el método de determinación de fibrinógeno plasmático por el método de Clauss o mediante FIBTEM en el ROTEM® o el Functional Fibrinogen en el TEG® para finalidades diagnósticas o cuando se deban tomar decisiones del manejo clínico de pacientes en el contexto de una hemorragia masiva (1C)6.
Recientemente, se ha investigado sobre los cambios en los perfiles de coagulación maternos en una HMO. Los niveles bajos de fibrinógeno previos al parto se han identificado como un importante factor de riesgo para que ocurra una HMO23,26. La coagulopatía de consumo acompaña de forma característica a diversas comorbilidades en obstetricia (desprendimiento placentario, embolia de líquido amniótico, retención de feto muerto), si bien no se correlaciona tan frecuentemente con otras más comunes como la atonía uterina32.
En la reposición de hemoderivados en la HMO se debe hacer un énfasis especial en la medida y la cuantificación precoz del nivel de fibrinógeno plasmático y proporcionar una respuesta rápida a unos niveles bajos. En la HMO, la medida del fibrinógeno plasmático se ha documentado como el parámetro mejor correlacionado con el riesgo de hemorragia posparto masiva y de coagulopatía concomitante4,23,26,33.
Los niveles maternos de fibrinógeno se han asociado de forma independiente con la gravedad de la hemorragia. Si el nivel de fibrinógeno está por debajo de 2g/l cuando comienza la hemorragia, el valor predictivo positivo de este parámetro para predecir la HMO es del 100%4,23,33.
Asimismo, la HMO aumenta el riesgo de aparición de fenómenos tromboembólicos en el posparto, por lo que se recomienda el uso de profilaxis de la enfermedad tromboembólica en cuanto cese la HMO18.
La administración preventiva de fibrinógeno en casos de HMO comparada con placebo no se ha demostrado efectiva34. Sin embargo, en este RCT la administración de fibrinógeno fue tardía, después de pérdidas importantes (>1.000ml) y con dosis fijas. Son necesarios más estudios para clarificar definitivamente su papel en este contexto.
Hemorragia obstétrica y transfusiónAunque los tratamientos farmacológicos y la terapia transfusional son los principales pilares en el manejo de la HMO, el grado de evidencia es bajo para la mayoría de estos procedimientos. Este hecho hace que puedan existir sesgos a la hora de recomendar determinadas acciones. Es imprescindible llevar a cabo más investigación de calidad en este campo de cara a recomendar acciones y terapias seguras para las parturientas con HMO35–39.
La tasa de transfusión en pacientes obstétricas es relativamente baja en países desarrollados (0,9-2,3%), si bien ha ido en aumento en los últimos años. La transfusión es un indicador importante de morbilidad obstétrica y debiera ser motivo de preocupación en las administraciones, como ya lo es en la de EE. UU.40,41.
La incidencia de transfusión masiva (10 o más unidades de CH transfundidas) es solo de 6 de cada 10.000 partos. La causa más frecuente de transfusión masiva son las anomalías de placentación (27%). Este hecho es preocupante, dado que la tasa de histerectomías ha ido en aumento en EE. UU. en los últimos años3.
Es obligatorio el uso racional de los recursos del Banco de Sangre. Todas las unidades que atiendan partos deberían disponer de varias bolsas (de 2 a 4) de CH del grupo 0 Rh negativo de manera inmediata.
El uso rutinario de grupo y escrutinio debe basarse en la individualización del riesgo: historia materna, posibilidad de complicaciones (acretismo, placenta previa, cesáreas previas) y políticas locales de cada hospital. La petición de sangre cruzada rutinaria no está justificada ni es necesaria en parturientas normales no complicadas antes de ser sometidas a cesárea o ante un parto. Algunos autores han estudiado la rentabilidad de la realización de grupo y escrutinio sistemático en cesáreas, viendo que solo el 1,7-3,3% de las pacientes requirieron transfusión. Además, más del 60% de las hemorragias no tenían factores de riesgo para transfusión. El 98% de las pacientes con grupo y escrutinio no precisó transfusión. Se recomienda que se estratifique el riesgo y en función de ello se solicite el estudio de forma estandarizada en cada hospital41.
Este es el ejemplo del Hospital de Stanford (EE. UU.)3:
- a)
Para pacientes de bajo riesgo para transfusión: solo test ABO y Rh.
- b)
Para pacientes de riesgo moderado de transfusión: grupo y escrutinio.
- c)
Para pacientes de riesgo elevado de transfusión: escrutinio y pruebas cruzadas.
En este hospital, esta estrategia redujo los test en un 55%, lo que redunda en un empleo más racional de los recursos.
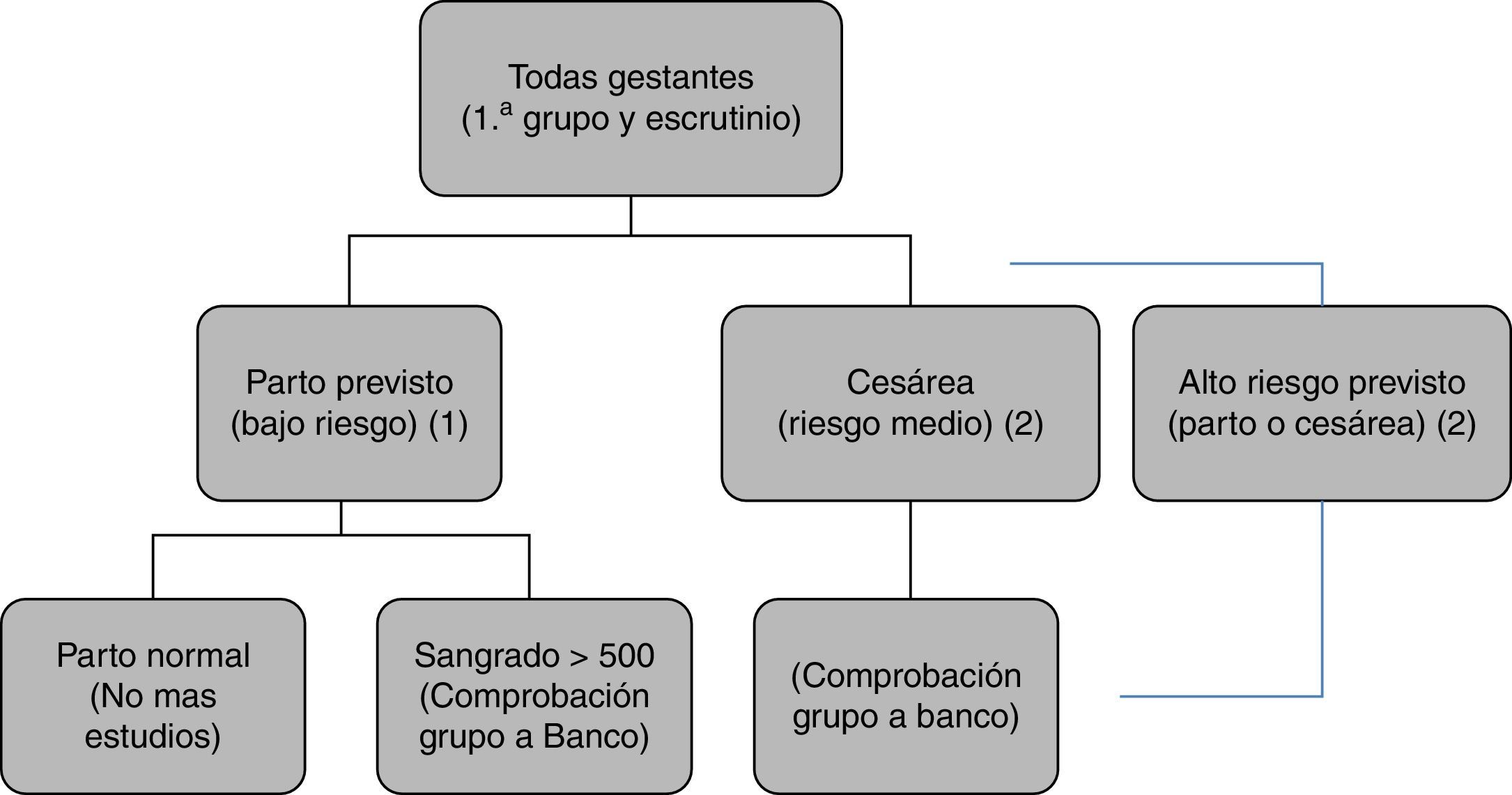
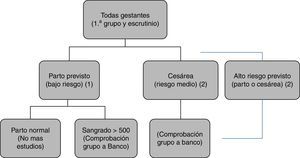
En nuestro hospital1 (fig. 1):
- -
Se hace grupo a todas las pacientes al ingreso. En los partos de bajo riesgo, no se realiza ningún estudio adicional.
- -
Si durante el parto hay una hemorragia excesiva, se extrae una muestra adicional para escrutinio.
- -
A todas las cesáreas se les extrae una muestra para escrutinio.
- -
A las cesáreas programadas de alto riesgo se les solicitan pruebas cruzadas.
Protocolo del Hospital Universitario La Paz para la petición de muestras al Banco de Sangre.
A todas las gestantes se les realiza una extracción al ingresar en el hospital, en la que se obtiene grupo sanguíneo y escrutinio de anticuerpos irregulares.
(1) En caso de parto considerado de bajo riesgo: no se hacen más estudios.
(2) En caso de hemorragia>500ml, cesárea programada o urgente o parto de alto riesgo previsto (gemelar, cesárea anterior, anomalías de placentación, etc.) se envía una segunda muestra al Banco para comprobación de grupo y facilitar así la disponibilidad de sangre compatible en caso necesario.
El proceso para conseguir CH de forma rápida y ágil en una HMO puede consumir un tiempo y unos recursos necesarios para otras tareas. El desarrollo de un protocolo de HMO facilita la petición y el transporte de CH. Esto debe figurar en el algoritmo del protocolo de cada hospital1,2,42,43.
El uso de protocolos de HMO ha demostrado su utilidad para facilitar la transfusión rápida de suficiente volumen de productos sanguíneos, y son coste-efectivos (menor uso general de productos). Su uso también mejora las líneas de comunicación para la orden de transfusión y su transporte desde el Banco de Sangre al lugar donde es necesaria la sangre. Para la activación de los protocolos deben ser necesarias órdenes electrónicas y verbales, y el Banco de Sangre debe ser capaz de responder a esta orden en 5-10min1,2,44.
La composición de los paquetes de HMO en los protocolos es variable. En general, se componen de 6-10 unidades de CH 0 Rh negativo no cruzado, 4 unidades de plasma AB y una unidad de plaquetas de aféresis. Si se conocen los resultados del escrutinio, se pueden enviar bolsas de CH isogrupo y plasma A en lugar del AB líquido, que es la primera opción en urgencias. El plasma y las plaquetas deben administrarse precozmente para corregir la coagulopatía y la trombocitopenia, tan frecuentes en la HMO. La ratio correcta de CH/plasma en el seno de la HMO no se conoce, pero los paquetes de los protocolos de hemorragia masiva están diseñados para asemejarse lo más posible a la sangre completa, y de esta forma minimizar el impacto de la coagulopatía dilucional y la hipovolemia3,44.
Las guías clínicas actuales4–6 recomiendan de forma clara la elaboración de protocolos de manejo de la HMO, si bien el nivel de evidencia no es elevado. Sin embargo, las ratios predefinidas de administración de hemoderivados no han demostrado su utilidad en este contexto. Tampoco la administración de concentrado de factores tiene indicaciones claras y definidas4.
En EE. UU., el 90-95% de las unidades cuentan con un protocolo de HMO, aunque su tasa de disponibilidad y utilización se desconocen44.
En nuestro centro:
- -
Se activa el protocolo cuando la hemorragia estimada excede los 2.000ml o si a pesar de una pérdida menor, la paciente se muestra inestable hemodinámicamente o presenta alteraciones en el estado de conciencia. El anestesiólogo pide ayuda inmediata y es el encargado de activar el protocolo con una llamada al Banco de Sangre.
- -
En el Banco de Sangre se prepara rápidamente una nevera portátil con 10 unidades de CH, 10 unidades de plasma fresco congelado (PFC) y 2 pools de plaquetas.
- -
La administración de concentrado de fibrinógeno comienza una vez activado el protocolo con 4g iv de forma inmediata y empírica. Se dispone de este producto en el paritorio de manera inmediata (no es necesaria la petición al Banco de Sangre).
- -
Si la hemorragia no es tan grave, especialmente no de tan rápida instauración, la petición al Banco de Sangre sigue la vía normal (electrónica o papel), que requerirá un mayor tiempo de respuesta por parte del Banco.
Los recuperadores intraoperatorios recogen la sangre del campo quirúrgico, la lavan y la filtran para que después se pueda reinfundir a la paciente. Su uso reduce la necesidad de transfusiones alogénicas, a la vez que reduce los riesgos asociados a las mismas. Puede además ser una solución aceptable para personas que rechacen una transfusión. La hemorragia debe ser cuantiosa para que se recupere una cantidad significativa susceptible de ser reinfundida y esto no siempre es posible preverlo cuando se requiere el recuperador de sangre intraoperatorio45,46.
La recuperación de sangre intraoperatoria en obstetricia hoy día es algo relativamente seguro, de tal forma que se van superando las preocupaciones asociadas a su uso (contaminación con contenido fetal, activación de factores, etc.). Algunas organizaciones internacionales, como el National Institute of Clinical Excellence, del Reino Unido10, recomiendan su uso en la HMO. Las guías europeas sobre sangrado masivo perioperatorio establecen las siguientes recomendaciones al respecto: «la recuperación perioperatoria de sangre en obstetricia se tolera bien, teniendo en cuenta las necesarias precauciones hacia la isoinmunización Rh» (Grado de recomendación C). «Sugerimos que el uso de recuperación perioperatoria durante la cesárea puede reducir la necesidad de sangre homóloga y la estancia hospitalaria» (Grado de recomendación 2B)4.
Además es necesario un análisis coste-efectividad de estos aparatos. La recuperación intraoperatoria de sangre en la HMO solo es coste-efectiva en la cesárea con alta probabilidad de hemorragia (con reinfusión de 2 o 3 unidades de CH). Se deben tener en cuenta los costes no solo de la transfusión, sino de los fungibles, los técnicos, el tiempo, etc., mientras en el balance deben colocarse los riesgos actuales de la transfusión alogénica45,46.
Recientemente se han usado con éxito los recuperadores sanguíneos también en partos vaginales47.
Embolización arterial selectivaSi las terapias iniciales son ineficaces hay que pasar al segundo o tercer escalón de tratamiento, junto con la activación de más recursos y personal. Entre estas medidas figuran algunas maniobras o recursos quirúrgicos (balones intrauterinos, suturas uterinas de contención, etc.) en un intento de evitar una histerectomía. Estas maniobras son tanto más efectivas cuanto más precozmente se realicen y menor haya sido la pérdida sanguínea hasta ese momento1.
Cuando estas maniobras siguen sin conseguir el cese de la hemorragia, la paciente puede ser susceptible de embolización arterial selectiva, devascularización pélvica o histerectomía2.
En los últimos años la embolización arterial se ha convertido en un tratamiento estándar para tratar de evitar una histerectomía y preservar la fertilidad. El éxito de este procedimiento es superior al 80%, con una tasa de complicaciones inferior al 10%. En algunos casos de alto riesgo, con placenta acreta o percreta, se han colocado balones arteriales profilácticos (en las arterias iliacas comunes o en las iliacas internas) con el ánimo de usarlos después del parto en caso necesario y ganar tiempo14.
Decisión de reponer (fig. 2)Aunque las pruebas convencionales de coagulación son poco fiables en la guía de la terapia en la hemorragia masiva posparto4, no podemos olvidar que los test viscoelásticos no están disponibles en muchos paritorios.
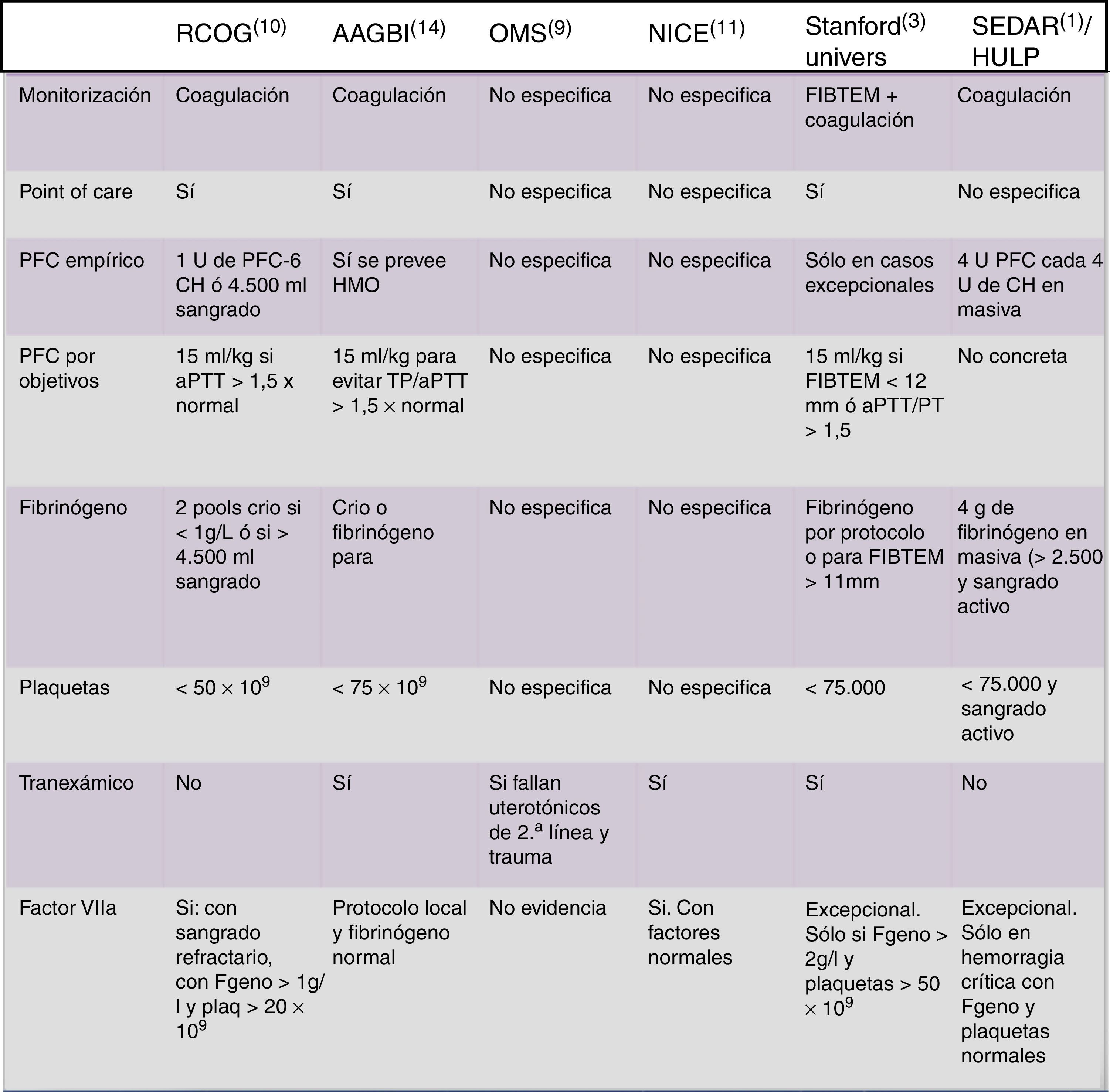
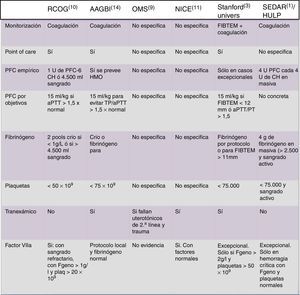
Recomendaciones de diferentes sociedades científicas internacionales sobre hemorragia masiva obstétrica.
AAGBI: Association of Anaesthetists of Great Britain and Ireland (Reino Unido); aPTT: tiempo parcial de tromboplastina activado; CH: concentrado de hematíes; FIBTEM: medida de tromboelastometría (firmeza de coágulo y fibrinógeno); HMO: hemorragia masiva obstétrica; HULP: Hospital Universitario La Paz (Madrid, España); NICE: National Institute of Clinical Excellence (Reino Unido); OMS: Organización Mundial de la Salud; PFC: plasma fresco congelado; RCOG: Royal College of Obstetricians and Gynaecologists (Reino Unido); Stanford Univers: Universidad de Stanford (EE. UU.); SEDAR: Sociedad Española de Anestesia y Reanimación (España); TP: tiempo de protrombina.
La mayoría de las guías y protocolos utilizados actualmente en la HMO vienen derivados de los escenarios de pacientes politraumatizados, si bien no hay datos objetivos que avalen este uso, aunque algunos autores recomienden de forma explícita seguir las mismas reglas generales18. En la población obstétrica, una alteración en los tiempos convencionales (PT/aPTT) suele indicar una alteración de la hemostasia y puede requerir una actuación rápida y decidida. Una guía clínica italiana recomienda un TP y/o aPTT>1,5 veces el normal, como trigger para la administración de PFC48. Esta misma guía recomienda la administración empírica de PFC si los test no pueden realizarse en unos tiempos razonables, si bien hay artículos que destacan que con frecuencia se administran dosis excesivas de PFC49.
En la guía de la Sociedad Británica de Hematología sobre hemorragia crítica se hace la siguiente recomendación: los test hemostáticos convencionales seriados, incluyendo recuento plaquetario, actividad de protrombina, aPTT y fibrinógeno, antes y después de la reanimación con líquidos y hemoderivados, deben ordenarse/pedirse de forma regular, cada 30-60min, dependiendo de la gravedad de la hemorragia, con el fin de servir de guía y asegurar el uso apropiado de hemostáticos y hemocomponentes (1C)18.
Además, las concentraciones de fibrinógeno plasmático disminuyen en la mayoría de las pacientes con HMO, a pesar de la administración excesiva de PFC, evidenciando la necesidad de otras alternativas4.
Los estudios actuales indican que un fibrinógeno plasmático de 1g/l es demasiado bajo para conseguir una adecuada hemostasia en una HMO, y que el dintel de 2g/l sería más adecuado en estas pacientes. Algunas guías incluyen recomendaciones específicas para la HMO, especialmente en lo que se refiere a las recomendaciones de uso de ácido tranexámico (TXA) y fibrinógeno.
En la figura 2 se muestra una comparación de las recomendaciones de las principales sociedades1,3,7–10,14.
Plasma fresco congeladoComo con otros productos, su uso se basa en lo que se utiliza en los pacientes politraumatizados. Existe una gran diversidad de protocolos, en los que se usa una ratio fija entre CH y PFC a razón de 1:1, mientras otros protocolos apoyan además la adición de un pool de plaquetas también a 1:1:1. Estos productos generalmente se usan en forma de shock pack una vez que es activado el protocolo de HMO. La justificación para su utilización es el intento de mantener la generación de trombina y de fibrinógeno mediante la reposición de factores lo antes posible, sin tener generalmente resultados de laboratorio que confirmen la necesidad exacta de la cantidad a reponer. El inconveniente que tienen estos packs sin monitorización es que la mayoría de las mujeres estarán recibiendo productos pobres en fibrinógeno y quizás con menor cantidad de este que el que ellas tienen en ese momento circulando. El plasma donado proviene de donantes no gestantes y tiene un nivel de fibrinógeno de 2g/l, con lo cual, habrá una reducción de la concentración de fibrinógeno con su administración, así como de factor viii y Von Willebrand debido a la dilución50,51.
Las guías actuales no distinguen respecto a la etiología de la HMO, por lo que la reposición empírica y precoz con plasma se justificaría si se sospecha que se va a producir un elevado consumo de factores (desprendimiento de placenta o embolia de líquido amniótico) o si se esperan grandes pérdidas sanguíneas (rotura uterina, placenta acreta). Por el contrario, ante una atonía uterina o un desgarro del canal del parto no es de esperar que se presente una alteración hemostática precoz, así que el uso empírico de plasma no estaría justificado. La administración de PFC a ratios predefinidas puede ser útil en trauma, y quizás también en la HMO. No obstante, su nivel de recomendación en la HMO es solo «2C»4.
Si se considera como trigger de transfusión de plasma la ratio aPTT/TP, cuando esta alcanza 1,59 la alteración hemostática puede ser ya muy importante. Probablemente si se espera a este límite sea demasiado tarde para comenzar una infusión de plasma en una HMO14.
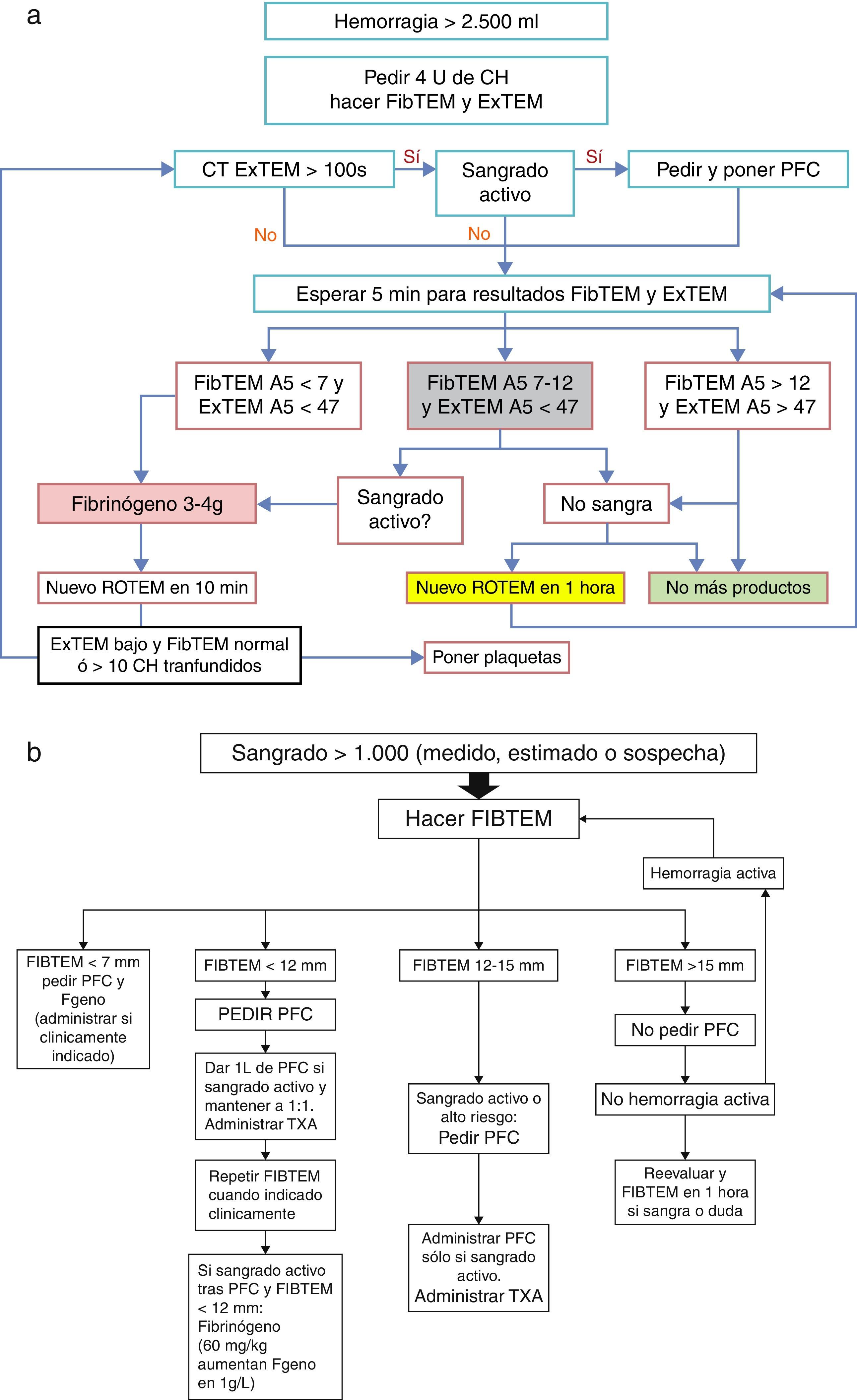
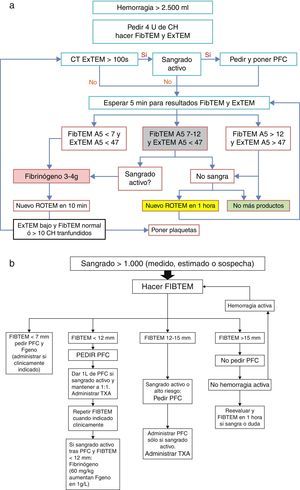
Se ha publicado recientemente un algoritmo (fig. 3a) para la infusión de PFC basado en el FIBTEM A5 (medida del fibrinógeno funcional a los 5min) en hemorragia grave (>2.500ml y sangrando activamente). En este, se recomienda administrar concentrado de fibrinógeno inmediatamente si el FIBTEM A5 es<7mm, que corresponde a un nivel plasmático de fibrinógeno muy bajo para una gestante (en lugar del shock pack de PFC+plaquetas), y si la hemorragia es muy intensa, se recomienda considerar la administración de fibrinógeno por debajo de FIBTEM A5<12mm. Con este protocolo, los autores han demostrado una reducción en el uso de CH, PFC y plaquetas, y de complicaciones como la sobrecarga circulatoria asociada a la transfusión16.
a) Protocolo de hemorragia masiva obstétrica>2.500ml; b) protocolo de hemorragia masiva obstétrica>1.000ml; ambos guiados por ROTEM.
CH: concentrado de hematíes; EXTEM A5: medida de tromboelastometría (vía extrínseca) a los 5min en mm; FIBTEM A5: medida de tromboelastometría (firmeza coágulo y fibrinógeno) a los 5min en mm; PFC: plasma fresco congelado; ROTEM: tromboelastometría; TXA: ácido tranexámico.
Fuente: Collis y Collins14.
Posiblemente, en el futuro, estudios como este darán más fuerza al uso de la terapia basada en point of care. En este estudio, una vez que la hemorragia ha cesado, no se deberían administrar más productos hemostáticos, cualquiera que sea el resultado de ROTEM. El uso de los shock packs hace que las pacientes acaben sobretransfundidas, por lo que muchas de ellas no se verán beneficiadas en absoluto16.
PlaquetasLas guías recomiendan que se mantengan por encima de 50×109·l−1 durante una hemorragia activa, lo que significa que quizás debería iniciarse la infusión cuando alcancen 75×109·l−1. Un recuento plaquetario inferior a 75×109·l−1 es muy poco frecuente en el embarazo (salvo abruptio placentae, embolia de líquido amniótico, preeclampsia grave o trombocitopenia inmune). Por tanto, la estrategia de los shock packs de 1:1:1 dará lugar a una sobretransfusión de plaquetas y no parece que esté justificado en todos los casos14,15,50,51.
Ácido tranexámicoLa administración de TXA tiene un alto grado de recomendación (1B) y la aconsejan varias sociedades5. Su administración ha conseguido disminuir la cuantía de la hemorragia y la necesidad de transfusión en hemorragias masivas no obstétricas. Su uso en la HMO no está totalmente establecido aún, si bien cada vez se usa más en la práctica diaria, a la luz de los resultados favorables en cirugía mayor y trauma. Las recomendaciones actuales se resumen en la figura 152,53.
Hasta la fecha, solo hay estudios pequeños que avalan el uso de TXA en este escenario de HMO. El WOMAN Trial es un estudio multicéntrico, prospectivo y doble ciego actualmente en marcha que está investigando el uso de TXA en la HMO precoz. Se incluirán 20.000 mujeres de forma aleatorizada a quienes tras una pérdida sanguínea posparto de 500ml se les administrará TXA o placebo. El objetivo principal de este ensayo es evaluar la incidencia de muerte o histerectomía y si estas varían con el uso o no de TXA. Este estudio arrojará luz a la utilidad del TXA en la progresión de la hemorragia54.
Crioprecipitados y concentrado de fibrinógenoLos crioprecipitados no están disponibles en muchos hospitales en España. Se han usado para mantener el nivel de fibrinógeno por encima de 1-1,5g/l si la administración de PFC no ha sido suficiente. Un pool de crioprecipitado es capaz de aumentar el nivel de fibrinógeno plasmático en 0,5g/l, aunque depende del nivel de consumo de este. En cualquier caso, la dosis depende además del nivel que se pretenda alcanzar de fibrinógeno plasmático3,15. El crioprecipitado contiene, además de fibrinógeno, una elevada concentración de factor viii, Von Willebrand y factor xiii14.
El concentrado de fibrinógeno se ha usado para corregir la hipofibrinogenemia durante la HMO, aunque su indicación está fuera de ficha técnica en muchos países. La literatura existente es sobre todo de casos y series de casos en estudios no controlados2,55.
Para aumentar el nivel de fibrinógeno en 1g/l se requieren alrededor de 60mg/kg, aunque si hay consumo adicional o dilución, los incrementos pueden ser menores56.
Un metaanálisis publicado en 2012, que incluye 6 ensayos clínicos aleatorizados en los que no hay ninguna paciente obstétrica, concluye que su administración disminuye la cuantía de la hemorragia y la necesidad de transfusión, aunque no la mortalidad57.
Concentrado de complejo protrombínicoEl concentrado de complejo protrombínico contiene factores de coagulación ii, vii, ix y x y se usa en ocasiones como off label en la HMO. Actualmente hay un estudio en curso sobre el uso de concentrado de complejo protrombínico y fibrinógeno durante la HMO58.
El concentrado de complejo protrombínico se puede asociar a fenómenos trombóticos en pacientes no gestantes, por lo que su uso debe ser y estar muy bien justificado (balance riesgo-beneficio) y siempre con el consejo del hematólogo14.
Factor VII recombinanteHa existido un gran interés durante algunos años en el factor vii recombinante para tratar la HMO que amenaza la vida o para prevenir una histerectomía, aunque el fabricante de este producto no lo recomienda para este uso51,59.
El Royal College of Obstetricians and Gynaecologists del Reino Unido recomienda su uso en la HMO siempre que el fibrinógeno plasmático sea>1g/l y el recuento plaquetario superior a 20×109·l−1. El National Institute of Clinical Excellence además añade que los valores de coagulación deberían ser normales antes de considerar la administración del factor vii51.
Existe una revisión Cochrane que asocia el uso de factor vii a la aparición de fenómenos trombóticos arteriales y venosos y recomienda que su uso se limite a ensayos clínicos controlados60.
Manejo práctico de la HMO- -
Se debe realizar o procurar una cuantificación cuidadosa de las pérdidas hemáticas (medida, peso de gasas, compresas, etc.).
- -
Es fundamental la implicación de todos los estamentos en la HMO en el momento adecuado, contando con un apropiado y coordinado liderazgo en los paritorios y unidades donde puedan estar ingresadas las pacientes susceptibles de presentar una HMO.
- -
La mayoría de las hemorragias se controlan sin necesidad de transfundir, si bien ante una HMO, la transfusión es la norma.
- -
Cuando se activa el protocolo de HMO se deben sacar muestras para FIBTEM, medición de hemoglobina, hematocrito y test de coagulación, según la disponibilidad de cada hospital.
Según Collis y Collins14 (fig. 3b):
- -
Si el FIBTEM>15mm (fibrinógeno 3g/l), el resto de los factores será normal y no es probable que se necesiten PFC ni crioprecipitados. La atención se debería centrar principalmente en la monitorización y en el estado cardiovascular materno. Dado que la mayoría de las hemorragias posparto no masivas son debidas a atonía y trauma del canal del parto, que no se asocian a un gran consumo de factores con anomalías precoces de coagulación o hipofibrinogenemia, la actuación obstétrica precoz generalmente controla esta sin necesidad de usar productos de coagulación14,32.
- -
Si ha habido una hemorragia importante (>1.000ml) pero ya no hay sangrado activo y el FIBTEM está por encima de 15mm o entre 12-15mm: no se recomienda administrar PFC. No es imprescindible, en estos casos, el traslado de la mujer a quirófano/paritorio, si esta no se encuentra allí en ese momento, para la realización de una revisión del canal del parto o de la cavidad uterina bajo anestesia14.
- -
Si el FIBTEM es<12mm y persiste el sangrado activo: la paciente debe ser trasladada urgentemente a quirófano/paritorio, si no está ya allí. Si además las ratios TP/aPTT son anormales, se administrarían 15ml/kg de PFC y para muchos autores el concentrado de fibrinógeno debería usarse precozmente, y no solo cuando la administración de plasma ha fracasado en corregir la hemorragia. Si la ratio TP/aPTT está por encima de 1,5, según el algoritmo de Collis, se transfunde una dosis mayor de PFC, con el consejo del hematólogo14.
Numerosos autores, en consonancia con la evidencia actual (1B), recomiendan el uso de 1g de TXA si la hemorragia no se controla con las medidas obstétricas iniciales, especialmente si hay signos de alteración hemostática18,52.
El papel de la simulación en la HMODado el gran impacto que tiene la HMO en la mortalidad materna, el Confidential Enquiry into Maternal and Child Health recomienda el uso de la simulación como herramienta de enseñanza y entrenamiento al personal implicado11.
Se han realizado ejercicios de cuantificación de hemorragia, identificación de errores potenciales de medicación o tiempos hasta la resolución correcta del episodio de HMO en simulación. Una de las cuestiones más recurrentes en estos escenarios es la de la infraestimación de la hemorragia por parte de los participantes, planteando que esta mejoraría con la realización de cursos periódicos para conseguir una actuación más precoz en una hemorragia real, especialmente en las graves, ya que la estimación de la hemorragia ocurrida se aleja más de los valores reales cuanto mayor es la cantidad de sangre que se ha perdido. Sin embargo, cuando la pérdida sanguínea es pequeña, la tendencia es a la sobreestimación, lo cual también entraña riesgos61,62.
Algunas maniobras obstétricas pueden ser ensayadas con simuladores para así adquirir la destreza necesaria cuando sean necesarias, de la misma forma que se mide la eficacia de las compresiones torácicas en la reanimación cardiopulmonar62.
En definitiva, el entrenamiento en urgencias obstétricas y especialmente en HMO es una herramienta muy potente capaz de mejorar los resultados en las pacientes, aunque es solo eso: una herramienta y no una solución en sí misma. La simulación debería estar impartida por expertos en la materia y en simulación e implicar a diferentes miembros del equipo, para así ir encontrando la vía de la efectividad y el beneficio para todos.
Puntos clave y recomendaciones- -
El reconocimiento precoz de la HMO es vital a fin de evitar la aparición de acidosis metabólica, hipotermia, coagulopatía y anemia, combinación que puede ser letal.
- -
Comunicación y trabajo en equipo: durante todo el tiempo que dure el episodio de HMO debe mantenerse la vigilancia y documentar perfectamente las observaciones. Es importante la comunicación precoz a otros miembros del equipo de la sospecha fundada de HMO.
- -
La reanimación con líquidos iv debe comenzar con rapidez y no confiarse a un simple resultado de hemoglobina. Esta solo sirve para ver cuál es el punto de partida. La hipotensión es siempre un signo tardío, y cuando aparece, la actuación debe ser inmediata.
- -
Si tras los primeros intentos no se obtiene éxito, se recomienda pedir ayuda más experta para tomar las decisiones adecuadas (incluyendo histerectomía) en el momento oportuno.
- -
Los uterotónicos pueden ser salvadores en la HMO, pero pueden ser peligrosos si no se usan con cautela. Carbetocina no ha demostrado ser mejor que oxitocina en la atonía uterina y su uso actual como tratamiento de la HMO es off label. Misoprostol debe usarse solo en consonancia con recomendaciones y protocolos escritos. Metilergonovina es un fármaco peligroso en caso de pacientes hipertensas, con enfermedad cardiovascular y en ciertas etnias porque puede provocar vasoespasmos.
- -
Es importante una adecuada comprensión y explicación de la causa subyacente del problema hemorrágico (hacer un diagnóstico correcto y no solo prescribir tratamiento sintomático).
- -
Todas las unidades que atiendan partos deberían tener una cierta cantidad de sangre 0 Rh negativo inmediatamente disponible (2-4 unidades de CH).
- -
Si se identifica una hipofibrinogenemia durante la hemorragia, la administración precoz de fibrinógeno puede ser una intervención sumamente útil, si bien las indicaciones precisas para la suplementación de fibrinógeno no están del todo establecidas. Otros factores de la coagulación, además de fibrinógeno, pueden ser necesarios de modo que se alcancen unos niveles mínimos de formación de trombina.
- -
Se recomienda la realización de una histerectomía solo si las medidas médicas y quirúrgicas se han mostrado ineficaces.
- -
Es recomendable la personalización de los tratamientos de acuerdo con el diagnóstico y la reevaluación de forma continua de la mujer (es una situación muy dinámica), en lugar de persistir en un tratamiento inefectivo o inapropiado.
Emilia Guasch ha recibido pagos por conferencias organizadas por CSL Behring y ha colaborado en la redacción de documentos patrocinados por dicha compañía. Fernando Gilsanz declara no tener ningún conflicto de intereses.