La infección de la prótesis aórtica (IPAo) es una grave complicación presente hasta en el 1,17% de los pacientes sometidos a reparación endovascular (EVAR) de un aneurisma de aorta abdominal (AAA)1. Desde la descripción del primer caso por Chalmers et al. en 1993 se han publicado numerosos casos pero, a diferencia de la infección de la prótesis abdominal secundaria a cirugía abierta, la infección protésica post-EVAR ha sido escasamente estudiada. A pesar de su baja incidencia constituye una enfermedad con una alta morbimortalidad y dificultad diagnóstica-terapéutica. Se produce por la contaminación perioperatoria del material protésico, por erosiones mecánicas de la endoprótesis o tras la diseminación hematógena desde otro foco infeccioso. Su presentación clínica dificulta en muchas ocasiones su diagnóstico al manifestarse de forma insidiosa con dolor abdominal, pérdida de peso, anemia, fiebre y émbolos sépticos semanas o años después de la cirugía del AAA2,3.
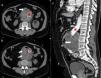
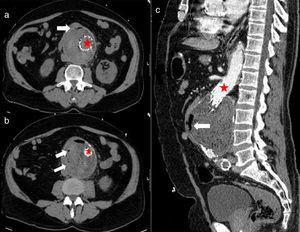
Presentamos el caso de un varón de 71 años con antecedentes de tabaquismo (20cigarrillos/d), obesidad, hipertensión arterial tratada con IECA y dislipidemia. Cardiopatía isquémica revascularizada en 2002 y 2009. Diagnosticado incidentalmente en 2009 de un AAA infrarrenal aterosclerótico de 9cm de diámetro, por lo que se le implantó una endoprótesis aortomonoilíaca derecha y un bypass femoro-femoral. En enero de 2011 presentó una isquemia arterial aguda en la pierna izquierda por obliteración de la arteria poplítea que no requirió cirugía. Cinco meses después acude a urgencias por febrícula de varios días, despeños diarreicos y dolor abdominal continuo. Presentaba Ta de 38°C, TA de 180/70mmHg, mal estado general, dolor en el epigastrio sin signos de irritación peritoneal y livideces en miembros inferiores con pulso conservado. En el análisis urgente destacaban: 19.940 leucocitos/uL (93,4% de neutrófilos), Hb: 10g/dl, urea: 84mg/dl, creatinina: 1,56mg/dl y proteína C reactiva: 372,4mg/L. La TAC mostraba un AAA de 10cm de diámetro que causaba un desplazamiento anterior de la tercera porción del duodeno y aire en el plano de separación con la pared aórtica (fig. 1a), además de un gran trombo intramural con burbujas en su interior (fig. 1b y c). Con la sospecha de la existencia de una fístula aortoentérica (FiAoE) con infección de la IPAo y del hematoma intraaórtico se inició un tratamiento antibiótico empírico con daptomicina (6mg/kg/d) e imipenem (500mg/6h). Fue intervenido de urgencias, confirmándose la perforación del duodeno a la aorta y un absceso en el hematoma intraaórtico. Se realizó un bypass axilo-prótesis femoral derecha con cierre terminal de la aorta y ambas ilíacas, apertura del aneurisma para la retirada de la prótesis (descartándose rotura o migración de la misma), limpieza del absceso, resección del saco aneurismático y cierre del duodeno con plastia de yeyuno y epiplon. En los hemocultivos se aisló Streptococcus milleri (S. milleri) y Escherichia coli (E. coli) y en las muestras del absceso intraabdominal una flora polimicrobiana con predominio de E. coli y Prevotella buccae (P. buccae). En el postoperatorio se apreció un nuevo absceso en el lecho quirúrgico, por lo que se reintervino, drenándose el absceso y comprobándose la desvitalización de la pared aórtica. Falleció al 11.°día de ingreso por shock séptico y fracaso multiorgánico.
Imagen de la TAC del abdomen. Aneurisma abdominal trombosado con la endoprótesis en su interior (estrella roja). En la cara anterior del aneurisma (fig. a) se aprecia una porción de asa del duodeno que contacta con la pared del mismo, no existe plano de separación y en su lugar se observa una burbuja de aire (flecha). En otros cortes (figs. b y c) se aprecian múltiples burbujas de aire en el espesor del trombo.
La IPAo constituye una entidad poco frecuente pero grave, difícil de diagnosticar y tratar. La contaminación perioperatoria del material protésico supone el 50% de las infecciones de la endoprótesis, además de la diseminación hematógena desde otro foco infeccioso y las erosiones mecánicas de la endoprótesis. Las erosiones mecánicas junto con las deficiencias del material protésico o del sellado llevan a la aparición de endofugas (salida de sangre al aneurisma excluido), favoreciendo su crecimiento, la formación de trombos y la infección4. Los tipos i y iii (incompetencia en el sellado del extremo proximal y distal de la endoprótesis, así como en la anastomosis de 2 piezas del stent) son los que principalmente contribuyen a la formación de trombos e infección de la prótesis. La presencia de trombos alrededor de la endoprótesis constituye «un medio de cultivo» para la infeccion2. La FiAoE supone otra causa de IPAo. Aparece en un 0,3 a 1,6%3,5 con una mortalidad superior al 50%6; se produce por erosión de la pared aórtica y el asa suprayacente (3.a y 4.a porción del duodeno) debido al crecimiento del aneurisma, infección o deterioro mecánico de la endoprótesis (endofuga, rotura y migración)3,5,6. La mitad de las IPAo ocurren entre 25 y 70 meses posteriores a la intervención y en el 24,5% la FiAoE es responsable de la infección2, como ocurrió en nuestro caso. Los microorganismos infectantes derivan de la flora cutánea o entérica, destacando Staphylococcus aureus (S. aureus) en la infección precoz y Streptococcus species (Streptococcus spp.) en la tardía junto a E. coli, Enterococus species (Enterococus spp.) y Proteus species (Proteus spp.)2. Por ello, deberíamos sospechar una IPAo secundaria a FiAoE en pacientes con prótesis sobre el AAA con una bacteriemia polimicrobiana. La TAC es diagnóstica en el 33-80%, mostrando cambios inflamatorios, gas dentro del saco aneurismático o colecciones alrededor del injerto y crecimiento del aneurisma3. El tratamiento combina la antibioterapia intravenosa y la cirugía con la revascularización mediante bypass extraanatómico, retirada de la prótesis y de la aorta nativa3,5,7,8. La mortalidad es del 14,6% con tasa de reinfecciones del 20%2.