Los pacientes con lesión pulmonar aguda o síndrome de distrés respiratorio agudo (SDRA) ingresados en unidades de cuidados intensivos (UCI) presentan alteraciones neuropsicológicas que en la mayoría de los casos se extienden más allá de la fase aguda, acarreando importantes déficits en su calidad de vida. El objetivo de la presente puesta al día es profundizar en el análisis de la compleja interacción entre el pulmón y el cerebro en el enfermo crítico sometido a ventilación mecánica. Inicialmente se describen las alteraciones neuropsicológicas asociadas tanto durante la fase aguda de estancia en la UCI como al alta hospitalaria. En un segundo apartado se analiza la interacción pulmón-cerebro durante la ventilación mecánica y, finalmente, se explora la etiología y los mecanismos que dan lugar a las alteraciones neurológicas que se observan en estos pacientes. El manejo del paciente crítico requiere de una visión integradora enfocada a minimizar los efectos deletéreos a corto, medio o largo plazo.
Patients with acute lung injury or acute respiratory distress syndrome (ARDS) admitted to the ICU present neuropsychological alterations, which in most cases extend beyond the acute phase and have an important adverse effect upon quality of life. The aim of this review is to deepen in the analysis of the complex interaction between lung and brain in critically ill patients subjected to mechanical ventilation. This update first describes the neuropsychological alterations occurring both during the acute phase of ICU stay and at discharge, followed by an analysis of lung-brain interactions during mechanical ventilation, and finally explores the etiology and mechanisms leading to the neurological disorders observed in these patients. The management of critical patients requires an integral approach focused on minimizing the deleterious effects over the short, middle or long term.
Los importantes avances desarrollados en el manejo del paciente crítico a lo largo de la última década han mejorado los índices de supervivencia de los mismos pero han puesto de relevancia la necesidad de velar también por reducir la morbilidad de estos pacientes. La lesión pulmonar aguda (LPA) y el síndrome de distrés respiratorio agudo (SDRA) se asocian aún a elevados índices de morbilidad1,2. Entre otras, los supervivientes de estas enfermedades presentan alteraciones neuropsicológicas que se extienden más allá de la fase aguda y de la estancia hospitalaria y conducen a importantes déficits en su calidad de vida que pueden perdurar a lo largo del tiempo. Estas secuelas neurocognitivas generan no solo un problema sociosanitario, sino también económico dada la gran cantidad de recursos que deben destinarse a compensar las situaciones de dependencia de los supervivientes. Por ello, el análisis de la compleja interacción entre órganos en el enfermo crítico es de crucial importancia para garantizar la optimización del abordaje clínico de estos pacientes y para minimizar las complicaciones derivadas de su manejo.
Las alteraciones cerebrales adquiridas en el paciente crítico son fruto tanto de las múltiples disfunciones orgánicas derivadas de la enfermedad como de su manejo durante la estancia en la unidad de cuidados intensivos (UCI)3. En la presente puesta al día focalizaremos nuestro interés en el eje pulmón-cerebro con la finalidad de identificar qué factores implicados en la LPA y en su manejo ventilatorio pueden conllevar la aparición de alteraciones neuropsicológicas. El objetivo es revisar la literatura más reciente relativa a la comunicación pulmón-cerebro en el paciente crítico, no neurológico. En un primer enfoque se describirán, desde el punto de vista clínico, las alteraciones psicológicas y neuropsicológicas que se observan en el paciente crítico y que ocurren tanto durante la fase aguda de estancia en la UCI como al alta hospitalaria. En un segundo apartado se analizarán los factores implicados en la interacción pulmón-cerebro ahondando tanto en los mecanismos fisiopatológicos relacionados con la enfermedad como en los derivados de su manejo clínico, prestando especial interés al papel que tiene la ventilación mecánica (VM). Para finalizar, se explorarán las posibles vías de señalización y las bases moleculares e histopatológicas de las alteraciones neurológicas descritas.
Alteraciones neuropsicológicas en el paciente críticoEl manejo médico y quirúrgico del paciente ingresado en la UCI se asocia frecuentemente con la presencia de déficits neurocognitivos1, incluso en aquellos pacientes sin alteraciones cognitivas previas. Además, recientemente, se ha puesto de manifiesto que la VM, a pesar de ser una herramienta de soporte vital para el paciente crítico, se relaciona con frecuencia con el desarrollo de déficits neuropsicológicos1.
Es posible distinguir 2 tipos de alteraciones neurocognitivas en el paciente crítico que recibe VM asociadas tanto a la fase aguda como a la fase crónica. El síndrome confusional es el cuadro neuropsiquiátrico más comúnmente observado durante la fase aguda del paciente crítico4,5. Se caracteriza por una alteración del nivel de alerta con disminución en la habilidad de focalizar, mantener y/o cambiar la atención, cambios en otras funciones cognitivas y/o el desarrollo de alteraciones perceptivas. Suele manifestarse durante un corto periodo de tiempo y muestra un curso fluctuante a lo largo del día. El síndrome confusional en pacientes de la UCI es una de las causas más frecuentemente relacionadas con la presencia de deterioro cognitivo a largo plazo6–8. En un estudio reciente se ha demostrado que en pacientes con VM la duración del síndrome confusional es, en sí misma, un predictor independiente del déficit cognitivo a los 3 y 12 meses tras el alta hospitalaria9. La prevalencia del síndrome confusional se sitúa, aproximadamente, entre un 50-70% en los pacientes de la UCI no ventilados mecánicamente y aumenta hasta un 60-80% en los pacientes ventilados mecánicamente10–13.
El interés por el estudio de los déficits cognitivos observados a largo plazo y asociados a la estancia en la UCI es relativamente reciente. Atendiendo a la última revisión de Hopkins y Jackson sobre el tema14, actualmente solo existen 10 cohortes con un total de 450 pacientes donde se han estudiado estos déficits neuropsicológicos en pacientes críticos tras su estancia en la UCI15. Los estudios se centraron en pacientes con SDRA15,16, LPA17, en pacientes con fallo respiratorio18, un solo estudio con pacientes de UCI médicas y otros 2 estudios incluían todos los pacientes críticos de la UCI19,20. Los datos sugieren que al menos un tercio de los pacientes de la UCI desarrollan déficits neurocognitivos crónicos de una magnitud similar al déficit cognitivo observado en las demencias leves y moderadas21. Esta prevalencia aumenta hasta en un 80% en aquellos pacientes que durante su estancia hospitalaria presentan SDRA15.
Las alteraciones neuropsicológicas asociadas a la estancia en la UCI han sido descritas en pacientes con SDRA tanto al alta hospitalaria como a los 2 meses tras el alta19, a los 6 meses, al año16, a los 2 años18 e incluso hasta 6 años después de la estancia en la UCI. Tales secuelas cognitivas suelen mejorar durante los primeros 6-12 meses posteriores al alta hospitalaria22 pero tienden a permanecer estables y a cronificarse a partir del año. Se ha observado que la prevalencia de estas alteraciones afectan a un 78% de los pacientes en el momento del alta hospitalaria, a un 47% a los 2 años y a un 25% a los 6 años tras la estancia en la UCI1.
Los déficits neuropsicológicos que pueden observarse en los supervivientes de la UCI se relacionan con una amplia variedad de dominios cognitivos. Hopkins et al.1 refieren que, en general, en la población crítica de la UCI, el déficit de memoria es la alteración que se presenta con más frecuencia, seguida del déficit en las funciones ejecutivas, la velocidad de procesamiento de la información y las alteraciones en la capacidad atencional. La comparación de las secuelas cognitivas entre grupos de pacientes distintos resulta una tarea difícil debido a las diferencias metodológicas de los estudios, a la discrepancia en el consenso de definición de secuelas cognitivas, a la variabilidad de pruebas neuropsicológicas administradas, al tiempo de seguimiento, al tipo de paciente en la UCI y a la gravedad de la enfermedad crítica. No obstante, algunos autores han sugerido un perfil neuropsicológico común a los pacientes que han permanecido ingresados en estas unidades. Larson et al.22 observaron un peor rendimiento en el funcionamiento intelectual general, las funciones ejecutivas, la velocidad de procesamiento de la información y la memoria verbal en pacientes con SDRA. Estos resultados concuerdan con otros estudios previos realizados en pacientes con SDRA y con supervivientes de UCI médicas8,21.
El paciente ventilado mecánicamente, además de presentar alteraciones cognitivas, también puede manifestar síntomas psicopatológicos como ansiedad y depresión23,24. Los estudios sobre el tema estiman la prevalencia de depresión y ansiedad de un 10 a un 58% en este tipo de pacientes. Hopkins et al.25 observaron que aproximadamente un 23% de los pacientes con SDRA presentaban síntomas de ansiedad al año y a los 2 años tras la estancia en el hospital y un 16% de esos mismos pacientes presentaron depresión al año del alta, aumentando hasta un 23% a los 2 años. La presencia de depresión y de secuelas cognitivas al año tras la estancia hospitalaria resultaron ser los mejores predictores de depresión a largo plazo. Este estudio sugiere una posible relación entre neurocognición y trastornos afectivos en los supervivientes de la UCI. No obstante, Larson et al. no encontraron influencia de las alteraciones emocionales en los resultados neurocognitivos en los pacientes de la UCI22.
Por el contrario, las consecuencias de los déficits neurocognitivos y psicopatológicos crónicos sí han sido ampliamente estudiadas. Hoy en día, se sabe que todos estos déficits tienen un gran impacto en la vida de los pacientes y contribuyen a disminuir su capacidad para llevar a cabo las actividades de la vida diaria, empeoran la calidad de vida de pacientes y familiares, suponen un aumento de los costes médicos asociados a su tratamiento y dificultan la vuelta al trabajo y a su vida diaria previa al ingreso en la UCI1,18,26. En un estudio de seguimiento de supervivientes de enfermedades críticas cerca del 50% de los pacientes no habían podido volver al trabajo debido principalmente a los efectos de los déficits cognitivos 6 años después de su estancia en la UCI17.
Factores implicados en la interacción pulmón-cerebro durante la ventilación mecánicaEl fracaso respiratorio agudo que requiere soporte con VM se produce por una gran variedad de factores, incluyendo enfermedades propias pulmonares, shock, necesidad de protección de la vía aérea o aplicación transitoria después de un procedimiento quirúrgico mayor27. El descenso de la presión pleural durante la respiración espontánea se sustituye por la aplicación de una presión positiva generada por el respirador a fin de suministrar un volumen corriente (VT) eficaz para oxigenar y eliminar anhídrido carbónico que sea confortable para el paciente. A pesar de ser una herramienta de soporte vital para muchos pacientes críticos, la VM no está exenta de complicaciones y per se puede agravar e incluso inducir lesión pulmonar de novo, pudiendo llegar a propagarse a otros órganos, entre ellos el cerebro, y conduciendo finalmente al fallo multiorgánico.
Años de investigaciones han derivado en un descenso progresivo de la mortalidad de estos pacientes. En la actualidad, se utilizan patrones de ventilación que protegen al pulmón del daño asociado a la excesiva sobredistensión producida por elevados VT y presiones alveolares, a la vez que minimizan patrones de reclutamiento y desreclutamiento alveolar durante cada ciclo respiratorio28,29. Además, la liberación de la VM debe conllevar una eficiente interacción paciente-ventilador ya que de lo contrario el paciente presenta frecuentes episodios de inadaptación y disincronías, prolongación del tiempo de VM, episodios de miedo, ansiedad, pánico y síndrome confusional, necesidad de aumentar sedantes y opioides y, finalmente, incremento tanto de la mortalidad30,31 como de las secuelas neuropsicológicas23,24. Un estudio reciente ha mostrado que la presencia de disnea es frecuente, intensa y se asocia a fenómenos de ansiedad en pacientes de intensivos sometidos a VM32. La intrínseca relación fisiológica y clínica entre ansiedad, disnea y dolor es un denominador común en pacientes de Medicina Intensiva donde médicos y enfermeros tratan de acortar tiempos de estancia y exposición a la VM aunque ello conlleve el riesgo de exponer a estos pacientes a estímulos disneicos por periodos prolongados.
Una buena adaptación del paciente intubado a la VM conlleva una adecuación de los parámetros ventilatorios a fin de normalizar el intercambio gaseoso y proporcionar confort al paciente. Este aspecto conlleva un preciso análisis de la fisiología respiratoria, la mecánica del sistema respiratorio y de los requerimientos metabólicos del paciente. Estudios recientes han demostrado que los pacientes en VM presentan de forma frecuente asincronías en su interacción con el ventilador (modo y parámetros). Estas asincronías acontecen durante todo el ciclo respiratorio y están relacionadas con el trigger inspiratorio, la duración de la inspiración del ventilador, el paso de inspiración a espiración, el atrapamiento aéreo y la presencia de esfuerzos inspiratorios no efectivos durante todo el ciclo respiratorio. Un análisis detallado de estas asincronías, sus mecanismos de aparición y su tratamiento puede encontrase en artículos recientes33–37.
La relación entre las distintas formas de asincronía del paciente con el respirador y su posible relación con el desarrollo de disnea, de alteraciones neurocognitivas tanto a corto como a medio plazo y la presencia de síndrome confusional durante el ingreso en Medicina Intensiva no es muy bien conocida. Estudios recientes demuestran que las asincronías paciente-ventilador pueden presentarse al inicio de la VM relacionadas con el nivel de sedación y al inicio de la liberación de la VM38. La presencia de asincronías se ha asociado a una mayor duración de la VM, mayor incidencia de traqueostomía, mayor estancia en la UCI y se ha sugerido un incremento de mortalidad34,35. Un estudio reciente de nuestro grupo donde se registraron de forma continua y durante todo el periodo de VM las asincronías paciente-ventilador demostró que estas acontecen en cualquier momento del día como de la estancia del paciente36. Por lo tanto, y al igual que la disnea, puede tratarse de un fenómeno muy infravalorado en Medicina Intensiva.
Factores asociados al desarrollo de disnea y asincronías paciente-ventilador son la ventilación a elevada presión transpulmonar, que puede darse tanto en respiración espontánea como asistida, el atrapamiento aéreo por limitación al flujo aéreo espiratorio y la disminución de los volúmenes pulmonares32,39. Aunque estas relaciones nacen de la fisiología básica aplicada al paciente con enfermedades respiratorias crónicas, es perfectamente extrapolable al enfermo en VM con elevado estímulo ventilatorio al inicio de una insuficiencia respiratoria grave, al paciente ventilado con excesivos volúmenes minuto y al paciente que debe interaccionar con un ventilador mecánico. Resulta interesante remarcar que la disnea resultante de la «falta de aire» (air hunger) asociada a la hipercapnia es más intensa que aquella que resulta de un trabajo respiratorio elevado en normocapnia40. Esta avidez de aire produce la activación de las vías aferentes, a través de quimio o barorreceptores, denotando un incremento de la señal en la resonancia magnética en las áreas cerebrales relacionadas con el sistema límbico y conlleva trastornos psicológicos, emocionales y alteraciones de memoria41.
El modelo neurofisiológico de respuesta al disconfort respiratorio (disnea) que puede acontecer en el enfermo crítico responde a estímulos neurales que alcanzan el córtex somatosensorial y proceden de distintos orígenes: 1) impulsos del tronco cerebral y centros corticales motores; 2) vías aferentes procedentes de mecanosensores respiratorios situados en los músculos respiratorios, el pulmón, la vía aérea y la caja torácica; 3) disminución de los reflejos inhibidores hacia el centro respiratorio desde el vago y las vías aferentes de los nervios intercostales como resultado de la ventilación protectora que limita el VT y 4) la activación del sistema límbico y paralímbico cuyo resultado es el desarrollo de un conjunto de alteraciones neuropsicológicas y delirio por parte del paciente crítico sometido a VM26,32,39,42.
Etiología, vías de señalización y mecanismos implicados en la interacción pulmón-cerebro durante la ventilación mecánicaDiversos autores han descrito el desarrollo de complicaciones pulmonares en pacientes con lesión cerebral aguda que se relacionan con un aumento en la susceptibilidad del pulmón a la VM43–45 y un incremento del riesgo de fallo respiratorio. Estos estudios avalan la existencia de un eje de comunicación cerebro-pulmón46–48 que podría estar relacionado con la liberación de catecolaminas, neurokininas y neuropéptidos.
La comunicación en sentido contrario, partiendo desde órganos periféricos, y en concreto del pulmón, hasta el sistema nervioso central (SNC) ha sido menos explorada, a pesar de que el deterioro cognitivo que se observa en el paciente crítico, a corto o a largo plazo, es una manifestación aguda cerebral secundaria a mecanismos patofisiológicos subyacentes cuyo origen puede situarse en la periferia.
La etiología de los déficits neurocognitivos observados tras la estancia en la UCI probablemente presenta una causa multifactorial21. Diferentes factores de riesgo como la hipoxemia15, el uso de sedantes y/o analgésicos, la hipotensión16, la desregularización de los niveles de glucosa en sangre, la duración de la VM49, el tiempo de estancia en la UCI y la presencia de síndrome confusional8,21 han sido asociados con los déficits neuropsicológicos descritos en los pacientes post-UCI. El aumento del nivel de citokinas y de indicadores inflamatorios también se ha relacionado con un aumento del déficit cognitivo y, más en concreto, con el déficit de memoria50. Por este motivo, la exploración de las vías de señalización implicadas en esta comunicación se sitúa entre las líneas de investigación más innovadoras en este campo.
Existe una relación causal entre los cambios en el consumo de oxígeno en el parénquima cerebral y el deterioro cognitivo y cabe tener en cuenta que la estrategia ventilatoria puede ocasionar modificaciones en el flujo sanguíneo regional y en la oxigenación cerebral. En este sentido Bickenbach et al.51,52 han descrito en un modelo porcino de LPA cómo la aplicación de la VM con VT bajo se traduce en una mejoría en el metabolismo y la oxigenación tisular cerebral sin analizar sus consecuencias a nivel cognitivo. También hay que destacar en este punto la asociación entre la hipoxia y las lesiones a nivel del hipocampo53. El hipocampo es la estructura cerebral más relacionada con la capacidad de aprendizaje y la memoria y, al mismo tiempo, es sabido que las neuronas del hipocampo son las más vulnerables a la hipoxia54,55. No solo la hipoxia conlleva alteraciones neuro-patológicas, también existe evidencia de que el SDRA y la LPA pueden provocar alteraciones estructurales en el hipocampo, con el consiguiente déficit de memoria secundario, y con independencia del grado de hipoxemia56. Además, se han descrito otras alteraciones estructurales en el cerebro entre las cuales destacan el aumento del tamaño ventricular y la atrofia generalizada57. Todas estas lesiones estructurales han sido relacionadas con el déficit neuropsicológico a largo plazo observado en los supervivientes de la UCI58.
Múltiples estudios clínicos y experimentales han demostrado que la VM per se desencadena una respuesta biológica que cursa con infiltración de monocitos y macrófagos y liberación de mediadores inflamatorios que puede agravar la lesión pulmonar y favorecer la propagación a órganos distales. La encefalopatía séptica ha sido ampliamente estudiada59,60 y algunos autores han sugerido que puede cursar por mecanismos comunes a la disfunción cerebral observada en pacientes con LPA y SDRA, tanto por sus similitudes mecanísticas como epidemiológicas («sepsis-like syndrome»)61.
A pesar de ello, las vías intrínsecas a través de las cuales los mediadores inflamatorios pueden ejercer sus efectos deletéreos en otros órganos y, en concreto, las vías de comunicación pulmón-cerebro son aun desconocidas. Durante la VM se produce una estimulación de los mecanorreceptores (barorreceptores/receptores de estiramiento) o quimiorreceptores ubicados en el pulmón cuya información alcanza el SNC por diversas vías62. El uso de una estrategia ventilatoria inadecuada desencadena la liberación de determinados mediadores inflamatorios43 o metabolitos al torrente sanguíneo que es detectada por el SNC62.
El cerebro puede responder alterando la permeabilidad de la barrera hematoencefálica (BHE)46 o modificando el flujo sanguíneo cerebral. Estos mismos estímulos también pueden ocasionar alteraciones neuronales. En un primer abordaje, Quilez et al.63 evaluaron la activación neuronal en un modelo de VM lesiva en ratas. En ese trabajo los autores analizaron los niveles del factor de transcripción de c-fos, miembro de la familia de los genes de expresión temprana y considerado marcador rápido de activación neuronal, para valorar cambios neuronales tempranos que podrían estar asociados con la LPA inducida por la VM en diversas áreas cerebrales. Los autores no encontraron grandes diferencias en la respuesta inflamatoria o en la función pulmonar entre los grupos ventilados con VT elevado y VT bajo. Sin embargo, los animales ventilados con alto VT presentaron mayor expresión de la proteína c-fos en determinadas áreas cerebrales, lo cual sugiere un papel sinergístico del volumen elevado y subraya la importancia que puede tener la estrategia ventilatoria más allá de su efecto directo sobre el pulmón63.
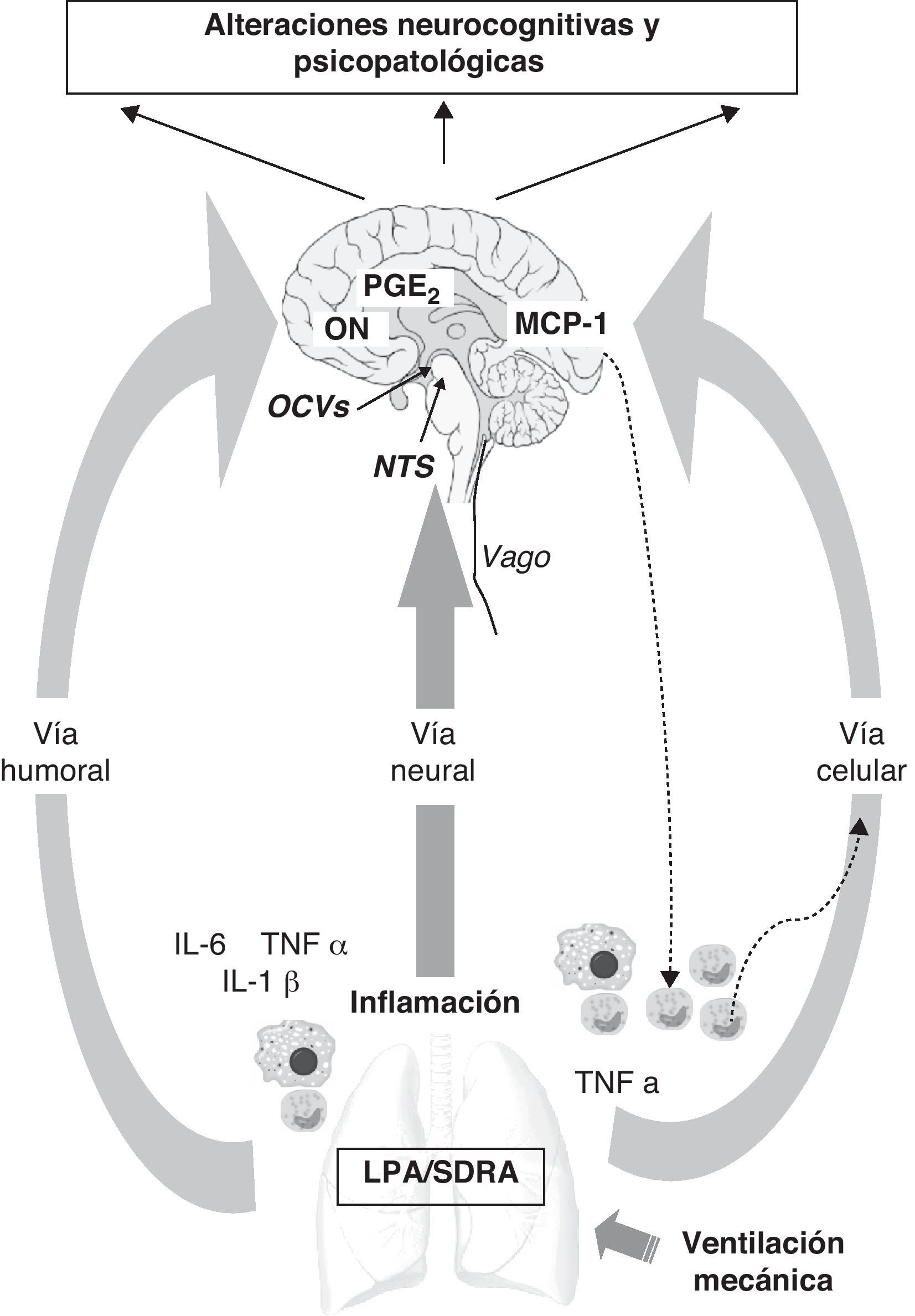
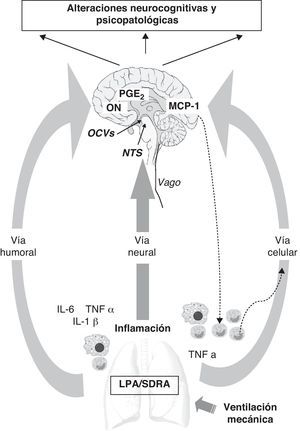
Las vías de comunicación entre la periferia y el SNC64–66, y viceversa, son diversas (fig. 1). En primer lugar cabría destacar la vía humoral, a través de la cual los mediadores inflamatorios, la interleuquina-6 (IL-6), el factor de necrosis tumoral α (TNFα) e IL-1β, generados por el reclutamiento de monocitos o macrófagos en la periferia, podrían alcanzar directamente el cerebro. La BHE funciona como una barrera protectora y es impermeable a una gran mayoría de moléculas, incluidas las células del sistema inmune66,67, pero los mediadores pueden alcanzar el cerebro a través de los órganos circunventriculares (OCV) o el plexo coroideo68–70 que están desprovistos de BHE (fig. 1). Pulmón y cerebro comparten idénticos mediadores inflamatorios y estos, al ser liberados a la circulación, pueden también entrar en contacto con el cerebro a través de la interacción con receptores específicos a nivel del SNC. En esta primera vía también coexisten mecanismos de transporte activo, así como otros relacionados con la activación directa del endotelio cerebral y que generan liberación de prostaglandina E2 (PGE2) y de óxido nítrico (ON) (fig. 1).
Vías de comunicación entre la periferia (pulmón) y el sistema nervioso central (SNC) durante la ventilación mecánica. El sistema nervioso central recibe información de la periferia del organismo a través de 3 vías: humoral, neural y celular. 1) El reclutamiento de monocitos o macrófagos en el pulmón incrementa los niveles de mediadores inflamatorios (IL-6, TNFα, IL-1β) que por vía humoral pueden alcanzar directamente el SNC a través de los órganos circumventriculares (OCV) sin necesidad de atravesar la barrera hematoencefálica (BHE). También coexisten otros mecanismos de transporte activo que generan liberación de PGE2 y de óxido nítrico a nivel cerebral. 2) Las aferencias de la vía vagal alcanzan el cerebro a través del núcleo del tracto solitario (NTS). 3) La vía celular está directamente regulada por la liberación del TNFα en el pulmón que estimula la liberación de MCP-1 a nivel cerebral, que a su vez es capaz de aumentar el reclutamiento de monocitos activados tanto a nivel del SNC como de la periferia.
Estos mismos mediadores inflamatorios pueden estimular el nervio vago (vía neural) cuyas aferencias llegan a alcanzar el cerebro a nivel del núcleo del tracto solitario (NTS)70,71. Por lo tanto, el sistema nervioso autónomo también debería ser considerado en este crosstalk neuroimmune ya que la vía colinérgica antiinflamatoria72 puede controlar a su vez la respuesta inflamatoria sistémica. Con el objeto de profundizar en el papel de esta vía Dos Santos et al. realizaron un estudio experimental73 donde demostraron que, así como la inhibición del vago potenciaba la LPA, la estimulación del reflejo colinérgico antiinflamatorio reducía la misma. Estos autores proponen la estimulación vagal como tratamiento alternativo para los pacientes ventilados de LPA/SDRA72,73, aunque sus efectos a nivel del SNC no han sido explorados.
Aún hay que mencionar una tercera vía que está directamente regulada por la liberación del TNFα (vía celular) a nivel periférico, que genera la liberación de proteína quimiotáctica de monocitos-1 (MCP-1) a nivel cerebral74 y que retroalimenta el reclutamiento de monocitos activados tanto a nivel cerebral como periférico multiplicando la respuesta.
ConclusionesEl paciente crítico sometido a VM está expuesto a sufrir alteraciones pulmonares y cerebrales que van más allá de las propias de la enfermedad que ha provocado su ingreso en el Servicio de Medicina Intensiva. La etiología de los déficits neurocognitivos observados tras la estancia en la UCI es multifactorial. A falta de métodos diagnósticos más específicos, los profesionales al cuidado de estos enfermos deben tener los conocimientos fisiológicos necesarios para definir aquellas intervenciones terapéuticas que minimicen los daños pulmonares y cerebrales añadidos a su enfermedad original. Es necesaria una optimización del patrón ventilatorio enfocada a buscar tanto la eficiencia de la ventilación como de la interacción paciente-ventilador, lo que conducirá a minimizar las alteraciones neurocognitivas antes descritas. La aplicación de una visión integradora durante el manejo del paciente crítico garantizará que las intervenciones que se realizan no tengan efectos deletéreos que puedan producir secuelas a corto, medio o largo plazo.
FinanciaciónFundació La Marató de TV3 (exp.112810), Proyecto Neurocontent: IPT-300000-2010-030 (Ministerio de Ciencia e Innovación), Fundación MAPFRE, Fundació Parc Taulí.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.