Artículo: Reinhart K, Menges T, Gardlund B, Zwaveling JH, Smithes M, Vincent JL, et al, for the AFELIMOMAB Sepsis Study Group.
Randomized, placebo-controlled trial of the anti-tumor necrosis factor antibody fragment afelimomab in hyperinflammatory response during severe sepsis: the RAMSES Study. Crit Care Med 2001;29:765-9.
Antecedentes: el TNF-α es una citocina proinflamatoria identificada como un mediador de la sepsis. Se ha sugerido que una excesiva actividad de este factor podría ocasionar una lesión tisular grave y un fracaso orgánico potencialmente mortal.
El afelimomab se une al TNF-α humano con alta especificidad y afinidad, neutralizando los efectos biológicos del TNF-α humano in vitro e in vivo.
Las concentraciones séricas de TNF-αen el momento del diagnóstico de sepsis no se relacionan de un modo reproducible con la gravedad.
Sin embargo, se ha mostrado que los valores séricos de interleucina (IL)-6 se asocian positivamente con la mortalidad.
Objetivo: estimar la eficacia y la seguridad de afelimomab en los pacientes con sepsis grave y concentraciones séricas de IL-6 ≥ 1.000 pg/ml.
Diseño: ensayo clínico con asignación aleatoria.
Lugar: 86 centros de Europa e Israel.
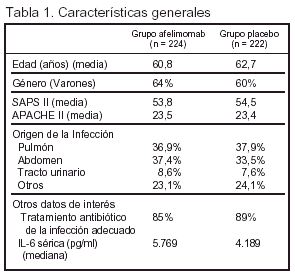
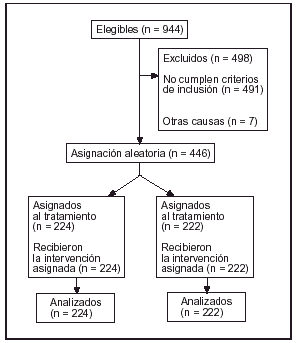
Pacientes (tabla 1) (fig. 1)
Figura 1
Criterios de Inclusión: edad < 18 años; sospecha de sepsis secundaria a infección; que dentro de las 24 h posteriores presenta evidencia clínica de infección aguda; hipertermia o hipotermia; taquicardia, taquipnea o necesidad de ventilación mecánica; hipotensión; signos de disfunción o mala perfusión de ≥ 2 órganos, y concentración sérica de IL-6 ≥ 1.000 pg/ml.
Criterios de exclusión: 1. Tratamiento previo con proteínas murinas. 2. Tratamiento con medicamentos anticitocinas en los 28 días anteriores. 3. Esperanza de vida < 2 meses. 4. Tratamiento con hidrocortisona a dosis ≥ 0,5 mg/kg/día en las 2 semanas anteriores. 5. Antecedentes de hipersensibilidad a las proteínas murinas o a la albúmina. 6. Embarazo o lactancia. 7. Tratamiento inmunosupresor. 8. Quemaduras > 30% de la superficie corporal. 9. Orden de no resucitación. 10. Peso > 100 kg.
Intervenciones que se comparan: Grupo tratamiento: afelimomab 1 mg/kg/8 h durante 3 días infundido durante 15 min. Grupo control: placebo.
Asignación aleatoria: sí. No se explica en el texto si la asignación se mantuvo oculta.
Enmascaramiento: sí.
Desenlaces principales: mortalidad a los 28 días.
Análisis por intención de tratar: sí.
Resultados principales (tablas 2 y 3)
El estudio se suspendió tras el primer análisis intermedio, dada la escasa diferencia de mortalidad entre los 2 grupos.
Información sobre costes: no consta.
Financiación del estudio: Knoll, AG.
Conclusiones de los autores: no se ha demostrado el efecto beneficioso sobre la mortalidad del afelimomab.
Conclusiones de los revisores: las conclusiones están de acuerdo con los resultados del estudio.
La población de estudio presenta una mortalidad en el grupo placebo en el rango alto de la descrita en la sepsis.