Artículo: Bernard GR, Vincent JL, Laterre PF, LaRosa SP, Dhainaut JF, López-Rodríguez A, et al, for the Recombinant Human Activated Protein C Worldwide Evaluation in Severe Sepsis (PROWESS) Study Group. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med 2001;344: 699-709.
Antecedentes: la proteína C activada es una proteína que favorece la fibrinólisis e inhibe la trombosis y la inflamación. Sus valores están disminuidos en la mayoría de los pacientes con sepsis. Se ha descrito que la reducción de las cifras de proteína C activada en los pacientes con sepsis se asocia con un incremento de la mortalidad. En modelos experimentales de sepsis grave se ha mostrado la reducción de la mortalidad tras la administración de proteína C activada recombinante.
Objetivo: evaluar el efecto sobre la mortalidad a los 28 días y la seguridad de drotrecogina alfa activada en los pacientes con sepsis grave.
Diseño: ensayo clínico con asignación aleatoria.
Lugar: 164 centros en 11 países.
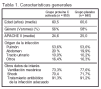
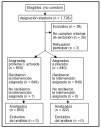
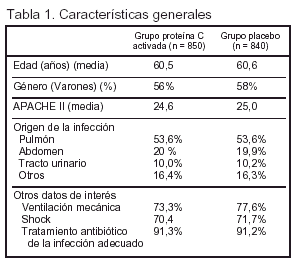
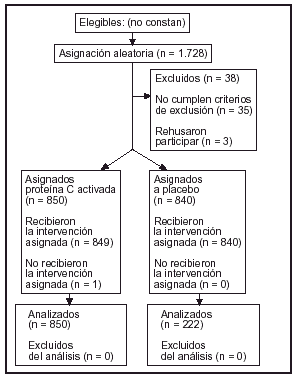
Pacientes (tabla 1 y fig. 1)
Figura 1
Criterios de Inclusión: edad < 18 años; sospecha clínica de infección; (en las 24 h anteriores) ≥ 3 signos de inflamación sistémica; ≤ 1 disfunción orgánica inducida por la sepsis con una duración < 24 h.
Criterios de Exclusión: 1. Embarazo. 2. Peso > 135 kg. 3. Plaquetas < 30.000 μl. 4. Riesgo de hemorragia. 5. Estado de hipercoagulabilidad. 6. Inmunodeficiencia. 7. Trasplantes de médula ósea, pulmón, hígado, páncreas o intestino delgado. 8. Insuficiencia renal crónica en diálisis. 9. Pancreatitis aguda sin foco de infección conocido. 10. Medicamentos a dosis anticoagulantes o antiagregantes o antitrombina III en las 12 h anteriores, o proteína C en las 24 h anteriores. 11. Limitación del esfuerzo terapéutico.
Intervenciones que se comparan:
Grupo tratamiento: drotrecogina alfa activada 24 μg/kg/h durante 96 h en perfusión intravenosa continua.
Grupo control: placebo.
Asignación aleatoria: sí. Oculta.
Enmascaramiento: sí.
Desenlaces principales: mortalidad a los 28 días. Efectos adversos mayores (no están definidos).
Análisis por intención de tratar: sí.
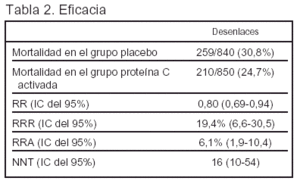
Resultados principales (tablas 2 y 3)
Información sobre costes: no consta.
Financiación del estudio: Eli Lilly.
Conclusiones de los autores: la administración de drotrecogina alfa activada reduce significativamente la mortalidad con una incidencia de efectos adversos aceptable en este grupo de pacientes.
Conclusiones de los revisores: las conclusiones de los autores están suficientemente fundadas en los resultados.
La población a la que potencialmente se pudieran aplicar los beneficios de la proteína C activada está limitada por los criterios de inclusión (sepsis grave) y de exclusión (patologías y medicamentos frecuentemente encontrados en pacientes sépticos graves). El artículo no informa sobre el número de pacientes elegibles, lo que aumenta la dificultad para conocer la población que potencialmente se beneficiaría de este tratamiento.
La mortalidad en el grupo placebo está en el rango inferior de la descrita en los pacientes con sepsis.
Otras referencias
Abraham E, Anzueto A, Gutiérrez G, Tessler S, San Pedro G, Wunderink R, et al. Double-blind randomised controlled trial of monoclonal antibody to human tumour necrosis factor in treatment of septic shock. NORASEPT II Study Group. Lancet 1998;351:929-33.
Natanson C, Esposito CJ, Banks SM. The sirens' songs of confirmatory sepsis trials: selection bias and sampling error. Crit Care Med 1998;26:1927-31.
Sprung CL, Finch RG, Thijs LG, Glauser MP. International sepsis trial (INTERSEPT): role and impact of a Clinical Evaluation Committee. Crit Care Med 1996;24:1441-7.
Glosario
RR (riesgo relativo): es el cociente entre el riesgo de presentar el desenlace en el grupo tratado dividido por el riesgo de presentar el desenlace en el grupo control. RRR (reducción del riesgo relativo): es la reducción proporcional en la incidencia de un desenlace expresada en porcentaje. Se calcula (1-RR) *100%. RRA (reducción del riesgo absoluto): es la diferencia entre el riesgo en el grupo control menos el riesgo en el grupo tratado, expresada en porcentajes. Se calcula (Rc Rt) *100. NNT (número necesario para tratar): es el número de pacientes que hay que tratar para prevenir un desenlace. Se calcula 100/RRA.