La glutamina es el aminoácido no esencial más abundante del organismo y está implicada en numerosos procesos del metabolismo intermediario. Los depósitos de glutamina pueden vaciarse en determinadas situaciones clínicas catabólicas y ello se ha asociado a alteraciones del balance nitrogenado y de disminución de la síntesis proteica, a un descenso de la función inmunológica, a cambios estructurales de la membrana intestinal y de su permeabilidad, y a un deterioro de la sensibilidad a la insulina. En algunas circunstancias puede incluso reducir el tiempo de hospitalización y la morbimortalidad. Por ello, se ha definido la glutamina como un aminoácido «condicionalmente esencial»1. La esencialidad dietética de un sustrato depende de la relación entre oferta y demanda. Independientemente de la clasificación utilizada, el juicio acerca de la esencialidad de un nuevo sustrato debe basarse en criterios de eficacia clínica y nutricional. Está demostrado que los niveles plasmáticos de glutamina están bajos en lo enfermos graves ingresados en Unidades de Cuidados Intensivos (UCI) y que dicho descenso se correlaciona con la mortalidad2. En este artículo discutiremos el papel de la glutamina en el metabolismo intermediario y cómo afecta el descenso de sus niveles a la función inmune, a la función de barrera de la mucosa intestinal, a su potencial antioxidativo y a los efectos reguladores sobre el metabolismo de la glucosa dependiente de la insulina. Asimismo, valoraremos los resultados de los últimos estudios clínicos publicados en el paciente grave.
METABOLISMO DE LA GLUTAMINA
La glutamina es un aminoácido no esencial con una composición característica, ya que presenta dos cadenas nitrogenadas (un grupo amino y otro amido). Es el aminoácido más abundante en la sangre y en el músculo estriado, con un gradiente intracelular marcado, de modo que la concentración intracelular de glutamina es 30 veces superior a la plasmática. El mantenimiento de este gradiente tiene implicaciones fisiológicas importantes: existe un mecanismo activo de transporte a través de membranas, distintos órganos tienen diferentes concentraciones intracelulares de glutamina y en condiciones de estrés o enfermedad este gradiente puede disminuir. La glutamina está involucrada en numerosas vías metabólicas en distintos órganos y sistemas; en el metabolismo intermediario celular, participa en el ciclo de Krebs como donante de grupos hidrocarbonados. Para ello, se hidroliza liberando amonio (procedente del grupo amino), transformándose en glutamato. Éste se transforma en *-cetoglutarato, liberando el amonio del grupo amido, y entrando en el ciclo de los ácidos tricarboxílicos. De todo ello se deduce la participación de la glutamina en numerosos procesos bioquímicos:
1. Es una fuente energética primordial, donando cadenas hidrocarbonadas sobre todo en músculo, linfocitos, riñón y células epiteliales intestinales.
2. Participa como sustrato primordial en la neoglucogénesis hepática a la vez que forma parte del ciclo de la urea.
3. La generación de amonio permite sintetizar otros aminoácidos, como la alanina y el aspartato, mediante reacciones de transaminación en músculo, intestino e hígado.
4. La desaminación de glutamato genera nicotin adenosin dehydrogenase (NADPH), involucrado en la regeneración del glutatión.
5. Junto con la alanina es el transportador de nitrógeno al riñón.
Por todo ello, la glutamina se ha considerado como el aminoácido más versátil de la fisiología humana y de ahí su importancia como nutriente3. La síntesis y degradación de la glutamina está regulada por dos enzimas, la glutaminasa, que cataliza la hidrólisis de glutamina a glutamato y amonio, y la sintetasa de glutamina, a partir de glutámico y amonio. Muchos órganos son consumidores netos de glutamina (mucosa intestinal, linfocitos y células tubulares renales), otros son productores netos como el músculo esquelético, las neuronas o el tejido pulmonar. Mención aparte merece el hígado, que puede ser productor o consumidor en función de las demandas extrahepáticas4. Los flujos de glutamina entre órganos y sistemas se modifican en función del estado clínico del sujeto. En condiciones normales, la glutamina sintetizada en el músculo estriado es captada por el intestino (tanto por la mucosa intestinal como por el tejido linfoide) y, en menor proporción, por el hígado. El ejercicio extenuante, el estrés quirúrgico y el uso de corticoides producen un incremento de la captación de glutamina por el intestino, mientras que se incrementa la síntesis de la misma en el músculo estriado y los pulmones. Ello hace que los niveles plasmáticos de glutamina se mantengan o disminuyan sólo transitoriamente. Por el contrario, si la enfermedad es grave o si aparece infección, se produce un fenómeno distinto. El hígado se convierte en el primer consumidor de glutamina, a costa del intestino, y el músculo estriado, junto con el riñón y el pulmón, son sintetizadores netos de glutamina. Finalmente, se produce una depleción de glutamina en dichos órganos y una disminución de sus niveles plasmáticos. Mientras que en condiciones de estrés quirúrgico y ejercicio la captación de glutamina está regulada por la respuesta hormonal, básicamente por los corticoides, en la infección el desvío de los flujos de glutamina se debe a la intervención de las citoquinas que modifican la capacidad de captación hepática e intestinal5.
LA GLUTAMINA EN LA ENFERMEDAD GRAVE
Como hemos visto, la respuesta metabólica al estrés, en particular la infección, puede producir una disrupción de la homeostasis de la glutamina. Ello se ve favorecido por la existencia de un pobre estado nutricional previo y el uso de corticoides, así como del ayuno al que puede estar sometido un paciente grave. Se ha demostrado que la concentración plasmática de glutamina disminuye tras la cirugía6, la sepsis7, un trauma mayor8, o una quemadura grave9. Esta disminución de los niveles plasmáticos se ha correlacionado con un aumento de la mortalidad1.
La glutamina es un sustrato energético básico para los linfocitos y los macrófagos y es un precursor de los nucleótidos. La actividad fagocítica aumenta de forma dosis-dependiente a la administración de glutamina10 y mejora la apoptosis11. Este efecto dosis-dependiente también aparece cuando se mide la expresión de HSP (heat shock proteins)12. Diversos estudios han demostrado que la administración de glutamina mejora la funcionalidad de los linfocitos y su respuesta tras un trasplante autólogo de médula ósea13. La glutamina tiene una actividad similar en la mucosa intestinal y el tejido linfoide asociado. Estudios experimentales han demostrado que los niveles bajos de glutamina se asocian con un aumento de la permeabilidad intestinal y un deterioro de la estructura microscópica de la mucosa y con un aumento de la translocación bacteriana14,15. Además está demostrado que la glutamina es un sustrato energético primario para las células epiteliales de la mucosa, incluso cuando procede de la luz intestinal y tiene efectos reguladores sobre la proliferación y diferenciación de las mismas16. Sin embargo, estos hallazgos no se han podido corroborar en estudios clínicos17,18.
La glutamina es uno de los precursores del glutatión, que se encuentra en concentraciones elevadas en las células de los mamíferos y que es el neutralizador endógeno de radicales libres de oxígeno más potente que se conoce. La depleción de glutamina se asocia a una disminución de los niveles intracelulares de glutatión, cuya reposición se consigue aportando glutamina exógena19. De igual modo, la taurina depende de los niveles plasmáticos de glutamina y la administración de la misma los normaliza. La taurina desempeña un papel importante en la captación de oxidantes clorados y tiene un efecto osmorregulador celular20. La lesión intestinal por isquemia-reperfusión aparece con frecuencia en situaciones clínicas graves, tras un shock de cualquier etiología, en el trauma y las grandes quemaduras y tras la cirugía. La administración de glutamina puede mejorar la capacidad de quelar radicales libres de oxígeno e incluso de inhibir la expresión de la sintetasa de óxido nítrico inducible (iNOS), aunque los estudios experimentales han revelado datos contradictorios21,22.
También se ha asociado la administración de glutamina con un mejor control de la glucemia mediada por insulina23. La glutamina es el sustrato primordial para la neoglucogénesis en el hígado, intestino y riñón. Parece ser que la administración de glutamina mejora la sensibilidad a la insulina y se suprime la neoglucogénesis intestinal24,25. Estos hallazgos son limitados por el momento y no permiten determinar la eficacia real de la glutamina sobre la resistencia a la insulina.
USO CLÍNICO DE LA GLUTAMINA
Desde los primeros datos clínicos publicados26 son muchos los ensayos clínicos que intentan demostrar la utilidad de la glutamina en los enfermos críticos. A pesar de ello quedan interrogantes por dilucidar, sobre todo respecto a las dosis a emplear, en qué situaciones clínicas se han demostrado efectos verdaderamente positivos y cuál es la vía de administración más eficaz, la suplementación enteral o la administración por vía parenteral.
En un estudio de 363 pacientes se administró por vía enteral una dosis diaria de 19 g de glutamina27. Se trataba de un estudio ciego para el enfermo, el médico y la enfermera. Los pacientes tenían un Apache II medio de 14, y no demostraron cambios en los objetivos primarios y secundarios entre el grupo de estudio y el grupo control, concluyendo que la glutamina administrada a bajas dosis no tenía beneficios en los enfermos graves. Al mismo tiempo, otro estudio prospectivo y con asignación aleatoria que empleó dosis altas de glutamina, 30 g día, administrada por vía parenteral en 144 enfermos que recibían nutrición parenteral (NPT), demostró un aumento de supervivencia a los 6 meses en el grupo que había recibido glutamina durante 9 días28. En un metaanálisis reciente en el que se analizan 14 estudios con asignación aleatoria, la dosis media de glutamina empleada fue de 0,31 g/kg y sólo se demostró efecto sobre la reducción de la tasa de infecciones y mortalidad en el grupo de enfermos quirúrgicos29. En otra revisión sistemática se concluye que las dosis recomendadas para pacientes críticos deberían oscilar entre 15-25 g día durante un mínimo de 5 días30. Dos estudios de aparición reciente, uno comparativo, randomizado y ciego con dipéptido de glutamina a dosis de 0,5 g/kg en enfermos críticos con nutrición parenteral, consigue demostrar una reducción de las complicaciones infecciosas y una mejor tolerancia metabólica en el sentido de un mejor control de la glucemia31. Al contrario, el otro estudio realizado en enfermos traumáticos y quirúrgicos graves nutridos por vía enteral, con tres grupos distintos de intervención nutricional, uno con dieta estándar, otro con dieta estándar más 0,6 g/kg de glutamina y otro con dieta inmunomoduladora más 0,6 g de glutamina, no demuestra mejoría en la mortalidad ni en los objetivos secundarios planteados32.
También están en discusión las indicaciones de uso de la glutamina en enfermos críticos, aunque en casos concretos parece que existe un claro efecto beneficioso. Así, los metaanálisis y revisiones sistemáticas demuestran efectos beneficiosos sobre la mortalidad, estancia media y complicaciones infecciosas con la administración de glutamina en enfermos quirúrgicos graves, traumáticos y quemados29,30,33. En las guías ESPEN de nutrición enteral recientemente publicadas se establece que la glutamina puede ser añadida a las preparaciones de nutrición enteral en enfermos quemados y traumáticos con un grado A de recomendación, y no hay datos suficientes para que sea administrada en una población heterogénea de enfermos críticos34.
Otro interesante aspecto del uso de glutamina es la vía por la que debe administrarse. Inicialmente, parecía que la administración de glutamina por vía enteral ofrecía mayores ventajas al considerar que podía tener un efecto local sobre el enterocito, y ofrecía una mayor estabilidad en las mezclas, pero los estudios clínicos y experimentales indican una mayor eficacia de la administración de dipéptidos de glutamina en nutrición parenteral. El metaanálisis anteriormente citado29 concluye que la administración por vía parenteral de glutamina disminuye la mortalidad y la estancia hospitalaria, pero esta opinión es difícil de sostener, ya que los trabajos que se analizan comparan los enfermos tratados con nutrición enteral más glutamina con un grupo control tratado con nutrición enteral, y los enfermos tratados con NPT más glutamina, con un grupo control tratado con NPT. En resumen, hay evidencias de que tanto la glutamina administrada por vía enteral como por vía parenteral son efectivas para contener la depleción sistémica de este aminoácido que se produce en el enfermo grave. La administración enteral facilitaría su disponibilidad en el área esplácnica y la administración parenteral suministraría glutamina a todo el organismo.
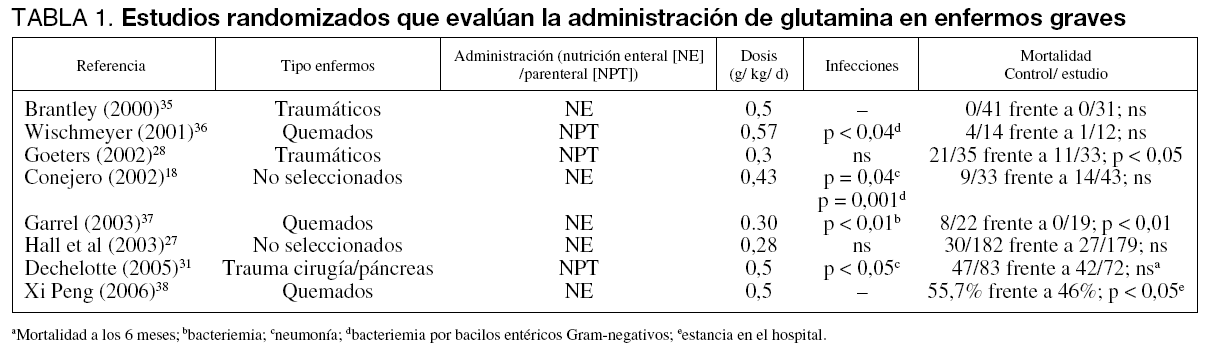
En la tabla 1 se muestran los estudios más relevantes publicados desde el año 2000 y que han sido repetidamente analizados en la literatura. Los resultados apoyan, en general, la hipótesis de que la glutamina puede mejorar los desenlaces de los pacientes graves, sobre todo reducir las infecciones nosocomiales. Más difícil es demostrar una disminución de la mortalidad que sólo aparece en un estudio. Como se puede apreciar, todos estos estudios adolecen de homogeneidad en el tipo de pacientes estudiados, en la dosis administrada y en la vía de administración. Parece claro que dosis de glutamina por encima de 0,5 g/kg/día administradas por vía parenteral tienen un efecto beneficioso mayor que dosis menores. Respecto a la vía de administración, es preciso recordar que la glutamina es un sustrato energético de la mucosa intestinal donde es metabolizada y no absorbida, por ello los mejores resultados se consiguen en aquellos estudios que emplean dosis más altas.
La glutamina es un sustrato prometedor y puede convertirse en el primer farmaconutriente con eficacia demostrada. Necesitamos conocer más de su farmacocinética en los enfermos graves para determinar la dosis más eficaz. Lógicamente, las dosis empleadas deben ser las suficientes para normalizar los niveles plasmáticos. A nivel práctico parece que son necesarias dosis superiores a 20 g/día o 0,5 g/ kg/día para normalizar dichos niveles. Por otro lado, la vía parenteral es más fiable que la enteral, debido a que no se producen pérdidas por la utilización de la glutamina como sustrato energético de las células de la mucosa intestinal. Sin embargo, la vía enteral puede ser más útil para restaurar la funcionalidad de la misma, en el caso de las mucositis o en la lesión intestinal por isquemia-reperfusión. Existen poblaciones de pacientes en las que se ha demostrado un beneficio claro, como es el caso de los pacientes quirúrgicos, traumáticos y aquellos sometidos a un trasplante autólogo de médula ósea. Existen en la actualidad dos estudios multicéntricos en marcha, uno escandinavo y otro español, que quizá aporten más datos en poblaciones heterogéneas de pacientes graves.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Correspondencia: Dr. A. Bonet.
Servicio de Medicina Intensiva.
Hospital Universitario de Girona Doctor Josep Trueta.
Carretera de Francia, s/n.
17007 Girona. España.
Correo electrónico: Uci.abonet@htrueta.scs.es
Manuscrito aceptado el 31-VIII-2006.