INTRODUCCIÓN
La proteinosis alveolar pulmonar (PAP) es una enfermedad infrecuente que se caracteriza por el cúmulo de material proteináceo dentro de los alveolos (presencia masiva de eosinófilos, material PAS-positivo en el alveolo y un exceso de componentes en el surfactante)1-3.
Estimaciones recientes sugieren una incidencia de 1:2.000.000 personas. Se da con más frecuencia en la tercera-cuarta década de la vida (80%)4. Podría presentarse en el período neonatal o en fases más tardías de la vida. Esta enfermedad puede ser consecuencia de un defecto genético, infecciones, tumores, exposición a polvo o el uso de ciertas drogas. En muchos casos, sin embargo, se presenta como una entidad aislada y sin una causa clara; lo que es conocido como proteinosis alveolar idiopática. La patogénesis de ésta sigue siendo controvertida, permaneciendo abiertas varias cuestiones sobre el cúmulo de surfactante en el alveolo: ¿se produce por un incremento de la secreción o a un descenso del aclaramiento desde los alveolos?, ¿se debe a un defecto localizado en los neumocitos tipo II o en otras células como los macrófagos? y/o ¿es consecuencia de una alteración en la composición del surfactante?5,6.
La homeostasis del surfactante es anormal y experimentos animales han sugerido que esto podría estar relacionado, en algunos casos al menos, con defectos en la señalización del GM-CSF4. La proteína A es la glucoproteína predominante que se asocia a los fosfolípidos del surfactante, y es específica del pulmón7.
La biopsia abierta de pulmón ha sido el medio tradicional del diagnóstico definitivo de la PAP, pero el lavado broncoalveolar y la biopsia transbronquial están sustituyendo en gran parte este procedimiento invasivo, sobre todo cuando se suman a las imágenes obtenidas con la tomografía axial computarizada (TAC)8,9.
El lavado broncoalveolar pulmonar es la forma más efectiva y segura de tratamiento para la PAP4. La técnica fue descrita por Ramírez et al en 1963 estableciendo este tratamiento sólo para casos graves. La restauración de la función pulmonar se debe parcialmente al vaciamiento mecánico de las vías aéreas3.
CASO CLÍNICO
Se trata de un varón de 31 años, fumador de 30 cigarrillos al día sin otros antecedentes de interés, que ingresó en el Servicio de Urgencias refiriendo pérdida de peso (aproximadamente 10 kg), astenia y tos seca durante los últimos 6 meses. Diez días antes del ingreso comenzó con fiebre de hasta 39º C, mialgias generalizadas y disnea de moderados esfuerzos.
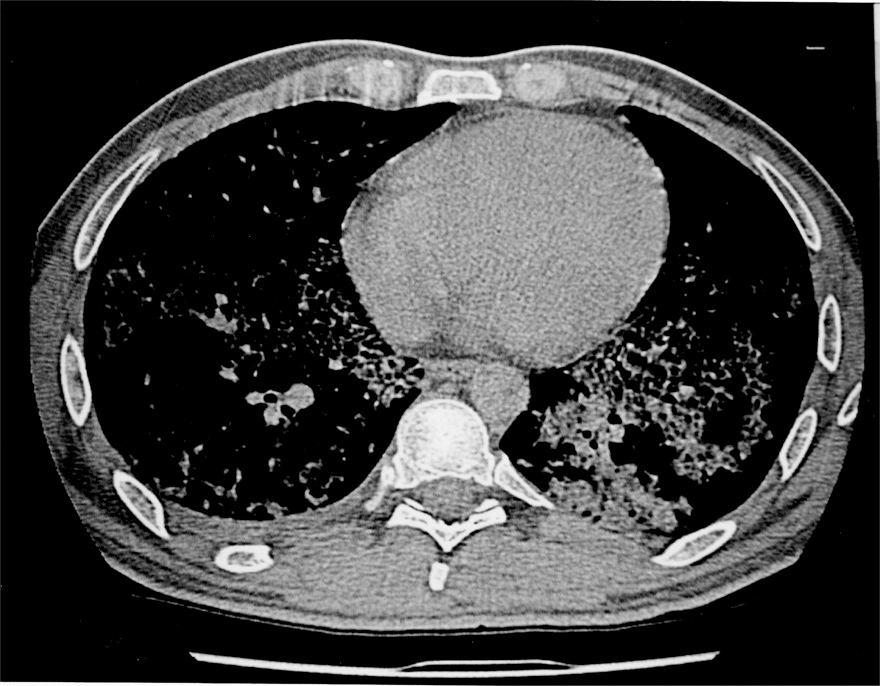
En la analítica de ingreso destaca una presión arterial de oxígeno (PaO2) basal de 63 mmHg; velocidad de sedimentación globular: 92 mm/h; recuento de leucocitos de 9.300 l/mm3 (73% neutrófilos); lacticodeshidrogenasa (LDH): 957 mg/dl, y fibrinógeno: 954 mg/dl. En la radiografía de tórax se observa infiltrado intersticio-alveolar difuso bilateral sobre el parénquima pulmonar. En la TAC torácica se observa una gran afectación del parénquima pulmonar con áreas de afectación alveolar, zonas simétricas y bilaterales de opacidad en vidrio deslustrado y adenopatías en hilio pulmonar, paratraqueales y por debajo de la carina (fig. 1). Al paciente se le realizó una biopsia transbronquial que fue inespecífica. Se le realizó una biopsia pulmonar en quirófano que muestra en el estudio histológico que se trata de una proteinosis alveolar. El estudio microbiológico de la biopsia aisla una Nocardia sp. Quince días después del ingreso el paciente presenta empeoramiento clínico con gran aumento de la disnea, hipoxia y empeoramiento del gradiente alveolo-arterial. Dada la situación clínica se decide realizarle un lavado broncoalveolar bilateral.
Figura 1. Imagen de la tomografía axial computarizada (TAC) torácica en donde se observa la afectación pulmonar del paciente antes de realizar el lavado broncoalveolar. En ella se aprecia una mayor afectación del pulmón izquierdo; ésa es la razón por la que el lavado se inicia por este pulmón.
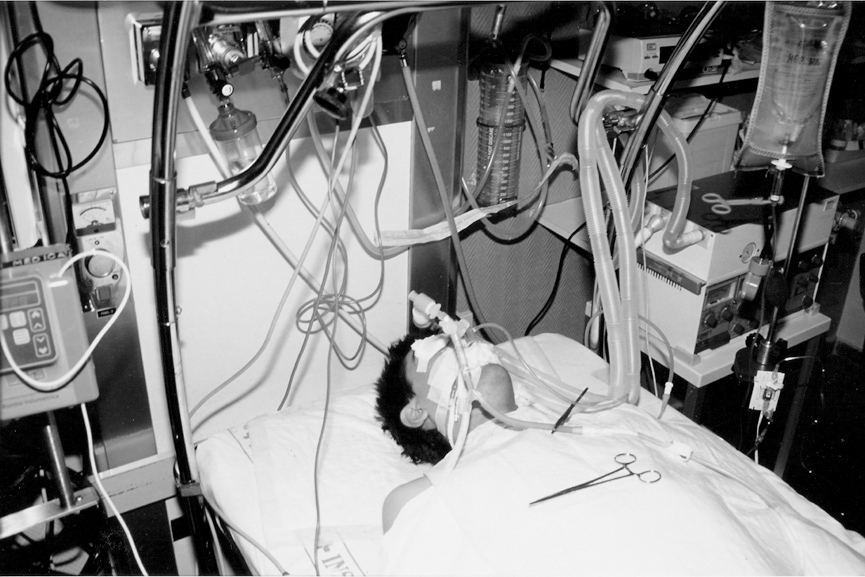
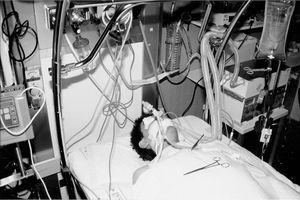
Previamente a la intubación orotraqueal sedamos al paciente con propofol, lo analgesiamos con fentanilo y lo relajamos con succinilcolina. La intubación la realizamos con un tubo de doble luz tipo Mallinckrodt 39F izquierdo (fig. 2). Comprobamos la localización del tubo por medio de fibrobroncoscopio pediátrico. Posteriormente le mantuvimos sedado y relajado con perfusión continua de propofol y cisatracurium.
Figura 2. Se observa al paciente una vez intubado y conectado a ventilación mecánica. En esta fotografía se puede observar cómo se ha iniciado ya el lavado del pulmón izquierdo.
Ventilamos al paciente inicialmente durante 30 minutos en presión control, con fracción inspirada de oxígeno (FiO2) de 100%, presión positiva al final de la espiración (PEEP) de 6 cm H2O, presión máxima de 30 cm H2O y frecuencia respiratoria de 12. El paciente realizaba volúmenes corrientes de 800 ml (volumen/minuto de 10 lpm) y su oxigenación fue del 96%.
Posteriormente nosotros medimos la compliance estática de cada pulmón (25 ml/cm H2O en el pulmón derecho y 15 ml/cm H2O en el pulmón izquierdo), por lo que decidimos comenzar el lavado en el pulmón izquierdo (el que tenía peor compliance estática) con el paciente en decúbito supino.
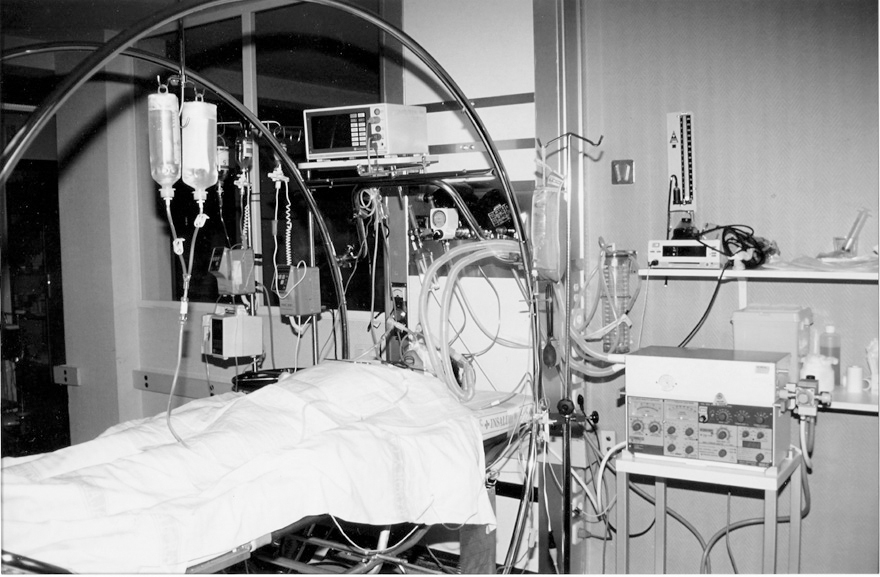
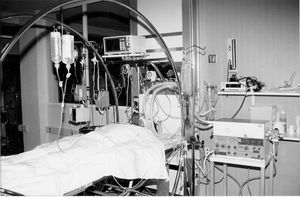
El lavado se realizó con solución salina isotónica calentada a 37º C (fig. 3). Infundimos un litro desde una altura de 30-40 cm sobre el paciente y drenamos éste por gravedad. La misma operación fue realizada hasta que el líquido del lavado se fue aclarando (figs. 2 y 4). Fueron necesarios 13 litros en esta primera fase. Para lograr un mejor resultado y drenaje se realizó percusión torácica sobre el pulmón lavado.
Figura 3. En esta fotografía se observa el tipo de cama que se utilizó para cambiar de posición al paciente (cama basculante). También observamos la altura a la que caía el suero de lavado calentado a 37º C.
Finalizado el lavado en supino, observamos una mejoría de la compliance estática del pulmón izquierdo de hasta 53 ml/cm H2O y una mejoría en la saturación de hasta el 98%.
A continuación colocamos al paciente en decúbito prono (fig. 3). Realizamos el mismo procedimiento que en supino, siendo necesarios en este caso 15 litros de solución salina a 37º C para obtener un drenaje claro. El tiempo total que llevó el lavado del pulmón izquierdo fue de 2 horas y 45 minutos.
Tras concluir el lavado del pulmón izquierdo, ventilamos ambos pulmones en modo presión control con FiO2 100%, PEEP 10 cm H2O y presión pico de 35 cm H2O durante 45 minutos. La compliance estática medida fue de 39 ml/cm H2O y la saturación de oxígeno del 96%. Decidimos ventilar el pulmón izquierdo solo, para comprobar que podría tolerar el lavado del pulmón derecho. El paciente tuvo una buena tolerancia con una saturación de oxígeno del 96%. Decidimos comenzar el lavado del pulmón derecho comenzando en decúbito prono.
En esta posición el drenaje comenzó a aclararse con 20 litros de suero salino en una hora y 35 minutos. Lo cambiamos a decúbito supino, siendo necesario en esta posición sólo 4 litros en 14 minutos hasta obtener un drenaje claro (fig. 4). Después de 30 minutos de ventilación mecánica la compliance estática de ambos pulmones fue de 64 ml/cm H2O y la saturación de oxígeno fue del 98%.
Figura 4. En esta imagen se recoge la cantidad de material proteinaceo que salía con los lavados. Están numerados según el orden en que iban saliendo. La I corresponde con el pulmón izquierdo. La D con el pulmón derecho. Sólo se recogieron los primeros 10 litros de lavado de cada pulmón, en donde se ve de forma más significativa cómo se va aclarando.
Para finalizar cambiamos el tubo de doble luz por uno estándar del número 8 y comenzamos la desconexión del paciente. El paciente fue extubado dos horas después de completar el lavado.
La radiografía de tórax de control mostró un patrón intersticial fino bilateral. Cuando el paciente fue dado de alta de la unidad de cuidados intensivos tenía una relación entre PaO2/FiO2 de 453,8 (193,8 al ingreso).
El lavado secuencial tuvo que ser repetido dos veces durante el siguiente año debido al empeoramiento de su enfermedad con buena tolerancia.
DISCUSIÓN
Ésta es una variante de la técnica descrita por Ramírez et al3 y muy similar a la propuesta por Shah et al4. Desde que describieron el lavado broncoalveolar en 1963, la técnica ha sufrido múltiples modificaciones con el propósito de mejorar la calidad y la tolerancia del lavado.
Observamos que la técnica, en algunos pacientes seleccionados, no era necesario pararla tras el lavado del primer pulmón, siempre y cuando la compliance estática y la oxigenación del paciente hubieran mejorado. No encontramos con respecto a lavados anteriores que habíamos realizado en nuestra Unidad10, ni un mayor tiempo de intubación ni una mayor estancia en la misma. En cambio sí encontramos una simplificación de la técnica, evitando un nuevo ingreso e intubación del paciente. Además, observamos que el lavado en prono es mejor tolerado (mejor compliance estática y mejor oxigenación) y es más efectivo que en decúbito supino, logrando un mayor drenaje de material proteinaceo al principio. Sobre todo si se acompañaba de una adecuada percusión torácica mecánica por parte de enfermería4,10-13. El resultado a medio-largo plazo, comparado con otros pacientes en los que se realizó un lavado broncoalveolar convencional en nuestra Unidad, fue similar13. Otra de las cosas que pudo influenciar en una mejor tolerancia de la técnica es la utilización de PEEP superiores a las utilizadas por nuestro grupo previamente10, lo cual puede mejorar el reclutamiento alveolar y la mejoría de la compliance estática.
Claypool et al en 1985 describieron que el lavado broncoalveolar es significativamente más eficiente que el lavado a través del broncoscopio14,15. Ellos sólo describían el lavado bilateral con oxigenación por membrana extracorpórea (ECMO)14. La necesidad de la ECMO no ha sido probada excepto en casos de afectación pulmonar masiva16.
Tsai et al experimentalmente aplicaron ventilación líquida parcial como último recurso en niños con fallo respiratorio progresivo severo, debido a proteinosis alveolar pulmonar atípica sin mejorar la supervivencia17.
El valor terapéutico del lavado broncoalveolar está ahora bien establecido para la proteinosis alveolar, siendo ésta la única indicación definida para este procedimiento18. Diferentes grupos han establecido nuevas variaciones en el lavado broncoalveolar con el propósito de ser más efectivo16,19.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
*Presentado como sesión clínica en el Hospital Ramón y Cajal. Madrid, 10 de mayo del 2000.
Presentado como póster en el XXXV congreso SEMICYUC. Barcelona 24-27 de mayo del 2000.
Correspondencia: Dr. R. Fernández del Campo.
Callejón de las Portadas, 11, 4.º E.
02004 Albacete. España.
Correo electrónico: rfdzdelcampo@hotmail.com
Manuscrito aceptado el 28-XI-2006.