Determinar las características más relevantes del manejo actual de las terapias continuas de reemplazo renal (TRRC), así como analizar la evolución de la función renal y la mortalidad de los pacientes tratados con estas terapias.
MétodosEstudio observacional sin intervención de 3meses de duración en 2012 con un periodo de seguimiento de 90 días, realizado en 21 hospitales de Cataluña, en que se registraron escalas de gravedad, datos demográficos, clínicos y de las TRRC. Criterios de inclusión: pacientes de ≥16 años ingresados en cuidados intensivos (UCI) tratados con TRRC.
ResultadosSe seleccionó a 261 pacientes. Un 35% tenía disfunción renal previa al ingreso. El principal motivo para iniciar las TRRC fue la oliguria, la modalidad más empleada fue la hemodiafiltración y la mediana de dosis prescrita al inicio fue de 35mL/kg/h. La mediana de tiempo de inicio de la TRRC desde el ingreso en UCI fue de un día. La mortalidad a los 30 y 90 días fue de 46 y 54%, respectivamente, y se relacionó con peores valores en las escalas de gravedad y con un inicio más tardío de la TRRC. Al alta hospitalaria, un 85% de los supervivientes había recuperado la función renal.
ConclusionesEl manejo de las TRRC en Cataluña se adecua a los estándares recomendados por las guías actuales. La mortalidad asociada a las TRRC se relaciona con un inicio más tardío. Un 85% de los pacientes tratados con TRRC recuperan la función renal al alta hospitalaria.
The aim of the study is to ascertain the most relevant aspects of the current management of renal replacement therapy (RRT) in critically ill patients, and to analyze renal function recovery and mortality in patients undergoing RRT.
MethodsA non-interventional three-month observational study was made in 2012, with a follow-up period of 90 days, in 21 centers in Catalonia (Spain). Demographic information, severity scores and clinical data were obtained, as well as RRT parameters. Inclusion criteria: patients aged ≥ 16 years admitted to Intensive Care Units (ICUs) and subjected to RRT.
ResultsA total of 261 critically ill patients were recruited, of which 35% had renal dysfunction prior to admission. The main reason for starting RRT was oliguria; the most widely used RRT modality was hemodiafiltration; and the median prescribed dose at baseline was 35mL/kg/h. The median time of RRT onset from ICU admission was one day. The mortality rate at 30 and 90 days was 46% and 54%, respectively, and was associated to greater severity scores and a later onset of RRT. At discharge, 85% of the survivors had recovered renal function.
ConclusionsCurrent practice in RRT in Catalonia abides with the current clinical practice guidelines. Mortality related to RRT is associated to later onset of such therapy. The renal function recovery rate at hospital discharge was 85% among the patients subjected to RRT.
La disfunción renal aguda es una complicación grave y frecuente en el ámbito de la Unidad de Cuidados Intensivos (UCI) que se asocia al empleo de terapias continuas reemplazo renal (TRRC), entre un 4 y un 10%1. Un estudio epidemiológico multicéntrico a nivel mundial2 reveló en 2007 que las TRRC empleadas son muy diversas, que la modalidad más usada es la hemofiltración (HFVVC, 53%), que la mediana de dosis prescrita era de 20mL/kg/h y que la mortalidad intrahospitalaria de los pacientes tratados con TRRC era del 64%. Asimismo, el análisis multivariante de dicho estudio demostró que ninguna de las variables relacionadas con la terapia (modalidad técnica, material de la membrana, anticoagulación ni dosis) influían en la mortalidad de estos pacientes. Posteriormente, otro estudio multicéntrico observacional3 de 30 UCI también reveló en 2009 que una dosis más elevada no influye en la supervivencia y que, en todo caso, podría mejorar los tiempos de ventilación mecánica y la estancia en UCI de los supervivientes.
En aquella época se realizaron 2 estudios de tipo encuesta que servirían como base de lo que más tarde serían los 2 ensayos clínicos mejor diseñados con relación a la dosis de las TRRC: el estudio VA/NIH Acute Renal Failure Trial Network Study4 (ATN), publicado en 2008, y el estudio Renal Replacement Therapy Study Investigators5 (RENAL), en 2009, que ratificaron que la dosis de la TRRC no influye en el pronóstico de los pacientes. Los resultados más destacables de aquellas encuestas previas fueron los siguientes: la encuesta6 que serviría de base para el ATN analizó 26 centros y observó que la terapia intermitente (TRRI) era la más común (57%) de todas las terapias de reemplazo renal (TRR) aplicadas en UCI; cuando usaban TRRC, la técnica más empleada era la hemodiálisis continua (HDVVC, 70%) y en más del 80% de los casos la dosis no se pautaba en función del peso del paciente. En la encuesta7 previa al RENAL, se analizaron 34 centros con los siguientes resultados: la TRRC fue la más comúnmente empleada, la hemodiafiltración con reposición en predilución (HDFVVC, 62%) fue la técnica más usada; la dosis no se ajustaba al peso del paciente, con una dosis pautada de efluente de 2 L/h de promedio. Más cerca de nuestro entorno, en Inglaterra también se realizó una encuesta8 en 270 UCI, y se observó que la técnica más usada era la hemofiltración (HFVVC, 65%) con una dosis superior a los 35mL/kg/h en el 75% de los casos. Y ya en nuestro ámbito, el estudio FRAMI9 destacó que el 75% de las TRR eran continuas, aunque en un 10% se usaba concomitantemente la TRRI, y que la disfunción renal al alta era del 15%.
En este contexto, nos planteamos hacer un estudio multicéntrico para conocer el manejo actual de estas TRR en el paciente agudo en nuestro medio y para analizar la evolución de la función renal (FR) y el pronóstico de los pacientes tratados mediante estos tratamientos.
Pacientes y métodosDiseño: Estudio epidemiológico multicéntrico prospectivo. Se obtuvo la aprobación de los comités éticos de los 6 hospitales promotores, que coincidieron en que no se requería la firma de un consentimiento informado por escrito dada la naturaleza tanto anónima como no intervencionista del estudio. No obstante, se informó a todos los familiares de los pacientes de la naturaleza del estudio y del registro de los datos. Los demás centros de forma individualizada informaron a sus comités éticos y solicitaron su aprobación para su participación en el estudio. El diseño del estudio se llevó a cabo por 6 expertos en el campo de las TRRC pertenecientes a 6 hospitales, que fueron los investigadores principales y promotores del estudio. La hoja de recogida de datos se diseñó con el objetivo de evitar un exceso de información que pudiese penalizar la recogida de datos, mediante un registro online (www.regisfra.com) que estuvo activo durante el periodo de reclutamiento del estudio. La creación y mantenimiento de esta web fue proporcionada por la industria, que se mantuvo durante 3 meses para el registro online. El análisis estadístico lo realizó el jefe de la Unidad de Epidemiología de uno de los hospitales promotores, perteneciente al Área de Medicina Preventiva y Salud Pública de la Universidad Autónoma de Barcelona.
Periodo del estudio: el reclutamiento de los pacientes se llevó a cabo entre los meses de febrero y mayo de 2012, y el periodo de seguimiento alcanzó los 90 días.
Criterios de inclusión: se requerían 2 criterios de inclusión para participar en el estudio que fueron tener 16 años o más, y estar tratado con TRR en UCI. Los pacientes se incluirían únicamente una vez.
Ámbito: el estudio se llevó a cabo en las UCI de 21 hospitales, tanto comarcales de segundo nivel como terciarios y de alta tecnología, de las 4 provincias catalanas.
Variables de interés: se registraron las características basales de los pacientes como las variables demográficas: edad, género y la cifra de creatinina plasmática basal (creatininab). En cuanto a la creatininab, se tomaba aquel valor de creatinina registrado en ficheros del propio hospital o en atención primaria determinado en los 3 meses previos al ingreso actual. Si no había ningún registro previo y el paciente era joven (<50 años) y sin comorbilidades, se le estimaba un valor de creatinina basal de 1mg/dL. En su defecto, se dejaba el valor de la variable en blanco. Al ingreso se registraron las escalas de gravedad como el índice de comorbilidad de Charlson10, el Índice de Severidad Individual de Liaño (ISI) 11 y la escala de gravedad Sepsis-related Organ Failure Assessment (SOFA)12; el tipo de paciente (médico, quirúrgico, traumático); datos clínicos al ingreso, como la creatinina (creatinina0), la oliguria0 (diuresis inferior a 400mL/día el primer día de ingreso), fármacos nefrotóxicos, necesidad de aminas y ventilación mecánica. Al inicio de la TRR, la cifra de creatinina (creatinina1), el débito urinario de las últimas 6 h antes del inicio de la TRR (diuresis6hTRR), SOFA al inicio de las TRR (SOFA1) y las características de la TRR. Se registraba la localización del acceso vascular (yugular, femoral o subclavio), el tipo de TRR (TRRC o TRRI) y la modalidad: HFVVC, HDFVVC, HDVVC, ultrafiltración lenta continua (SCUF), hemodiálisis intermitente (HDI), diálisis lenta extendida u otras modalidades intermitentes. La situación clínica del paciente (sepsis, isquemia, nefrotoxicidad, intoxicación, multifactorial u otras) y el motivo de inicio de la TRR (oliguria u otras). La dosis registrada era la que se prescribía el primer día, en mL/kg/h, considerándose alto volumen o altos flujos si la dosis excedía de 35mL/kg/h. También se registraba el tiempo de duración de la TRR y la necesidad de HDI tras la retirada de la TRRC. La retirada de la TRR se realizaba según el protocolo de cada centro. Asimismo, se registró la recuperación de la FR, que se definió como la determinación de una cifra de creatinina plasmática<1,2mg/dL en ausencia de necesidad de TRR, en aquellos pacientes sin deterioro de la FR previa. Finalmente, se registró la mortalidad tanto en la UCI como la hospitalaria, a los 30 y 90 días.
La información discordante o ausente se intentó recuperar mediante llamadas telefónicas o por correo electrónico.
Análisis estadísticoEn primer lugar, se realizó un análisis descriptivo de la muestra. Para las variables cualitativas categóricas se usaron porcentajes, para las variables cuantitativas continuas se determinaron las medianas y los valores máximo y mínimo.
Se realizaron 2 estudios comparativos con el objetivo de determinar las variables relacionadas con el pronóstico funcional renal y para determinar las variables relacionadas con la mortalidad.
En los análisis bivariantes se compararon las variables utilizando los test de chi cuadrado o el test exacto de Fisher, para tamaños muestrales pequeños. El test de Student se empleó para variables continuas con distribución normal y el test U de Mann-Whitney para las variables continuas con distribución asimétrica.
Se analizaron los factores asociados a la mortalidad con relación al momento de inicio de la TRR. Para analizar la mortalidad se aplicó una regresión logística múltiple: todas las variables con valor de p<0,15 obtenidas del análisis univariante fueron incluidas en el modelo multivariante de regresión de Cox. Se ajustó a: hospitales de alta tecnología, género, contexto (médico, quirúrgico o trauma), oliguria, ISI de Liaño, edad, tiempo transcurrido desde el ingreso en el hospital hasta el inicio de la TRR, desde el ingreso en UCI hasta el inicio de la TRR, y desde el ingreso en el hospital hasta el ingreso en UCI, escalas de SOFA al ingreso en UCI y al inicio de la TRR.
Los valores de p<0,05 fueron considerados estadísticamente significativos.
Los datos fueron analizados mediante la versión 9.3 del software SAS (SAS Institute Inc., Cary, NC).
ResultadosParticiparon 21 centros, 13 de los cuales disponían de Unidad de Hemodiálisis, y se incluyó a 261 pacientes críticos con las siguientes características: el 67% eran hombres con una mediana de edad de 66 años. Con relación a las escalas de gravedad, la mediana de Charlson era de 3, la del ISI de Liaño era de 0,64 y se registró un SOFA al ingreso en UCI de 8 y de 10 al inicio de la TRR. La mortalidad registrada al día 30 y al 90 fue de 42,91 y de 54,02%, respectivamente. El principal motivo de inicio de la TRR fue la oliguria en un 82,75%. En cuanto a la terapia, en todos los casos, la localización de los catéteres fue en una vena central y el acceso más frecuentemente empleado fue el femoral (85,6%). La anticoagulación del circuito extracorpóreo se efectuó con heparina sódica no fraccionada en la práctica totalidad de los centros, exceptuando uno, que se iniciaba en la anticoagulación regional con citrato. En cuanto al tipo de TRR, la TRRC fue la elegida en el 91,57% de los casos, con la HDFVVC como la modalidad de técnica más empleada (86,61%), con una mediana de dosis prescrita al inicio de 35mL/kg/h. En el 60% de los casos se pautó una dosis entre 25 y 35mL/kg/h el primer día de la TRRC. Un 28% de los pacientes recibieron alto volumen (efluente>35mL/kg/h). Estos pacientes que recibieron alto volumen estaban más graves tanto al ingreso en UCI (SOFA0 10 vs. 8; p=0,022) como al inicio de la terapia (SOFA1 11,5 vs. 10; p=0,045), pero su mortalidad no difirió de la de los pacientes que habían recibido una dosis inferior (p=0,74). La mediana de tiempo de inicio de la TRR desde el ingreso en UCI fue de un día. La duración de la TRR fue de 5 días de mediana, y hasta un 22% de los pacientes tras la retirada de la TRRC fueron tratados con HDI durante 5 días más de mediana. Únicamente un 8,4% de los pacientes de UCI recibieron TRRI desde el inicio del tratamiento, con una mediana de 3 días de tratamiento. La estancia en UCI fue de 12 días de mediana y se continuó con 14 días más en planta de hospitalización (tabla 1).
Análisis de la función renalSe evaluó la FR previa de los pacientes, y se analizó por separado a aquellos con FR previa normal y a los que no la tenían normal.
En aquellos sujetos con FR previa normal, se consideró recuperación de la FR, en los supervivientes y en ausencia de tratamiento depurativo, si la cifra de la creatinina al alta hospitalaria se había normalizado (creatinina<1,2mg/dL) (tabla 1).
Características de los pacientes del estudio y de las terapias de reemplazo renal
| Variables | Resultados |
|---|---|
| Edad [años, mediana (mín-máx)] | 66,2 (16,1-87,2) |
| Género [masculino, n (%)] | 175 (67,1) |
| Escalas de gravedad [mediana (mín-máx)]: | |
| Charlson | 3 (0-17) |
| ISI Liaño | 0,65 (0,07-1,12) |
| SOFA0 | 8 (0-17) |
| SOFA1 | 10 (1-18) |
| CV-SOFA0 | |
| 0-2 | 97 (37,2) |
| 3-4 | 164 (62,8) |
| Biomarcadores de función renal: | |
| Creatininab [mg/dL, mediana (mín-máx)] | 1,06 (0,41-7,40) |
| Creatinina0 [mg/dL, mediana (mín-máx)] | 2,17 (0,3-17,71) |
| Creatinina1 [mg/dL, mediana (mín-máx)] | 2,87 (0,47-17,71) |
| Diuresis6hTRR [mL; mediana (mín-máx)] | 80 (0-400) |
| Situación precipitante del FRA: [n (%)] | |
| Multifactorial | 108 (41,4) |
| Isquemia | 29 (11,1) |
| Sepsis | 92 (35,6) |
| Intoxicación | 4 (1,5) |
| Nefrotoxicidad | 10 (3,8) |
| Otras | 18 (6,9) |
| Situación clínica al ingreso en UCI: [n (%)] | |
| Oliguria0 | 225 (86,2) |
| Shock0 | 200 (76,7) |
| Ventilación mecánica0 | 178 (68,2) |
| Acceso vascular [n (%)]: | |
| Femoral | 222 (85,6) |
| Yugular | 32 (12,26) |
| Subclavio | 7 (2,68) |
| TRR inicial: | |
| TRRC | 239 (91,6) |
| TRRI [n (%)] | 22 (8,4) |
| Dosis de TRRC [mL/kg/h; mediana (mín-máx)] | 35 (10-90) |
| Duración de la TRRC [días; mediana (mín-máx)] | 5 (1-35) |
| Duración de la TRRI [días; mediana (mín-máx)] | 6 (1-148) |
| Modalidad de la TRRC [n (%)]: (inicial) | |
| HDFVVC | 207 (86,61) |
| HFVVC | 19 (7,95) |
| HDVVC | 10 (4,18) |
| SCUF | 3 (1,26) |
| TRRC y TRRI | 46 (17,62) |
| Modalidad de la TRRI [n (%)]: | |
| HDI | 76 (96) |
| Otras | 3 (3,95) |
| Recuperación de la función renal [n (%)] | |
| Al alta hospitalaria (vivos=135) | 115 (85,18) |
| Tiempos varios: [días, mediana (mín-máx)] | |
| Días pre-UCI | 0 (0-120) |
| UCI a TRR | 1 (0-89) |
| Hospital a TRR | 3 (0-121) |
| Estancia en UCI | 12 (1-108) |
| Estancia en planta | 14 (1-123) |
| Estancia en el hospital | 25 (1-208) |
| Mortalidad: [n (%)] | |
| UCI | 112 (42,91) |
| Hospitalaria | 126 (48,28) |
| Al día 30 | 121 (46,36) |
| Al día 90 | 141 (54,02) |
Cualquier palabra que contenga en el subíndice un 0 representa al ingreso en UCI; si contiene en el subíndice un 1 significa al inicio de la TRR.
Comorbilidad: comorbilidad de Charlson; Creatinina0: creatinina al ingreso; Creatinina1: Creatinina al inicio de la TRR; Creatininab: creatinina basal; CV-SOFA0: SOFA cardiovascular al ingreso en UCI; De hospital a ICU: tiempo desde el ingreso hospitalario hasta el ingreso en la UCI; De hospital a TRR: tiempo transcurrido desde el ingreso en el hospital hasta el inicio de la TRR; De UCI a TRR: tiempo transcurrido desde el ingreso en UCI hasta el inicio de la TRR; Diuresis6hTRR: débito urinario durante las 6 h previas al inicio de la TRR; Dosis de TRRC: dosis prescrita de la terapia continua; HDFVVC: hemodiafiltración veno-venosa continua; HDI: hemodiálisis intermitente; HDVVC: hemodiálisis veno-venosa continua; HFVVC: hemofiltración veno-venosa continua; Oliguria0: diuresis inferior a 400mL/día el primer día de ingreso en UCI; SCUF: ultrafiltración lenta continua; SOFA0: SOFA al ingreso en UCI; SOFA1: SOFA al inicio de la TRR; TRRC: terapia continua de reemplazo renal; TRRI: terapia de reemplazo renal intermitente; Recuperación de la función renal: creatinina<1,2mg/dL en ausencia de TRR.
Se observó que el 35% tenían un deterioro de la FR (creatinina >1,2mg/dL) previo al ingreso. En estos pacientes con FR previa deteriorada, se consideró recuperación de la FR cuando la cifra de la creatinina al alta hospitalaria con relación a la inicial se había incrementado menos de un 25%.
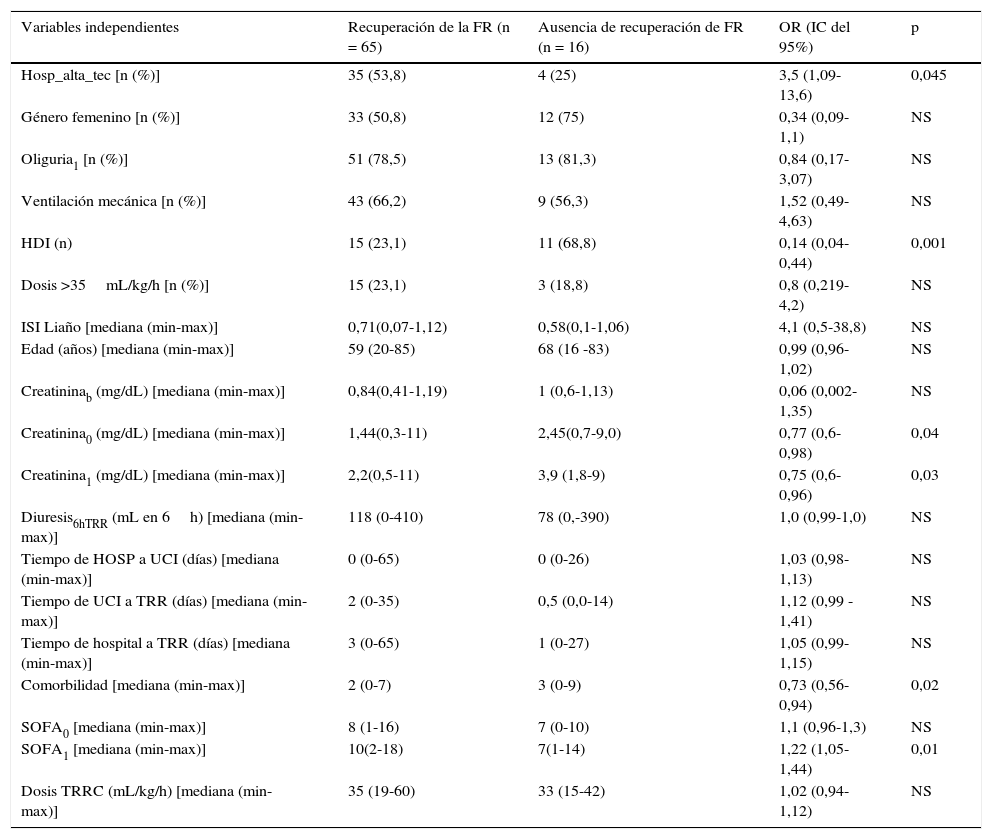
La recuperación de la FR en los supervivientes al alta hospitalaria fue del 85%. Se realizó un análisis bivariante de los predictores de la recuperación de la FR de aquellos pacientes con FR previa normal y se determinó que la recuperación de la FR se relacionaba con una menor comorbilidad, menor cifra de creatinina plasmática al ingreso y en el momento del inicio de la terapia, y con una menor necesidad de HDI durante el ingreso. Asimismo, la recuperación de la FR se relacionó con una mayor gravedad en el momento del inicio de la terapia y con el hecho de haber ingresado en un hospital de alta tecnología (ver tabla 2).
Análisis bivariante de los predictores de la recuperación de la función renal al alta del hospital
| Variables independientes | Recuperación de la FR (n = 65) | Ausencia de recuperación de FR (n = 16) | OR (IC del 95%) | p |
|---|---|---|---|---|
| Hosp_alta_tec [n (%)] | 35 (53,8) | 4 (25) | 3,5 (1,09-13,6) | 0,045 |
| Género femenino [n (%)] | 33 (50,8) | 12 (75) | 0,34 (0,09-1,1) | NS |
| Oliguria1 [n (%)] | 51 (78,5) | 13 (81,3) | 0,84 (0,17-3,07) | NS |
| Ventilación mecánica [n (%)] | 43 (66,2) | 9 (56,3) | 1,52 (0,49-4,63) | NS |
| HDI (n) | 15 (23,1) | 11 (68,8) | 0,14 (0,04-0,44) | 0,001 |
| Dosis >35mL/kg/h [n (%)] | 15 (23,1) | 3 (18,8) | 0,8 (0,219-4,2) | NS |
| ISI Liaño [mediana (min-max)] | 0,71(0,07-1,12) | 0,58(0,1-1,06) | 4,1 (0,5-38,8) | NS |
| Edad (años) [mediana (min-max)] | 59 (20-85) | 68 (16 -83) | 0,99 (0,96-1,02) | NS |
| Creatininab (mg/dL) [mediana (min-max)] | 0,84(0,41-1,19) | 1 (0,6-1,13) | 0,06 (0,002-1,35) | NS |
| Creatinina0 (mg/dL) [mediana (min-max)] | 1,44(0,3-11) | 2,45(0,7-9,0) | 0,77 (0,6-0,98) | 0,04 |
| Creatinina1 (mg/dL) [mediana (min-max)] | 2,2(0,5-11) | 3,9 (1,8-9) | 0,75 (0,6-0,96) | 0,03 |
| Diuresis6hTRR (mL en 6h) [mediana (min-max)] | 118 (0-410) | 78 (0,-390) | 1,0 (0,99-1,0) | NS |
| Tiempo de HOSP a UCI (días) [mediana (min-max)] | 0 (0-65) | 0 (0-26) | 1,03 (0,98-1,13) | NS |
| Tiempo de UCI a TRR (días) [mediana (min-max)] | 2 (0-35) | 0,5 (0,0-14) | 1,12 (0,99 -1,41) | NS |
| Tiempo de hospital a TRR (días) [mediana (min-max)] | 3 (0-65) | 1 (0-27) | 1,05 (0,99-1,15) | NS |
| Comorbilidad [mediana (min-max)] | 2 (0-7) | 3 (0-9) | 0,73 (0,56-0,94) | 0,02 |
| SOFA0 [mediana (min-max)] | 8 (1-16) | 7 (0-10) | 1,1 (0,96-1,3) | NS |
| SOFA1 [mediana (min-max)] | 10(2-18) | 7(1-14) | 1,22 (1,05-1,44) | 0,01 |
| Dosis TRRC (mL/kg/h) [mediana (min-max)] | 35 (19-60) | 33 (15-42) | 1,02 (0,94-1,12) | NS |
Creatinina0: cifra de creatinina plasmática al ingreso en UCI;
Creatinina1: cifra de creatinina plasmática al inicio de la TRR; Creatininab: cifra de creatinina plasmática previa; Diuresis6hTRR; volumen de orina recogido durante las 6 h previas al inicio de la TRR; Dosis TRRC: dosis de tratamiento de la TRRC (efluente); FR: función renal; Hosp_alta_tec: hospitales de alta tecnología; ISI Liaño: índice de severidad individual de Liaño; NS: no significativo (p>0,05); SOFA0: escala de gravedad de SOFA determinada al ingreso en UCI; SOFA1: escala de gravedad de SOFA determinada al inicio de la TRR; Tiempo de hospital a ICU: tiempo desde el ingreso hospitalario hasta el ingreso en la UCI; Tiempo de hospital a TRR: tiempo transcurrido desde el ingreso en elhospital hasta el inicio de la TRR; Tiempo de UCI a TRR: tiempo transcurrido desde el ingreso en UCI hasta el inicio de la TRR; TRR: terapia de reemplazo renal.
Sin embargo, el análisis multivariante no pudo demostrar ninguna relación independiente entre las variables estudiadas y la recuperación de la FR.
Análisis de la mortalidadLa mortalidad en UCI fue del 42,91%, a los 30 días fue del 46,36%, al alta hospitalaria fue del 48,28% y a los 90 días fue del 54,02%. Ningún paciente ingresado por intoxicaciones ni por nefrotoxicidad había fallecido al alta hospitalaria, ni tampoco murió ningún paciente cuya TRR de inicio hubiera sido una SCUF o una TRRI.
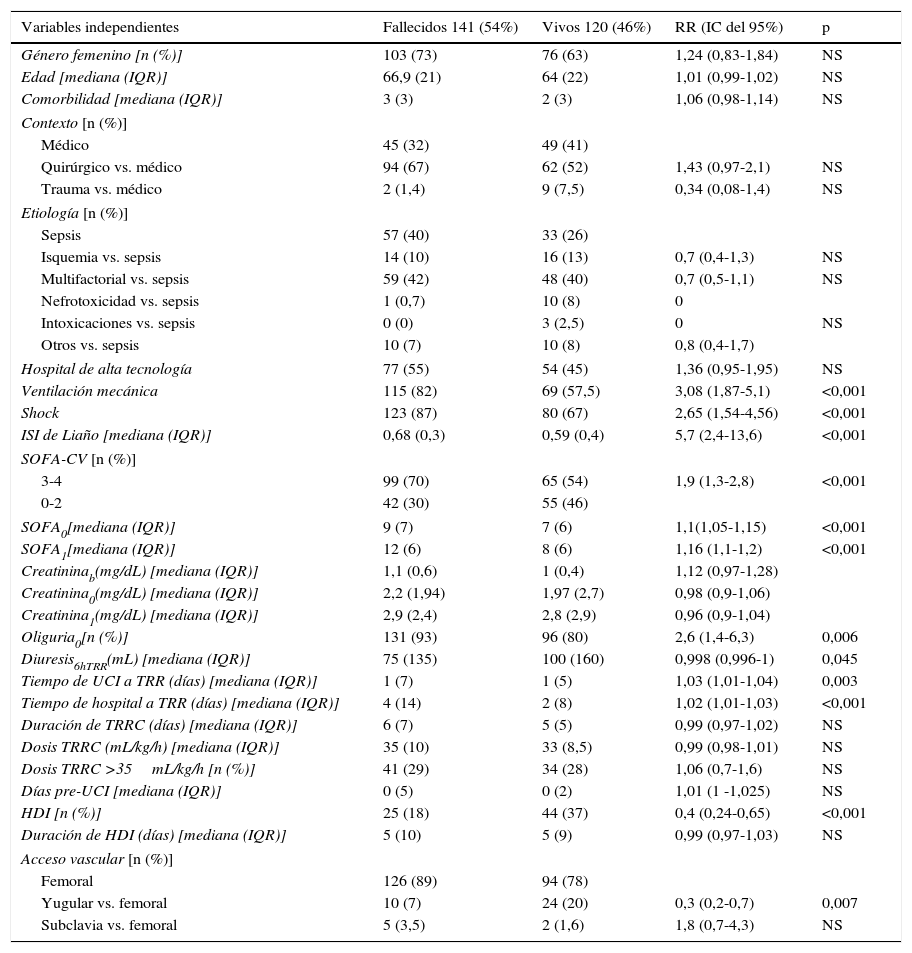
Se realizó el análisis de mortalidad a los 30 y a los 90 días. Los análisis realizados tanto al día 30 como a los 90 días son muy similares, con lo que se expone el realizado a los 90 días, por comprender la totalidad de los fallecidos. El análisis bivariante mostró que las variables relacionadas con la mortalidad fueron: la oliguria, el shock, la necesidad de ventilación mecánica al ingreso, las escalas de gravedad (el SOFA y el ISI de Liaño), y un mayor tiempo transcurrido desde el ingreso hasta la instauración de la terapia depurativa. Resultados que se exponen en la tabla 3. El análisis multivariante determinó que la mortalidad se asociaba con mayor SOFA al inicio de la técnica (SOFA1 de 11 vs. 8; RR 1,13 e IC 95%: 1,1-1,2; p=0,0007) y con un mayor tiempo transcurrido desde el ingreso en UCI hasta el inicio de la TRR (0 vs. 1 día; RR 1,02 e IC 95%: 1,01-1,03; p=0,0016). El contexto médico resultó ser un factor protector para la mortalidad. Los resultados se exponen en la tabla 4.
Análisis bivariante de las variables predictivas de la mortalidad a los 90 días del ingreso
| Variables independientes | Fallecidos 141 (54%) | Vivos 120 (46%) | RR (IC del 95%) | p |
|---|---|---|---|---|
| Género femenino [n (%)] | 103 (73) | 76 (63) | 1,24 (0,83-1,84) | NS |
| Edad [mediana (IQR)] | 66,9 (21) | 64 (22) | 1,01 (0,99-1,02) | NS |
| Comorbilidad [mediana (IQR)] | 3 (3) | 2 (3) | 1,06 (0,98-1,14) | NS |
| Contexto [n (%)] | ||||
| Médico | 45 (32) | 49 (41) | ||
| Quirúrgico vs. médico | 94 (67) | 62 (52) | 1,43 (0,97-2,1) | NS |
| Trauma vs. médico | 2 (1,4) | 9 (7,5) | 0,34 (0,08-1,4) | NS |
| Etiología [n (%)] | ||||
| Sepsis | 57 (40) | 33 (26) | ||
| Isquemia vs. sepsis | 14 (10) | 16 (13) | 0,7 (0,4-1,3) | NS |
| Multifactorial vs. sepsis | 59 (42) | 48 (40) | 0,7 (0,5-1,1) | NS |
| Nefrotoxicidad vs. sepsis | 1 (0,7) | 10 (8) | 0 | |
| Intoxicaciones vs. sepsis | 0 (0) | 3 (2,5) | 0 | NS |
| Otros vs. sepsis | 10 (7) | 10 (8) | 0,8 (0,4-1,7) | |
| Hospital de alta tecnología | 77 (55) | 54 (45) | 1,36 (0,95-1,95) | NS |
| Ventilación mecánica | 115 (82) | 69 (57,5) | 3,08 (1,87-5,1) | <0,001 |
| Shock | 123 (87) | 80 (67) | 2,65 (1,54-4,56) | <0,001 |
| ISI de Liaño [mediana (IQR)] | 0,68 (0,3) | 0,59 (0,4) | 5,7 (2,4-13,6) | <0,001 |
| SOFA-CV [n (%)] | ||||
| 3-4 | 99 (70) | 65 (54) | 1,9 (1,3-2,8) | <0,001 |
| 0-2 | 42 (30) | 55 (46) | ||
| SOFA0[mediana (IQR)] | 9 (7) | 7 (6) | 1,1(1,05-1,15) | <0,001 |
| SOFA1[mediana (IQR)] | 12 (6) | 8 (6) | 1,16 (1,1-1,2) | <0,001 |
| Creatininab(mg/dL) [mediana (IQR)] | 1,1 (0,6) | 1 (0,4) | 1,12 (0,97-1,28) | |
| Creatinina0(mg/dL) [mediana (IQR)] | 2,2 (1,94) | 1,97 (2,7) | 0,98 (0,9-1,06) | |
| Creatinina1(mg/dL) [mediana (IQR)] | 2,9 (2,4) | 2,8 (2,9) | 0,96 (0,9-1,04) | |
| Oliguria0[n (%)] | 131 (93) | 96 (80) | 2,6 (1,4-6,3) | 0,006 |
| Diuresis6hTRR(mL) [mediana (IQR)] | 75 (135) | 100 (160) | 0,998 (0,996-1) | 0,045 |
| Tiempo de UCI a TRR (días) [mediana (IQR)] | 1 (7) | 1 (5) | 1,03 (1,01-1,04) | 0,003 |
| Tiempo de hospital a TRR (días) [mediana (IQR)] | 4 (14) | 2 (8) | 1,02 (1,01-1,03) | <0,001 |
| Duración de TRRC (días) [mediana (IQR)] | 6 (7) | 5 (5) | 0,99 (0,97-1,02) | NS |
| Dosis TRRC (mL/kg/h) [mediana (IQR)] | 35 (10) | 33 (8,5) | 0,99 (0,98-1,01) | NS |
| Dosis TRRC >35mL/kg/h [n (%)] | 41 (29) | 34 (28) | 1,06 (0,7-1,6) | NS |
| Días pre-UCI [mediana (IQR)] | 0 (5) | 0 (2) | 1,01 (1 -1,025) | NS |
| HDI [n (%)] | 25 (18) | 44 (37) | 0,4 (0,24-0,65) | <0,001 |
| Duración de HDI (días) [mediana (IQR)] | 5 (10) | 5 (9) | 0,99 (0,97-1,03) | NS |
| Acceso vascular [n (%)] | ||||
| Femoral | 126 (89) | 94 (78) | ||
| Yugular vs. femoral | 10 (7) | 24 (20) | 0,3 (0,2-0,7) | 0,007 |
| Subclavia vs. femoral | 5 (3,5) | 2 (1,6) | 1,8 (0,7-4,3) | NS |
Creatinina0: cifra de creatinina plasmática al ingreso en UCI; Creatinina1: cifra de creatinina plasmática al inicio de la TRR; Creatininab: cifra de creatinina plasmática previa; Días pre-UCI: días de estancia hospitalaria previos al ingreso en UCI; Diuresis6hTRR: volumen de orina recogido durante las 6 h previas al inicio de la TRR; Dosis TRRC: dosis de tratamiento de la TRRC (efluente); ISI Liaño: índice de severidad individual de Liaño; NS: no significativo (p>0,05); SOFA-CV: SOFA cardiovascular; SOFA0: escala de gravedad de SOFA determinada al ingreso en UCI; SOFA1: escala de gravedad de SOFA determinada al inicio de la TRR; Tiempo hasta TRR: tiempo transcurrido entre la fecha de ingreso en UCI y el momento de inicio de la TRR; TRR: terapia de reemplazo renal; TRRC: terapia continua de reemplazo renal.
Análisis multivariante de la mortalidad a los 90 días
| RR (IC 95%) | p | |
|---|---|---|
| SOFA1 (determinado al inicio de la terapia) | 1,131 (1,053-1,214) | <0,001 |
| Tiempo transcurrido desde el ingreso en UCI hasta el inicio de la TRR (días) | 1,016 (1,006-1,026) | 0,002 |
| Tipo de contexto médico con relación al quirúrgico | 0,617 (0,400-0,952) | 0,03 |
Modelo multivariante de regresión múltiple de Cox. Se ajustó a la edad, al tipo de centro, al contexto y a la etiología, a la oliguria al ingreso en UCI y a la diuresis de las 6 h previas al inicio de la terapia, a las escalas de gravedad SOFA al ingreso y al inicio de la terapia, SOFA-CV al ingreso e ISI-Liaño, al tiempo transcurrido desde el ingreso en UCI hasta el inicio de la TRR y al tiempo transcurrido desde el ingreso en UCI hasta el inicio de la TRR.
Presentamos los resultados de un estudio multicéntrico en Cataluña sobre uso de TRR en UCI que muestra que el principal motivo por el que se indica la terapia es la oliguria, que el acceso vascular más frecuentemente elegido es la vena femoral, que la continua es la TRR más utilizada y que la HDFVVC es la modalidad más comúnmente empleada, con una dosis inicial pautada de 35mL/kg/h. En cuanto al tipo de paciente tratado con TRRC, es el de un hombre de 66 años cuya mortalidad alcanzará el 50% a los 3meses, la cual está relacionada con una mayor gravedad y con un inicio más tardío de la TRR. Los supervivientes recuperarán la FR en un 85% al alta hospitalaria.
Este trabajo se planteó como un estudio epidemiológico multicéntrico para conocer con mayor profundidad el manejo actual de las TRR en Cataluña, después de haber finalizado un primer estudio preliminar en 6 centros13. El estudio actual ha incorporado 21 UCI de Cataluña y ha incluido a 261 pacientes.
De otra parte, tras haber completado el periodo de reclutamiento del estudio, en verano de 2012, aparecieron las guías KDIGO14 (Kidney Disease: Improving Global Outcomes. Clinical practice guideline for the evaluation and management of acute kidney injury) con unas recomendaciones específicas para el manejo de la lesión renal aguda (acute kidney injury). Con todo, al analizar los datos del estudio quisimos conocer el grado de cumplimiento de las recomendaciones de las KDIGO, a pesar de que nuestro estudio se realizó antes de su aparición, y también quisimos comparar nuestros datos con los de los estudios BEST2, ATN4 y RENAL5.
En comparación con el estudio BEST2 en el que la mayor parte de los pacientes se trataban con HFVVC (53%) y una dosis de 20mL/kg/h, en nuestro ámbito se depuran mediante HDFVVC (87%) y la dosis prescrita el primer día es de 35mL/kg/h. Con la aparición de las guías KDIGO14 se recomienda una dosis administrada de entre 20 y 25mL/kg/h, aunque se advierte de que para conseguir administrar esas dosis generalmente es necesario pautar dosis más altas. Así, podríamos inferir que en ausencia de realizar una anticoagulación regional con citrato, como era el caso de nuestro estudio, la dosis pautada al inicio probablemente se ajusta a las recomendaciones de las guías KDIGO. Sin embargo, detectamos que un 28% de los pacientes se habían tratado con alto volumen, no recomendándose su uso en las KDIGO puesto que no se han demostrado efectos beneficiosos en la supervivencia15–17 y, además, las altas dosis pueden incrementar los efectos adversos de las TRR4,5,17. De otra parte, estudios previos18 sí que parecían encontrar beneficios en el pronóstico aplicando el alto volumen. En nuestro caso los pacientes tratados con altos flujos estaban más graves, pero su mortalidad fue similar a la de los otros pacientes. Así pues, es posible que en pacientes seleccionados, en el momento oportuno y durante un periodo limitado de tiempo, el alto volumen pueda tener algún papel, aunque, siempre, en manos expertas para minimizar el dialytrauma19.
Otro aspecto reseñable es la localización femoral como el acceso vascular más frecuentemente seleccionado; por el contrario, la yugular se utiliza únicamente en un 12% de los pacientes. Este dato contrasta con las recomendaciones de las KDIGO14, en las que se recomienda el acceso yugular derecho en primer lugar. Sin embargo, más recientemente, se defiende usar20 de manera indistinta el acceso vascular femoral y el yugular, ambos como las vías de acceso de elección para TRR en las mismas condiciones.
El tiempo transcurrido entre el ingreso y el inicio de la TRR también es una cuestión controvertida, en buena parte porque apenas había estudios especialmente diseñados con esta finalidad21,22. Los metaanálisis no eran concluyentes, si bien parecía que en el grupo de pacientes quirúrgicos, en los cuales el momento de la agresión es perfectamente conocido, la precocidad en el inicio de las TRR tendía a resultar beneficiosa en el pronóstico23,24. Igualmente, el efecto del retraso en el inicio de la terapia sobre la mortalidad también se aprecia en los estudios RENAL5 y ATN4, de manera que, en el RENAL, un inicio más precoz se acompañó de mejor pronóstico (mortalidad del 44,7% al día 90), mientras que en el ATN, con un inicio más tardío, la mortalidad fue más elevada (del 52,5% al día 60), con similares condiciones de gravedad. En nuestro caso, un inicio más tardío también auguró un peor pronóstico. Este punto es de vital importancia, puesto que el momento de inicio de la terapia es un aspecto modificable por el clínico y, por lo tanto, únicamente depende de nuestra práctica clínica.
La mortalidad asociada a las TRR sigue siendo muy elevada. Si bien es cierto que con relación al estudio BEST publicado en 20072, la mortalidad hospitalaria ha descendido del 63,8 al 48,3% en nuestro registro, el hecho de que uno de cada 2pacientes con TRRC vaya a morir parece inaceptable. Además, los últimos ensayos clínicos también constatan pronósticos muy sombríos. El estudio ATN4 que describe una media de CV-SOFA de 2,3±1,7 halla una mortalidad del 52,5% determinada al día 60; el estudio RENAL5 con una media de CV-SOFA de 2,8±1,5 halla una mortalidad del 44,7% analizada al día 90; y nuestro registro, que detecta una media de CV-SOFA de 2,6±1,7, halla una mortalidad del 54,04% determinada al día 90. Nuestro registro aporta, además, datos sobre las comorbilidades10 de los pacientes e incluye la escala de gravedad de Liaño11 que ajusta mejor el pronóstico de los pacientes con fracaso renal agudo. Y así, observamos que eran pacientes con una comorbilidad destacable y que estaban muy graves en el momento del ingreso en UCI. A pesar de que los otros estudios mencionados no aplicasen el ISI, sí que valoraron otras escalas de gravedad, y en todos ellos se verifica que la mortalidad se relaciona estrechamente con la gravedad de los pacientes25–27. De otra parte, y al igual que se ha corroborado en otros estudios, la mortalidad no se ha relacionado con ningún otro aspecto ligado a la TRR (modalidad técnica, dosis de efluente, etc.)2.
El registro detectó que hasta un 86,21% de los pacientes estaban oligúricos al ingreso en UCI. Además, se observó que, a pesar de la resucitación de los pacientes realizada en cada centro, el 82,75% de los pacientes persistían oligúricos en el momento de inicio de la TRR. Por consiguiente, no es de extrañar que el motivo principal por el que los pacientes se tratasen con TRR fuera la oliguria. Sin embargo, el estudio RENAL5 determinó un 60% de oliguria en sus pacientes. En este punto caben un par de reflexiones: de una parte, es sabido que la oliguria transitoria es un evento frecuente en las UCI y que ello no necesariamente se asocia con fracaso renal agudo28. Y, de otra parte, también es notorio que una oliguria persistente de más de 12 h se asocia con peor pronóstico29, con lo cual el momento de inicio de la TRR debería ser el adecuado para cada paciente, para evitar precipitarse e iniciar TRR en pacientes prerrenales o insuficientemente resucitados o bien demorarse demasiado en aquellos pacientes muy graves que sí podrían beneficiarse de un inicio más precoz.
Recientemente, se han publicado un par de ensayos clínicos diseñados con el objetivo de evaluar la mortalidad con relación al inicio de las TRR en los pacientes críticos con fracaso renal agudo que, por su especial relevancia, se discuten a continuación.
De una parte, se analiza el estudio francés AKIKI30, cuyos resultados han puesto de manifiesto que un inicio más precoz no se acompaña de un mejor pronóstico (mortalidad del 49,7 vs. 48,5% a los 60 días). Sin embargo, este trabajo multicéntrico francés tiene una serie de peculiaridades destacables: los pacientes se aleatorizaron una vez ya habían entrado en un estadio 3 de KDIGO14, momento en el que el grupo precoz iniciaba la TRR tan pronto como era posible y el grupo tardío se esperaba a las 72 h. En este estudio no se describe la estrategia de resucitación de los pacientes ni tampoco se hace referencia al protocolo del estudio en cuanto al tipo de técnica escogida ni su análisis en relación con la mortalidad. Los autores del estudio describen que el 55% de los pacientes fueron tratados con HDI y solo un 30% recibieron TRRC. Destacan que el grupo tardío recibió muchos más diuréticos y que apenas un 40% acabaron necesitando TRR. Los pacientes que no recibieron TRR tenían un SOFA de 10 y presentaron una mortalidad del 37%; los que recibieron la TRR precozmente tenían un SOFA de 11 y murieron en un 48,5% y los que la recibieron tardíamente tenían un SOFA de 12 y fallecieron en un 61,8%. Sin embargo, el SAPS III no resultó significativamente diferente entre los 3grupos. Como pedictores de necesidad de TRR (analizados en el grupo tardío) obtuvieron la urea, el pH y el SOFA. Es decir, los pacientes más graves acaban necesitando TRR, pero es posible que el hecho de iniciarla tardíamente se acompañe de un aumento de la mortalidad. Además, los pacientes del grupo tardío presentaron más complicaciones hemorrágicas (4 vs. 0,3%), de modo que la única complicación hemorrágica en el grupo precoz se debió a una punción arterial que sangró. En cambio, en el grupo tardío se registraron 6 sangrados abdominales, 3 hemotórax, una hemoptisis, un sangrado en un politrauma y 2 sangrados con relación a punciones de catéter.
De otra parte, tenemos el estudio alemán ELAIN31, que publica unos resultados contrapuestos respecto al AKIKI30. Estos autores encuentran que un inicio precoz (con la TRRC instaurada en las primeras 8 h de un estadio 2 de KDIGO), tras unas 6 h de mediana de la aleatorización, se asocia con una mortalidad del 39,3% en comparación con un 54,7% tras inicio más tardío (durante las primeras 12 h de un estadio 3 de KDIGO), tras unas 26 h de mediana de la aleatorización. En este estudio además del criterio KDIGO se exigía una determinación de la lipocalina asociada a la gelatinasa de neutrófilos en plasma superior a 150ng/mL, con el objetivo de descartar los casos prerrenales. Los pacientes recibían una dosis alrededor de 26mL/kg/h de HDFVVC en predilución 1:1 bajo una anticoagulación regional con citrato. Además de una mejoría en la supervivencia a los 90 días, un inicio precoz se asoció con una menor duración de la TRRC (9 vs. 35 días; p=0,04), de la ventilación mecánica (126 vs. 181 h; p=0,002) y de la estancia hospitalaria (51 vs. 82 días; p<0,001). No se observaron diferencias en la necesidad de diálisis a los 90 días (13 vs. 15%). No se registró ninguna complicación hemorrágica destacable. Asimismo, el análisis de mediadores inflamatorios detectó una reducción significativa en las concentraciones de citocinas en el grupo precoz en comparación con el grupo tardío, a las 24 h de la aleatorización, que los autores relacionan con la mejoría de supervivencia de estos pacientes. Sin embargo, este estudio tiene una serie de limitaciones, entre las que cabe destacar: está realizado en un único centro, la mayoría son pacientes quirúrgicos y, a pesar de que solo tienen un 35% de pacientes sépticos, reportan un promedio de SOFA de 16, considerablemente más elevado que el resto de los estudios publicados discutidos anteriormente.
Dada la trascendencia de estos 2últimos estudios publicados con relación al momento de inicio de la TRR con la mortalidad y puesto que nuestros resultados también relacionan el momento de inicio de la terapia con la supervivencia, hemos analizado a posteriori si el inicio de la terapia en un estadio KDIGO 2 o 3 modifica el pronóstico de los pacientes y no hemos encontrado diferencias significativas, aunque sí se observa una correspondencia entre un peor estadio de KDIGO y una mayor mortalidad. Otro aspecto destacable es que el componente «creatinina» de la escala KDIGO adquiere mayor relevancia en el pronóstico en aquellos casos de insuficiencia renal aguda no oligúrica, pero la pierde para los pacientes oligúricos. En cambio, la oliguria tanto al ingreso como al inicio de la TRR, sí se relaciona significativamente con la mortalidad. Los resultados se exponen en el material suplementario del anexo B.
No obstante, el momento de inicio probablemente se deba individualizar para cada paciente. Seguramente dependerá de su gravedad, valorándose un inicio de la TRR más precoz en el paciente inestable tras una óptima resucitación con volumen que descarte los estados prerrenales, pero también dependerá de la reversibilidad de su fracaso renal agudo, que podría valorarse mediante el uso de biomarcadores renales32 o mediante el test de estrés de furosemida33, o incluso podría plantearse más tardíamente en pacientes estables.
Con todo, pensamos que es prioritario seguir investigando mediante ensayos clínicos multicéntricos bien diseñados y con suficiente potencia como para poder evaluar el efecto del momento de inicio de la terapia en la mortalidad en nuestro medio, con el tipo de pacientes que tenemos y con el tipo de terapias que empleamos.
Finalmente, hallamos un deterioro en la FR previa en el 35% de los pacientes, similar a otros estudios1. La recuperación de la FR al alta hospitalaria fue del 85%, que coincide con la descrita en los estudios BEST y FRAMI2,9 y se relaciona con un mayor deterioro de la FR al ingreso y con la comorbilidad, resultados que concuerdan con los hallados en la literatura2,34–37. Son todos ellos factores que se no pueden modificar de antemano. Por consiguiente, aquellos pacientes de más edad, con deterioro de la FR y con otras comorbilidades, deberían ser vigilados más estrechamente y evitarles las agresiones renales en la medida de lo posible. Asimismo, parece obvio que cualquier paciente tratado con TRR siga controles de su FR, por lo que se podría valorar protocolizar una interconsulta a nefrología para su seguimiento al alta de UCI.
Limitaciones del estudioEl estudio tiene varias limitaciones. En primer lugar, aunque los resultados del registro indican que la precocidad en el inicio de la TRR es un factor independiente en la supervivencia de estos pacientes, estos resultados corresponden a un estudio epidemiológico observacional sin ningún tipo de intervención, con lo cual, las conclusiones deben tomarse con precaución. Así pues, la principal limitación de las conclusiones del estudio es que no se puede asegurar que esta asociación entre la precocidad del uso de la terapia y la supervivencia sea irrefutable. En segundo lugar, otra limitación de este tipo de estudios epidemiológicos es la incapacidad para controlar variables potencialmente confusoras, de manera que la asociación que se encuentra entre 2variables puede ser debida a una tercera. Es decir, es posible que se haya instaurado la TRR precozmente en alguna situación de prerrenal con un buen resultado clínico o que, por el contrario, se haya retrasado el inicio de la TRR en algún paciente límite, a la espera de una evolución del desenlace. En ambos casos, el resultado pronóstico dependería de esa tercera variable y podría confundir su relación con el inicio de la TRR. De otra parte, sin embargo, también es posible que sí que se haya correspondido un inicio precoz con una mejoría de la supervivencia. No se puede aseverar ni refutar. Finalmente, el diseño del estudio determinó que el reclutamiento se llevara a cabo durante un periodo de 3 meses en primavera, hecho que podría no ser apropiado ni representativo del manejo de las TRRC ni del tipo de paciente tratado con ellas fuera de esta época del año.
ConclusionesSe ha llevado a cabo un estudio epidemiológico multicéntrico que ha analizado el manejo actual de las TRRC en Cataluña y se ha observado que mayoritariamente se adecua a las recomendaciones de práctica clínica actuales. La mayoría de los pacientes tratados mediante TRRC están oligúricos al ingreso en UCI y persisten oligúricos 6 h antes del inicio de la terapia, que es el motivo principal por el que se indican las TRRC. La mortalidad asociada a las TRRC supera el 50% a los 3 meses y se relaciona con la gravedad del paciente y con un inicio más tardío de la TRR. Y la recuperación de la FR de los supervivientes alcanza el 85%.
FinanciaciónEl manuscrito no tiene fuente de financiación.
Autoría/colaboracionesTMT fue una de las personas que idearon el estudio, contribuyó en el diseño, contribuyó en su difusión para el reclutamiento de centros, se encargó de resolver las dudas de otros investigadores con relación a la recogida de datos, hizo la recogida de datos de su centro, revisó la base de datos global, realizó el análisis estadístico y escribió el manuscrito; JS contribuyó en el diseño del estudio, revisó la base de datos y corrigió el manuscrito; EP fue una de las personas que idearon el estudio, contribuyó en el diseño, contribuyó en su difusión para el reclutamiento de centros y se encargó de resolver las dudas de otros investigadores con relación a la recogida de datos; JF fue una de las personas que idearon el estudio y contribuyó a su diseño; MJLL fue una de las personas que contribuyó en la recogida de datos de su centro y revisó su base de datos; JR realizó el análisis estadístico; AN se encargó de la recogida de datos de su centro y revisó su base de datos; PO se encargó de la recogida de datos de su centro y revisó su base de datos; LLS se encargó de la recogida de datos de su centro y revisó su base de datos; FJGM se encargó de la recogida de datos de su centro y revisó su base de datos; CR se encargó de la recogida de datos de su centro y revisó su base de datos y ARTMT fue una de las personas que idearon el estudio, contribuyó en el diseño, se encargó de resolver las dudas de otros investigadores con relación a la recogida de datos, se encargó de la recogida de datos de su centro, revisó la base de datos global y corrigió el manuscrito.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Enviamos un afectuoso agradecimiento a todas aquellas personas que de un modo u otro han colaborado con el estudio por su contribución en el artículo, tanto en la selección de pacientes como en la recogida y revisión de los datos, el seguimiento de los pacientes y demás quehaceres, y que, en definitiva, son todos miembros del Grupo Colaborativo REGISFRA: sin su inestimable trabajo no habría sido posible elaborar un registro de pacientes tan representativo de lo que se pretendía abarcar.
Hospital Arnau de Vilanova de Lérida: Lluís Servià, Joana Domingo, Marisa Martín; Hospital de Bellvitge: Miguel Hueso; Hospital Clínic: José M. Nicolás, Pedro Castro, Néstor Rodríguez, Alejandra Hernández; Hospital General de Catalunya: Teresa Doñate, Maria L. Martínez; Hospital General de L’Hospitalet: Raúl Lafuente; Hospital General de Vic: Rosa M. Catalan, Eugenia Castellote; Hospital Germans Trias i Pujol de Badalona: José M. Manciño, Loreto Fernández; Hospital de Granollers: Judith Xirgu, Diana Colon, Silvia Garcia; Hospital Joan XXIII de Tarragona: Federico Esteban, Carmen Gilavert, Marcos Ibañez, Carmen Peralta, Olga Moreno; Hospital Josep Trueta de Gerona: Josep M. Sirvent, Patricia Ortiz, Anna Baró, Anna Garia-Fragua, Martí Vallés, Cristina Martínez; Hospital de Manresa: Silvia Cano, Núria Garra; Hospital del Mar: Yolanda Díaz; Eva Rodríguez, Juan Rodríguez, Igini Cao; Hospital de Mataró: Manel Solsona; Hospital Moisés Broggi: Miguel Rodríguez, Pilar Ruiz, Oana Rap; Hospital Mútua de Terrassa: Joan Llibre, Maria A. Martínez, Francisco J. González de Molina; Hospital de Palamós: Rosa García; Hospital Parc Taulí de Sabadell: Loreley Betancourt, Manuel García, Gemma Gomà, Gisela Gili. Antonio Artigas; Hospital del Sagrat Cor: Mercedes Ibarz, Antoni Pelegrí; Hospital Sant Joan de Reus: Conxita Rovira; Hospital de Sant Pau: Hernán Aguirre-Bermeo, Mireia Cuartero, Montserrat Vila; Hospital de Terrassa: Maria Alvarez, Alfons Arizmendi, Vanesa Arauzo, Ana Saurina; Hospital Vall d’Hebrón: Raquel Albertos, Lluís Llopart, Marcos Pérez, Elías Jatem, Natalia Ramos; Hospital Verge de la Cinta de Tortosa: Marcos Ibáñez, Juan P. Castañeda, José Luna, P. Angelet; Fundació Puigvert: Enric Andrés, Juan M. Díaz.