Mejorar la seguridad del paciente crítico en la prevención de enfermedad tromboembólica venosa mediante metodología de la herramienta de seguridad del análisis modal de fallos y efectos.
DiseñoEstudio de cohortes con serie contemporánea de enero de 2014 a marzo de 2015 en 4 fases: fase 1) previa al análisis modal de fallos y efectos; fase 2) desarrollo del análisis modal e implementación de las mejoras detectadas; fase 3) evaluación de los resultados, y fase 4) impacto tras introducción post-checklist.
ÁmbitoPacientes hospitalizados en una UCI polivalente de adultos en un hospital de tercer nivel.
PacientesCiento noventa y seis pacientes hospitalizados en UCI, mayores de 18 años, sin enfermedad tromboembólica al ingreso y sin haber recibido tratamiento anticoagulante previamente.
IntervencionesTras el análisis modal, se implementó un paquete de intervenciones: formación, instauración de protocolo y checklist, para incrementar las medidas profilácticas de enfermedad tromboembólica.
Variables de interésIndicación y prescripción de medidas profilácticas de trombosis venosa antes y después de la implementación de medidas resultantes del análisis modal de fallos y efectos.
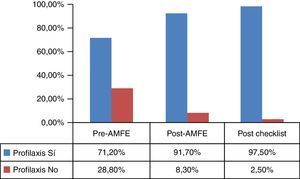
ResultadosEn la fase 1 se incluyeron 59 pacientes, 97 en la fase 3 y 40 en la fase 4, analizando el porcentaje de pacientes que recibieron tromboprofilaxis. Se desarrolló un análisis modal de fallos y efectos detectando errores potenciales, asociados a la ausencia de formación y de protocolos relacionados con la enfermedad tromboembólica. Se elaboró una campaña de sensibilización y formación del personal, así como la introducción del protocolo para la prevención de tromboembolismo venoso. La prescripción de medidas profilácticas aumentó en el grupo de la fase 3 (91,7 vs. 71,2%, p=0,001). En el grupo post-checklist, la profilaxis fue prescrita en el 97,5% de los pacientes, aumentado la indicación de la doble profilaxis (4,7, 6,7 y 41%; p<0,05). No hubo diferencias en la tasa de complicaciones asociadas al incremento de medidas profilácticas.
ConclusionesTras el análisis modal de fallos y efectos, se objetivaron mejoras en la prevención de enfermedad tromboembólica en el paciente crítico, por lo que consideramos que puede ser una herramienta útil para mejorar la seguridad de nuestros pacientes en diferentes procesos.
To improve critical patient safety in the prevention of venous thromboembolic disease, using failure mode and effects analysis as safety tool.
DesignA contemporaneous cohort study covering the period January 2014-March 2015 was made in 4 phases: phase 1) prior to failure mode and effects analysis; phase 2) conduction of mode analysis and implementation of the detected improvements; phase 3) evaluation of outcomes, and phase 4) (post-checklist introduction impact.
SettingPatients admitted to the adult polyvalent ICU of a third-level hospital center.
PatientsA total of 196 patients, older than 18 years, without thromboembolic disease upon admission to the ICU and with no prior anticoagulant treatment.
InterventionsA series of interventions were implemented following mode analysis: training, and introduction of a protocol and checklist to increase preventive measures in relation to thromboembolic disease.
Variables of interestIndication and prescription of venous thrombosis prevention measures before and after introduction of the measures derived from the failure mode and effects analysis.
ResultsA total of 59, 97 and 40 patients were included in phase 1, 3 and 4, respectively, with an analysis of the percentage of subjects who received thromboprophylaxis. The failure mode and effects analysis was used to detect potential errors associated to a lack of training and protocols referred to thromboembolic disease. An awareness-enhancing campaign was developed, with staff training and the adoption of a protocol for the prevention of venous thromboembolic disease. The prescription of preventive measures increased in the phase 3 group (91.7 vs. 71.2%, P=.001). In the post-checklist group, prophylaxis was prescribed in 97.5% of the patients, with an increase in the indication of dual prophylactic measures (4.7, 6.7 and 41%; P<.05). There were no differences in complications rate associated to the increase in prophylactic measures.
ConclusionsThe failure mode and effects analysis allowed us to identify improvements in the prevention of thromboembolic disease in critical patients. We therefore consider that it may be a useful tool for improving patient safety in different processes.
La trombosis venosa profunda y el tromboembolismo pulmonar constituyen la enfermedad tromboembólica venosa (ETV). Ambas representan complicaciones frecuentes, a menudo silentes, que incrementan la morbilidad y potencialmente la mortalidad de los pacientes1,2. Se estima que la ausencia de tromboprofilaxis (TP) es la responsable de la aparición de ETV hasta en un 31% de los pacientes en las unidades de cuidados intensivos (UCI)3, atribuyéndose al tromboembolismo pulmonar como causa de muerte en el 12-13% de los mismos4.
El estudio multicéntrico español sobre profilaxis de la ETV evidenció que en los hospitales de Madrid, el 82% de los pacientes tenían prescrita alguna medida de TP y que la existencia de un protocolo específico para la prevención de la misma solo estaba presente en el 50% de las UCI participantes5.
Tanto la administración de fármacos anticoagulantes como la instauración de medidas mecánicas no están exentas de complicaciones, siendo el sangrado y las lesiones cutáneas las más frecuentes, respectivamente. Por ello, la instauración de la profilaxis debe regirse por una valoración exhaustiva del riesgo de sangrado en relación con el de trombosis.
Dado que el retraso en el inicio de las medidas profilácticas más allá de las 24h de ingreso implica peor pronóstico6, su instauración es considerada actualmente como un indicador de calidad por nuestra sociedad científica (SEMICYUC) en materia de seguridad del paciente (SP)7.
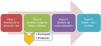
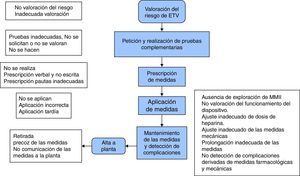
El presente estudio desarrolla las diferentes fases de un proyecto de mejora (fig. 1), cuyo objetivo general fue aumentar la SP mediante la prevención de la ETV en la UCI Polivalente del Servicio de Medicina Intensiva del Hospital 12 de Octubre. De forma paralela al proyecto se ha constituido una estructura de seguridad, sustentada en las herramientas de detección y análisis de los problemas de SP; un proceso de incorporación de acciones de mejora; y una posterior evaluación de los resultados, que ha seguido el esquema clásico en la evaluación de la calidad de Donabedian8.
El análisis modal de fallos y efectos (AMFE) constituyó el pilar central de nuestro trabajo. El AMFE es una herramienta para identificar y evaluar los fallos potenciales de los procesos, sus causas, así como los posibles efectos9. A pesar de que su origen se sitúa en la industria, es una herramienta muy útil para los procesos sanitarios10,11. Se estructura en 5 fases y utiliza un equipo interdisciplinario para evaluar proactivamente un proceso sanitario. En este caso, aplicamos un AMFE de proceso cuyo objetivo era discriminar y eliminar los fallos de seguridad de las medidas de profilaxis de la ETV.
El objetivo de la fase final del proyecto ha sido evaluar las mejoras en la seguridad de la profilaxis de la ETV implementadas en la Unidad Polivalente del Servicio de Medicina Intensiva tras la aplicación de las acciones de mejora priorizadas mediante la metodología AMFE.
Material y métodoSe realizó un estudio prospectivo diseñado en 4 fases. Se incluyeron todos los pacientes ingresados en nuestra UCI mayores de 18 años, quedando excluidos aquellos con ETV presente en el momento del ingreso o que recibían tratamiento anticoagulante previamente.
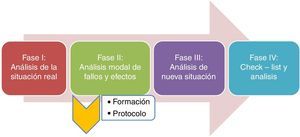
Fase I: de enero a abril de 2014; se realizó una valoración de la situación real en materia de prevención de ETV en nuestra UCI. Para ello, llevamos a cabo una recogida semanal de variables demográficas, motivo de ingreso, scores de gravedad, factores de riesgo para hemorragia mediante la escala de riesgo hemorrágico de la cohorte IMPROVE12, de trombosis con arreglo a la escala de Caprini13,14, así como medidas de prevención de ETV pautadas en nuestros pacientes.
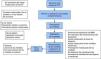
Fase II: de mayo a julio de 2014; se analizaron los datos recogidos mediante un AMFE10, una herramienta de análisis de calidad que requiere la participación de todo el personal implicado en el proceso y que trata la identificación, la evaluación y la prevención de los posibles fallos y efectos que pueden aparecer en un producto o servicio ofrecido. Prioriza fallos potenciales en función del riesgo, la posibilidad de ocurrencia y la posibilidad de detección, de manera que en función de estas prioridades se establecen acciones para disminuir la posibilidad del error/fallo. De nuestro AMFE surgió una campaña de sensibilización al personal, un paquete de medidas formativas tanto para medicina como para enfermería, así como el desarrollo de un protocolo de profilaxis de ETV (fig. 2).
Este AMFE de proceso se estructuró con base en la siguiente metodología:
- •
Área objeto de análisis: proceso de implementación de medidas profilácticas de ETV en la UCI Polivalente del Hospital 12 de Octubre.
- •
Elección de un equipo con experiencia en las terapias y en la herramienta de seguridad que cuente con capacidad de decisión en la organización: jefe de sección UCI Polivalente, jefe de la Unidad de Calidad, supervisor de Enfermería, médico adjunto experto, 2 residentes de Medicina Intensiva, 2 enfermeras expertas y una especialista de producto de la empresa suministradora de la tecnología.
- •
Desarrollo del diagrama de flujo del proceso (fig. 3): desarrollo gráfico de cada uno de los subprocesos en orden secuencial donde se recogen los posibles fallos que pueden aparecer en cada una de ellos.
- •
Determinación de fallos potenciales, causas y efectos de cada una de las actividades del proceso en una tabla AMFE.
- •
Análisis de cada una de las causas de fallo en función de su frecuencia, gravedad y posibilidad de detección. Se dan valores numéricos asociados (entre 1 y 10) a los ítems de una escala tipo Likert9.
- •
Obtención del número de priorización de riesgos (NPR) a través del producto de los 3 valores (frecuencia×gravedad×posibilidad de detección).
- •
Priorización de las causas de los fallos en función de su NPR.
- •
Propuesta de acciones de mejora para eliminar o mitigar aquellas causas con NPR más elevado.
- •
Desarrollo de indicadores de control y evaluación de las acciones propuestas.
- •
Evaluación del efecto de las acciones propuestas.
Fase III: de agosto de 2014 a enero de 2015: estudio de cohortes siguiendo la metodología de la herramienta AMFE. Se recogieron de nuevo semanalmente las mismas variables y con igual método de inclusión que en la fase i. Con ello, se realizó una comparación de las tasas de implementación de medidas profilácticas.
Fase IV: de febrero a marzo de 2015: se introdujo una checklist diaria, a pie de cama, mediante una herramienta informática, y se evalúo su impacto añadido a las mejoras implementadas en la fase iii.
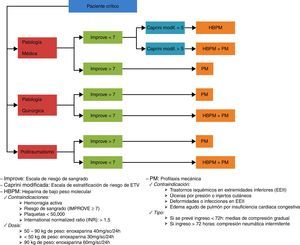
Las contraindicaciones absolutas para recibir profilaxis farmacológica fueron: la presencia de hemorragia activa, un elevado riesgo de hemorragia, valorado mediante la escala IMPROVE como una puntuación≥7, así como la presencia única de menos de 50.000 plaquetas o INR>1,5, mientras que el antecedente reciente de sangrado mayor o el descenso en las cifras de hemoglobina, que precisaron de transfusión, sin posibilidad objetiva de descartar foco hemorrágico activo, fueron causa de contraindicación relativa.
Por otro lado, los pacientes con trastornos vasculares isquémicos en las extremidades inferiores, úlceras por presión (UPP) o injertos cutáneos, deformidades o infecciones en las extremidades inferiores, así como aquellos en situación de edema agudo de pulmón por insuficiencia cardiaca congestiva o con edemas que excedieran los límites de las tallas de los dispositivos disponibles en la unidad fueron excluidos para recibir profilaxis mecánica.
Consideraciones éticasEl proyecto fue valorado por el Comité de Ensayos Clínicos del Hospital 12 de Octubre, que no consideró necesario solicitar el consentimiento informado.
Análisis de datosLas variables continuas se presentan como la media y su desviación estándar. Por otro lado, las variables cualitativas son expresadas como frecuencias relativas y absolutas. Se realizó un estudio de normalidad cuando fue necesario mediante análisis de histograma y test de Shapiro-Wilk. Se compararon medias mediante la prueba de la t o el text de Wilcoxon. Se realizaron contrastes de proporciones mediante el test de la Chi-cuadrado y el exacto de Fisher. Se fijó el nivel de significación estadística en 0,05. El análisis se llevó a cabo con el paquete estadístico SPSS® v22.0.0.
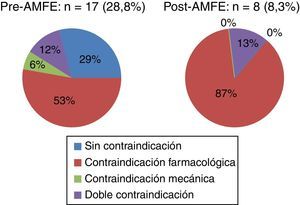
ResultadosEn el periodo pre-AMFE se recogieron 59 pacientes para su estudio. Las características epidemiológicas principales se muestran en la tabla 1. El 71,1% (42/59) (fig. 4) recibió profilaxis: de ellos, el 61,9% (26/42) mediante fármacos, el 33,3% con medidas mecánicas (14/42) y el 4,7% recibió profilaxis dual (2/42), cumpliendo criterios para la misma el 38,1% del total de los incluidos en el grupo. El 100% (26/26) de los pacientes que recibieron profilaxis farmacológica lo hizo mediante enoxaparina. La profilaxis mecánica se llevó a cabo mediante medias de compresión neumática intermitente (MCNI) en el 64,3% (9/14) de los pacientes, y las medias de compresión graduada se prescribieron en el 35,7% (5/14). El 28,8% (17/59) de todos los pacientes no recibió profilaxis (fig. 5). El 29,4% (5/17) de ellos no presentaba ninguna contraindicación, el 52,9% (9/17) presentaba contraindicación farmacológica y el 5,8% (1/17), contraindicación mecánica. Solamente el 11,6% (2/17) de los pacientes tenía contraindicación de medidas profilácticas farmacológicas y mecánicas. Se observó un tiempo de demora en la instauración de las medidas de prevención de 28h.
Características generales de los pacientes ingresados durante el periodo pre-AMFE y post-AMFE
| Pre-AMFE | Post-AMFE | |
|---|---|---|
| Pacientes | n=59 | n=97 |
| Enfermedad de ingreso, % | Infecciosa 27,8 | Infecciosa 28,8 |
| Respiratoria 19,4 | Respiratoria 22,6 | |
| Neurológica 19,4 | Neurológica 20,6 | |
| Posquirúrgica 11,1 | Posquirúrgica 13,4 | |
| Tóxico-metabólica 11,1 | Tóxico-metabólica 9,2 | |
| Otras 11,2 | Otras 5,2 | |
| Edad en años, media±DE | 57,8±13,5 | 58,95±11,15 |
| Sexo, n (%) | Varones 37 (62,7) | Varones 56 (57,7) |
| Mujeres 22 (37,3) | Mujeres 41 (42,2) | |
| APACHE, media±DE | 18,61±9,3 | 18,1±8,8 |
| SOFA, media±DE | 7,3±3,0 | 8,0±3,0 |
| Fármacos vasoactivos, % | 30,5 | 34 |
| Ventilación mecánica, % | 71,2 | 67,0 |
Sin diferencias significativas (p>0,05).
Con el desarrollo y análisis del AMFE, los principales fallos potenciales detectados sobre cada uno de los subelementos del diagrama de flujo establecido y sobre los que se realizó la intervención por NPR fueron: 1) la ausencia o inadecuada valoración del riesgo de ETV; 2) la ausencia o petición de pruebas inadecuadas; 3) la ausencia de prescripción de medidas; 4) los errores en la aplicación de las medidas prescritas, y 5) el mantenimiento de estas y la detección de complicaciones; todos ellos, relacionados con el déficit en formación (NPR 486, 540, 729, 640 y 810, respectivamente), así como con la falta de protocolos relacionados (NPR 486, 486, 315, 0 y 810, respectivamente).
Tras el análisis, las acciones de mejora propuestas fueron: la elaboración de un protocolo de prevención de ETV que incluía las indicaciones, las contraindicaciones, la dosificación y los factores de riesgo tanto de desarrollar ETV como de sangrado mediante escalas (fig. 2). Asimismo, se desarrolló una campaña de sensibilización hacia el personal en materia de ETV mediante carteles informativos en la unidad y la realización de sesiones formativas dirigidas tanto al personal médico como de enfermería de la unidad. También se plantea reforzar la sensibilización del personal mediante la implementación a posteriori de una checklist diaria si fuera necesario.
En el periodo post-AMFE se recogen 97 pacientes de características muy similares a la primera cohorte (tabla 1). El 91,7% (89/97) de los pacientes recibió profilaxis de ETV (p<0,001) (fig. 4); en el 77,5% (69/89) fue farmacológica, en el 15,7% (14/89) mecánica y la dual fue recibida por el 6,7% (6/89) de los pacientes, habiendo cumplido criterios para ella el 47,1% del total de los pacientes. El 100% (69/69) de los que recibieron profilaxis farmacológica lo hizo mediante enoxaparina. La profilaxis mecánica se llevó a cabo mediante MCNI en el 60,0% (12/20) de los pacientes y las medias de compresión graduada se prescribieron en el 40,0% (8/20). Finalmente, el 7,2% (7/97) del total de los pacientes (fig. 5) presentaron un alto riesgo de sangrado, pero no recibieron profilaxis mecánica y solo el 1,0% (1/97) tuvo contraindicación para ambos tipos de medidas. El tiempo medio en la instauración de alguna medida profiláctica fue de 23h.
Tras la introducción de una checklist (fig. 4), mediante una herramienta informática a realizar a pie de cama durante la visita diaria a los pacientes, se incluyeron 40 pacientes a analizar. El 97,5% (39/40) de los pacientes recibió medidas profilácticas. De estos, el 46,1% tenía prescritos fármacos (18/39), el 12,8% (5/39) mecánica, y la doble profilaxis ascendió al 41,0% (16/39) de los pacientes, estando indicada en todos ellos (p<0,001). Solo un paciente (2,5%) tenía doble contraindicación para medidas de ETV. Todos los individuos con indicación de profilaxis farmacológica recibieron enoxaparina, mientras que entre los que recibieron profilaxis mecánica, el 66,7% (14/21) adoptó medias de compresión graduada y el 33,3% (7/21) MCNI. El tiempo medio en la instauración de alguna medida profiláctica fue de 23h.
Aunque el porcentaje de pacientes con profilaxis de ETV aumentó post-checklist con respecto al grupo post-AMFE, mediante el test exacto de Fisher no se alcanzó la significación estadística (p=0,28).
No se registraron casos de sangrado grave en relación con el uso de heparina. Únicamente aparecieron hematomas locales en la pared abdominal en el 59,8% (79/139) de los pacientes tratados con enoxaparina, sin presentar abscesificación ninguno de ellos. En 2 casos, con sospecha de trombocitopenia inducida por heparina, se solicitó la determinación de anticuerpos mediante ELISA, que si bien resultaron negativos, conllevaron previamente la sustitución temporal de la profilaxis farmacológica por profilaxis mecánica.
La única complicación asociada a la profilaxis mecánica fue la presencia de UPP. Aparecieron en 4 (2,0%) y 6 (3,0%) pacientes en la fase pre y post-AMFE, respectivamente (p>0,05). Cuatro de estos pacientes presentaron UPP grado i y 2 de ellos UPP grado ii.
DiscusiónAunque hay pocos ensayos clínicos en pacientes críticos sobre el uso de la TP, las guías de la ACCP 2012 recomiendan su implementación con un grado de recomendación 2C15, al igual que las guías NICE16. Igualmente, nuestra sociedad científica, SEMICYUC, establece la implantación de dichas medidas como un indicador de calidad de nuestro trabajo7.
A pesar de lo anterior, inicialmente un 28,8% de nuestros pacientes no recibieron ningún tipo de medidas profilácticas de ETV. Además, existía una baja utilización de doble profilaxis en pacientes de muy alto riesgo, por lo que con base en estos datos, presentábamos un campo de mejora potencial en nuestra unidad. Recientemente, en el estudio multicéntrico PROF-ETEV, realizado en pacientes críticos en España, se pone en evidencia la escasa prescripción de estas medidas, no presentes hasta en un 19% de los pacientes, con un uso infrecuente de doble profilaxis (11%) y la escasa presencia de protocolos específicos en nuestras unidades17. Algo similar ha sido igualmente reportado en distintos estudios de diferentes países, lo que pone de manifiesto, una vez más, la baja adherencia a las guías clínicas que en ocasiones existe en nuestro medio18.
En nuestro servicio, todos los pacientes que requirieron profilaxis farmacológica recibieron HBPM, en concreto, enoxaparina ajustada al peso corporal (fig. 2), procurando su administración en el turno de tarde para facilitar por la mañana la realización de las técnicas o intervenciones programadas, sin necesidad de interrumpir la profilaxis. No se objetivaron complicaciones graves derivadas de la administración de HBPM, siendo frecuentes los hematomas en el tejido celular subcutáneo, aunque sin trascendencia clínica. Los niveles de anti-Xa fueron determinados en pacientes con obesidad mórbida o fracaso renal según nuestro protocolo.
La profilaxis mecánica se recomienda en pacientes con contraindicación para recibir profilaxis farmacológica según la ACCP15, siendo muy pocos los individuos en nuestra serie que no podían recibirla. Las MCNI fueron las más utilizadas, al igual que en el estudio de García-Olivares et al.17, si bien es posible que no pudiéramos aumentar las cifras de su uso debido a limitaciones en el número de dispositivos disponibles en la unidad en ese momento. La presencia de UPP grado i y ii superficiales fue poco frecuente, al igual que en la serie de Knudson et al.19. Todas ellas se registraron con los sistemas de MCNI como consecuencia de un problema de tallaje de estas, que se solventó con la proporción de la totalidad de tallas por parte del proveedor. Además, esto sirvió para la realización de seminarios formativos dirigidos a Enfermería para la prevención y el manejo de UPP en UCI.
Conforme a nuestro protocolo, los pacientes posquirúrgicos y politraumatizados, sin contraindicación para la profilaxis farmacológica y con bajo riesgo de sangrado (IMPROVE<7), son candidatos a recibir doble profilaxis dado su elevado riesgo de trombosis per se. Sin embargo, los pacientes médicos, además de las 2 premisas anteriores deben presentar un elevado riesgo de trombosis (Caprini>5). Las medidas adoptadas inicialmente post-AMFE no fueron suficientemente eficaces para la prescripción de TP, siendo la checklist diaria la herramienta que nos permitió cubrir al 100% de los pacientes con esta indicación.
Las enfermeras, encargadas de cubrir las necesidades de los pacientes a pie de cama, son responsables de la instauración y el mantenimiento de las medidas mecánicas, así como de los cuidados preventivos o curativos del deterioro de la integridad cutánea en nuestra unidad, y por eso fueron involucradas en nuestro proyecto formando parte del equipo investigador. Por tanto, el papel del trabajo en equipo y la comunicación fluida entre medicina y enfermería es fundamental no solo a la hora de prevenir los riesgos asociados a la ETV, sino también para evitar errores en el cuidado con el fin de mejorar la SP20–22. Dicha seguridad es un proceso dinámico que valida la calidad de la atención ofrecida. En este sentido, el AMFE ha sido aceptado como una herramienta útil que permite reconocer fallos potenciales dentro de un proceso sanitario, las consecuencias y las medidas para minimizarlos desde los análisis y enfoques de diferentes profesionales sanitarios23. La evaluación de nuestro AMFE de proceso permitió la elaboración de un protocolo específico de ETV, una campaña de formación del personal y la elaboración de una checklist diaria que han mejorado la eficacia, la seguridad, así como la calidad en la asistencia de nuestros pacientes18,24.
La existencia de protocolos asistenciales nos parece básica para mejorar la SP, ya que evitan la variabilidad en la atención de nuestros pacientes e incluso disminuyen la estancia en la UCI, como ya ha demostrado la implementación de alguno de ellos en dichas unidades25–27. En este sentido, la instauración de nuestro protocolo y la formación del personal optimizaron la prescripción de medidas de prevención de ETEV, pasando de un 72,8 a un 97,5% los pacientes que las recibieron.
La introducción de una checklist a la práctica clínica diaria ha permitido obtener resultados favorables en las extubaciones precoces del paciente28, la prevención de infecciones relacionadas con el catéter29,30, disminuir los errores por omisión31 e incluso, aunque con limitaciones, Weiss et al. demostraron una disminución de la mortalidad y de la estancia en UCI32. En nuestro estudio no solo permitió una mayor prescripción de la doble profilaxis, sino un mayor conocimiento y adherencia al protocolo.
Limitaciones del análisis modal de fallos y efectosLa principal limitación del uso del AMFE es su carácter cualitativo. Shebl et al.33 encontraron grandes discrepancias entre 2 equipos multidisciplinares que realizaron un AMFE para el uso de 2 antibióticos distintos. Concluyeron que el AMFE falla en validez aparente. Este mismo grupo de investigadores34 recomienda que no se utilice nunca como una herramienta cuantitativa para priorizar, promover o estudiar intervenciones sobre la SP. A pesar de sus limitaciones, esta herramienta nos aportó una metodología adecuada para la estandarización, el análisis y la esquematización del proceso clínico en el contexto de un grupo de trabajo multidisciplinar35, por lo que nos parece una herramienta muy útil para mejorar la SP en diferentes ámbitos.
ConclusionesDespués de la implementación de las medidas de mejora propuestas a través del AMFE hemos mejorado en la prescripción de medidas profilácticas en materia de ETV, consiguiendo alcanzar los estándares de calidad establecidos por nuestra sociedad científica (SEMICYUC). Consideramos esta herramienta de seguridad muy útil para mejorar diferentes procesos en la atención al paciente crítico.
Por otro lado, el manejo dinámico protocolizado y el uso de la checklist diaria ha permitido optimizar la eficacia y la eficiencia de los tratamientos profilácticos en nuestros pacientes.
FinanciaciónSe han recibido ayudas para el desarrollo de proyectos de investigación del Instituto de Investigación del 12 de Octubre, i+12, patrocinada por AMGEN S. A.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
A todo el staff médico y de Enfermería de la UCI Polivalente del Hospital 12 de Octubre, quienes participan activamente en la proporción de unos cuidados de calidad hacia nuestros pacientes.