INTRODUCCION
La "neumonía asociada a intubación" es la neumonía que se desarrolla en un paciente en ventilación mecánica después de la intubación. La neumonía nosocomial es la principal causa de muerte debida a infecciones adquiridas en el hospital. El 20% de los pacientes intubados y hasta e1 70% de los pacientes con síndrome de distrés respiratorio agudo desarrollan neumonía asociada al respirador. En pacientes intubados y ventilados mecánicamente, la incidencia de neumonía asociada a ventilación mecánica es del 1% por día durante el primer mes de ventilación mecánica. La tasa de mortalidad de la neumonía asociada a ventilación mecánica puede superar el 50%, especialmente si en la infección participan microorganismos multirresistentes, como estafilococos resistentes a meticilina (MRSA), Pseudomonas aeruginosa y Acinetobacter baumanii, que son particularmente frecuentes en pacientes que han recibido previamente terapia antibiótica por neumonía asociada a ventilación mecánica.
EXPOSICION
Procedimiento diagnóstico en la neumonía asociada a ventilación mecánica1
El diagnóstico clínico se establece cuando el paciente presenta un infiltrado pulmonar nuevo o progresivo en la radiografía de tórax y, al menos, dos de los siguientes criterios: fiebre superior a 39 °C, secreciones traqueales purulentas, leucopenia o leucocitosis con desviación a izquierda (> 10% de bandas) o deterioro de la oxigenación (> 15% de disminución de la relación PaO2/FiO2). La traqueobronquitis purulenta puede distinguirse de la neumonía asociada a la ventilación mecánica por la ausencia de un infiltrado radiológico compatible. Esta definición clínica de neumonía tiene una alta sensibilidad, pero en los pacientes con otros procesos, incluyendo el infarto pulmonar, el edema pulmonar o la atelectasia, pueden confundirse con una neumonía adquirida en el hospital. El sobrediagnóstico de la neumonía asociada a ventilación mecánica es, por tanto, preocupante. En pacientes intubados y ventilados, se ha propuesto que una forma de solventar este problema es la evaluación bacteriológica cuantitativa de las muestras broncoscópicas de las infecciones de las vías respiratorias bajas. Los estudios microbiológicos se deberían comenzar con una tinción de Gram de las muestras respiratorias, dado que esto proporciona importantes datos que orientan en la elección inicial antibiótica. Una tinción positiva de Gram y, específicamente, la presencia de bacterias intracelulares pueden ser de gran ayuda en la selección inicial del antibiótico, aunque aproximadamente un tercio de los episodios causados por P. aeruginosa, así como la mayoría de pacientes que reciben esteroides, se asocia a tinciones negativas de Gram. Las principales técnicas para el diagnóstico en pacientes intubados son:
1. Hemocultivos. Su sensibilidad en el diagnóstico de la neumonía asociada a ventilación mecánica resulta baja. Además, la especificidad también es baja, dado que la bacteriemia puede proceder simultáneamente de focos pulmonares y extrapulmonares (p. ej., una sepsis relacionada con un catéter intravascular). Los microorganismos que crecen en la sangre también deberían encontrarse en secreciones respiratorias antes de que puedan considerarse microorganismos causales de la neumonía.
2. Cultivo y análisis del líquido pleural. En caso de derrame pleural paraneumónico importante, debería realizarse un toracocentesis a fin de excluir un empiema. Sin embargo, en la práctica este procedimiento resulta de poca ayuda en el aislamiento de agente etiológico.
3. Toma de muestras no invasiva de secreciones respiratorias. Pueden obtenerse aspirados endotraqueales utilizando un catéter de aspiración estéril endotraqueal con una trampa colectora.
4. Toma de muestras invasiva de secreciones respiratorias:
a) Toma de muestras no broncoscópica (ciega) de vía aérea distal:
Catéter telescopado protegido.
Lavado broncoalveolar (BAL) protegido.
b) Toma de muestras broncoscópica de la vía aérea distal:
BAL.
BAL protegido.
Catéter telescopado.
Los cultivos cuantitativos de secreciones respiratorias se han utilizado para definir si existe una neumonía (tabla 1).
La punción percutánea y aspiración con aguja fina es más probable que proporcione un diagnóstico específico en la neumonía bacteriana. Sin embargo, puede fracasar a la hora de poner de evidencia el diagnóstico microbiológico, aun a pesar de existir microbios en el parénquima pulmonar. Además, puede causar un alto grado de morbilidad: neumotórax (frecuente tras la punción) en pacientes no ventilados, por lo que está relativamente contraindicado en pacientes ventilados, y posiblemente de forma absoluta en los que están con PEEP. La obtención de muestras mediante aspiración a través del tubo endotraqueal es menos probable que proporcione el diagnóstico, ya que se coloniza rápidamente con flora oral. La correlación de los hallazgos con los microorganismos del parénquima es baja. La biopsia transbronquial es de ayuda en el diagnóstico de una infección oportunista invasiva. No tiene ningun valor, sin embargo, en el diagnóstico de neumonías nosocomiales no oportunistas, ya que las muestras están contaminadas de secreciones de la vía aérea superior. Aunque con esta técnica pueden existir barotrauma y hemorragia, se acostumbra tolerar bastante bien y su morbilidad asociada se espera que sea menor que la de la punción con aguja en el paciente ventilado y que recibe PEEP con una coagulación normal.
La tinción de Gram puede ser de ayuda para orientar la terapia, pero no constituye un estándar de oro diagnóstico.
La evaluación de la infección pulmonar es a menudo compleja, prefiriéndose en general una técnica agresiva. La elección entre la biopsia transbronquial o a cielo abierto depende de las condiciones del paciente y de la localización y carácter del proceso. A menudo el paciente no tolera la biopsia transbronquial, debido a la diátesis hemorrágica.
En pacientes en los que existe alto índice de sospecha de virus, hongos o neumonía parasitaria, se prefiere el diagnóstico definitivo inmediato con tejido, la antibioterapia no debería postergarse en espera del resultado de la biopsia y un tratamiento durante 24 h no alterará el resultado del diagnóstico con biopsia de una neumonía fúngica, vírica o parasitaria.
En el paciente adulto con leucemia aguda, la presencia de infiltrados pulmonares difusos requiere una estrategia más agresiva y temprana en comparación con el caso de infiltrados localizados, en los que la terapia empírica puede ser útil. Se ha demostrado la relativa seguridad de la biopsia transbronquial en pacientes ventilados (incluso con PEEP > 10 cmH2O).
En el sida, la infeccion pulmonar constituye un desafio. Hoy parece que el diagnóstico de la neumonía secundaria a Pneumocystis carinii (PCP), la infeccion más frecuente de este grupo, puede realizarse mediante BAL en la mayoría de los pacientes. Combinando BAL, biopsia transbronquial y telescopado, se aumenta el rendimiento. El diagnóstico también se puede realizar mediante examen del esputo. Ya que los pacientes con sida pueden presentar neumonía a Pneumocystis carinii (PCP) incluso en ausencia de alteraciones en la radiografía de tórax, si existe un aumento de gradiente de oxígeno alveoloarterial significativo se recomienda una fibrobroncoscopia con BAL, catéter telescopado y biopsia tempranos. Los pacientes con PCP invariablemente presentan gamagrafía pulmonar con galio positiva, incluso aunque la radiografía sea normal.
En general, cuanto más grave esté el paciente, más invasivas han de ser las técnicas diagnósticas, desde la punción aspiracion transtraqueal o transtorácica con aguja, el lavado broncoalveolar, la biopsia transbronquial hasta la biopsia pulmonar a cielo abierto. Pero en este subgrupo de enfermos se utiliza raramente la primera por la morbilidad asociada, que es inaceptablemente alta. Dado que a menudo se requiere tejido pulmonar para el diagnóstico, y la biopsia a cielo abierto garantiza virtualmente suficiente tejido, muchos expertos se decantan por ella, y precozmente. Otros son partidarios de una actitud más cauta. Se han publicado numerosos artículos sobre las ventajas diagnósticas relativas (sensibilidad, especificidad y valor predictivo) de diferentes técnicas de toma de muestras en el diagnóstico de la neumonía asociada a ventilación mecánica. Esta estrategia es controvertida, porque se basa en definir una concentración microbiológica límite (unidades formadoras de colonias, o ufc) para distinguir la neumonía asociada a ventilación mecánica de la colonización traqueal (103 ufc/ml en el caso del catéter telescopado protegido; 104 ufc/ml en el caso del BAL, y 105 ufc/ml en el caso de la aspiración endotraqueal). La especificidad global de estos puntos de corte para el diagnóstico de la neumonía asociada a ventilación mecánica es de hasta el 90% en la mayor parte de las series. Aunque las concentraciones por encima de estos puntos de corte son altamente específicas, concentraciones inferiores pueden ser clínicamente significativas en algunos casos, como pacientes que reciben una dosis de un nuevo antibiótico ante la sospecha clínica de neumonía antes de la toma de muestras de secreciones respiratorias. La exposición a nuevos antibióticos es el factor principal que, con mayor frecuencia, reduce la concentración bacteriana de los organismos en los cultivos, induciendo erróneamente al clínico a establecer un diagnóstico de colonización. Algunos investigadores han propuesto esperar de 24 a 48 h en pacientes con sospecha de neumonía asociada a ventilación mecánica, a fin de mejorar el rendimiento microbiológico. Esta estrategia debería ser desaconsejada, dado que se retrasa el inicio del tratamiento antimicrobiano en la neumonía asociada a ventilación mecánica, lo que aumenta el riesgo de mortalidad. Estudios recientes2,3 han comunicado que la sensibilidad y especificidad del catéter telescopado o del lavado broncoalveolar son aceptables en pacientes que reciben durante largos períodos antibióticos por una infección previa. Ello se debe a que la mayoría de los microorganismos causantes de la neumonía asociada a ventilación mecánica en estos casos son resistentes a los antibióticos previamente administrados. En contraste, numerosos estudios4,5 han descrito una disminución de la sensibilidad diagnosticada de las muestras debido a la reciente introducción de nuevos antibióticos. Por ello, deben realizarse esfuerzos para obtener muestras respiratorias antes de iniciar la nueva terapia antibiótica.
Se ha recomendado6 que las investigaciones sobre las técnicas diagnósticas en la neumonía asociada a ventilación mecánica dejen de centrarse en la precisión diagnóstica (sensibilidad y especificidad) y en la definición de los límites específicos para establecer el diagnóstico de neumonía. En lugar de ello, la investigación de la neumonía asociada a ventilación mecánica debería centrarse en la evaluación del impacto sobre la evolución. Estos estudios deberían demostrar el modo en que las diferentes técnicas y estrategias diagnósticas mejoran la evolución de los pacientes, de un modo mesurable, como, por ejemplo, la reducción de la mortalidad o la reducción general en la frecuencia de desarrollo de resistencias antibióticas en cuidados intensivos. Reduciendo el uso de cobertura antimicrobiana de amplio espectro, disminuiría la presión selectiva del uso antibiótico y se evitaría el desarrollo de resistencias antibióticas. Esta posibilidad no debe ser infravalorada debido al aumento de mortalidad en la neumonía asociada a ventilación mecánica causada por organismos multirresistentes.
Se ha dedicado mucho más tiempo y esfuerzo a la búsqueda del test diagnóstico ideal para la neumonía asociada a ventilación mecánica con la más alta sensibilidad y especificidad, que en la evaluación del impacto de diferentes tests diagnósticos sobre la evolución. En el momento de escribir este trabajo, diversos estudios recientes7-11 se han centrado en la evaluación del impacto sobre la evolución. En el estudio piloto de Sánchez-Nieto et al11, 50 pacientes con sospecha de neumonía asociada a ventilación mecánica fueron aleatorizados para seguir dos estrategias diagnósticas: cultivo cuantitativo de aspirados endotraqueales y telescopados y lavado broncoalveolar ("estrategia invasiva") frente al cultivo cuantitativo de aspirados traqueales ("estrategia no invasiva"). No se hallaron diferencias en cuanto a morbilidad, valorada por la duración de la estancia en la UCI y por la duración de la ventilación mecánica, ni en cuanto a la mortalidad entre los dos grupos de estudio. Este estudio piloto, que era reducido y no era ciego, demostró que los cultivos cuantitativos del aspirado bronquial representan una alternativa fiable a las técnicas invasivas y no se asocian a una peor evolución.
Fisiopatogenia
La mayoría de los autores coinciden en que la neumonía asociada a ventilación mecánica se desarrolla como consecuencia de la aspiración de secreciones contaminadas con organismos patógenos que parecen adquirirse por vía endógena. Estos patógenos alcanzan la vía distal mediante el reflujo y aspiración mecánicos de contenido gástrico contaminado, y también mediante la inoculación repetitiva de secreciones de la vía aérea superior hacia el árbol traqueobronquial distal.
Es interesante destacar que en la orofaringe, senos, tráquea y tracto intestinal superior se produce una translocación bacteriana dinámica, que a menudo precede al desarrollo de la neumonía nosocomial. Al parecer dicha translocación se produce en relación con interacciones entre las bacterias y las superficies mucosas, a través de adhesinas que se unen a los receptores de superficie del huésped. Normalmente la superficie luminal de la orofaringe está recubierta de fibronectina, que proporciona una superficie de adhesión para los estreptococos orales. La disminución de la fibronectina salivar que presentan a menudo los enfermos críticos, fundamentalmente debido a la presencia de P. aeruginosa, Staphylococcus aureus, Clostridium, Bacteroides y otras especies bacterianas con actividad propia capaz de degradar la fibronectina, dificulta la adherencia de los cocos grampositivos, favoreciendo la adherencia de bacterias gramnegativas entéricas. En la placa subgingival de pacientes con periodontitis se encuentran grandes cantidades de bacterias gramnegativas, proporción que puede aumentar al utilizarse terapia antiácida con bloqueadores de los receptores H2. Entre los mecanismos de la colonización, por tanto, se incluye la pérdida de *-Streptococcus residentes normales, protectores, inhibidores, debido a la terapia antibiótica o a la degradación de la fibronectina oral, con adherencia de bacterias gramnegativas, en particular P. aeruginosa, que presentan un gran trofismo por la superficie traqueal lesionada. Así, se produce inoculación de la vía aérea por el uso de tubos traqueales con manguitos de baja presión, que proporcionan una vía directa a la tráquea de las secreciones almacenadas en la orofaringe y que se inoculan hacia la vía aérea distal en forma de embolada.
Es también conocida la capacidad del estafilococo para adherirse a las heridas, dispositivos intravasculares y prótesis, que tienen en común la génesis de conglomerados de fibrina. Resulta llamativo que la heparina puede reducir significativamente la adherencia de S. aureus a estos coágulos de fibrina. S. aureus y Haemophilus influenzae se aíslan frecuentemente en presencia de sangre en la vía aérea, aunque también pueden proceder de la vía hematógena12.
Recientemente se ha publicado la importancia de la placa dental como reservorio potencial de gramnegativos. Si esta placa dental va sufriendo acumulación, se produce inflamación subgingival que progresa hacia una periodontitis, con gran proliferación de gramnegativos. Aunque se estableció una asociación entre la caries dental y el desarrollo de abscesos pulmonares, no se ha estudiado la relación entre la enfermedad periodontal y la colonización de la orofaringe en pacientes hospitalizados, especialmente los que requieren intubación y ventilación mecánica. Por otra parte, se ha demostrado una correlación significativa entre el uso de antibióticos por vía sistémica y el aislamiento de enterobacterias respiratorias12. Así, la terapia antibiótica se asocia con un aumento de la colonización de la orofaringe y del tracto respiratorio superior por gramnegativos.
Barreras del árbol traqueobronquial
Las vías respiratorias inferiores están protegidas de la colonización bacteriana y, en un huésped normal, permanecen estériles. Los mecanismos de defensa son el aclaramiento mucociliar y, en menor grado, las inmunoglobulinas A. El aclaramiento mucociliar incluye el acoplamiento del latido ciliar y la viscosidad del moco. La tos también resulta eficaz en el aclaramiento de la vía aérea y puede contribuir en un 50% de dicho aclaramiento en los casos de bronquitis crónica. La inflamación bronquial y traqueal produce un enlentecimiento del epitelio ciliar, favoreciendo la colonización bacteriana, particularmente por P. aeruginosa. La colonización e inflamación de la vía aérea tras la intubación puede aumentar la degradación de las inmunoglobulinas A, favoreciendo aún más la colonización por microorganismos gramnegativos12. La gran proliferación de P. aeruginosa en la tráquea puede ser debida a una lesión inducida por la vía aérea artificial y conversión del epitelio ciliar en un epitelio predominantemente no ciliar. La infección sinusal nosocomial se ha asociado a la intubación nasoorofaríngea, y el diagnóstico de sinusitis requiere un alto nivel de sospecha clínica, siendo confirmado mediante procedimientos de imagen. Casi siempre es suficiente la simple retirada del tubo nasoorofaríngeo sin otra terapia específica, lo que permite el aclaramiento de los senos, y en pocas ocasiones debe procederse al drenaje.
Tracto gastrointestinal superior
Numerosos estudios revisados en pacientes hospitalizados han demostrado el aumento de la colonización gástrica por microorganismos gramnegativos tras el tratamiento con bloqueadores H2 o antiácidos. Una posible explicación para el sobrecrecimiento gástrico por gramnegativos sería el aumento de flora gramnegativa, que contaminaría la saliva orofaríngea. Esta saliva contaminada se deglutiría en un ambiente gástrico favorable, permitiendo la proliferación bacteriana y la colonización gástrica por bacterias gramnegativas. El reflujo del contenido gástrico contaminado con bacterias y la aspiración mecánica de estos contenidos hacia el árbol traqueobronquial pueden favorecer el desarrollo de la neumonía asociada a ventilación mecánica. Excepcionalmente, la isquemia de la mucosa y su correspondiente translocación de bacterias entéricas y toxinas pueden contribuir a la patogenia de la neumonía nosocomial en el paciente crítico. Los riesgos específicos de la aspiración del contenido gástrico incluyen la posición supina y el tiempo de duración de esta posición.
Inoculación de la vía aérea
La intubación y la ventilación mecánica, así como la manipulación inadecuada de circuitos del respirador, constituyen uno de los factores de riesgo más importantes de desarrollo de neumonía nosocomial en pacientes hospitalizados. Una vez intubados, prácticamente todos los pacientes desarrollan aspiraciones de contenido orofaríngeo. Los balones de baja presión, que pueden conseguir un correcto sellado clínico a presiones inferiores a 30 cmH2O, producen una baja tasa de daño traqueal y son los que prácticamente siempre se utilizan en las UCI. Los balones más delgados de poliuretano son los que parecen producir menor incidencia de aspiración. Los cambios transitorios de la presión del balón a valores inferiores a los de la presión hidrostática de las secreciones almacenadas por encima de dicho balón permiten la entrada de estas secreciones en las vías aéreas inferiores. Además, los cambios de diámetro traqueal durante la ventilación pueden inducir que los canales del balón se expandan y contraigan, lo que permite el paso del contenido del balón hacia la tráquea. La superficie de los tubos endotraqueales a menudo se contamina con secreciones orofaríngeas infectadas que bañan la superficie externa del tubo endotraqueal, alcanzando la tráquea a través de los pliegues del balón, y posteriormente ascienden hacia el interior de la luz del tubo endotraqueal. Durante la ventilación mecánica habitual se producen "duchas" recurrentes de inóculos bacterianos hacia la vía aérea, produciendo bronconeumonía12. La mayoría de los aislamientos bacterianos obtenidos de los circuitos del respirador y de los condensados se pueden aislar previamente en cultivos de esputo, y la manipulación de estos circuitos favorece la contaminación de las vías respiratorias inferiores, demostrándose que cambiando los circuitos de ventilador cada 24 horas en lugar de con menos frecuencia aumenta el riesgo de neumonía12. Existe una pobre correlación entre la alta tasa de contaminación de nebulizados y la relativamente baja de neumonía nosocomial.
Defensas pulmonares del huésped
La neumonía representa la respuesta inflamatoria del huésped a la multiplicación de los microorganismos en la vía aérea distal. Dado que los agentes infecciosos tienen la capacidad de replicarse, un simple microorganismo, en ausencia de mecanismos de defensa, podría teóricamente llenar el pulmón, aunque afortunadamente éste está provisto de unos mecanismos de defensa eficaces y, cuando las bacterias alcanzan los alvéolos, se ponen en marcha mecanismos celulares (macrófagos alveolares, linfocitos y neutrófilos) y humorales para inactivar o destruir los patógenos invasores, distinguiéndose 6 etapas: reconocimiento microbiano para fagocitosis, destrucción intracelular de microbios, activación de linfocitos y macrófagos, reacción inflamatoria y respuesta inmunológica.
Efectos sistémicos de la neumonía
El impacto de la neumonía sobre la mortalidad puede resultar difícil de apreciar, dado que la ventilación mecánica a menudo es capaz de corregir las anomalías de ventilación/perfusión que la neumonía causa y evitar la muerte por hipoxemia refractaria. Así, la muerte resulta atribuible más a los efectos sistémicos de la infección o a la incapacidad de los pulmones para recuperarse de la insuficiencia respiratoria aguda. La neumonía es un factor etiológico reconocido de síndrome de distrés respiratorio agudo, síndrome séptico y shock séptico. Se ha descrito la neumonía como un factor precipitante de síndrome de distrés respiratorio agudo en un 12 a un 21%. Asimismo, la neumonía puede producir graves disfunciones orgánicas a distancia si se produce liberación sistémica de microorganismos, de sus productos o de mediadores de la inflamación. La modulación de citocinas como causa de daño orgánico es una nueva área de investigación. La liberación de citocinas, tanto locales como sistémicas, desempeña un papel importante en el desarrollo del síndrome de distrés respiratorio agudo.
Desarrollo y relaciones con el síndrome de distrés respiratorio agudo
El desarrollo de neumonía en pacientes con síndrome de distrés respiratorio agudo (SDRA) es frecuente, y tiene un impacto negativo sobre la supervivencia. Cuando el pulmón sufre un SDRA, disminuye su capacidad para responder a la amenaza bacteriana. Se han implicado numerosos defectos intrínsecos relacionados con cambios en el ambiente alveolar, anatomía del pulmón y función de las células fagocíticas. El edema pulmonar dificulta la actividad bactericida de los macrófagos alveolares, y el aumento de la concentración de proteínas en el líquido constituye un medio ideal para el crecimiento microbiano. También la función de los neutrófilos puede verse comprometida por el proceso inflamatorio: la intensa degranulación de los polimorfonucleares y la presencia de oxidantes en el medio alveolar se han implicado en la patogenia de la disfunción neutrófila alveolar.
Relación con infecciones extrapulmonares
Las infecciones extrapulmonares, complicación frecuente en pacientes con insuficiencia respiratoria, pueden afectar directamente a la capacidad pulmonar de eliminar las bacterias. Los pacientes con infecciones intraabdominales presentan un mayor riesgo de desarrollo de neumonía intercurrente. La isquemia intestinal puede favorecer la translocación bacteriana intestinal con extensión a los ganglios linfáticos regionales y al hígado. La acidosis y la malnutrición son enfermedades sistémicas que pueden afectar negativamente la inmunidad del huésped, favoreciendo el efecto inhibidor sobre la función de los macrófagos alveolares, la colonización de la vía aérea inferior por P. aeruginosa y la translocación bacteriana inducida por la endotoxemia.
Intervenciones terapéuticas
Finalmente, las intervenciones terapéuticas pueden afectar negativamente a un huésped ya comprometido. La administración de altas concentraciones de oxígeno afecta a la velocidad traqueal del moco y dificulta la actividad antibacteriana pulmonar. Diversos fármacos actúan sobre la función inmune, en particular dificultando la actividad bactericida de los macrófagos y de los polimorfonucleares: barbitúricos, aminofilina, digoxina, glucocorticoides y ciertos antibióticos. Los antibióticos pueden afectar de forma adversa al huésped dificultando los mecanismos de defensa del pulmón, facilitando la liberación de mediadores y favoreciendo la colonización y sobreinfección por microbios seleccionados13. Antibióticos como los macrólidos y las tetraciclinas inhiben la síntesis proteica reduciendo la liberación de quimiotácticos. La rifampicina y las tetraciclinas inhiben la actividad quimiotáctica de los polimorfonucleares. Las tetraciclinas y la bacitracina reducen la fagocitosis, mientras que el trimetropim-sulfametoxazol disminuye la destrucción intracelular. Además, los antibióticos activos sobre la pared celular inducen liberación de lipopolisacáridos bacterianos, un potente estímulo para la producción de TNF-*. La tasa de destrucción bacteriana por los antibióticos también es importante al determinar la liberación de TNF. Así, antibióticos como la amicacina o el imipenem causan una rápida destrucción bacteriana con mínima generación de TNF, mientras que otros agentes betalactámicos tienen una tasa de destrucción más lenta (ceftazidima, cefotaxima y aztreonam) y producen una mayor liberación de TNF. La ciprofloxacina genera valores intermedios de TNF.
La administración de determinado tipo de antibióticos a un paciente susceptible puede aumentar la probabilidad de que dicho paciente desarrolle lesión tisular por respuesta inflamatoria o shock tóxico. En pacientes en ventilación mecánica, el tratamiento antibiótico constituye el principal factor de riesgo para el desarrollo de colonización y sobreinfección de la vía aérea inferior por microorganismos multirresistentes13.
Prevención de la neumonía asociada a ventilación mecánica
Las recomendaciones que exponemos a continuación se basan en la evidencia14 y pueden clasificarse en medidas no farmacológicas y farmacológicas para la prevención de la neumonía asociada a ventilación mecánica.
A. Prevención no farmacológica de la neumonía asociada a ventilación mecánica
1. El factor más importante en la difusión de numerosos patógenos nosocomiales es la contaminación de las manos del personal hospitalario. Por tanto, el lavado de manos tiene un papel central en el control de la infección. Los microorganismos patógenos nosocomiales pueden hallarse en las manos tras la retirada de los guantes. Por consiguiente, independientemente de si se llevan unos guantes, deben lavarse las manos entre el contacto con un paciente y el contacto con otros. En las unidades de cuidados intensivos, en las que las bacterias resistentes a los antibióticos contaminan las manos, se recomienda una preparación antiséptica para el lavado.
2. Precauciones barrera. El uso de guantes y batas protectores disminuye la difusión de algunas infecciones causadas por microorganismos resistentes a los antibióticos, tales como las causadas por S. aureus resistente a la meticilina (MRSA) y enterococos resistentes a la vancomicina. Por tanto, se recomienda el uso de barreras cuando los trabajadores sanitarios toman contacto con pacientes colonizados o infectados con estos microorganismos patógenos. En el momento actual, no se recomienda el uso habitual de estas precauciones para todos los pacientes.
3. Posición de los pacientes. La posición semiincorporada del paciente en ventilación mecánica, con elevación entre 30 y 45° del cabezal, reduce la incidencia de aspiración y neumonía secundaria. Torres et al15 demostraron que la aspiración pulmonar de contenido gástrico en pacientes en ventilación mecánica se reducía mediante la posición semiincorporada del paciente. En un reciente estudio del mismo grupo16, se distribuyeron de forma aleatoria pacientes intubados y ventilados mecánicamente para colocarlos en posición semiincorporada o supina. La incidencia de neumonía nosocomial confirmada por microbiología fue significativamente inferior en el grupo semiincorporado (5%) que en el grupo en posición supina (23%). Un análisis multivariante halló que tanto la posición supina del cuerpo como la nutrición enteral continua a través de una sonda nasogástrica constituían factores de riesgo independientes de neumonía nosocomial. La ventilación mecánica prolongada (> 7 días) y la disminución del nivel de conciencia (puntuación de coma de Glasgow < 9) son factores de riesgo adicionales.
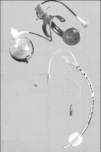
4. Medidas preventivas relacionadas con los tubos. Los tubos endotraqueal y nasogástrico deberían ser retirados cuanto antes. Cuanto más tiempo están colocados, mayor es el riesgo de distrés y neumonía. Por otra parte, la reintubación aumenta el riesgo de neumonía nosocomial en pacientes que requieren ventilación mecánica17. La intubación nasal durante más de 2 días constituye un factor de riesgo de sinusitis nosocomial, que a su vez predispone al paciente a desarrollar neumonía asociada a ventilación mecánica. El almacenamiento de secreciones por encima del manguito del tubo endotraqueal (espacio subglótico) puede causar neumonía asociada a ventilación mecánica. Vallés et al18, en un ensayo aleatorizado controlado, demostraron una reducción significativa de la incidencia de neumonía asociada a ventilación mecánica en pacientes sometidos a aspiración continua de las secreciones subglóticas (fig. 1). Además, para prevenir la migración de secreciones colonizadas del espacio subglótico hacia la vía aérea inferior, se requiere mantener una presión adecuada (< 25 cmH2O) de forma continuada del manguito del tubo endotraqueal19.
Fig. 1. Tubo endotraqueal destinado a evitar la aspiración de secreciones subglóticas. Las flechas indican la conexión a vacío para aspiración continua de secreciones subglóticas.
5. La mejor estrategia para prevenir la neumonía asociada a ventilación mecánica consiste en evitar la intubación endotraqueal, lo que resulta posible mediante el uso de ventilación no invasiva a presión positiva20. La aplicación de protocolos de weaning puede reducir la duración de la ventilación mecánica, tal como describieron Ely et al21, y puede disminuirse la incidencia de neumonía asociada a ventilación mecánica. En su estudio, el registro diario de la función respiratoria mediante ensayos de respiración espontánea aceleraba la desconexión de la ventilación mecánica.
6. Mantenimiento de las tubuladuras del circuito del respirador. En el líquido del condensado se hallan elevadas concentraciones de bacterias patógenas. Por tanto, se debería drenar periódicamente todo el líquido condensado que se recoja en las tubuladuras de un respirador. No se recomienda cambiar habitualmente los circuitos del respirador. En un ensayo controlado y aleatorio, Kollef et al22 no demostraron ningún beneficio en el recambio semanal del circuito frente al no recambio. Los medicamentos aplicados en nebulizadores a través de las líneas del respirador deberían ser lavados y limpiados después de cada uso, a fin de evitar la contaminación bacteriana. No son necesarios los cambios diarios del sistema de catéter de aspiración a través de las líneas del circuito. Los intercambiadores de calor y humedad constituyen una alternativa a los humidificadores. La humidificación mediante intercambiadores de calor y humedad no ha demostrado reducir de forma significativa la incidencia de neumonía asociada a ventilación mecánica, aunque evitan la formación de condensado. No se recomienda el cambio diario de los intercambiadores de calor y humedad, y algunos intercambiadores pueden mantenerse hasta una semana.
7. Nutrición. La mayoría de los estudios que demuestran que el soporte nutricional mejora la morbilidad y mortalidad se han realizado en pacientes traumatizados; no obstante, en la práctica se generalizan estos datos a todo tipo de pacientes críticos23. Es importante prevenir la aspiración asociada a la nutrición enteral. La cabecera de la cama debería elevarse a un ángulo de 30-45°. Se debería verificar la adecuada colocación de la sonda nasogástrica. Debería evitarse la sobredistensión gástrica monitorizando los volúmenes residuales gástricos y comprobando la motilidad intestinal (p. ej., auscultando la presencia de ruidos peristálticos abdominales).
8. Ajustar la sedación utilizando escalas de sedación, evitando la sedación y relajación innecesarias.
9. Evitar agentes inmunodepresores como glucocorticoides, pentotal o citotóxicos.
B. Prevención farmacológica y tratamiento de la neumonía asociada a la ventilación mecánica
1. Se ha recomendado la profilaxis sistemática de la úlcera de estrés para la prevención de la hemorragia gastrointestinal alta en pacientes críticos. Dos factores de riesgo independientes fuertemente predictivos de hemorragia son la insuficiencia respiratoria y la coagulopatía. Los pacientes en ventilación mecánica, por tanto, requieren una profilaxis de la úlcera de estrés; sin embargo, la neutralización del ácido gástrico elimina la "barrera ácida" que previene la colonización del estómago por diversas bacterias. En tres metaanálisis, el uso de sucralfato, que no altera el pH gástrico, se asoció con una menor incidencia de neumonía al compararlo con los antiácidos simples o en combinación con los bloqueadores H224-26. Los antiácidos aumentan tanto el pH gástrico como el volumen, mientras que los bloqueadores H2 elevan el pH gástrico sin aumentar el volumen gástrico. En un reciente ensayo multicéntrico a doble ciego, controlado con placebo, el grupo de estudios canadienses de cuidados críticos27 comparó el sucralfato con la ranitidina en la prevención de la hemorragia digestiva alta en 1.200 pacientes que requerían ventilación mecánica. Los pacientes que recibieron ranitidina presentaron una incidencia significativamente inferior de hemorragias digestivas altas clínicamente importantes que los tratados con sucralfato. No existieron diferencias significativas en cuanto a las tasas de neumonía asociada a ventilación, a la duración de la estancia en la UCI o a la mortalidad. Por consiguiente, parece que el péndulo ha oscilado en favor de los agentes bloqueadores H2. No existen ensayos controlados aleatorios sobre el posible efecto favorable de la nutrición enteral en la profilaxis de la úlcera de estrés.
2. Evitar antibióticos innecesarios. La exposición previa a los antibióticos constituye un factor de riesgo importante de neumonía asociada a ventilación por bacterias resistentes a los antibióticos. En un estudio observacional prospectivo, Trouillet et al28 observaron que la neumonía asociada a ventilación de inicio tardío (duración previa de la ventilación mecánica > 7 días) y el uso reciente de antibióticos (dentro de un margen de 15 días) constituyeron los dos factores clave en el desarrollo de la neumonía asociada a ventilación causada por bacterias multirresistentes comunes, tales como P. aeruginosa, A. baumanii, Stenotrophomonas maltophila y MRSA. La neumonía asociada a ventilación mecánica causada por microorganismos gramnegativos no fermentadores, en particular P. aeruginosa y especies de Acinetobacter, comporta un alto riesgo de mortalidad29. Por tanto, evitar el innecesario uso de antibióticos debería ser un componente importante en la prevención de la neumonía asociada a ventilación mecánica.
3. Tratamiento de la sinusitis maxilar. En un estudio aleatorio, Holzapfel et al30 demostraron que, en la búsqueda sistemática de la sinusitis nosocomial en pacientes ventilados mecánicamente, intubados por vía nasotraqueal que desarrollan fiebre, es útil la tomografía axial computarizada (TAC) de senos. En estos casos algunos autores recomiendan la punción-aspiración con aguja del seno correspondiente para realizar el cultivo cuantitativo y comenzar la terapia antibiótica por vía intravenosa.
4. La descontaminación selectiva digestiva se ha estudiado durante muchos años y se ha utilizado de forma mayoritaria en Europa. Incluye el uso de antibióticos tópicos, por vía oral intestinal, a menudo añadiendo un antibiótico sistémico durante los primeros días del régimen; su objetivo consiste en la eliminación de los patógenos potenciales del tracto gastrointestinal. El uso generalizado de la descontaminación digestiva selectiva no se ha adoptado, debido a la posible emergencia de microorganismos patógenos resistentes a los antibióticos por sobreuso de los antibióticos, al alto coste de la descontaminación selectiva digestiva y a la ausencia de un beneficio significativo sobre la mortalidad. El grupo de estudio francés realizó un ensayo controlado aleatorio en unidades de cuidados intensivos con el uso de la descontaminación selectiva digestiva con antibióticos no absorbibles31. La descontaminación selectiva digestiva no mejoró la supervivencia en pacientes en ventilación mecánica y en cuidados intensivos, aunque aumentó sustancialmente el coste de la asistencia. Un reciente metaanálisis demuestra una reducción ligera de la mortalidad, pero es consecuencia de una reducción significativa en el subgrupo que recibe antibióticos por vía parenteral.
5. Lavado oral con clorhexidina. La clorhexidina es un antiséptico con actividad frente a bacterias grampositivas y gramnegativas, así como frente a algunos hongos y levaduras. Es relativamente no irritante, destruye con rapidez los microorganismos y tiene una actividad antimicrobiana persistente. DeRiso et al32 evaluaron la eficacia del lavado oral con gluconato de clorhexidina al 0,12% sobre las infecciones nosocomiales en un ensayo clínico prospectivo a doble ciego y aleatorio, controlado con placebo, en pacientes sometidos a cirugía cardíaca. En este ensayo clínico aleatorio, el lavado oral con clorhexidina redujo la incidencia total de infecciones nosocomiales respiratorias en un 69% de los casos, y el uso de antibióticos sistémicos no profilácticos en un 65%, en comparación con los pacientes que recibieron placebo. Estos resultados son estimulantes e invitan a realizar ensayos adicionales sobre descontaminación orofaríngea con lavados orales con clorhexidina.
Tratamiento de la neumonía asociada a ventilador
La piedra angular de la terapia son los antibióticos. Dado que en el momento del diagnóstico clínico de la neumonía asociada a ventilación mecánica no se dispone de resultados de cultivo, la terapia antibiótica inicial es empírica, independientemente de qué técnica de cultivo se ha utilizado. Se ha demostrado10 que la terapia antibiótica inicial inapropiada es uno de los factores más significativos de mal pronóstico en la neumonía asociada a ventilación mecánica. Este hallazgo subraya la importancia crítica de establecer una antibioterapia inicial apropiada. La práctica estándar actual es la de iniciar una terapia antibiótica de "amplio espectro", "empírica" y, una vez que se conocen los resultados de cultivo, "optimar" la terapia antibiótica de acuerdo con el patógeno aislado.
Las orientaciones para la terapia empírica más difundidas se basan en las recomendaciones de la sociedad americana de tórax (American Thoracic Society, ATS)33 y se resumen en la tabla 2. Los pacientes con neumonía asociada a ventilación mecánica entran dentro de la categoría de neumonía grave adquirida en el hospital. El tratamiento empírico en estos pacientes suele incluir la combinación de antibióticos con actividad antipseudomónica ("cobertura doble" frente a P. aeruginosa), incluyendo generalmente un betalactámico y un aminoglucósido (que en teoría aumenta el sinergismo, pero que in vivo posiblemente sea dudoso al penetrar éstos mínimamente en el parénquima pulmonar), o bien un betalactámico y una quinolona. La adición de vancomicina ante un posible MRSA debe reservarse para aquellas unidades con una elevada incidencia en pacientes que han recibido tratamiento antibiótico previo, aunque más recientemente es posible que la incorporación de las nuevas oxazolidinonas (Linezolid®) o las estreptograminas (Synercid®) presenten también actividad frente a estos grampositivos34.
La tinción de Gram de muestras respiratorias1 acostumbra indicar los patrones bacteriológicos y ayuda en la toma de decisiones de la terapia inicial. La exposición previa a antibióticos debe ser considerada, dado que éste es un importante factor de riesgo de neumonía asociada a ventilación mecánica causada por bacterias resistentes a los antibióticos28.
Determinados factores de riesgo pueden orientar sobre el probable microorganismo responsable34 y, por lo tanto, ayudar en la decisión de la antibioterapia óptima empírica (tabla 3).
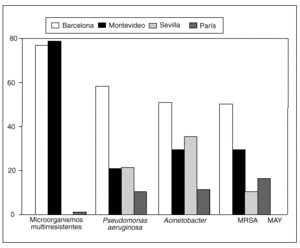
En cualquier caso, la variabilidad entre diferentes unidades35,36 impide la generalización de recomendaciones (fig. 2). En su lugar, cada UCI debería elaborar sus propias guías y actualizarlas periódicamente, de acuerdo con su sensiblidad, teniendo en cuenta que el objetivo es por encima de todo mejorar la evolución del paciente37. La tabla 4 resume los 10 principios generales de la política de antibióticos en el paciente crítico con neumonía nosocomial.
Fig. 2. Variabilidad de microorganismos causantes de neumonía asociada a intubación en 4 diferentes unidades de cuidados intensivos. MRSA: Staphylococcus aureus resistente a la meticilina.
Sin embargo, dado que los métodos diagnósticos (incluyendo hasta los más agresivos) continúan adoleciendo de grandes limitaciones, y dado que probablemente la antibioterapia empírica en pacientes con edema o infiltrados pulmonares de causa no infecciosa proporciona más desventajas que beneficios, la limitación terapéutica puede resultar ventajosa. A este respecto, un reciente trabajo38 demuestra que limitando el número y la duración del tratamiento antibiótico en pacientes con baja probabilidad de neumonía se reduce a menos de la mitad la presentación de resistencias bacterianas o de sobreinfecciones.