La monitorización exhaustiva del enfermo neurocrítico tiene como principal objetivo la prevención de la lesión secundaria. En los últimos años hemos asistido a un incremento en las herramientas de monitorización cerebral, más allá de la observación de la presión intracraneal y la presión de perfusión cerebral, toda vez que parece que estos sistemas, ampliamente empleados, proporcionan una información valiosa, pero posiblemente insuficiente. El reconocimiento y corrección de la hipoxia cerebral, cuya etiología puede ser muy variada, se postula como una medida interesante y útil, tanto desde el punto de vista diagnóstico como para orientar el tratamiento y vislumbrar un pronóstico. Sería deseable utilizar la información obtenida con los sistemas de monitorización de la oxigenación cerebral de forma integrada con el resto de dispositivos de la monitorización multimodal, para intentar proporcionar a cada paciente un tratamiento lo más individualizado posible.
The main goal of exhaustively monitoring neurocritical patients is to avoid secondary injury. In the last few years we have witnessed an increase in brain monitoring tools, beyond the checking of intracranial and brain perfusion pressures. These widely used systems offer valuable but possibly insufficient information. Awareness and correction of brain hypoxia is a useful and interesting measure, not only for diagnostic purposes but also when deciding treatment, and to predict an outcome. In this context, it would be of great interest to use all the information gathered from brain oxygenation monitoring systems in conjunction with other available multimodal monitoring devices, in order to offer individualized treatment for each patient.
La monitorización, en muchos casos exhaustiva, forma parte de la esencia del manejo del paciente en las unidades de cuidados intensivos (UCI) y es un elemento clave diferenciador con otras áreas del hospital. Facilita una visión amplia y un manejo integral del enfermo crítico, aporta datos para afianzar un diagnóstico y, aunque obviamente no constituye una medida terapéutica, nos ayudará a adoptar determinadas pautas de tratamiento, nos informará acerca de los resultados obtenidos y nos alertará en caso de que dichos resultados no sean los deseados.
En nuestras UCI empleamos sistemas de monitorización no invasivos (temperatura, tensión arterial no invasiva, electrocardiograma, patrón respiratorio, pulsioximetría, etc.) y otros mínimamente invasivos (gasto cardiaco y parámetros hemodinámicos, función y motilidad gastrointestinal, mecánica respiratoria, neuromonitorización…). En lo referente a la neuromonitorización, el avance experimentado en los últimos años proporciona al clínico una variada colección de herramientas para la evaluación del paciente con traumatismo craneoencefálico (TCE), hemorragia subaracnoidea (HSA), ictus o encefalopatía. En esencia, estos sistemas de neuromonitorización se centran en diversos parámetros: a) presión intracraneal (PIC) (cálculo de la presión en valor absoluto y análisis de la forma de la onda de presión) y presión de perfusión cerebral (PPC); b) flujo sanguíneo cerebral, fundamentalmente gracias a la ultrasonografía doppler transcraneal; c) oxigenación cerebral, mediante la oximetría venosa yugular (SjO2), la espectroscopia de haz de luz cercana al infrarrojo (near-infrared spectroscopy [NIRS]), la presión tisular de oxígeno (PTiO2) y la microdiálisis, y d) la monitorización electrofisiológica (potenciales evocados somatosensoriales, electroencefalograma continuo)1–3. La integración de la información que ofrecen los diferentes sistemas, conocida como monitorización multimodal, puede facilitar un manejo más preciso del paciente neurocrítico al mejorar la sensibilidad y especificidad respecto a las que cada sistema ofrece por separado.
Neuromonitorización: objetivoNuestro cerebro representa solo el 2-3% del peso corporal total, pero su actividad supone el 25% del gasto energético total, y a ella va destinado el 20% del gasto cardiaco. Sus elevadas demandas metabólicas así como su incapacidad para almacenar glucosa (su principal sustrato energético), oxígeno o moléculas fosfatadas de elevada energía explican su dependencia total de un aporte continuo de sustratos a través del flujo sanguíneo que permita asumir esta demanda4,5.
No hay datos concluyentes que demuestren una reducción de la morbimortalidad atribuible a la obtención de información mediante la monitorización: la monitorización en sí misma no es un tratamiento. El principal objetivo de la neuromonitorización consiste en detectar, para intentar evitar o reducir, la lesión cerebral secundaria, representada en la hipoxia e isquemia cerebral, la disfunción metabólica, la hipertensión endocraneal y la aparición de actividad comicial. El logro de este objetivo pasará por asegurar un adecuado aporte de oxígeno y sustrato metabólico al cerebro.
En las horas siguientes a un TCE tiene lugar una reducción del flujo sanguíneo cerebral y simultáneamente un incremento en sus demandas metabólicas6. El reconocimiento precoz de la lesión secundaria puede mejorar el tratamiento de la misma y, por tanto, el pronóstico del paciente.
Diversos estudios han puesto de manifiesto que la monitorización de la PIC y la PPC normales no son suficientes para garantizar una adecuada oxigenación cerebral, puesto que solo aportan información acerca de la hipoxia cerebral isquémica, pero es sabido que existen otros tipos de hipoxia tisular (cerebral). La lesión cerebral secundaria no siempre se asocia a valores patológicos en la PIC o en la PPC, de forma que, con valores normales de estos parámetros se puede producir daño neuronal e infarto cerebral6-8.
La PTiO2 es la presión parcial de oxígeno en el espacio extracelular cerebral. Es un parámetro de oxigenación cerebral que refleja el equilibrio entre la perfusión cerebral, la difusión del oxígeno en el tejido cerebral y el consumo celular de oxígeno. Puede presentar valores bajos o patológicos (hipoxia cerebral) en presencia de cifras de PIC y de PPC normales8,9.
El fundamento fisiopatológico de este hecho descansa en la descripción de los diferentes tipos de hipoxia tisular (en este caso, hipoxia tisular cerebral) que ofrece la clasificación de Sigaard-Andersen10:
- 1
Hipoxia isquémica por disminución del gasto cardiaco o del flujo sanguíneo cerebral
- 2
Hipoxia por baja extractividad de oxígeno cuyas causas pueden ser:
- a
Hipoxia hipoxémica: PaO2 baja
- b
Hipoxia anémica: concentración efectiva de hemoglobina baja
- c
Hipoxia por alta afinidad: una afinidad elevada de la hemoglobina por el oxígeno se refleja en un valor bajo de la p50 en la gasometría arterial (la p50 es la pO2 a la cual está saturada de oxígeno el 50% de la hemoglobina), y tiene lugar en aquellas circunstancias en las que la curva de disociación de la hemoglobina se desplaza hacia la izquierda (es decir, en caso de hipocapnia, hipotermia, alcalosis o defectos de fósforo o de 2-3 difosfoglicerato);
- a
- 3
Hipoxia por shunt en caso de cortocircuito arteriovenoso
- 4
Hipoxia por disperfusión por aumento en la distancia desde el eritrocito hasta la mitocondria (por swelling endotelial, por edema perivascular, intracelular o intersticial, por colapso de los capilares por presión u obstrucción por microembolia)
- 5
Hipoxia citotóxica en los casos en que diversos agentes tóxicos (p.ej. cianidas) inhiben la actividad enzimática de los citocromos necesaria para la reducción del oxígeno en la mitocondria
- 6
Hipoxia por desacoplamiento condición en la que determinados agentes, algunos terapéuticos, interfieren el acoplamiento entre la reducción del oxígeno en la mitocondria y la generación de ATP (el acoplamiento entre la reducción de oxígeno y la síntesis de ATP es una reacción muy eficiente desde el punto de vista bioenergético, y sustancias como los cumarínicos, los ácidos salicílicos, el dinitrofenol y algunos antibióticos y anestésicos locales como la bupivacaína pueden interferir en ella)
- 7
Hipoxia hipermetabólica en aquellas situaciones en las que el incremento en la hidrólisis de ATP no se ve equilibrado por un incremento en la síntesis de ATP (entre las causas de un aumento en la hidrólisis de ATP se encuentran la hipertermia y aquellas circunstancias en que se incrementa el requerimiento energético por actividad muscular, como hipertonía, ejercicio físico, temblor, calambres, etc.).
Apoyándonos en esta exhaustiva descripción de hipoxia tisular es fácil inferir que existe una multitud de factores que podrían explicar un valor bajo de PTiO2. En la práctica clínica, si bien la hipoxia isquémica por una elevada PIC o una PPC insuficiente es la más frecuente, existen otras causas de hipoxia tisular cerebral que podemos identificar con relativa facilidad10,11 como la hipocapnia e hipotermia, empleadas en ocasiones para el manejo del paciente neurocrítico grave, que pueden provocar la hipoxia por baja extractividad (la información obtenida de la gasometría arterial nos puede poner sobre la pista de estas circunstancias), o la hipoxia por anemia relativa.
Neuromonitorización. RecomendacionesSegún las últimas guías de tratamiento del TCE grave elaboradas por la Brain Trauma Foundation (BTF), la PIC debería monitorizarse en todos los pacientes potencialmente recuperables, con TCE grave (puntuación menor de 9 en la escala de coma de Glasgow [GCS] tras la resucitación) y con imágenes patológicas en la tomografía computarizada (TC), entendiendo estas como presencia de hematomas, contusiones, edema, herniación o compresión de las cisternas basales (nivel II) (tabla 1)12. En estas mismas guías se recoge, con un nivel de recomendación III, la monitorización de la PIC en pacientes con TCE grave y TC normal si además se cumplen al menos 2 de las siguientes circunstancias: edad mayor de 40 años, respuesta motora patológica uni- o bilateral y tensión arterial sistólica menor de 90mmHg. También con nivel III se recoge la recomendación de monitorizar la SjO2 o la PtiO2, puesto que valores inferiores a 50% en la SjO2 o inferiores a 15mmHg en la PtiO2 se consideran umbrales de tratamiento13.
Criterios para clasificación de evidencia
| Clase de evidencia | Diseño del estudio | Criterios de calidad | Nivel de recomendación |
| I | Aleatorizado controlado (alta calidad) | Asignación aleatorizada adecuadaAsignación con encubrimientoGrupos similaresTamaño de muestra adecuadoAnálisis por intención de tratarSeguimiento>85%, sin diferencias entre grupos | I |
| II | Aleatorizado controlado (calidad moderada)De cohortes (calidad buena)Estudio casos-control (de buena calidad) | Violación de 1 o más criterios de los estudios aleatorizados controlados de alta calidadEvaluación ciega o independiente en un estudio prospectivo, o uso de datos fiables en un estudio retrospectivoSelección sin sesgosSeguimiento>85%Adecuado tamaño de muestraAnálisis estadístico de posibles factores de confusiónVerificación precisa de los casosSelección sin sesgos de los casos/controles con criterios de exclusión aplicados a ambosAdecuada tasa de respuestasAtención adecuada a potenciales variables de confusión | II |
| III | Aleatorizados controlados (baja calidad)De cohortes (moderada o baja calidad)Estudio casos-controles (de moderada o baja calidad)Series de casos, bases de datos, registros | Violaciones de los criterios de estudios aleatorizados controlados de buena o moderada calidadViolación en uno o más criterios para un estudio de cohortes de buena calidadViolación de uno o más criterios para un estudio de casos-controles de buena calidad | III |
En el año 2008, la sección de Cuidados Neurointensivos y Medicina de Emergencia (NICEM) de la Sociedad Europea de Medicina Intensiva (ESICM) promueve la elaboración de un documento de consenso sobre neuromonitorización en cuidados neurocríticos14. En este documento, se admite que la evidencia es «suficientemente buena» para recomendar la monitorización de la PIC en pacientes con traumatismos graves, en los que exista elevado riesgo de padecer hipertensión endocraneal. En concreto, su recomendación se centra en aquellos pacientes potencialmente salvables, con TCE grave (es decir, puntuación menor de 9 en la GCS) y TC patológica. En lo referente a la monitorización de la PTiO2, el documento reconoce que existe una base fisiológica verosímil y suficientemente sólida para indicar que esta medida es una herramienta útil para el manejo de pacientes con TCE y HSA, apoyándose en el hecho de que la monitorización de la PTiO2 puede detectar cambios en la oxigenación cerebral que pueden pasar desapercibidos con el uso de sistemas de monitorización más globales como la SjO2 o la diferencia arterioyugular de O2 (AjDO2).
Presión tisular de oxígeno: buen marcador pronósticoEstá ampliamente admitido el valor de la PTiO2 como marcador pronóstico. Se consideran valores normales de PTiO2 los superiores a 25-30mmHg. Por debajo de 20mmHg se considera hipoxia leve; entre 15 y 20mmHg, moderada; grave entre 10 y 15mmHg y crítica por debajo de 5mmHg9. Así se propone como objetivo terapéutico conseguir valores superiores a 20mmHg. Las posibilidades de muerte o gran discapacidad aumentan en caso de periodos mantenidos de PTiO2<15mmHg. Valores inferiores a 15mmHg durante más de 4 h se asocian a una mortalidad del 50%. Si la PTiO2 es menor de 10mmHg durante más de 30 min, la mortalidad se eleva al 56%.
Esta contribución de una baja PTiO2 al mal pronóstico es independiente de las cifras de PIC o de PPC. Se han documentado episodios de hipoxia tisular moderada y severa, con resultado de la aparición de áreas de infarto cerebral, coexistiendo con valores normales de PPC9,15–17.
Presión tisular de oxígeno: utilidad como guía de tratamientoHemos mencionado que valores normales de PIC o PPC no aseguran una adecuada oxigenación cerebral. Pero ¿existe consenso acerca del valor «normal» de la PPC? El más comúnmente utilizado y el recomendado por la BTF es 60mmHg12; este objetivo puede ser correcto en algunos pacientes, pero para otros puede ser insuficiente y podrían necesitar presiones de perfusión en torno a 70mmHg, o incluso más. Existen trabajos en los que se registran valores de PTiO2 en rango hipóxico con valores de PPC de 60-70mmHg, e incluso en algunos con PPC superiores a 70mmHg. En algunos de ellos se han documentado cifras de PPC>60mmHg durante cerca del 50% del tiempo de hipoxia cerebral. La monitorización de la PTiO2 podría facilitar la optimización de la PPC, buscando un objetivo individualizado para cada paciente. De hecho, algunos autores solo han encontrado una asociación de PPC baja con pronóstico desfavorable, si coexistía una PTiO2 baja. Elevar la PPC de 60 a 70mmHg puede ser una estrategia para mejorar la oxigenación cerebral en casos de hipoxia tisular cerebral, una vez descartadas otras causas de hipoxia no isquémica, pero debemos recordar que las medidas terapéuticas necesarias para elevar la PPC no están exentas de riesgos. El tratamiento intensivo mediante repleción de cristaloides o el uso de fármacos vasoactivos se ha asociado a un incremento de las complicaciones respiratorias y cardiovasculares18–23, y podría contribuir también a un posible agravamiento del edema cerebral; de ahí el interés en que nuestro abordaje terapéutico sea lo más individualizado posible.
Por otra parte, existen estudios que han demostrado que la información obtenida mediante la monitorización de la PTiO2 precede en algunas horas a la ofrecida por otros métodos; en paralelo, otros trabajos han documentado cambios metabólicos indicativos de disfunción celular antes de que aparezcan incrementos de la PIC. Así, podríamos contar con una interesante ventana terapéutica, que nos permitiría adelantarnos y evitar que llegaran a presentarse eventos potencialmente deletéreos21–25.
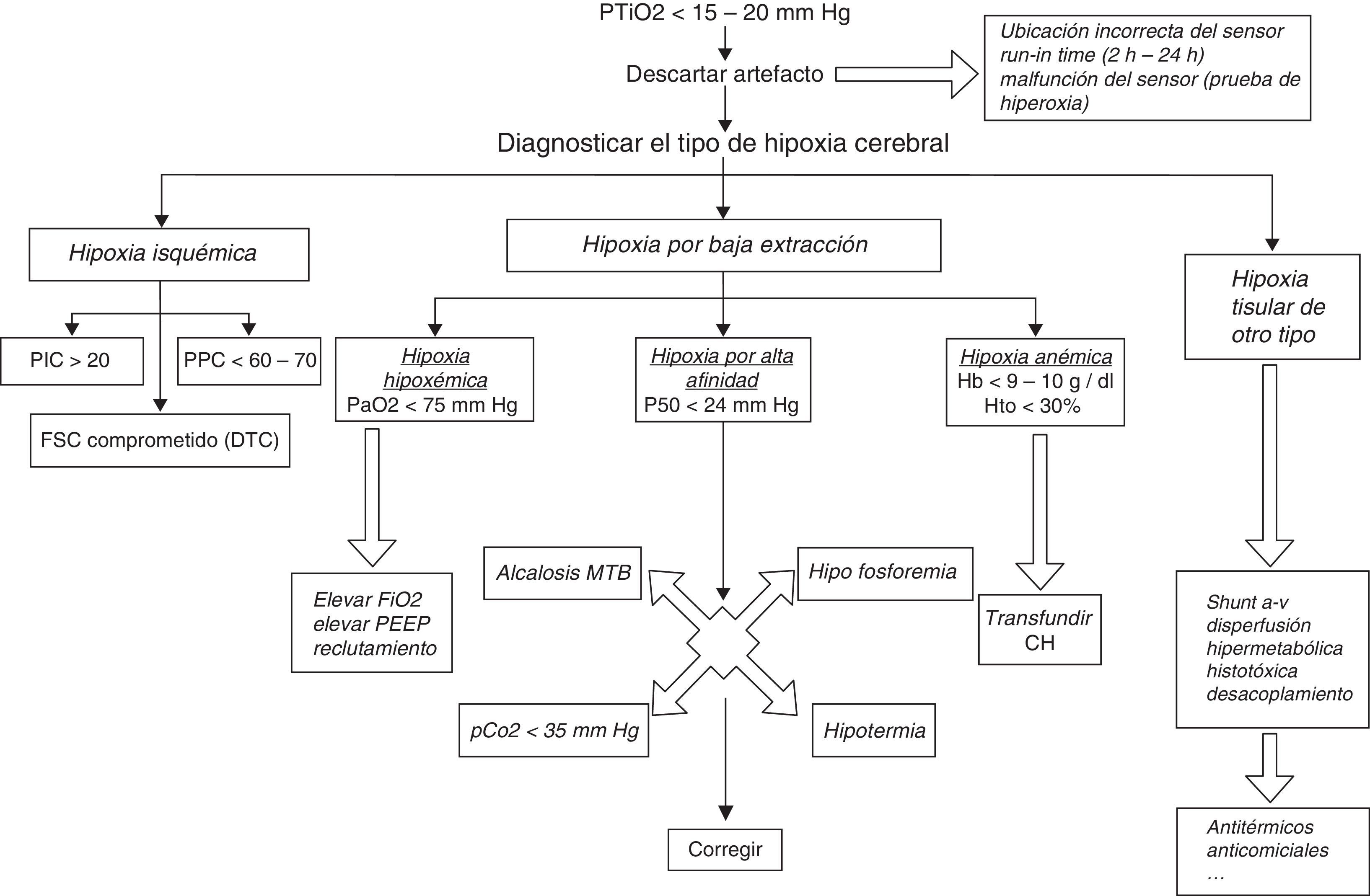
Cómo actuar ante un paciente con una presión tisular de oxígeno bajaProponemos un esquema sencillo que puede facilitar la toma de decisiones en casos de hipoxia cerebral puesta de manifiesto por un valor inferior a 15-20mmHg (fig. 1).
La causa más frecuente de hipoxia cerebral es la hipoxia isquémica, que se produce en caso de elevada PIC o de PPC insuficiente. Un trabajo publicado por Oddo et al.18 muestra las causas de hipoxia cerebral encontradas en un estudio sobre 103 pacientes. En un 50% de los casos, la hipoxia cerebral estaba motivada por una PIC elevada y una PPC baja; en un 25% encontró PIC normal con PPC baja; pero en el restante 25%, las causas de hipoxia cerebral eran otras: hipotermia, anemia relativa o hipoxemia.
Hipoxia hipoxémica. Utilidad de la hiperoxia normobáricaLa PTiO2 se relaciona directamente con la FiO2 administrada, es decir, una elevación de la FiO2 en el respirador consigue, en unos minutos, elevar la PTiO2. La utilidad de esta maniobra para mejorar la situación metabólica del tejido cerebral es más controvertida, como también lo es que ello sirva para mejorar el pronóstico de los pacientes. Algunos trabajos, utilizando técnicas de microdiálisis cerebral, han demostrado mejoría en algunos parámetros metabólicos al administrar FiO2 del 100% durante 24 h tras el TCE para elevar la PTiO2. En algunos casos, esta mejoría en la PTiO2 se ha acompañado de reducción de la PIC y elevación de la PPC, e incluso una tendencia a mejor pronóstico6,26,27. Este beneficio no ha sido confirmado en otros trabajos, en los que no se ha encontrado evidencia suficiente de un beneficio clínico de la hiperoxia en el TCE severo, con la mirada puesta en potenciales complicaciones asociadas a la hiperoxia normobárica como la reducción del flujo sanguíneo cerebral por vasoconstricción o la toxicidad pulmonar28. Por todo ello, podemos decir que el empleo de FiO2 de 100% en pacientes con TCE severo y PTiO2 baja sigue siendo controvertido, aunque la mayoría de los autores recomiendan elevar la PaO2 por encima de 100mmHg, sobre todo en casos de hipoxia cerebral.
Hipoxia por alta afinidad. El papel de la hiperventilaciónLa hiperventilación se ha empleado durante mucho tiempo como terapia para bajar la PIC, debido a su potente efecto vasoconstrictor cerebral. Esa vasoconstricción consigue, en efecto, disminuir la PIC, pero a costa de una reducción en el FSC, efecto que puede resultar deletéreo en pacientes con TCE, en los que es conocido que existe ya una reducción del FSC de hasta el 50% (sobre todo en las primeras 24 h)5. En el trabajo de Adamides et al.20 encuentran que un 25% de los episodios de hipoxia cerebral están ligados a hiperventilación, y que este riesgo de hipoxia asociada a hiperventilación va aumentando progresivamente, situándose el pico en torno al 5.° día tras el TCE. Las recomendaciones de la BTF también recogen como inadecuada la hiperventilación por aumentar el riesgo de hipoxia cerebral en el TCE grave. Solo se recomienda usar la hiperventilación para controlar la PIC de forma puntual, y, en todo caso, no emplearla las primeras 24 h tras un TCE. Según esta misma guía, en caso de recurrir a esta terapia, el aporte de oxígeno al cerebro debería estar monitorizado por PTiO2 o por SjO25,29–31.
Hipoxia anémica. El papel de los hemoderivados en la hipoxia cerebralLa anemia es una situación muy prevalente entre los pacientes ingresados en la UCI. En el caso de pacientes neurocríticos, es posible que contribuya a agravar la hipoxia tisular cerebral dado que la reducción en la concentración de hemoglobina implica una reducción en el contenido arterial de O2. Incluso una anemia considerada leve o moderada (con concentraciones de hemoglobina en torno a 10g/dl) puede inducir vasodilatación cerebral y, con ello, empeoramiento del edema y elevación de la PIC32.
La transfusión de concentrado de hematíes es capaz de elevar la PTiO2 en pacientes con TCE o HSA. Este efecto, que parece más acusado y prolongado entre los pacientes cuya PTiO2 pretransfusional es más baja, no está necesariamente asociado a un incremento de la PPC33,34.
La transfusión de concentrado de hematíes se considera un factor independiente predictor de mal pronóstico, asociado a un aumento en la morbimortalidad del paciente crítico, en general. De hecho, las recomendaciones de transfusión de hemoderivados han llevado a una política mucho más restrictiva en los últimos años. Sin embargo, cabría la posibilidad de que una adherencia estricta a estas recomendaciones no fuera lo más adecuado para los pacientes neurocríticos, en los que sería aconsejable encontrar un punto de equilibrio entre la anemia (que puede llevar a hipoxia tisular cerebral anémica, por baja extracción) y el riesgo asociado a la transfusión. No existen recomendaciones con nivel de evidencia I acerca de cuál debe ser el umbral de transfusión: algunos autores lo sitúan en 9g/dl, otros lo elevan a 10g/dl35 o hasta 12,5g/dl36. El tiempo de almacenamiento de los hematíes en el banco de sangre también influye en su efectividad: cuando este tiempo es prolongado, se producen cambios en la membrana de los eritrocitos que alteran su deformabilidad y cambios bioquímicos como la depleción en 2,3-difosfoglicerato que afecta a su capacidad para transportar oxígeno. Por ello, conviene evitar la transfusión de hematíes cuyo tiempo de almacenamiento sea superior a 14-19 días; por encima de este plazo, su efecto beneficioso es francamente menor y aumenta el riesgo de complicaciones asociadas32,37.
¿La monitorización con una presión tisular de oxígeno mejora el pronóstico del paciente neurocrítico?Hemos visto que la monitorización con PTiO2 aporta información valiosa que puede ayudarnos en el manejo del paciente neurocrítico, fundamentalmente en el TCE. Pero existe controversia acerca de si esta monitorización redunda en un mejor pronóstico.
Algunos trabajos han documentado una reducción en la mortalidad con terapias guiadas por monitorización conjunta de PPC/PIC+PTiO2 con respecto a la guiada exclusivamente con monitorización de la PPC/PIC. El trabajo de Spiotta et al. publicado en 201015 sobre 123 pacientes de los cuales 70 estaban monitorizados con PTiO2+PIC y 53 exclusivamente con PIC demuestra que la terapia guiada por PTiO2+PIC se asocia a reducción en la mortalidad y mejor pronóstico a corto plazo. En este trabajo, la mortalidad a 3 meses del traumatismo fue significativamente menor en el grupo con monitorización de PTiO2+PIC (45,3 vs. 25,7%; p<0,05), y la posibilidad de buen pronóstico neurológico entre los supervivientes (medido por la escala Glasgow Outcome Scale [GOS] score 4 o 5 vs. 1, 2 o 3) fue significativamente mayor en este grupo (64,3 vs. 39,6%; p<0,05). El trabajo hace referencia a la gran variedad de terapias usadas en los pacientes con PTiO2 comprometida como ajustes en la estrategia ventilatoria, uso de la hiperoxia normobárica, elevación de la PPC, transfusión de hemoderivados, realización de craneotomía descompresiva, etc.
Stiefel et al.35 publican un trabajo prospectivo sobre 53 pacientes (25 con monitorización PIC frente a 28 con monitorización PIC+PTiO2), en el que también demuestran una reducción en la mortalidad en el segundo grupo. En el grupo guiado por PTiO2 se toleraron cifras de PIC discretamente más elevadas (aunque sin llegar a significación estadística), siempre que la PTiO2 fuera normal y en ausencia de masas en la TC. El manejo de la PPC fue menos intensivo en el grupo guiado por PTiO2, atendiendo al mayor riesgo de complicaciones respiratorias asociadas al mismo. Los autores proponen que el tratamiento guiado por PTiO2 puede ayudar a encontrar la PPC más apropiada para cada individuo, para reducir los efectos secundarios potencialmente deletéreos del tratamiento estricto e intensivo de la PPC, dada la marcada heterogeneidad en la fisiopatología del TCE.
Narotam et al.36 llevan a cabo un trabajo prospectivo observacional aportando su experiencia de 5 años con la monitorización con PTiO2 y su efecto sobre tratamiento guiado por este método. Analizan la mortalidad y el pronóstico clínico a 6 meses (utilizando también la GOS) en 139 pacientes con monitorización PTiO2+PIC, que comparan con una serie histórica de 41 pacientes en los cuales se había monitorizado exclusivamente la PIC. Estos autores afirman que la aplicación de un programa de tratamiento apoyado en la monitorización con PTiO2+PIC logra una reducción significativa en la mortalidad (25,9 vs. 41,5%; reducción de riesgo relativo de 37%) y en el pronóstico a 6 meses, con respecto al tratamiento apoyado exclusivamente en el control de la PIC.
Nangunoori et al. realizan una revisión de la literatura incluyendo en su análisis final un total de 491 pacientes. Concluyen que, en pacientes con TCE severo, la terapia basada en monitorización con PTiO2+PIC/PPC está asociada a un mejor pronóstico respecto a la basada solamente en la monitorización PIC/PPC24.
Otros autores no han demostrado beneficio en la mortalidad o en la tasa de discapacidad cuando se incluye la monitorización de la PTiO2 como guía de tratamiento en el TCE grave. Martini et al.28 publican en 2009 sus resultados tras analizar 2 grupos de pacientes (uno de 123 pacientes con monitorización PIC+PTiO2 frente a otro de 506 pacientes con monitorización PIC) respecto a diversas variables: mortalidad hospitalaria, dependencia funcional al alta hospitalaria, duración de la ventilación mecánica, estancia hospitalaria y costes. En este trabajo, la monitorización PIC+PTiO2 no resulta en una reducción de la mortalidad, ni disminuye la posibilidad de buen resultado neurológico. El grupo con monitorización PIC+PTiO2 tiene una mayor duración de ventilación mecánica y soporta un mayor coste. El artículo hace referencia, sin embargo, a que los 2 grupos no son comparables debido a que existen importantes diferencias en las características clínicas de uno y otro, de tal forma que el grupo con monitorización PIC+PTiO2 tiene lesiones más severas de base y sus parámetros respiratorios (PaO2/FiO2 ratio) eran significativamente peores que los que presentaba el grupo de PIC solo.
Con anterioridad a este trabajo, Meixenberger et al. publicaron sus datos comparando 2 grupos de pacientes, ambos con la doble monitorización (PIC+PTiO2)38. En uno de los grupos (grupo 1: 40 pacientes), si bien la PTiO2 era monitorizada, la constatación de una PTiO2 baja no era seguida de ninguna actuación terapéutica (es decir, solo existía una observación del parámetro); en el otro grupo (grupo 2: 53 pacientes) sí se aplicaba tratamiento en caso de PTiO2 bajas. Cabe destacar en este trabajo que se emplea un umbral de tratamiento de PTiO2 de 10mmHg (excesivamente bajo, a la luz de lo publicado en la literatura), y que el tratamiento empleado en caso de bajas PTiO2 se orienta exclusivamente a elevar la PPC, sin utilizar la transfusión de hemoderivados o la elevación de la FiO2 como posibles bazas terapéuticas (aunque los autores las reconocen como posiblemente válidas en su discusión). Estos autores encuentran en el grupo 2 valores de PTiO2 más elevados, y una buena respuesta de la PTiO2 al tratamiento. Los eventos hipóxicos fueron más frecuentes en el grupo 1, así como los valores elevados de la PIC. Se documentó una tendencia a mejor pronóstico en el grupo 2 (monitorización PIC y PTiO2, con intervencionismo) reflejado en un 65% de pronóstico favorable a 6 meses vs. 54% en el grupo 1, aunque no se alcanzaron diferencias estadísticamente significativas, que en su opinión podrían deberse a una muestra excesivamente pequeña, sin olvidar que se ha empleado un umbral de tratamiento de PTiO2 muy bajo.
También Green et al. realizan un estudio retrospectivo sobre 74 pacientes (37 con monitorización PIC y 37 con monitorización PIC+PTiO2, en los que la elección del tipo de monitorización fue discrecional)39. En su análisis de la mortalidad y del estado funcional al alta hospitalaria no encontraron diferencias significativas entre los 2 grupos.
Aunque los datos apoyan la incorporación de la monitorización a la clínica, la literatura acerca del impacto de la terapia guiada por PTiO2 sobre el pronóstico sigue siendo controvertida. Merece la pena destacar que existen marcadas diferencias metodológicas entre los diversos trabajos publicados: en lo referente al umbral de tratamiento de PIC, de PPC o de PTiO2, a la actitud terapéutica ante una PTiO2 baja, al momento de inicio de la monitorización, etc. Un acercamiento bastante razonable podría ser, como proponen Oddo et al.18 que, de forma ideal, PIC, PPC y PTiO2 deberían monitorizarse. La integración de los datos que ofrecen las diferentes monitorizaciones permitiría individualizar la terapia a la fisiopatología de cada paciente. En la misma línea, otros autores como Poca et al.40 y Stochetti et al.41 en sus recientes actualizaciones afirman que la utilidad de la información que se obtiene al monitorizar a un paciente dependerá, en buena medida, de la interpretación de la misma que hace el clínico.
Monitorizar con sensor de la presión tisular de oxígeno. Consideraciones prácticasLa elección del lugar donde colocar el sensor de PTiO2 es importante. Al tratarse de un sistema de monitorización regional, obtendremos información de un área reducida (en torno a 18 mm2) alrededor del extremo distal del sensor, pero extrapolaremos esta información al resto del parénquima cerebral no lesionado, con intención de prevenir en él la lesión cerebral secundaria. Por lo general, se recomienda colocarlo en el área aparentemente sana del hemisferio dañado o, en caso de lesión difusa, en la profundidad de la sustancia blanca del hemisferio no lesionado, a ser posible en el lóbulo frontal derecho, en el territorio frontera entre la arteria cerebral anterior y la cerebral media, donde el consumo de O2 es más estable y, por tanto, también lo será la señal obtenida. Es una zona muy sensible a la hipoxia, poco protegida frente a la isquemia dado que recibe irrigación terminal y tiene menor densidad de capilares. La colocación del sensor en el tejido no lesionado nos permitirá utilizar la información obtenida como un indicador de oxigenación global14,42. En los casos en que se decida colocar el sensor en el área de penumbra próxima a la lesión, tendremos información regional.
Tras la colocación del sensor, ya sea en el quirófano o en la UCI, conviene realizar una TC de control para descartar posibles complicaciones y asegurarnos de que la ubicación del dispositivo es la deseada. La lectura que obtenemos no es fiable durante los momentos iniciales debido al microtraumatismo que se produce en el tejido cerebral con la inserción del sensor. Por lo general, este tiempo de adaptación (run-in-time) no es superior a las 2 h; en casos excepcionales, este tiempo puede prolongarse hasta 6–24 h9. La medición debe ser corregida dependiendo de la temperatura del paciente (hay una variación de 4,5% por cada °C.)
En cuanto a las complicaciones, la frecuencia documentada en la literatura es francamente baja, por lo que se considera una técnica muy segura8,22. Estas complicaciones, cuando aparecen, suelen ser leves, fundamentalmente microhemorragias (< 2% de los casos, con un volumen de sangre inferior a 2 cc). Teóricamente podrían aparecer infecciones en el punto de inserción, pero no hay ningún caso recogido en la literatura. También es posible un mal funcionamiento del sensor por incorrecta manipulación del mismo o por desplazamiento del dispositivo durante los traslados del paciente a otras dependencias (sala de TC, quirófano, etc.).
Existen, en la literatura, otros escenarios de monitorización de PTiO2 más allá del TCE grave. Así, se han publicado estudios con su empleo en la HSA, como apoyo al tratamiento en la UCI, en la detección de la isquemia por vasoespasmo, o en el quirófano, durante la cirugía de pinzamiento del aneurisma, para evaluar los efectos y la reversibilidad del pinzamiento temporal o asegurar la posición correcta del clip permanente43–46. También se ha empleado como herramienta útil en la decisión del momento correcto para realizar una craneotomía descompresiva y para evaluar su efectividad posterior47-49.
ConclusionesEn el momento actual, la incorporación de la monitorización de la PTiO2 como parte de la monitorización multimodal en pacientes neurocríticos, fundamentalmente con TCE, puede considerarse una estrategia segura y posiblemente útil, si bien su impacto sobre el pronóstico no está demostrado. La hipoxia cerebral, puesta de manifiesto por valores patológicamente bajos de PTiO2, aparece vinculada a un pronóstico desfavorable. La integración de la información obtenida por los diferentes sistemas de monitorización nos puede ofrecer la posibilidad de proporcionar a cada paciente un tratamiento individualizado, en nuestro intento de evitar o minimizar la lesión cerebral secundaria con la intención de mejorar el pronóstico.
Conflicto de interesesNo existe conflicto de intereses por parte de ninguno de los autores.
A D. Eugenio Sanz Vázquez, jefe de negocio de Neurocirugía de PRIM S.A., por su colaboración y aportaciones en la iconografía y búsqueda bibliográfica.