Los traumatismos son uno de los principales problemas de salud en todo el mundo. En los últimos años hemos presenciado profundas modificaciones en el paradigma de la resucitación del paciente traumatizado crítico, se han desarrollado nuevos conceptos en relación con la coagulopatía inducida por el trauma, así como hemos asistido a la expansión comercial de productos específicos relacionados con la hemostasia, entre otros. Las nuevas estrategias de resucitación en el trauma incluyen: identificar de manera precoz las lesiones que amenazan la vida del paciente, la detección de aquellas que precisan de un inmediato control quirúrgico o intervencionismo radiológico, tolerar una hipotensión moderada, reponer de manera racional el volumen intravascular, prevenir la hipotermia, evitar la acidosis, optimizar los transportadores de oxígeno, así como identificar aquellos factores necesarios para el paciente (plasma fresco congelado, plaquetas, ácido tranexámico, fibrinógeno, crioprecipitados y complejo protrombínico). Sin embargo, a pesar de estos avances, se necesitan más evidencias para reducir las tasas de mortalidad de los pacientes traumatizados graves.
Traumatic injuries represent a major health problem all over the world. In recent years we have witnessed profound changes in the paradigm of severe trauma patient resuscitation, new concepts regarding acute coagulopathy in trauma have been proposed, and there has been an expansion of specific commercial products related to hemostasis, among other aspects. New strategies in severe trauma management include the early identification of those injuries that are life threatening and require surgical hemostasis, tolerance of moderate hypotension, rational intravascular volume replacement, prevention of hypothermia, correction of acidosis, optimization of oxygen carriers, and identification of those factors required by the patient (fresh frozen plasma, platelets, tranexamic acid, fibrinogen, cryoprecipitates and prothrombin complex). However, despite such advances, further evidence is required to improve survival rates in severe trauma patients.
A nivel mundial, la patología traumática continúa siendo un problema de primera magnitud, desde un punto de vista sanitario, social y económico. En los últimos años hemos presenciado profundas modificaciones en el paradigma de la resucitación del paciente traumatizado crítico, se han desarrollado nuevos conceptos en relación con la coagulopatía inducida por el trauma (CIT), así como hemos asistido a la expansión comercial de productos específicos relacionados con la hemostasia, entre otros. En gran parte, todos estos cambios se encuentran motivados por la experiencia acumulada en conflictos armados durante esta última década, donde las estrategias de actuación son evaluadas y posteriormente trasladadas al ámbito civil1–6.
Generalidades sobre las nuevas estrategias de resucitación en el traumaSe entiende por resucitación de control del daño (RCD) el conjunto de intervenciones estructuradas que se inician durante la atención al trauma grave, con riesgo elevado de muerte por shock hemorrágico. Estas actuaciones tienen que comenzar en la propia escena del accidente y deben mantenerse tanto en el quirófano como en las Unidades de Cuidados Intensivos (UCI)1,2. Por tanto, en la RCD los esfuerzos deben ir dirigidos a identificar precozmente aquellas lesiones potencialmente letales y, de manera simultánea, reponer de manera racional el volumen intravascular tolerando una hipotensión moderada, prevenir de forma enérgica la hipotermia, controlar la acidosis (o evitar que progrese), optimizar los transportadores de oxígeno y realizar un mayor énfasis en la corrección de la CIT3,4. El abordaje de este tipo de coagulopatía incluye la transfusión precoz de plasma fresco congelado (PFC) y plaquetas, reconocer desde un punto de vista fisiopatológico, aquellos factores que pudieran ser necesarios para el paciente (fibrinógeno, crioprecipitados y complejo protrombínico) y modular el estado de hiperfibrinólisis haciendo uso del ácido tranexámico (ATX)2,5,6. Todas estas intervenciones son dependientes del tiempo y deben ser desarrolladas de forma simultánea a la cirugía de control del daño (CCD), cuyo fin es tratar de manera emergente aquellas lesiones quirúrgicas que amenazan la vida, dejando para un segundo tiempo la reparación definitiva de las mismas.
La falta de control de alguno de estos eslabones conlleva la entrada en un círculo vicioso conocido como «tríada letal» (hipoperfusión/acidosis, hipotermia y coagulopatía)2. Algunos autores postulan que a estos 3 factores, clásicamente asociados a la mortalidad en el trauma, se suman 2 más: la hipoxia y la hiperglucemia. Esta «pentada letal» resulta en una disminución del oxígeno disponible a nivel tisular de forma secundaria a la hipoperfusión, con utilización de rutas anaeróbicas, generándose mayores cantidades de lactato y disminución del pH. Estas rutas, menos eficientes desde un punto de vista energético, limitan la producción endógena de calor, empeorando la hipotermia por exposición, sumado a la reposición de fluidos y hemoderivados previamente no calentados, condicionando una situación insostenible para el organismo y que provocará el fallecimiento del paciente traumatizado por shock hemorrágico refractario1.
Garantizar una adecuada perfusión tisular y administrar racionalmente los fluidosDurante la fase inicial de la resucitación en el trauma, los objetivos tensionales deben ser moderados y permitir unas cifras de presión arterial sistólica entre 80-90mmHg4–6. Esta hipotensión permisiva se alcanza retrasando el inicio de la fluidoterapia o limitando el volumen a infundir. Los beneficios teóricos de esta estrategia consistirían en mantener una perfusión óptima/subóptima de los tejidos con el fin de evitar la disrupción del coágulo, minimizar la hipotermia, la dilución de factores de la coagulación y las pérdidas sanguíneas por focos no controlados5-8. Debemos tener en cuenta que la presión arterial es un parámetro subrogado de la oxigenación tisular, por tanto este control en sus cifras debería ser entendido como un concepto dinámico, en el que los umbrales se ajustarían de forma individualizada en cada caso, considerando: los antecedentes personales (hipertensión arterial, mujeres embarazadas, etc.), el tiempo de demora previsto hasta recibir asistencia en el medio hospitalario, así como del tipo de lesiones evidenciadas tras el trauma. A modo de ejemplo, en aquellos pacientes con traumatismo cráneo-encefálico (TCE) grave o lesión medular aguda la hipotensión podría tener efectos deletéreos sobre la lesión secundaria9. Para este último, grupo la presión arterial media recomendada sería ≥ 80mmHg4.
Desde hace décadas, la administración de fluidos es la piedra angular de la reanimación circulatoria del paciente traumatizado en shock, intentando preservar la perfusión orgánica mediante el reemplazo de las pérdidas de sangre. La oliguria con frecuencia está presente durante las fases iniciales de la reanimación. Los esfuerzos en estadios precoces por recuperar el gasto urinario genera irremediablemente una sobrecarga de volumen y un aumento del tercer espacio. Es conocido que la estrategia liberal y agresiva de fluidos presenta efectos deletéreos sobre la CIT y está relacionada con la aparición de síndrome compartimental abdominal o lesión pulmonar6,7. Varios estudios in vitro demuestran que la concentración de factores de la coagulación y de fibrinógeno son directamente proporcionales a la cantidad de volumen administrado al paciente tras el trauma10,11. El estudio realizado por Bickell et al.12, en un grupo de pacientes que habían presentado un trauma penetrante, mostró beneficios en la supervivencia cuando se utilizaba un menor volumen de fluidos durante la resucitación. Sin embargo, estudios posteriores han mostrado resultados variables13,14. La última revisión de la Cochrane Database, que evalúa el momento idóneo para iniciar la resucitación con fluidos, así como la cantidad de volumen que debe ser administrada, en el paciente en shock hemorrágico, no permite extraer conclusiones robustas15.
El uso de cristaloides en la reanimación inicial es el estándar en la práctica diaria y la recomendación establecida tanto por la Advanced Trauma Life Support (ATLS) como por las distintas guías de práctica clínica4. No obstante, el uso de suero salino isotónico a altas dosis puede condicionar una situación de acidosis hiperclorémica7. Los estudios inmunológicos, realizados en los distintos tipos de fluidos, muestran que el L-isómero del Ringer lactato podría inducir menor disfunción inflamatoria e inmunitaria, así como un menor trastorno electrolítico. Aunque, debemos señalar que el Ringer lactato en los pacientes con daño cerebral no sería de elección por sus características hipotónicas16.
El uso de coloides no ha logrado mostrar beneficio respecto a los cristaloides en el paciente crítico. Aunque todos los fluidos son capaces de causar coagulopatía dilucional, los coloides generan anormalidades de la polimerización del fibrinógeno y una menor estabilidad del coágulo, con un efecto dependiente de la dosis17. Uno de los últimos ensayos clínicos, el estudio multicéntrico CRISTAL, con 2.857 pacientes incluidos, no ha revelado diferencias en la mortalidad al mes entre el uso de cristaloides y coloides18. Recientemente, el Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia ha recomendado la suspensión de la comercialización de los coloides que contengan hidroxietil-starch debido a su asociación con el desarrollo de insuficiencia renal y aumento de mortalidad en el paciente crítico19. Por tanto, las guías europeas de 2013 hacen especial hincapié en el uso de coloides en general de una manera ajustada, tanto en el tiempo, como en el volumen administrado, insistiendo en la necesidad de seguir las dosis descritas según la ficha técnica de cada producto4.
La reanimación con pequeñas dosis de suero salino hipertónico (7,5%) en el shock hemorrágico actúa como eficaz expansor plasmático y presenta un positivo papel inmunomodulador. Dado su menor volumen y peso, en comparación con otros fluidos, permite un transporte y almacenaje más sencillo, sobre todo en el ámbito militar y prehospitalario. No obstante, hasta donde conocemos, el suero salino hipertónico no ha demostrado superioridad sobre el isotónico en la reanimación del paciente crítico20.
Los vasopresores en el trauma grave, concretamente la noradrenalina, se utilizan en situaciones de hipotensión arterial refractaria a la resucitación con fluidos, con compromiso vital del paciente. Aunque su uso en estudios experimentales ha reflejado una reducción en los requerimientos de fluidos, menores pérdidas sanguíneas y mejorar la supervivencia, los estudios realizados en humanos muestran resultados contradictorios e incluso su administración precoz en el trauma asocian un aumento de la mortalidad21.
Dado que la corrección de los parámetros hemodinámicos de macrocirculación no garantizan la resolución de la hipoperfusión tisular, las determinaciones iniciales de lactato o déficit de bases, y su aclaramiento con posterioridad, permitirán identificar pacientes con resucitación incompleta o con problemas no resueltos como lesiones graves infradiagnosticadas22,23. Recientemente, un estudio prospectivo ha mostrado que el aclaramiento precoz de lactato (0-2 h) es un importante factor pronóstico, por lo que podría ser de gran utilidad su seguimiento durante la resucitación del trauma22.
Evitar la coagulopatía inducida por el traumaLa edad, los antecedentes personales, las características genéticas del paciente, el tipo de lesión o la gravedad del mismo, entre otros, son factores no modificables una vez que ha sucedido el traumatismo24. Por tanto, debemos actuar sobre aquellos elementos potencialmente reversibles que agravan la CIT. En este sentido, la hemorragia en el paciente traumático en muchas ocasiones puede ser controlada si se actúa de manera precoz y apropiada. Sin embargo, el shock hemorrágico continúa siendo la causa de la muerte en más del 40% de los pacientes traumatizados graves. Entre un 33 y un 56% de estos fallecimientos suceden dentro del período prehospitalario, llegándose a describir hasta un 81% dentro de las primeras 6 h de ingreso. Una vez pasadas las primeras 24 h, la causa principal de muerte en el paciente traumatizado suele ser el desarrollo de fallo multiorgánico o la hipertensión intracraneal, si hubo TCE grave25.
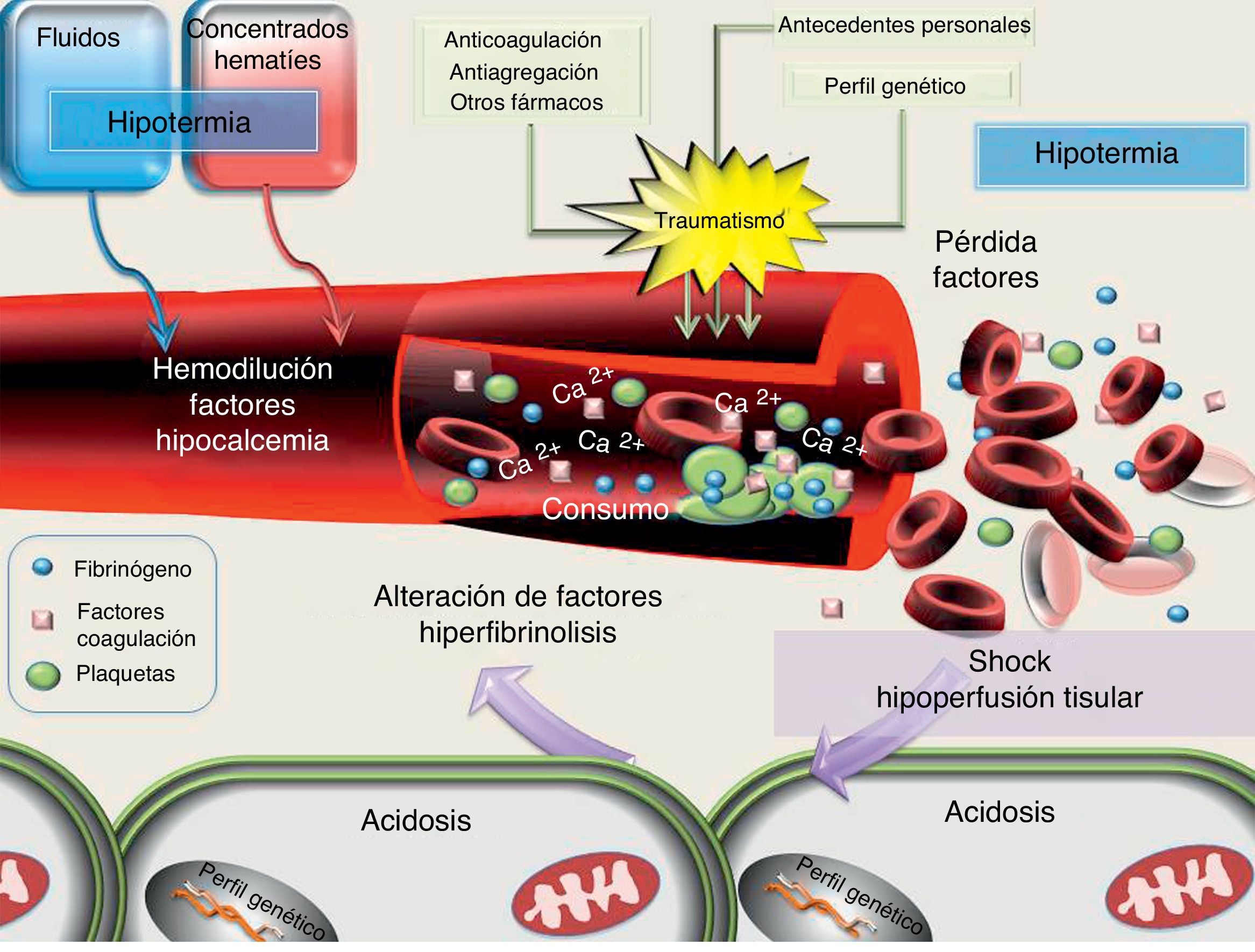
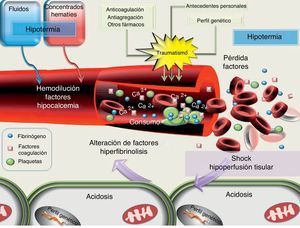
Debemos tener en cuenta que hasta un 25-43% de los pacientes traumatizados que llegan al hospital presentan trastornos en la coagulación26-28. El origen de la CIT es multifactorial y se representa en la figura 1. Podemos citar, entre otros, la pérdida de factores por los puntos sangrantes, la dilución de los existentes (por la infusión de fluidos o la administración de concentrados de hematíes [CH] sin asociar PFC), la activación de la fibrinólisis, así como la alteración en la funcionalidad de las proteasas de manera secundaria a la acidemia, la hipotermia y el shock29.
Actualmente, la coagulopatía dilucional se reconoce como uno de los elementos que favorecen la CIT10,11,17. No obstante, se ha demostrado que dichas alteraciones pueden ser independientes del volumen de fluidos utilizados durante la atención prehospitalaria17,27,28. Son múltiples los trabajos que relacionan la gravedad o la extensión del traumatismo con los trastornos de la coagulación27,28. La CIT se agrava ante la presencia de shock al ingreso hospitalario, dado que la hipoperfusión promueve un estado de hiperfibrinólisis (mediante la activación de la trombomodulina y proteína C) de manera independiente a la presencia de hipotermia, acidosis o dilución de factores, los cuales se presentarán posteriormente, caso de una resucitación no apropiada17,29,30. Trabajos recientes definen la CIT como una coagulopatía intravascular diseminada con un perfil fibrinolítico31. La hipotermia se ha mostrado como un factor de riesgo independiente de mortalidad en el trauma27,29. La corrección de la hipotermia mejora la actividad de los tiempos de la coagulación y de la actividad plaquetaria2,32. Un descenso del pH a 7,2 se relaciona con un descenso del 50% en la generación de trombina, la disminución de la actividad de los factores va y xa, junto con un incremento de la fibrinólisis. Este descenso puede llegar hasta un 90% cuando el valor del pH desciende a 7. Sin embargo, a nivel experimental, la corrección de la acidosis tras la administración de bicarbonato no mejora la CIT32. Este hecho nos indica que, a pesar de normalizar los niveles de pH, si el estado de hipoperfusión secundario al shock hemorrágico no se controla, la CIT persistirá32,33. Cabe subrayar que las concentraciones de calcio, ión básico para la coagulación, se ven influidas por el equilibrio ácido-base y por el citrato administrado con los hemoderivados, de ahí que una falta de control en sus niveles se relacione tanto con la mortalidad, como con las necesidades transfusionales3,34.
El manejo de la CIT haciendo uso de estudios convencionales de coagulación no se recomienda, dado que la información que se obtiene de ellos siempre se encontraría desfasada y no se correspondería con la situación real del paciente3,35,36. Por este motivo, la implementación de pruebas viscoelásticas en las áreas de urgencia del trauma se encuentra cada vez más extendida, al igual que sucede en las grandes cirugías36,37. Se considera que la CIT podría tener unas características específicas bajo estas técnicas38. El análisis mediante ROTEM (ROtation ThrombElastometry Method) muestra que el coágulo tendría alterado su tiempo de formación (CFT), su amplitud a los 5 min (CA5), su máxima firmeza (CFT), así como el ángulo alfa. A modo de resumen, se indica que existe una formación lenta del coágulo y una reducción en su fuerza en un 40%38. Dicha información permitiría al clínico en tiempo real y a pie de cama dirigir de forma inmediata las actuaciones específicas para el control de la coagulopatía37.
La CIT se encuentra asociada a un aumento en las necesidades transfusionales, una mayor incidencia de disfunción multiorgánica, una estancia en UCI prolongada y un aumento en la mortalidad24,28,30. Por todo ello, en los últimos años las estrategias de atención al trauma han ido dirigidas a evitar la progresión de la CIT2,3,29.
Transfusión proporcional de hemoderivadosEl reemplazo de las pérdidas sanguíneas tras el traumatismo, mediante transfusión de hemoderivados, ha variado de forma sustancial en las últimas décadas. Es conocido que el uso de estos productos aumenta la morbimortalidad tras el trauma39. Aunque en algunos escenarios militares se continúe usando la transfusión de sangre total, hace años que las estrategias se modificaron hacia la administración de los componentes específicos de la sangre (CH, PFC o plaquetas)40. El objetivo de esta estrategia es evitar enfermedades transmisibles y aportar únicamente los elementos necesarios que precise el paciente. No obstante, este concepto válido para situaciones controladas y cirugías electivas, se vuelve ineficaz durante el manejo del shock hemorrágico traumático41,42.
La proporción en la que estos componentes deben ser infundidos también ha sido fruto de estudio y debate. Mediante modelos computacionales se ha demostrado la necesidad de aumentar la cantidad de PFC y plaquetas administrados a los pacientes tras el trauma42. Por tanto, la definición de hemorragia masiva que utilizamos, descrita en los años 90 como la necesidad de recibir más de 10 CH en menos de 24 h, no refleja de forma exacta la manera en la que debe realizarse la transfusión hoy en día en el paciente traumatizado grave35,41,43. Recientemente, se han publicado los resultados del estudio PROMMPT, que incluyó a 1.245 pacientes en 10 centros de trauma, mostrando una reducción en la mortalidad cuando las ratios de PFC y plaquetas respecto a CH se aproximaban al 1:126. Estos resultados se muestran acordes con trabajos previos que indicaban que ratios de PFC:CH menores de 1:2 disminuían la mortalidad tras el trauma1,41,44,45. De igual forma, el uso de crioprecipitados o fibrinógeno administrados en relación con el número de CH infundidos también mejoran la supervivencia3,46. A la vista de los ensayos clínicos presentados, se comprueba la falta de homogeneidad en la administración de las ratios indicadas, sobre todo durante las primeras horas26,36. En definitiva, podemos concluir que las recomendaciones actuales sugieren la transfusión de ratios elevadas (entre 1:1 y 1:2) de PFC:CH y plaquetas:CH, así como realizar dicha transfusión de forma constante durante la resucitación del paciente traumatizado1,26,41,44,45.
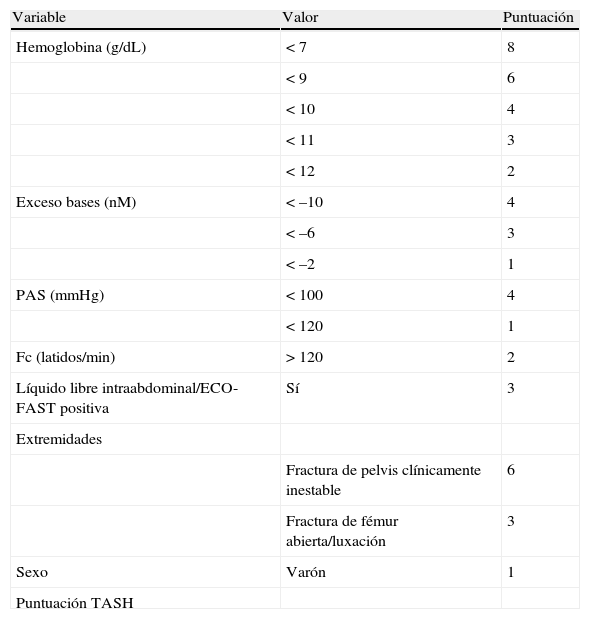
De todos los traumatizados que reciben hemoderivados, el 36% precisará la activación del protocolo de transfusión masiva (PTM). En líneas generales, representan únicamente el 2,6% de los traumas graves, pero la mortalidad asociada es tan elevada que hace necesaria una cuidadosa atención y coordinación con los bancos de sangre3. Dado que la disponibilidad de los hemoderivados debería estar presente a la llegada del paciente al hospital, se recomienda la existencia de un PTM en los centros donde se realice la atención al trauma grave para evitar demoras innecesarias1. A modo de ejemplo, en escenarios militares se realiza la descongelación rutinaria de plasma todos los días, o se preconiza el uso de métodos para disponer de PFC de manera precoz (plasma de donante universal, descongeladores rápidos, formulaciones específicas de plasma) para optimizar el manejo de estos pacientes e intentar alcanzar ratios transfusionales apropiadas2,3,47. En este sentido, encontramos diferentes scores que tratan de predecir aquellos pacientes con hemorragia masiva a su llegada al hospital mediante el uso de variables clínicas y exploraciones básicas. Un trabajo reciente ha comparado algunas de estas escalas, objetivándose que la puntuación Trauma Associated Severe Hemorrhage-Score (TASH) era la que presentaba una mejor correlación y permitía descartar a aquellos pacientes que no precisarían de la activación del PTM43. En la tabla 1 se describe el TASH-score, así como la probabilidad de presentar una hemorragia masiva según la puntuación alcanzada48.
Probabilidad de hemorragia masiva según puntuación alcanzada en el Trauma Associated Severe Hemorraghe-Score (TASH-Score)
| Variable | Valor | Puntuación |
| Hemoglobina (g/dL) | < 7 | 8 |
| < 9 | 6 | |
| < 10 | 4 | |
| < 11 | 3 | |
| < 12 | 2 | |
| Exceso bases (nM) | < –10 | 4 |
| < –6 | 3 | |
| < –2 | 1 | |
| PAS (mmHg) | < 100 | 4 |
| < 120 | 1 | |
| Fc (latidos/min) | > 120 | 2 |
| Líquido libre intraabdominal/ECO-FAST positiva | Sí | 3 |
| Extremidades | ||
| Fractura de pelvis clínicamente inestable | 6 | |
| Fractura de fémur abierta/luxación | 3 | |
| Sexo | Varón | 1 |
| Puntuación TASH |
| PuntuaciónTASH | Probabilidad de transfusión masiva |
| 1-8 | < 5% |
| 9 | 6% |
| 10 | 8% |
| 11 | 11% |
| 12 | 14% |
| 13 | 18% |
| 14 | 23% |
| 15 | 29% |
| 16 | 35% |
| 17 | 43% |
| 18 | 50% |
| 19 | 57% |
| 20 | 65% |
| 21 | 71% |
| 22 | 77% |
| 23 | 82% |
| 24 | > 85% |
ECO-FAST: Focused Assessment Sonography in Trauma; Fc. frecuencia cardíaca; PAS: presión arterial sistólica.
Tomado Maegele et al.48.
Existen otros parámetros que pueden ser predictores de la necesidad de activación del PTM, entre los que destacan la presencia de hipocalcemia o resultados del ROTEM34,38. En este último, a los 5 min, mediante el CA5 con un punto de corte en 35mm, permite diferenciar aquellos pacientes en riesgo de desarrollar una hemorragia masiva tras el trauma38.
Fármacos prohemostáticosHasta la fecha, ningún ensayo clínico había encontrado unos resultados tan esperanzadores en la reducción de la mortalidad en el trauma, como lo ha sido el CRASH-2. Este estudio evaluó el uso del ATX dentro de las primeras 8 h del trauma, objetivando una reducción significativa de la mortalidad global al mes y de la mortalidad por hemorragia masiva respecto a placebo49. El perfil antifibrinolítico del fármaco mediante la inhibición del paso de plasminógeno a plasmina es la hipótesis que mejor podría justificar esta reducción de mortalidad, teniendo en cuenta, como se ha comentado previamente, el estado de hiperfibrinólisis asociado al paciente traumatizado grave30. Sin embargo, debemos señalar que su uso no disminuyó los requerimientos transfusionales en los pacientes tratados con este fármaco. El análisis temporal del momento de administración del ATX reveló que, dentro de las primeras 3 h, optimizaba de forma considerable la efectividad de sus resultados49. De ahí que el uso precoz del ATX es recomendado por las guías de manejo de los pacientes traumatizados, sugiriéndose su administración durante la atención prehospitalaria4. Un análisis de coste-efectividad realizado por el National Health Service sobre el uso del ATX reveló que su uso implicaba únicamente un incremento de 64 $ por cada vida salvada.
Debemos destacar que, tras su administración en más de 20.000 pacientes, no se detectaron mayores incidencias de efectos adversos isquémicos en el grupo de tratamiento49. No obstante, encontramos series retrospectivas, posteriores al CRASH-2, en las que, a pesar de objetivar una reducción en la mortalidad de los pacientes politraumatizados, sí indicaban una mayor tendencia a la presentación de eventos trombóticos pulmonares y venosos50. Recientemente, se ha publicado una serie de recomendaciones sobre cuáles deberían ser las futuras líneas de investigación y su prioridad en relación con el ATX. El objetivo de estas recomendaciones, expuestas en la tabla 2, se centran en profundizar en el conocimiento de los mecanismos específicos de actuación del fármaco, así como explorar su perfil de seguridad, entre otros51. Algunas de ellas ya han comenzado a desarrollarse, concretamente en subpoblaciones específicas de pacientes traumatizados que presentan un TCE con lesiones hemorrágicas intracraneales, mediante el estudio CRASH-352.
Adaptación de las líneas de investigación sugeridas según prioridad y lagunas de conocimiento en relación con el uso del ATX
| Categoría | Dudas y líneas de investigación futuras |
| Prioridad 1 | |
| Seguridad | Investigar de forma específica el aumento del riesgo de morir por sangrado en el grupo de pacientes que recibieron ATX pasadas las 3 h del traumatismo. Averiguar si hubo, en los estudios que se han desarrollado, un aumento del riesgo de trombosis venosa profunda y tromboembolismo pulmonar |
| Investigar riesgo tromboembólico durante la CCD | |
| Estudiar las complicaciones potenciales en pacientes en los que pudiera estar contraindicado el ATX, incluyendo pacientes con trauma craneal, y el impacto en el desarrollo de crisis comiciales tras la cirugía. | |
| Evaluación de los pacientes de los ensayos clínicos que fallecieron, para determinar la existencia de microtrombos | |
| Modelos animales | Desarrollo de modelos animales que permitan estudiar la eficacia, seguridad y los mecanismos de actuación del ATX |
| Pruebas adicionales sobre la eficacia y la definición de aquellos pacientes que pudieran beneficiarse del ATX | Diseño de ensayos clínicos que permitan establecer la eficacia del fármaco en el ámbito militar y civil siguiendo las últimas recomendaciones en el manejo |
| Mecanismo de acción | Información sobre el mecanismo de acción en la hemorragia traumática. Se han propuesto diferentes mecanismos, pero no han sido probados |
| Eficacia y seguridad en el traumatismo craneal sin lesiones asociadas | Es precisa la información sobre la eficacia y seguridad potencial en pacientes con lesiones cerebrales traumáticas/hemorrágicas |
| Uso prehospitalario (ámbito militar) | Potencial uso en el ámbito prehospitalario, casos de evacuación diferida o limitación en las medidas de soporte (no hemoderivados o únicamente plasma) y modificación de la dosis/ventana temporal caso de poder administrarse de forma inmediata tras la lesión |
| Interacciones con otros fluidos o fármacos, impacto sobre su almacenaje en el campo de batalla | |
| Compatibilidad con el concepto de resucitación teleguiada de control del daño | |
| Prioridad 2 | |
| Optimizar el conocimiento sobre la ventana temporal para su administraciónn | Eficacia y seguridad del ATX con su administración en diferentes momentos tras el trauma. ¿Cuál es el mejor momento para su administración? ¿Cuándo se consideraría que se ha excedido la ventana temporal? |
| Uso del ATX en combinación con otros productos sanguíneos | ¿Cómo mejoraría su utilidad en caso de administrarse con otros productos sanguíneos? |
| Rutas alternativas de administración | Uso potencial de otras vías de administración (intravenosa, oral, intraósea, etc.) |
| Prioridad 3 | |
| Interacción con las cascadas inflamatorias y de la coagulación | Identificar patrones temporales de inflamación y coagulación. Estudiar cómo la administración del ATX en diferentes momentos influye sobre ellos |
| Dosificación | Todos los datos disponibles se basan en una sola pauta. ¿Podrían otras posologías incrementar la eficacia y la seguridad? ¿Cómo se afecta la farmacocinética en el trauma? |
| Uso con fluidos de resucitación comunes | Uso potencial del ATX en combinación con fluidos de nueva generación |
| Microcirculación | Efectos del ATX en el flujo sanguíneo a nivel de la microcirculación |
| Interacción con otros fármacos | Interacción con profilaxis antitrombótica, fármacos prohemostáticos (como el factor vii recombinante activado), anticomiciales u otros fármacos |
ATX; ácido tranexámico; CCD: cirugía de control del daño.
Tomado de Pusateri et al.51.
La CIT se asocia a una disminución en los factores i, ii, v, vii, viii, ix y x, mediada por la activación de la proteína C30. El descenso más llamativo sucede en el fibrinógeno y sus niveles no mejoran hasta lograr el control del daño10,11,17,46. Estudios retrospectivos revelan que el aumento de la ratio en la administración de fibrinógeno:CH es un factor asociado a la supervivencia de los pacientes3,46. Su administración se puede realizar de forma individual o asociado al factor viii y xiii en forma de crioprecipitado. Por tanto, se aconseja su uso según resultados del ROTEM o cuando sus niveles plasmáticos se detecten por debajo de 1,5g/l37,40.
El complejo protrombínico permite aportar grandes dosis de factores de la coagulación (ii, vii, ix y x) en un volumen reducido, en comparación con el PFC. Presenta una clara indicación si el paciente se encuentra bajo los efectos de determinados fármacos anticoagulantes35. El resto de las experiencias, guiadas por ROTEM, aún no han podido ser validadas37.
Por último, los ensayos clínicos que han evaluado el uso del factor vii activado recombinante han objetivado una menor necesidad de hemoderivados, así como una mejora en el sangrado en el trauma cerrado53. Si bien, al no existir una reducción clara en la mortalidad, no se considera un tratamiento de primera línea, reservándose su uso con carácter compasivo cuando otras medidas no han sido efectivas4.
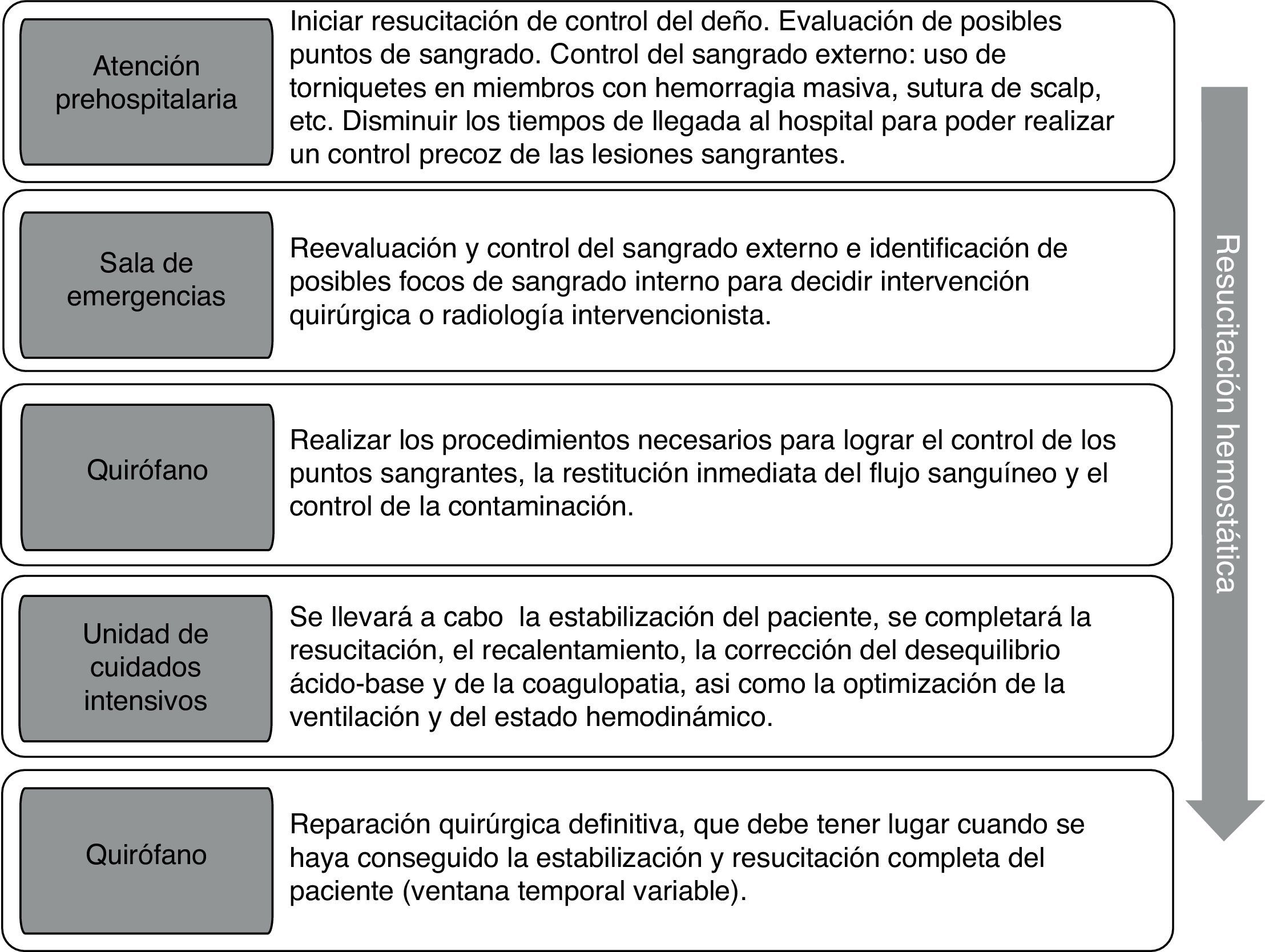
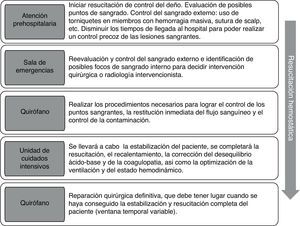
Control de la hemorragia: cirugía de control del dañoComo se ha comentado previamente, el objetivo de la CCD es minimizar los tiempos quirúrgicos, dado que un tratamiento definitivo de las lesiones empeoraría la situación del paciente e incluso podría condicionar la muerte, debido a la pérdida de calor acelerada por exposición durante la cirugía, la dificultad para una reposición de volumen apropiada, así como el aumento de la acidosis y de la coagulopatía2,5,6,54. Este concepto, inicialmente orientado a lesiones abdominales mayores con un sangrado incontrolable y fracturas pélvicas inestables, se ha extendido a cualquier tipo de lesiones, renales, retroperitoneales, vasculares de extremidades, torácicas, cerebrales, etc. La hemostasia habitualmente se alcanza mediante ligadura arterial, taponamiento mediante catéteres con balón, shunts vasculares o packing55. Las estrategias de resucitación deben ser mantenidas durante la CCD y deben considerarse tan importantes como la propia reparación anatómica5. No existe una ventana temporal concreta para la realización de un tratamiento definitivo de las lesiones tras la CCD. Como se muestra en la figura 2, estas intervenciones deberán realizarse según la situación de clínica del paciente, el tipo de lesión y la CCD que se haya llevado a cabo, por lo que con frecuencia se llevan a cabo más allá de las 48 h clásicamente propuestas54,55.
Se recomienda que el tiempo entre que sucede el daño traumático y el paso a quirófano se minimice en los pacientes que precisen un control quirúrgico del sangrado4. Por tanto, es esencial realizar un diagnóstico y detección precoz de dichas lesiones. A los métodos diagnósticos tradicionales, se han añadido otros, como la Focused Assessment Sonography in Trauma (ECO-FAST), la TAC helicoidal, la angiografía digital, etc., que facilitan, no solo la localización, sino la extensión y el alcance de las lesiones para una mejor aproximación quirúrgica56.
Los pacientes que deben someterse a CCD son aquellos que presenten una mayor probabilidad de muerte debido a la situación de hemorragia no controlada y en los que se objetiven los parámetros expuestos en la tabla 32,5.
Situaciones susceptibles de realización de cirugía de control del daño
| 1. Traumatismo de alta energía con lesiones penetrantes o en estallido2. Coagulopatía presente con incapacidad de realizar hemostasia3. Lesión vascular mayor4. Lesiones viscerales múltiples5. Tiempo quirúrgico estimado para reparación definitiva > 90 min6. Índices de gravedad como el ISS mayor de 257. Signos vitales: PAS < 70mmHg, pH < 7,1, Temp. < 34°C o lactato > 6 mmol/l8. Inestabilidad hemodinámica9. Necesidad de una transfusión masiva |
ISS: injury severity score; PAS. presión arterial sistólica; Temp.: temperatura.
a. Packing abdominal: es una laparotomía precoz que permite identificar lesiones graves y fuentes de hemorragia. Cuando las medidas quirúrgicas no tienen éxito, el packing puede ser el primer paso dentro del concepto de control del daño. Puede comprimir roturas hepáticas o ejercer presión directa sobre los puntos de sangrado. Permite futuros intentos para lograr la hemostasia completa mediante arteriografía y/o hasta la corrección de la CIT. En ocasiones, es necesario incluso el clampaje y bypass de la aorta para reducir el sangrado y redistribuir el flujo de sangre al corazón y al cerebro4. La contaminación se controla bien mediante ligadura temporal o abocamiento a piel, en caso de uréteres rotos o vísceras huecas con lesiones, o bien mediante el cierre de las lesiones intestinales sin anastomosis terminales. Si el cierre de la pared abdominal no es posible, se cubren las vísceras con paños estériles que se fijan a los bordes de la pared, o mediante bolsas de sueros abiertas («bolsa de Bogotá») o mediante un Opsite («Vacpac»)5. En estas circunstancias, la laparotomía debe ser revisada en menos de 48 h, cuando ya exista un menor riesgo de sangrado4. En dicha revisión, se retira el packing y se lleva a cabo una exploración completa de la zona.
La principal complicación del procedimiento es el desarrollo de un síndrome compartimental abdominal, con una incidencia de hasta el 15% y que incrementa notablemente la mortalidad. El origen es doble, primero como consecuencia del aporte masivo de fluidos durante la resucitación, y segundo, como consecuencia del daño visceral por el traumatismo. En ambos casos se produce un edema intestinal que da lugar a la hipertensión abdominal7.
b. Arteriografía y embolización: es uno de los métodos más eficaces que permite de una forma mínimamente invasiva el control del sangrado de zonas en ocasiones inaccesibles o incoercibles desde el punto de vista quirúrgico o como complemento terapéutico al packing57. La embolización debe ser lo más distal posible en la arteria responsable, para disminuir el riesgo de isquemia tisular y acidosis láctica. Esta técnica se encuentra indicada cuando: 1) existe inestabilidad hemodinámica, signos de sangrado activo y se hayan descartado orígenes de sangrado distintos al abdominal, y 2) haya evidencia de extravasación de contraste en la TAC.
Actualmente, se postula la posibilidad de disponer en el mismo quirófano de la urgencia traumática a un equipo de radiología intervencionista entrenado para actuar en el escenario de la reanimación. Este proyecto, titulado Resuscitation with angiography, percutaneous techniques and operative repair (RAPTOR), podría aumentar las opciones de tratamiento sobre el foco de sangrado, minimizando las demoras y los traslados intrahospitalarios58. Aunque interesante, hoy en día se trata de una apuesta difícil de alcanzar por muchos hospitales.
Cirugía de control del daño pélvicoEl volumen pélvico tras una fractura inestable de pelvis aumenta de forma significativa. Este aumento de volumen favorece el sangrado y las hemorragias masivas que provocan estas fracturas, contribuyendo al shock hemorrágico. En los pacientes hemodinámicamente estables, con fractura pélvica, es recomendable la realización de una TAC abdómino-pélvica, dada la alta asociación con lesiones intraabdominales4,59.
- a.
Fijador externo: el uso del fijador externo reduce el desplazamiento de la fractura y disminuye así el volumen pélvico, pero no limita la pérdida de sangre en los pacientes con hemorragia pélvica activa. Se ha observado una mayor necesidad de transfusiones de hemoderivados en las primeras 24-48 h, con el fijador externo en relación al cinturón circunferencial pélvico, probablemente atribuible a la precocidad con la que se aplica el cinturón59.
- b.
Cinturón circunferencial pélvico: a pesar que los modelos teóricos sostienen que la compresión ayudaría al control de la hemorragia, posteriormente no existen trabajos que cuantifiquen el efecto real sobre la estabilización hemodinámica del paciente inestable59. Cabe destacar que durante su uso debe evitarse la reducción excesiva de la fractura, hay que tener en consideración los puntos de apoyo, así como considerar en las fracturas sacras, que las raíces pueden verse comprimidas a este nivel.
- c.
Packing pélvico: además del cierre y la estabilización de la fractura de pelvis, el efecto de taponamiento del hematoma, con packing pre, extra o retroperitoneal puede reducir o detener el sangrado venoso. El packing pélvico podría ayudar al control de la hemorragia intrapélvica de manera precoz y proporcionar un mejor momento para el tratamiento más selectivo del foco hemorrágico. La técnica se puede combinar con una laparotomía posterior si fuera necesaria. Esto puede disminuir la elevada tasa de mortalidad observada en pacientes con grandes lesiones pélvicas que deben someterse a una laparotomía como intervención primaria4.
- d.
Arteriografía y embolización: actualmente, se acepta como un método eficaz para el control del sangrado arterial cuando no ha sido posible mediante la estabilización de la fractura. Indicada cuando: 1) existe inestabilidad hemodinámica, signos de sangrado activo a este nivel y se hayan descartado orígenes distintos a la pelvis; 2) hay evidencia de extravasación de contraste en la TAC, y 3) pacientes mayores de 60 años con fracturas pélvicas mayores (verticales, en libro abierto o en alas de mariposa), independientemente de su situación hemodinámica59. Varios autores señalan que la hipotensión permisiva hasta conseguir la estabilización de la fractura y/o la arteriografía, pueden mejorar la superviviencia5,6.
Las guías europeas recomiendan que los pacientes con una disrupción del anillo pélvico en situación de shock hemorrágico deben someterse a la estabilización inmediata. Así como, ante la presencia de inestabilidad hemodinámica, a pesar de una adecuada estabilización del anillo pélvico, se recomienda la realización de packing preperitoneal, arteriografía y embolización si precisa y/o control quirúrgico de la hemorragia4.
Cirugía de control de daños en miembrosEl uso del torniquete se restringe a sangrados que comprometan la vida del paciente en heridas abiertas de extremidades hasta la resolución quirúrgica. Habitualmente, se ha descrito en el ámbito de catástrofes o intervenciones militares. El tiempo de aplicación debe ser el menor posible, sugiriéndose un máximo de 2 h4. Las fracturas relevantes se estabilizan principalmente con fijadores externos en lugar de una osteosíntesis definitiva primaria. La cirugía de osteosíntesis definitiva se puede realizar posteriormente, de 4 a 14 días, cuando el paciente se encuentre estabilizado5.
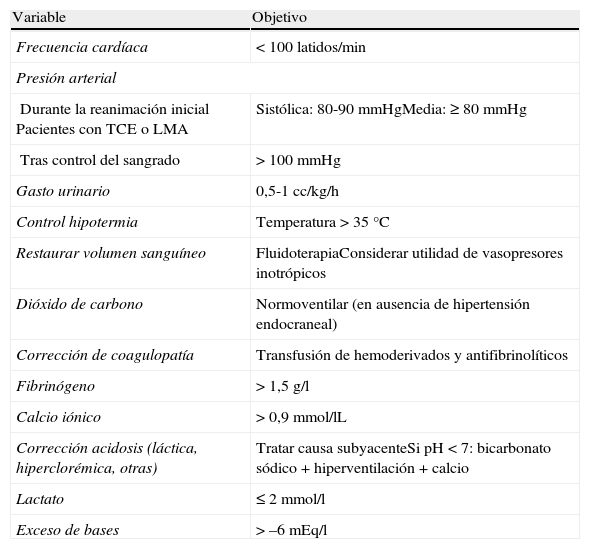
DiscusiónLa mayor parte de los objetivos de resucitación en el trauma han sido enumerados a lo largo del texto y se presentan en la tabla 4.
Objetivos de la reanimación en el paciente traumatizado grave
| Variable | Objetivo |
| Frecuencia cardíaca | < 100 latidos/min |
| Presión arterial | |
| Durante la reanimación inicialPacientes con TCE o LMA | Sistólica: 80-90 mmHgMedia: ≥ 80 mmHg |
| Tras control del sangrado | > 100 mmHg |
| Gasto urinario | 0,5-1 cc/kg/h |
| Control hipotermia | Temperatura > 35°C |
| Restaurar volumen sanguíneo | FluidoterapiaConsiderar utilidad de vasopresores inotrópicos |
| Dióxido de carbono | Normoventilar (en ausencia de hipertensión endocraneal) |
| Corrección de coagulopatía | Transfusión de hemoderivados y antifibrinolíticos |
| Fibrinógeno | > 1,5 g/l |
| Calcio iónico | > 0,9 mmol/lL |
| Corrección acidosis (láctica, hiperclorémica, otras) | Tratar causa subyacenteSi pH < 7: bicarbonato sódico + hiperventilación + calcio |
| Lactato | ≤ 2 mmol/l |
| Exceso de bases | > –6 mEq/l |
LMA: lesión medular aguda; TCE: traumatismo cráneo-encefálico.
Aunque hemos profundizado en los conocimientos fisiopatológicos relacionados con el traumatismo, no podemos considerar como definitiva la revisión de la literatura actual. Los fenómenos desencadenados tras el daño, así como sus consecuencias, aún no son totalmente conocidos, por lo que no podemos hacer una resucitación guiada al individuo y a los acontecimientos concretos que en él se suceden1. Actualmente, nos basamos en el concepto de asegurar la perfusión y restablecer la hemostasia, pero adolece de una evidencia consistente que la justifique plenamente. A modo de ejemplo, se cita el trabajo de Khan et al.33, publicado poco antes de la redacción final de este trabajo, en el que nos indican que la resucitación hemostática no alcanzó un control de la CIT ni restauró la perfusión tisular hasta pasadas las 24 h del trauma, es decir, hasta el momento en el que se habían controlado los daños y el sangrado. Por otro lado, comentar que gran parte de la evidencia disponible se basa en escenarios militares, los cuales presentan peculiaridades específicas, que en ocasiones no permiten su extrapolación al ámbito civil.
En definitiva, a pesar de los profundos cambios conceptuales en la atención prehospitalaria y durante las primeras horas de atención al trauma, debemos seguir trabajando en promover el conocimiento relacionado con los pacientes traumatizados, para poder evaluar las estrategias actuales desarrolladas en nuestras propias unidades60. Para ello, son necesarios más ensayos clínicos de calidad, que permitan de una forma apropiada afianzar cambios en el manejo del trauma grave, como ha sucedido recientemente con el uso del ATX49. Por último, se debe indicar la necesidad de implementar en nuestras propias UCI y hospitales protocolos de resucitación del paciente traumatizado crítico, que permitan una detección temprana de los focos de sangrado, un tratamiento precoz de los mismos mediante técnicas quirúrgicas o intervencionistas, así como la instauración de un PTM, que reduzcan los tiempos de actuación durante el control del sangrado masivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.