El uso de plasma de pacientes recuperados de infecciones víricas fue utilizado por primera vez en el tratamiento de la gripe española a principios del siglo XX1. Más recientemente, el plasma procedente de paciente convaleciente (PC) se ha utilizado de forma eficaz y segura en el tratamiento de infecciones respiratorias por SARS-CoV y en el Middle East Respiratory Syndrome (MERS-CoV)2, demostrando algunos estudios una mejor evolución clínica cuando se utilizaba en los primeros 14 días3. En 2014, la Organización Mundial de la Salud (OMS) recomendó su uso para tratar el ébola, clasificándolo como tratamiento empírico4, y un año más tarde, diversos organismos recomendaron al PC como uno de los tratamientos potenciales para la enfermedad grave para el MERS-CoV5.
La pandemia por SARS-CoV-2 originó una crisis sanitaria mundial y colapsó las unidades de cuidados intensivos (UCI) con pacientes afectados de neumonía y síndrome de distrés respiratorio agudo (SDRA). Ante la falta de tratamientos eficaces, inicialmente se planteó el uso de plasma de paciente convalecientes como fuente de anticuerpos disponibles, con la hipótesis de que podrían mejorar el curso de la enfermedad si se utilizaba precozmente al disminuir la viremia inicial cuando no hay anticuerpos o existen títulos bajos de anticuerpos totales (IgM e IgG)6,7.
Con el fin de evaluar la eficacia y seguridad del PC en pacientes graves con COVID-19 que no habían desarrollado anticuerpos, se realizó un estudio en pacientes ingresados en una UCI polivalente de un hospital de tercer nivel dotada de 44 camas prepandemia desde septiembre del 2020 a diciembre del 2020. Para evaluar la eficacia se consideró los días de ventilación mecánica (VM) y la mortalidad y para la seguridad la ausencia de complicaciones clínicas potencialmente atribuibles a la administración del plasma. Los criterios de inclusión eran: pacientes mayores de 18 años, ingresados con SDRA leve, moderado o grave de acuerdo a la definición de Berlín y que precisaban VM. La presencia de SARS-CoV-2 para el diagnóstico de COVID-19 se realizó mediante la detección del genoma viral utilizando una RT-PCR cuantitativa múltiple. Los ácidos nucleicos fueron purificados mediante MagNa Pure 96 System (Roche, Ginebra, Suiza). Las extracciones fueron sometidas a una reacción de amplificación usando el preparado comercial TaqMan Fast 1-Step Master Mix (Life technologies, Carlsbad, CA) suplementado con una mezcla de cebadores (Thermo Fisher Scientific, Waltham, MA) y sondas TaqMan MGB (Applied Biosystems, Foster City, CA) dirigidos contra dos dianas, los genes ORF1ab y N. Las amplificaciones y su posterior análisis se llevaron a cabo usando el Applied Biosystems 7500 Real-time PCR System.
Los sujetos del grupo control fueron pacientes emparejados por edad, sexo y gravedad, ingresados en UCI en el mismo periodo del estudio y que cumplían algún criterio de exclusión (presencia de anticuerpos en plasma y fecha de ingreso en la UCI después de los primeros 10 días desde el inicio de los síntomas). Análisis estadístico: las variables cualitativas se expresan en frecuencias absolutas y porcentajes, y las variables cuantitativas mediante media, mediana y desviación típica. Análisis comparativo mediante pruebas de Student-Welch, χ2 y análisis de supervivencia de Kaplan-Meier. Todos los valores p e intervalos de confianza (IC) fueron calculados y evaluados usando un nivel de confianza bilateral del 95%. El estudio fue aprobado por el Comité de Ética de Investigación del Principado de Asturias con el código 2020.196.
El plasma de convaleciente se obtuvo mediante donación altruista de pacientes que se habían recuperado de COVID-19. Se seleccionaron aquellos convalecientes que presentaban un valor de anticuerpos anti-SARS-CoV-2>5 veces el valor de corte considerado positivo. La determinación de anticuerpos se realizó utilizando un sistema quimioluminiscente comercial automatizado en la plataforma Liaison XL® (Liaison® SARS-CoV-2 TrimericS IgG, DiaSorin, VC, Italia) Los resultados se presentan en unidades arbitrarias por mL (AU/mL), con un límite inferior de 13 AU/mL y una respuesta máxima de 800 AU/mL. El plasma se obtuvo mediante plasmaféresis en el Centro Comunitario Regional de Sangre y Tejidos. En cada donación se extrajeron entre 500-600 mL de plasma. Posteriormente se sometió a un proceso de inactivación viral con azul de metileno y se congeló hasta su uso de acuerdo con los procedimientos estándares existentes en el banco de sangre. Al paciente se le infundieron dos bolsas de PC que sumaban aproximadamente 500 mL.
El estudio se realizó sobre un total de 81 pacientes, de los cuales 28 fueron tratados con PC y 53 pacientes considerados controles. Se emparejaron por edad, sexo y APACHE II al ingreso y no existían diferencias significativas entre ambos grupos (tabla 1). El 35% eran mujeres y la edad media fue de 67,6 años. La mortalidad global fue del 38,2%. Los pacientes recibieron el PC con una mediana de nueve días desde el inicio de los síntomas y una mediana de dos días desde la hospitalización en la UCI. Desde el inicio de los síntomas hasta la intubación, la media en los pacientes que recibieron el plasma de convalecientes fue de 8,3 días (3-17) y en el grupo control de 9,1 días (1-16).
Características clínicas y resultados de los dos grupos de pacientes
| Pacientes con PCn = 28 | Pacientes sin PCn = 53 | p | |
|---|---|---|---|
| Mujeres [n (%)] | 10 (35,7) | 18 (34) | 0,87 |
| Edad [media (SD)] | 67 (13,4) | 67,4 (11,4) | 0,87 |
| APACHE II al ingreso [media (SD)] | 16,4 (4,9) | 16,1 (4,4) | 0,79 |
| Días VM [mediana] | 10 | 15 | 0,18 |
| Días UCI [mediana] | 10 | 16 | 0,66 |
| Días hospital [mediana] | 26 | 32 | 0,50 |
| Exitus [n (%] | 13 (46,4) | 18 (33,9) | 0,27 |
PC: plasma de convaleciente; VM: ventilación mecánica; SD: desviación típica.
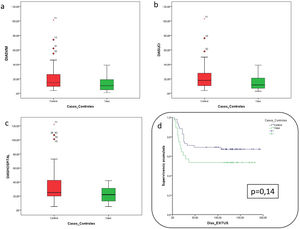
Los días de estancia en UCI, estancia hospitalaria y días en VM fueron menores en el grupo de los pacientes tratados con PC, aunque sin objetivarse una diferencia estadísticamente significativa (tabla 1 y fig. 1). Comparando estas mismas variables entre los pacientes supervivientes de cada grupo, los pacientes tratados con PC tenían una mediana de tiempo de VM de 8 vs. 14 días en los no tratados (p = 0,19), una estancia en UCI de 10 vs. 16 días en los no tratados (p = 0,66) y una estancia hospitalaria de 26 vs. 32 días (p = 0,50).
La mortalidad en los pacientes tratados con PC fue del 46,4 vs. 33,9% en el grupo control (p = 0,27). Analizando el gráfico de supervivencia por Kaplan-Meier se obtuvo una p = 0,14 (tabla 1 y fig. 1). No se documentaron efectos adversos por el uso del PC.
Por lo tanto, en nuestra experiencia, la transfusión de plasma de convalecientes en pacientes críticos con neumonía SARS-CoV-2 no obtiene beneficios con respecto a disminuir mortalidad, días de VM ni estancia en UCI. Entre las limitaciones del estudio se encuentran su pequeño tamaño muestral careciendo de la potencia estadística necesaria para extraer conclusiones definitivas y el método de selección de casos y control.
Pese a que en otras patologías infecciosas se han descrito buenos resultados con el uso de PC, nuestros hallazgos son concordantes con los obtenidos en diversos estudios realizados durante estos dos años de pandemia, donde no se ha demostrado beneficios clínicos en pacientes graves8, ni tampoco en pacientes con síntomas leves como posible inhibidor de evolución a un cuadro grave9. Sin embargo, muy recientemente se ha publicado un estudio que encuentra disminución del riesgo de progresión a enfermedad grave en pacientes tratados con PC dentro de los primeros nueve días desde el inicio de los síntomas10. En la actualidad, aunque no se recomienda administrar sistemáticamente PC en casos graves de COVID-19, su eficacia en pacientes leves u otro subgrupo de pacientes inmunodeprimidos permanece incierto.
Contribución de los autoresIván Astola y Dolores Escudero escribieron el manuscrito. Iván Astola, María Martínez, Ángeles Fernández y Eva Martínez participaron en la recogida de datos. Ana María Ojea y Pablo Herrero seleccionaron los donantes. Todos los autores revisaron el manuscrito.
Aprobación del Comité de Ética de Investigación con el código 2020.196.
FinanciaciónLa financiación para este trabajo de investigación se realizó a través de la Fundación para la Investigación Biosanitaria de Asturias (FINBA). Ensayo clínico con código de protocolo COV20/00871.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los pacientes convalecientes de COVID-19 que donaron su plasma, por su generosidad, y sin los cuales este trabajo no habría sido posible. A la Sociedad Española de Medicina y Cirugía Estética por su donación a la Fundación para la Investigación Biosanitaria de Asturias (FINBA) para realizar este trabajo.