Editado por: Federico Gordo - Medicina Intensiva del Hospital Universitario del Henares (Coslada-Madrid)
Última actualización: Octubre 2023
Más datosEl Acinetobacter baumannii es un patógeno gramnegativo, multirresistente (MR) que causa infecciones nosocomiales, especialmente en las unidades de cuidados intensivos (UCI) y en los pacientes inmunocomprometidos. El A. baumannii ha desarrollado una resistencia antibiótica de amplio espectro, asociada con alta tasa de mortalidad entre los pacientes infectados comparada con las otras especies de Acinetobacter no baumannii. En relación con el impacto clínico, las cepas resistentes están asociadas con incremento de la estadía hospitalaria y de la mortalidad. El A. baumannii puede causar diferentes infecciones, especialmente neumonía asociada a la ventilación mecánica, bacteriemia, e infección de piel y partes blandas, entre otras. Los factores de riesgo más frecuentes para la adquisición de A. baumannii MR son el uso previo de antibióticos, la asistencia respiratoria mecánica, la estadía en la UCI y en el hospital, la severidad de la enfermedad y el uso de dispositivos médicos. Los esfuerzos actuales están focalizados en determinar todos los mecanismos de resistencia descritos en el A. baumannii, con el objetivo de identificar esquemas terapéuticos más efectivos.
Acinetobacter baumannii is a Gram-negative, multidrug-resistant (MDR) pathogen that causes nosocomial infections, especially in intensive care units (ICUs) and immunocompromised patients. A. baumannii has developed a broad spectrum of antimicrobial resistance, associated with a higher mortality rate among infected patients compared with other non-baumannii species. In terms of clinical impact, resistant strains are associated with increases in both in-hospital length of stay and mortality. A. baumannii can cause a variety of infections, especially ventilator-associated pneumonia, bacteremia, and skin wound infections, among others. The most common risk factors for the acquisition of MDR A. baumannii are previous antibiotic use, mechanical ventilation, length of ICU and hospital stay, severity of illness, and use of medical devices. Current efforts are focused on addressing all the antimicrobial resistance mechanisms described in A. baumannii, with the objective of identifying the most promising therapeutic scheme.
La resistencia antimicrobiana de la mayoría de los microorganismos conlleva una grave amenaza mundial a la salud, incrementando los costos, prolongando la estadía hospitalaria, y aumentando la mortalidad de los pacientes. La Organización Mundial de la Salud (OMS) ha lanzado una fuerte alerta sobre esta amenaza, incluyendo al Acinetobacter baumannii (AB) resistente a los carbapémicos, junto con la Pseudomonas aeruginosa resistente a los carbapenémicos y las Enterobacteriaceae resistentes a los carbapenémicos y productoras de betalactamasas de espectro extendido (BLEE), dentro de la lista de «patógenos de prioridad 1 o crítica» multirresistentes a los antibióticos y peligrosos para la salud humana, y prioritarios para la Investigación y Desarrrollo (I+D) de nuevos antibióticos1.
Una reciente revisión realizada en 204 países determinó seis patógenos principales asociados con la multirresistencia (Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Acinetobacter baumannii y Pseudomonas aeruginosa), responsables de 929.000 (660.000-1.270.000) muertes atribuibles, y de 3,57 millones (2,62-4,78) muertes asociadas a la multirresistencia en el 2019. El porcentaje de aislados de AB resistentes a los carbapenémicos en estos países fue del 60 al 80%, especialmente en los países asiáticos y en los de bajos y medianos ingresos2.
El AB es un bacilo gramnegativo no fermentador, causante de infecciones intrahospitalarias graves e invasivas, asociadas con alta mortalidad. El cambio epidemiólogico del AB hacia la multirresistencia o la panresistencia antibiótica es, actualmente, un gran desafío que deja a los médicos con muy pocas opciones de tratamiento3.
Mecanismos de resistencia antibióticaLos mecanismos de resistencia a los antibióticos pueden ser a través de tres mecanismos principales:
- 1.
Control del transporte del antibiótico (ATB) a través de las membranas (reducción de la permeabilidad por porinas, incremento del eflujo o disminución del influjo del ATB).
- 2.
Protección de la bacteria al efecto del ATB a través de mutaciones genéticas o modificaciones postranslacional, que modifican el objetivo del ATB.
- 3.
Inactivación enzimática del ATB por mecanismos de hidrólisis o modificación ATB.
Una de las herramientas más importantes del AB para generar resistencia es su impresionante plasticidad genética que le facilita una rápida mutación genética y reacomodación. Además, el AB puede formar biofilm y de esta forma prolongar su sobrevida en los dispositivos médicos, como tubos endotraqueales, catéteres, entre otros3.
Resistencia a los betalactámicos: el AB muestra resistencia a los betalactámicos, a través de los diferentes mecanismos anteriormente mencionados (inactivación por hidrólisis, incrementos del eflujo, disminución del influjo y protección del ATB). Los diferentes tipos de mecanismos de resistencia a betalactámicos se muestran en la tabla 13.
A. baumannii. Mecanismos de Resistencia a betalactámicos3
| Betalactamasa | Variantes | Perfil de resistencia |
|---|---|---|
| Clase A | Betalactamasas de amplio espectro: TEM-1, TEM-2CARB-5, VEB-1, PER-1, PER-2, TEM-92, TEM-116. SHV-5, SHV-12, CTX-M-2, CTX-M-43Carbapenemasas KPC | PenicilinasCefalosporinas de espectro extendido, aztreonamCarbapenémicos, penicilinas, cefalosporinas, aztreonam |
| Clase B | Carbapenemasas IMP, VIM, SPM, SIM y NDM | Carbapenémicos, penicilinas, cefalosporinas, no hidrolizan el aztreonam |
| Clase D | Carbapenemasas: OXA-23, OXA-24, OXA-58, OXA-51 | Carbapenémicos, penicilinas, cefalosporinas, más débil para cefalosporinas de 3° y de 4° generación |
Resistencia a las polimixinas B y E (colistina): el AB presenta una membrana externa semipermeable a la inserción de elementos esenciales y para el clearance de componentes tóxicos. Los lipopolisacáridos (LPS) residen en la superficie externa y contienen lípido A hidrofóbico con carga negativa, el cual interactúa con los cationes lipopéptidos no ribosómicos de las polimixinas. Esta interacción resulta en desestabilización de la membrana externa, captación de las polimixinas en el periplasma, e incremento de la permeabilidad por alteración de la integridad tanto de la parte interna como externa de la membrana. Aunque se desconoce el mecanismo de acción exacto, la parte hidrofóbica de las polimixinas parece ser crucial para la inducción del daño de la membrana, sugiriendo un modo de acción tipo detergente (detergent-like). Los mecanismos de resistencia a las polimixinas incluyen: (a) alteración del ATB por modificación del lípido A de los LPS debido a mutaciones genéticas; (b) mutaciones de genes esenciales para la biosíntesis del lípido A y asociado con deficiencia del lípido A; (c) expresiones asociadas con defectos en la permeabilidad y en la resistencia osmótica de la membrana externa, promoviendo una marcada elevación de la concentración inhibitoria mínima (CIM) a las polimixinas; (d) concentración insuficiente de cofactores constitucionales para la formación de los LPS, esenciales para la sensibilidad a las polimixinas; y (e) bombas de eflujo4.
Resistencia a los aminoglucósidos (AG): es una resistencia adquirida. Esta resistencia ocurre por tres mecanismos diferentes1: enzima que modifica a los aminoglucósidos que debilitan la capacidad de unión de los AG2; alteración del sitio objetivo de la metiltransferasa 16S rRNA3; y limitación de la captación del AG por pérdida de la permeabilidad o sobrerreactivación de las bombas de eflujo5.
Resistencia a sulbactam: la resistencia al sulbactam no es totalmente conocida, pero parece ser fundamentalmente producida por mutación de la proteína que une a la penicilina (PBP); la producción de betalactamasas también puede contribuir al desarrollo de resistencia5,6.
Infecciones clínicas por A. baumanniiNeumonía por A. baumanniiLa neumonía intrahospitalaria (NIH) y la neumonía asociada a la ventilación mecánica (NAVM) por AB suelen ser frecuentes (40 al 95%), están asociadas con una evolución desfavorable, mayor hospitalización y costos y una mortalidad global del 45 al 85%6. Lamentablemente, el AB es altamente resistente a la mayoría de los ATB habitualmente disponibles quedando unos pocos ATB como colistina, tigeciclina y sulbactam para su tratamiento. Los carbapenemes, frecuentemente en combinación con otros ATB, son fundamentales integrantes del tratamiento de infecciones graves; sin embargo, en los últimos años se ha visto un incremento en cepas de AB resistentes a los carbapenemes, especialmente, al meropenem7,8.
El AB tiene una alta capacidad de formar biofilm en el tubo endotraqueal donde se hace muy difícil la llegada de los ATB, facilitando su lento crecimiento y mayor riesgo de NAVM. Es común la colonización bacteriana del tubo endotraqueal o traqueobronquitis asociada a ventilación mecánica (TBAVM), con incremento de la secreción purulenta e inflamación del tracto respiratorio inferior9. La TBAVM y la NAVM pueden tener presentación clínica y criterios diagnósticos muy similares, excepto que la NAVM requiere de infiltrados nuevos o persistentes en la radiografía de tórax para su diagnóstico. Debido a esta similitud, y a veces por la difícil distinción diagnóstica (por infiltrados de causa extrapulmonar que puede confundir con una NAVM), algunos autores consideran que la TBAVM podría representar un proceso previo al desarrollo de la NAVM y debería ser tratada con ATB. Sin embargo, existen controversias sobre si iniciar o no un tratamiento ATB cuando el paciente presenta TBAVM, debido al riesgo de prolongar o incrementar la infección por organismos multirresistentes, además de que no está claro del impacto que podría tener este tratamiento en la evolución del paciente10,11. El manejo de la TBAVM con ATB nebulizados se presenta como una mejor opción, debido a que los ATB nebulizados (especialmente colistina y aminoglucósidos) logran importantes concentraciones a nivel pulmonar (hasta 100 veces por encima de la CIM del AB) con casi nula difusión al plasma, minimizando los eventos adversos de estos ATB. Aunque la evidencia aún es de baja calidad, los ATB nebulizados han logrado erradicación bacteriana y mejoría clínica sin impacto en la mortalidad12,13.
Bacteriemia por A. baumanniiDiferentes series establecen una incidencia de bacteriemia por AB entre el 36 y el 64%, con una tasa de mortalidad cruda del 34-43,4%, y con una mortalidad atribuible que puede llegar al 58,6%14 .Uno de los factores de riesgo para la bacteriemia es el alto uso de procedimientos o dispositivos invasivos en estos pacientes, como intubación orotraqueal y asistencia respiratoria mecánica (ARM), catéter venoso central (CVC), catéter arterial, sonda vesical (SV), sonda nasogástrica (SNG), drenajes de tórax o abdominal, entre otros. En un metaanálisis, Zhou et al. definieron los siguientes odds ratio (OR) para la bacteriemia por AB: ARM: OR 4,79 (IC 95% 3,09-7,43); CVC: OR 6,25 (IC 95% 2,58-15,11); SV: OR 2,55 (IC 95% 1,49-4,36); y SNG: OR 4,70 (IC 95% 2,79-7,91)15. Por lo tanto, una de las conductas más importantes para disminuir las bacteriemias sería limitar al menor tiempo posible los procedimientos invasivos.
El inicio de un tratamiento ATB apropiado precoz reduce significativamente la mortalidad por AB, especialmente en los pacientes más graves14.
Tratamiento antibiótico de infecciones graves por A. baumanniiAntimicrobianos de elecciónEl tratamiento antimicrobiano inapropiado claramente ha sido asociado a mayor mortalidad en las infecciones graves por A. baumannii (AB). Frente a AB con alta resistencia a los carbapenemes, estos no parecieran ser la mejor opción dentro de un esquema de tratamiento antimicrobiano7,16.
PolimixinasLas polimixinas son los antimicrobianos con la mayor actividad in vitro contra el A. baumannii. Existen dos tipos: polimixina B y polimixina E (colistina), con estructuras y actividad antibacteriana in vitro similares, pero con diferentes propiedades farmacológicas. El punto de corte de la concentración inhibitoria mínima (CIM) para considerar la sensibilidad antibacteriana es similar para ambas polimixinas: ≤ 2 mg/L, según el Clinical and Laboratory Standards Institute (CLSI) y el European Committee on Antimicrobial Susceptibility Testing (EUCAST)17–19. El mecanismo de acción de las polimixinas sería, en parte, disrupción o ruptura de las membranas externa e interna de la bacteria a través de un mecanismo de autocaptación, inicialmente con unión de las polimixinas con carga positiva que se une a la carga negativa de los lipopolisacáridos (LPS) de la membrana externa de la bacteria vía interacciones electrostáticas e hidrofóbicas.
Polimixina E o colistina: actualmente, la polimixina E o colistina es la polimixina más frecuentemente utilizada para el tratamiento de infecciones por AB, y con la que se han realizado la mayoría de los estudios. El CLSI y el EUCAST18,19 definen igual punto de corte de la CIM para la sensibilidad pero diferentes para la resistencia (tabla 2).
De acuerdo a las International Consensus Guidelines for the Optimal Use of the Polymyxins20, se recomienda emplear polimixina B excepto en caso de infecciones del tracto urinario.
Se administra como colistina metanosulfonato sódico (CMS), una prodroga inactiva que se hidroliza a colistina base, su forma activa, en los tejidos.
El 70% de la CMS administrada se excreta a nivel tubular renal, quedando solo el 30% que se hidrolizará a colistina base. En este proceso, la colistina base también sufrirá excreción renal y extrarrenal, mientras alcanza el tejido infectado17. Un factor importante de confusión sobre el uso efectivo del CMS es la diferencia en la terminología acerca de la dosis de administración, expresadas en Unidad Internacional (UI) o en mg, dependiendo de los países. En general, un millón de UI de CMS es igual a 80 mg de CMS o 34 mg de colistina base. Luego de la administración endovenosa de la CMS, la colistina base se va formando lentamente, en aproximadamente 36 a 48 h, para alcanzar la concentración plasmática bactericida (CPB) estable mínima de 2 mg/L, administrada cada 8 h en pacientes con buena función renal. Esta baja concentración inicial de la colistina base formada ha sido un desafío en definir la dosis óptima de CMS y su forma de administración. Para contrarrestar este efecto lento de formación de la colistina, se sugiere una dosis de carga de 9-10 millones UI o de 4-5 mg/kg, y luego continuar con dosis de mantenimiento de 9-10 millones UI/día o de 4-5 mg/kg/día, repartidos cada 12 h. La dosis de carga es independiente de la función renal. Las dosis de mantenimiento deben ajustarse a la función renal para mantener una CPB entre 2 y 3 mg/L. En los pacientes hiperfiltrantes (filtrado glomerular mayor de 130 mL/min) y en los pacientes con terapias continuas de reemplazo renal puede filtrarse colistina base en exceso, disminuyendo ostensiblemente la CPB sugerida, y llegando a requerirse iguales dosis que las administradas a pacientes con función renal normal. Además, se debe tener presente la variabilidad intra paciente de la función renal, que puede mejorar o empeorar durante el tratamiento, requiriendo modificaciones de las dosis16,17,20.
En las tabla 3 y tabla 4 se resumen las recomendaciones de las International Consensus Guidelines for the Optimal Use of the Polymyxins20.
Dosis de CMS según Cl. Creatinina, para concentración de colistin plasmático de 2 mg/L20
| Dosis de carga, independiente de CI. Creatinina: 4-5 mg/kg o 9-10 millones UI | ||
|---|---|---|
| CI. Creatinina mL/min | CBA, mg/día | Millones UI/día |
| 0 | 130 | 3,95 |
| 5 a<10 | 145 | 4,40 |
| 10 a <20 | 160 | 4,85 |
| 20 a <30 | 175 | 5,30 |
| 30 a <40 | 195 | 5,90 |
| 40 a <50 | 220 | 6,65 |
| 50 a <60 | 245 | 7,40 |
| 60 a <70 | 275 | 8,35 |
| 70 a <80 | 300 | 9,00 |
| 80 a <90 | 340 | 10,3 |
| ≥ 90 | 360 | 10,9 |
Cl: clearance; CMS: colistinametanosulfonato; CBA: actividad de colistina base.
Dosis adicional de colistin, según la terapia reemplazo renal20
| a. Hemodiálisis intermitente (HDI) (≈ 3-4 horas duración): |
| * Día no HDI: 130mg o 3,95 millones UI |
| * Día HDI: dosis extra posterior HDI: |
| HDI 3 horas: 40mg o 1.2 millones UI |
| HDI 4 horas: 50mg o 1.6 millones UI |
| b. Terapias dialíticas lentas (8-10 horas duración) (SLED: Sustained Low-Efficiency Dialysis): |
| * Adicionar 10% de la dosis basal x cada 1 h de diálisis: ≈ 260 mg/d (130 + 130) o 7,9 millones UI/día, repartidos c/12 horas |
| c. Terapia reemplazo renal continua (CRRT) (durante 24 horas duración) |
| * 440 mg/d o 13.3 millones UI/día, repartidos c/12 horas |
Polimixina B (PMB): se administra directamente como su forma activa. En diferentes países también se puede expresar en mg o en UI, considerándose 1 mg = 10.000 UI.
Comparada con la CMS, solo unos pocos estudios pequeños han evaluado la farmacocinética de la PMB luego de la administración endovenosa. Su eliminación es fundamentalmente por vía no renal, con < 1% recuperada sin cambios en la orina. La función renal no afecta marcadamente la concentración plasmática de la PMB y no debería ser usada para ajustar la dosis21. Similar a la colistina, la PMB es removida durante la diálisis; sin embargo, no se recomiendan ajustes de las dosis en pacientes con terapia de reemplazo renal debido a datos clínicos limitados22.
La mayoría de los estudios que evalúan la farmacodinamia de las polimixinas han sido realizados usando la colistina. La colistina muestra una rápida actividad de muerte bacteriana dependiente de la concentración contra el AB y la P. aeruginosa, con mínimo efecto postantibiótico. Sin embargo, el mejor parámetro que describe su actividad antimicrobiana (índice PK/PD) es la relación del área bajo la curva tiempo-concentración libre sobre la CIM (fAUC/CIM)23. A pesar de una rápida muerte inicial, el recrecimiento puede ocurrir muy rápidamente (tan temprano como dentro de las dos horas de la exposición inicial)23–26. En los pacientes con buena función renal, es muy probable que la administración de PMB genere mayores concentraciones plasmáticas sobre la CIM que la CMS porque: (a) la función renal influencia la distribución de la CMS pero no de la PMB; y (b) la conversión a colistina in vivo es lenta e incompleta.
La PMB muestra una farmacodinamia muy similar a la colistina, con similar efecto rápido de muerte contra el AB, la K. pneumoniae y la P. aeruginosain vitro, seguido por un rápido recrecimiento27–29. En las cepas heterorresistentes a las polimixinas, la amplificación de las subpoblaciones resistentes a las polimixinas ha demostrado jugar un importante rol en la rápida emergencia de resistencia30–32.
Toxicidad de las polimixinas: la nefrotoxicidad es el efecto adverso más común y dosis limitante del uso endovenoso, con una incidencia de hasta el 60%33,34. La PMB y la colistina se acumulan en la célula tubular renal posiblemente a través de mecanismos de captación activos mediados por megalina y transportadores PEPT235,36. Estas concentraciones extremadamente altas en las células tubular renal causan cambios dramáticos en la morfología de las mitocondrias, pérdida del potencial de membrana citoplasmática, apoptosis y parada del ciclo celular. El mecanismo preciso de la captación de las polimixinas por la célula tubular y posterior muerte celular aún permanece poco conocido37,38.
Colistina nebulizadaVarios estudios evaluaron el uso de colistina nebulizada vs. combinación de colistina nebulizada más colistina endovenosa vs. colistina endovenosa solo para neumonía asociada al respirador, lográndose una mayor cura clínica con colistina nebulizada sobre las otras dos opciones. La colistina nebulizada alcanza altas concentraciones en el líquido alveolar (de hasta 100 veces sobre la CIM del AB), logrando la muerte bacteriana en pocas horas, con nula difusión al plasma (baja toxicidad). Estas concentraciones son imposibles de alcanzar con la administración endovenosa sin exponer al paciente a una mayor toxicidad39,40.
TigeciclinaEs una glicilciclina con efecto sobre bacilos gramnegativos y cocos positivos. Sin embargo, solo posee autorización de la U.S. Food and Drug Administration (FDA) para infecciones complicadas de la cavidad abdominal, de infecciones cutáneas y sus anexos, y de neumonía de la comunidad; no tiene indicación para infecciones bacteriémicas y urinarias. La FDA publicó un alerta sobre el incremento en el riesgo de mortalidad de la tigecilina comparada con otros ATB para tratar infecciones graves similares. Este mayor riesgo de muerte fue más claro en pacientes con neumonía severa intrahospitalaria (NIH) y con neumonía asociada a la ventilación mecánica (NAVM), por lo que no fue aprobada para el tratamiento de estas neumonías41.
La dosis estándar recomendada es: carga de 100 mg, seguida por 50 mg cada 12 h. Recientemente, algunos autores han sugerido administrar dosis doble (carga de 200 mg, seguida por 100 mg cada 12 h) para optimizar el efecto antibacteriano y alcanzar la cura clínica en pacientes obesos, con NIH, y con NAVM42,43. En los pacientes con neumonía grave (NIH, NAVM) estas altas dosis estuvieron asociadas con una mejor evolución, debido a que las concentraciones de tigeciclina en el líquido endotelial pulmonar son insuficientes con las dosis estándares, especialmente para infecciones con AB con una CIM mayor a 2 mg/L, usualmente en combinación con otro antibiótico. A estas dosis doble, la tigeciclina fue bien tolerada, sin toxicidad relevante43.
SulbactamEs un inhibidor de betalactamasas, con actividad bactericida contra varias cepas de AB multirresistentes a otros fármacos. Se comercializa fundamentalmente en combinación con un betalactámico, como ampicilina-sulbactam o cefoperazona-sulbactam. Su rol más importante es su unión irreversible a los sitios activos de las enzimas producidas por el patógeno y así bloquear la actividad de la betalactamasa contra el betalactámico. La propiedad antimicrobiana que distingue al sulbactam de otros inhibidores de betalactamasas es su actividad contra el AB.
El sulbactam es considerado un ATB con actividad antibacteriana tiempo dependiente, es decir, que el parámetro farmacocinético/farmacodinámico (PK/PD) que mejor se correlaciona con su eficacia es el porcentaje durante el cual la droga libre permanece por más del 50% del intervalo de dosis por encima de la CIM del AB. Para lograr esta eficacia, la mejor forma de administrar el sulbactam es en una infusión prolongada de cuatro horas de duración de cada dosis44. Por lo tanto, la dosis sugerida, especialmente para los aislados menos sensibles (CIM de hasta 8 mg/L), es de 3 g de sulbactam cada ocho horas en una infusión prolongada de cuatro horas de duración16,44.
CefiderocolEl cefiderocol es una cefalosporina siderófora con un mecanismo peculiar de entrada a través de la membrana celular externa de los patógenos gramnegativos. Cefiderocol, utiliza el sistema de absorción de hierro de la propia bacteria para acceder al interior la misma. Tienen una potente actividad frente a una amplia actividad contra Enterobacteriales y bacilos gramnegativos no fermentadores, como Pseudomonas aeruginosa y Acinetobacter baumannii, incluidas cepas resistentes a carbapenemes. Esta nueva cefalosporina no es afectada por las metalobetalactamasas tipo VIM o NDM, así como por las carbapenemasas de la clase D (OXA-23 u OXA-51) que son los principales mecanismos enzimáticos que posee el AB para inactivar los betalactámicos45.
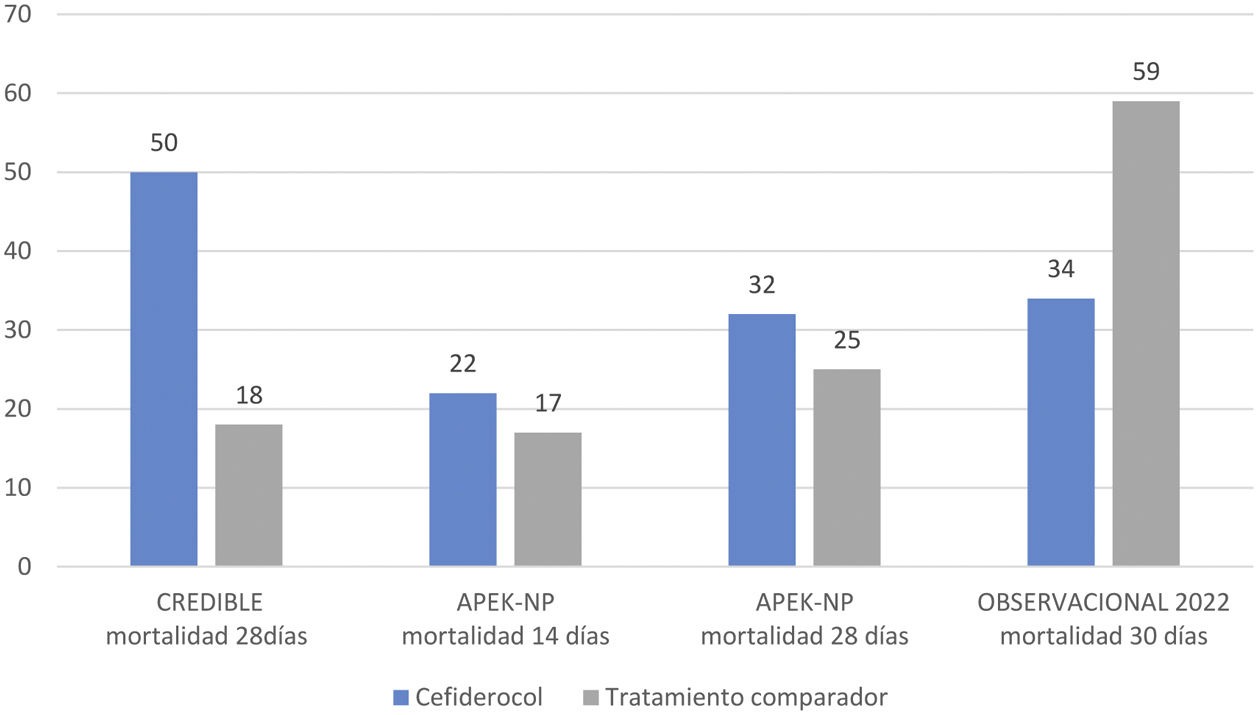
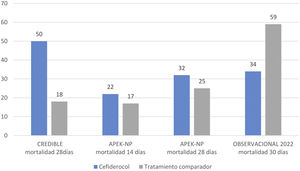
El estudio CREDIBLE46 es un ensayo clínico abierto fase 3, para describir la eficacia y seguridad de cefiderocol o de la mejor terapia disponible (MTD) para el tratamiento de un amplio espectro de infecciones graves causadas por patógenos resistentes a carbapanémicos, independientemente del sitio de infección. Aunque los resultados clínicos y microbiológicos fueron globalmente similares entre cefiderocol y la MTD, en el subgrupo de pacientes con infecciones por A. baumannii la mortalidad fue superior en el grupo tratado con cefiderocol que en el grupo que recibió la MTD (50 vs. 18%) (fig. 1).
Por el contrario, el estudio APEKS-NP es un ensayo clínico doble ciego que evaluó cefiderocol frente a meropenem en pacientes con neumonía nosocomial por bacilos gramnegativos47. En el mismo se demostró la no inferioridad del cefiderocol y al realizar el subanálisis de los pacientes con neumonía por AB no hubo diferencias entre los dos grupos ni en mortalidad a los 14 días (objetivo primario del estudio) ni en los otros objetivos secundarios (fig. 1).
Con base en los resultados de estos estudios, principalmente el CREDIBLE, tanto las guías europeas (ESCMID y ESICM) como las guías americanas de la IDSA desaconsejan el uso de cefiderocol en infecciones por AB y si se emplea por falta de otros recursos recomiendan se administre, siempre que sea posible, en tratamiento combinado con otro antibiótico activo in vitro48,49.
Más recientemente, un estudio observacional retrospectivo ha reportado la experiencia con cefiderocol en el tratamiento de infecciones graves por AB (79 pacientes con bacteriemia, 35 con NAVM y 10 con otro tipo de infecciones) en un hospital italiano50. Se compararon 47 pacientes tratados con cefiderocol (32% en monoterapia) con 77 pacientes que recibieron un tratamiento basado en colistina (solo 17% en monoterapia). La mortalidad a los 30 días fue significativamente superior en el grupo que recibió colistina (55.8 vs. 34%, p = 0,018) identificando el análisis multivariante como factor protector de mortalidad el recibir tratamiento con cefiderocol. Como era esperado, el desarrollo de nefrotoxicidad fue más frecuente en el grupo de colistina.
Monoterapia o terapia combinadaEl beneficio clínico de la monoterapia vs. la terapia combinada es aún tema de debate, debido a la falta de evidencia definitiva de adecuados ensayos controlados aleatorizados, la mayoría de los estudios son observacionales. López-Cortés et al.51 evaluaron 101 pacientes con sepsis por AB multirresistente en 28 hospitales españoles: el 67,3% de los pacientes recibieron monoterapia vs. el 32,7% que recibió terapia combinada. La neumonía fue la infección más frecuente (50,5%), y de estas, el 68,6% fueron NAVM. La colistina (67,6%) y los carbapenemes (14,7%) fueron los ATB más comúnmente utilizados en la monoterapia; en cambio, colistina más tigeciclina (27,3%), y carbapenemes más tigeciclina (12.1%) fueron las combinaciones más frecuentes. En el análisis multivariado, la sobrevida a los 30 días no mostró diferencias entre ambos esquemas: monoterapia 23,5% y terapia combinada 24,2%.
En la tabla 5 se resumen los resultados de seis estudios, aleatorizados que evaluaron la monoterapia (MT) vs. la terapia combinada (TC) en infecciones por AB multirresistente52–57. Algunos autores encontraron un 20% de antagonismo in vitro entre los antibióticos estudiados, como colistina, tigeciclina, meropenem, sulbactam o aminoglucósidos58.
Monoterapia vs. terapia combinada. Estudios randomizados, aleatorizados
| Estudio, año (Ref.) | Población | Tratamiento | Resultados |
|---|---|---|---|
| Paul M et al., 201852 | 406 pacientes con neumonía o bacteriemia por BGN resistentes a carbapenemes; 77% fueron por AB | Colistin (MT) vs. colistin más Meropenem (TC) | MT vs. TC: no diferencia significativa en fallo clínico y mortalidad a los 14 días: 79 vs. 73%. Resultados similares entre pacientes con infección por AB. |
| Durante-Mangoni E et al., 201353 | 210 pacientes con infecciones por AB | Colistin (MT) vs. colistin más rifampicina (TC) | MT vs. TC: mortalidad no diferencia a los 30 días (42,9 vs. 43,3%). Diferencia significativa en erradicación microbiológica en TC; (p = 0,034) |
| Aydemir H et al., 201354 | 43 pacientes con NAVM por AB | Colistin (MT) vs. colistin más rifampicina (TC) | MT vs. TC: mortalidad no diferente: 63,6 vs. 38,1% (p = 0,017); Diferencia en tiempo a la erradicación microbiológica: 4,5 ± 1,7 días vs. 3,1 ± 0,5 días; (p = 0,029) |
| Park HJ et al., 201955 | 9 pacientes con neumonía por AB | Colistin (MT) vs. colistin más rifampicina (TC) | MT vs. TC:no diferencia en cura clínica (80 vs. 66,7%; p > 0,99) ni en respuesta microbiológica (40 vs. 100%; p = 0,19) |
| Makris D et al., 201856 | 39 pacientes con NAVM por AB | Colistin (MT) vs. colistin más ampicilina/sulbactam (TC) | MT vs. TC:diferencia en cura clínica (15,8 vs. 70%; p = 0,001). No diferencia en mortalidad ajustada a los 28 días (63,2 vs. 50%; p = 0,32) |
| Sirijatuphat R et al., 201457 | 94 pacientes con Infección por AB; por neumonía en 78% de MT y en 74% de TC | Colistin (MT) vs. colistin más fosfomicina (TC) | MT vs. TC:No diferencia en mortalidad a los 28 días (53,8 vs. 44,2%; p = 0,50) ni en respuesta clínica (56,4 vs. 62,8%; p = 0,65). Diferencia significativa en erradicación bacteriana (84,5 vs. 100%; p = 0,023) |
BGN: bacilo gramnegativo; MT: monoterapia; TC: terapia combinada; AB: A. baumannii; NAVM: neumonía asociada a ventilación mecánica.
Como se evidencia en estos estudios, el tratamiento ATB de los AB multirresistentes es un gran desafío, especialmente en las infecciones graves; no hay un claro régimen de ATB «estándar de cuidado (standard of care)», con el cual estimar la efectividad de los diferentes regímenes de tratamiento. Los AB que muestran resistencia a los carbapenemes generalmente podrían también haber ya adquirido resistencia a la mayoría de los ATB que se consideraran activos (sulbactam, aminoglucósidos, fluoroquinolonas)59.
Las recientes guías IDSA59 sugieren que un tratamiento ATB con un solo agente activo podría ser suficiente para infecciones leves causadas por AB resistente a carbapenemes (AB-RCB), de preferencia ampicilina/sulbactam. Mientras que recomiendan una terapia combinada en infecciones moderadas a severas con al menos dos ATB con actividad in vitro, con datos clínicos de moderada evidencia, al menos hasta que se observe una adecuada respuesta clínica.
En las últimas guías de la ESCMID recientemente publicadas60 definieron las siguientes recomendaciones en relación al tratamiento ATB para infecciones por AB resistentes a carbapenemes (AB-RCB):
- a.
No recomiendan terapia combinada de polimixinas más meropenem (fuerte recomendación en contra de su uso, alta certeza de la evidencia), ni combinación de polimixina más rifampicina (fuerte recomendación en contra de su uso, evidencia de moderada certeza).
- b.
Para infecciones graves y con alto riesgo de AB-RCB, sugieren terapia combinada que incluya dos ATB activos in vitro entre los ATB disponibles (polimixinas, aminoglucósidos, tigeciclina, sulbactam) (recomendación condicional para su uso, evidencia de muy baja certeza).
- c.
Para infecciones por AB-RCB con CIM al meropenem ≤ 8 mg/L consideran terapia combinada de carbapenemes usando dosis alta en infusión prolongada o extendida (recomendación de buenas prácticas, opinión de expertos).
- d.
Para pacientes con neumonía intrahospitalaria y NAVM por AB-RCB sensibles a sulbactam, sugieren ampicilina/sulbactam (recomendación condicional, evidencia de baja certeza).
- e.
Para pacientes con AB-RCB resistente a sulbactam, recomiendan usar una polimixina o altas dosis de tigeciclina si muestran actividad in vitro (falta de evidencia para recomendar un ATB de preferencia).
- f.
Recomiendan en contra del tratamiento con cefiderocol para AB-RCB (recomendación condicional en contra de su uso, baja certeza de la evidencia).
Dos metaanálisis han evaluado los resultados de datos observacionales y de ensayos clínicos randomizados de diferentes tratamientos para infecciones por AB-RCB61,62. En su metaanálisis publicado en 2021, Liu et al.61 incluyeron 18 estudios que sumaron 1.835 pacientes; encontraron que ampicilina/sulbactam a dosis diaria máxima de 18 g por día en combinación con un segundo agente fue el más efectivo para reducir la mortalidad; la nefrotoxicidad fue menos evidente en los regímenes con ampicilina/sulbactam que en los regímenes basados en polimixinas. Jung SY et al. 62 publicaron su metaanálisis en 2017 incluyendo 23 estudios observacionales o ensayos clínicos randomizados con 2.118 pacientes; identificaron que el sulbactam fue el que tuvo mayor impacto en reducir la mortalidad cuando se evaluaron regímenes basados en sulbactam vs. regímenes basados en polimixinas o tetraciclinas; desafortunadamente no pudieron comparar eventos adversos entre los diferentes esquemas.
Duración del tratamiento ATBA pesar de que múltiples guidelines recomiendan acortar la duración del tratamiento ATB debido al preocupante incremento de la resistencia antimicrobiana, esto no se suele aplicar mayoritariamente en la vida real, especialmente en los pacientes con infecciones severas, muchas veces críticos, con shock, y con disfunción multiorgánica63.
En los últimos años se ha puesto énfasis en la disrupción del microbioma intestinal que puede llevar a la colonización con organismos patógenos, y cómo esta situación puede ser un reservorio de resistencia antimicrobiana como, por ejemplo, resistencia a betalactámicos y a quinolonas mediada por plásmidos64.
Un reciente metaanálisis de 19 estudios aleatorizados que incluyeron 2.867 pacientes evaluó los resultados de un tratamiento ATB corto vs. un tratamiento prolongado. No se encontró ninguna diferencia significativa en la cura microbiológica, en la recurrencia de la infección, o en la mortalidad a los 45, 60 y 180 días. La heterogeneidad entre los estudios no fue significativa para estos diferentes resultados. Los autores concluyeron que un curso corto de ATB puede ser seguro en los pacientes hospitalizados, con infecciones frecuentes como neumonía, infección del tracto urinario, infección intraabdominal, y que se puede alcanzar la resolución clínica y microbiológica sin efectos adversos sobre la mortalidad o la recurrencia65.
La duración óptima de un tratamiento ATB debe balancear la eficacia o muerte antimicrobiana (bacterial killing) y los efectos adversos de los ATB como la toxicidad o el desarrollo de resistencia. Infecciones frecuentes en pacientes críticos inmunocompetentes se podrían tratar con un curso corto de siete días o menos, siempre que sea con el ATB activo o apropiado y a las dosis adecuadas, y con control del foco infeccioso cuando corresponde. La integración de diferentes parámetros como los signos clínicos de resolución de la infección, biomarcadores, y el juicio clínico pueden ayudar a definir la duración óptima del tratamiento ATB en infecciones severas causadas por organismos multirresistentes o extremadamente resistentes que amenazan la vida del paciente66. Para los pacientes con una infección confirmada, la duración del tratamiento ATB puede estar determinada por la interacción entre factores del huésped, del patógeno y del ATB, y de otros prerrequisistos para definir un acortamiento del tratamiento, como: (i) mejoría de los signos y síntomas clínicos; (ii) control adecuado y a tiempo del foco infeccioso; (iii) sensibilidad confirmada al ATB administrado cuando se recibe el resultado bacteriológico (tratamiento empírico apropiado); y (iv) seguimiento adecuado de la farmacocinética/farmacodinamia (PK/PD) de los ATB indicados66.
La duración de la terapia ATB para las infecciones por AB no ha sido adecuadamente definida. En algunos estudios se consideró un curso corto a un tratamiento menor a 10 días, y un curso largo al de igual o mayor a 10 días67,68. Sin embargo, otros estudios definieron tratamiento mayor de siete u ocho días como un curso largo69.
En un ya clásico trabajo, Chastre et al.70 compararon un tratamiento ATB de ocho días (n = 197) vs. 15 días (n = 204) de duración en pacientes con NAVM; sus resultados fueron: (i) igual evolución favorable y estadía en la UCI; (ii) igual mortalidad (18,8 vs. 17,2%); (iii) igual tasa de recurrencia (28,9 vs. 26%), recaída (16,8 vs. 11,3%) y sobreinfección (19,8 vs. 18,6%). Cuando se analizó el subgrupo de pacientes con infección por P. aeruginosa y A. baumannii no hubo diferencias con respecto a la estadía en la UCI, fallo multiorgánico y mortalidad; sin embargo, la recurrencia fue significativamente mayor en el grupo de ocho días vs. el de 15 días (40,6 vs. 25,4%; p = 0,003), aunque la recurrencia por organismos multirresistentes fue significativamente menor en el grupo de ocho días (42,1 vs. 62%; p = 0,04). Los autores concluyeron que un tratamiento corto de ocho días es posible en pacientes con NAVM, incluso por bacilos gramnegativos no fermentador
En las guías de práctica clínica de la IDSA/ATS, un curso corto de siete días, en lugar de un curso más largo, fue fuertemente recomendado en neumonía intrahospitalaria y en NAVM, incluso producidas por bacilos gramnegativos no fermentador como P. aeruginosa y A. baumannii71.
En una revisión, Busch et al.72 definieron los siguientes cursos de tratamiento ATB según el sitio de la infección:
- a.
Bacteriemia: 10 a 14 días.
- b.
Neumonía asociada a la ventilación mecánica (NAVM): siete a 10 días.
- c.
Neumonía adquirida en el hospital: siete a 10 días.
- d.
Neumonía adquirida en la comunidad: cinco a siete días.
- e.
Infección intraabdominal complicada: cinco a siete días.
- f.
Infección urinaria complicada: cinco a siete días.
Finalmente, las guías de la Surviving Sepsis Campaign 202173, para los adultos con sepsis o shock séptico y adecuado control del foco, en relación con el manejo del tratamiento ATB, sugieren:
- a.
Tratamiento ATB corto sobre un curso largo (recomendación débil, muy baja calidad de la evidencia).
- b.
De escalar el tratamiento ATB vs. continuar con una duración fija recomendación débil, muy baja calidad de la evidencia).
- c.
Usar procalcitonina más evaluación clínica sobre la evaluación clínica sola, para decidir cuándo suspender la terapéutica (recomendación débil, baja calidad de la evidencia).
El riesgo de un curso largo de ATB fue evaluado por Curran et al.74, en un metaanálisis de 71 estudios controlados randomizados (23.174 pacientes). Cada día de terapia ATB estuvo asociada con 4% de incremento en el odds de experimentar un evento adverso (OR 1,04, IC 95% 1,02-1,07). El odds diario de eventos adversos severos también se incrementó (OR 1,09, IC 95% 1,00-1,19). El incremento diario del odds de sobreinfección y de resistencia ATB fueron OR 0,98 (0,92-1,06) y OR 1,03 (0,98-1,07), respectivamente.
Estos datos permitirán balancear riesgos vs. beneficio cuando se decide por una terapéutica prolongada.
Antibióticos en desarrolloAunque el listado puede ser mayor, en este apartado se revisan dos nuevas moléculas con actividad frente a AB si bien no cuentan aún con datos clínicos, especialmente la segunda de ellas.
Eravaciclina: pertenece al grupo de antibióticos de las tetraciclinas, por lo que inhibe la síntesis de la proteína bacteriana mediante la unión a la subunidad 30S ribosomal. Posee una potente actividad de amplio espectro contra bacilos gramnegativos (excepto P. aeruginosa y Burkholderia spp.) y cocos grampositivos, incluidos los anaerobios, así como patógenos bacterianos atípicos. Entre los bacilos gramnegativos (BGN) presenta actividad frente a Enterobacterales productores de carbapenemasa (incluyendo KPC, VIM, IMP, NDM y OXA-48), así como AB resistente a carbapenemes. Posee una potencia cuatro a ocho veces superior a tigeciclina frente a AB75. Existe muy escasa experiencia clínica con este antibiótico en infecciones por AB. Es más, aunque según estos datos eravaciclina podría ser una alternativa válida en reciente estudio retrospectivo de pacientes con infecciones graves por AB no muestra resultados muy favorables, especialmente en pacientes con bacteriemia en los que la mortalidad fue superior en los tratados con eravaciclina en comparación con los que recibieron la mejor terapia disponible76.
Durlobactam: es un nuevo inhibidor de amplio espectro de las betalactamasas de tipo serina (clases A, C y D de Ambler), que tiene además una débil actividad intrínseca frente a AB. Durlobactam mejora la actividad de varios betalactámicos frente a AB, pero la combinación más potente se ha observado con otro inhibidor de betalactamasa, sulbactam. En un estudio reciente, la actividad in vitro de la combinación de durlobactam/sulbactam se evaluó frente a 1.722 aislamientos clínicos de AB, recolectados en los cinco continentes en 2016 y 2017. Más del 50% de estas muestras resultaron resistentes a los carbapenémicos. Durlobactam/sulbactam mostró valores de CMI50 de uno, mientras que para sulbactam fue de 8 g/mL y una CIM90 de 64 g/mL. En este estudio, la colistina fue el único antimicrobiano tradicional con actividad similar a durlobactam/sulbactam 77. En la actualidad faltan datos clínicos que demuestren la utilidad de esta combinación de inhibidores de betalactamasas en infecciones por AB. Se ha completado un ensayo clínico fase 3 (ATTACK) comparando durlobactam/sulbactam con colistina en infecciones graves por AB. Estos datos no están aún publicados, pero un reporte preliminar comunica que se ha alcanzado el criterio de no inferioridad en el objetivo primario (mortalidad cruda a los 28 días) 78.
ConclusionesEl A. baumannii es un bacilo gramnegativo no fermentador con alto grado de multirresistencia, que causa múltiples infecciones nosocomiales graves, que está asociado con alta morbimortalidad, especialmente en pacientes críticos, con shock séptico y falla multiorgánica. En las últimas décadas el A. baumannii reveló mayor resistencia contra múltiples ATB, incluso contra carbapenemes, a través de múltiples mecanismos de resistencia que actualmente significan una complicación y un enorme desafío al momento de decidir un esquema antibiótico efectivo, así como también la duración del mismo. El entendimiento de estos mecanismos, así como de los factores de riesgo para el desarrollo de infecciones por AB son cruciales para disminuir su incidencia en las UCI y en el hospital, y llevar al mínimo la colonización y la prevención de la transmisión de la infección por A. baumannii.
FinanciaciónLos auotores declaran que este artículo no tiene financiación ni becas.
Conflicto de interesesLos autores eclaran no tener conflicto de intereses.