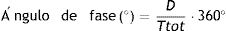Editado por: Rosario Amaya Villar - Unidad de Cuidados Intensivos, Hospital Universitario Virgen del Rocio, Sevilla, España
Última actualización: Febrero 2024
Más datosEsta revisión aborda el fenómeno «trigger reverso», una asincronía que se presenta en pacientes sedados o en transición de despertar, con una prevalencia en estos grupos del 30% al 90%. Los mecanismos fisiopatológicos aún no están claros, pero se propone el «entrainment» como uno de ellos. Detectar esta asincronía es complejo y se han usado métodos como inspección visual, presión esofágica, ecografía diafragmática y métodos automáticos. El trigger reverso puede tener efectos en la función pulmonar y diafragmática, mediados porbablemente por el nivel de esfuerzo respiratorio y la activación excéntrica del diafragma. El manejo óptimo no está establecido y puede incluir ajuste de parámetros ventilatorios, frecuencia respiratoria, nivel de sedación y en casos extremos, bloqueo neuromuscular. Es importante comprender su significación, su detección e incrementar la investigación para mejorar su manejo clínico y sus potenciales efectos en los pacientes críticamente enfermos.
This review addresses the phenomenon of “reverse triggering”, an asynchrony that occurs in deeply sedated or patients in transition from deep to light sedation. Reverse triggering has been reported to occur between 30% and 90% of ventilated patients. The pathophysiological mechanisms are still unclear, but “entrainment” is proposed as one of them. Detecting this asynchrony is crucial, and methods such as visual inspection, esophageal pressure, diaphragmatic ultrasound, and automatic methods have been used. Reverse triggering may have effects on lung and diaphragm function, probably mediated by the level of breathing effort and eccentric activation of the diaphragm. The optimal management of reverse triggering is not established and may include adjustment of ventilatory parameters as well as sedation level, and in extreme cases, neuromuscular blockade. It is important to understand the significance of this condition, its detection, but also to conduct dedicated research to improve its clinical management and its potential effects in critically ill patients.
La ventilación mecánica (VM) es una técnica de soporte vital frecuentemente utilizada en la unidad de cuidados intensivos en un amplio espectro de pacientes. Una ventilación segura y eficaz depende de una correcta interacción entre el paciente y el ventilador. Cuando esta interacción es inapropiada, surgen discrepancias entre las fases del ciclo respiratorio y el esfuerzo del paciente, fenómeno conocido como asincronía paciente-ventilador (APV)1. Existen diversos tipos de APV y se pueden clasificar según el momento del ciclo ventilatorio en que ocurren, el mecanismo fisiopatológico que lo subyace o bien sus potenciales consecuencias2-4.
Recientemente, el trigger reverso (TR) ha sido descrito como un tipo de APV donde la contracción de los músculos respiratorios ocurre de manera retrasada a la insuflación pasiva del ventilador5. TR puede generar diversos efectos tanto a nivel pulmonar como a nivel diafragmático dependiendo de la magnitud del esfuerzo respiratorio y de la situación clínica del paciente6. El objetivo de esta revisión es describir la epidemiología, los métodos de detección y las potenciales consecuencias de la asincronía TR con el fin de optimizar su manejo en la práctica clínica.
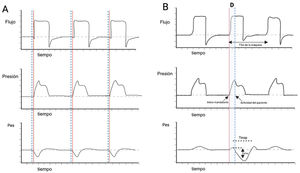
Definición y epidemiología del TREsta asincronía, en inglés se denomina como «reverse triggering», se suele traducir como trigger reverso y corresponde a un tipo específico de interacción entre el paciente y el ventilador mecánico en donde ocurre una contracción del diafragma de manera retrasada o cierto tiempo después de una insuflación pasiva iniciada por el ventilador (fig. 1)6, sin excluir una activación de otros músculos respiratorios7.
Descripción esquematica de trigger reverso. Panel A) se observa una ventilación espontánea, en un modo VC, donde el inicio del esfuerzo realizado por el paciente (líneas punteadas azules) anteceden el inicio del ciclo ventilatorio mandatorio (líneas continuas rojas). Panel B) Se observa una asincronía de TR donde destaca la ocurrencia desfasada D) del esfuerzo respiratorio del paciente (deflexion negativa Pes y línea punteada azul) en comparación con el inicio del ciclo de ventilación mandatoria (línea continua roja). El color de la figura solo puede apreciarse en la versión electrónica del artículo.
D: desfase; Pes: presión esofágica; TR: trigger reverso; VC: volumen controlado.
La presencia de este fenómeno fue descrita por primera vez en la unidad de cuidados intensivos el año 2013, en 8 pacientes ventilados con modos asistidos por volumen o por presión, con monitoreo de mecánica respiratoria con un balón esofágico5. Los autores notaron que la insuflación pasiva del ventilador provocó una respuesta refleja del paciente que resultó en una contracción diafragmática. El TR se ha observado que ocurre principalmente en pacientes bajo sedación profunda o que se encuentren en una fase de transición desde la ventilación controlada a la ventilación espontánea. El TR también se puede presentar en forma de patrones regulares que pueden variar entre pacientes o dentro del mismo individuo8.
La frecuencia y forma de presentación de este fenómeno es variable entre las publicaciones dependiendo del método de detección, tiempo de registro, modo ventilatorio, situación clínica del paciente y unidad de análisis (por ejemplo, número de pacientes o número de respiraciones con TR analizados y registrados en un mismo paciente). La frecuencia de la asincronía registrada en los pacientes ha sido variable, pudiendo representar hasta el 75% de las respiraciones incluso algunos pacientes presentaron una frecuencia superior al 90% de sus respiraciones con TR8,9.
FisiopatologíaExisten diversos mecanismos potenciales que pueden explicar la ocurrencia de TR, los cuales se describen a continuación.
EntrainmentUno de los principales mecanismos propuestos para la ocurrencia de TR corresponde al fenómeno de «entrainment» que se define como un acoplamiento o alineamiento entre el centro respiratorio del paciente y los ciclos ventilatorios programados en el ventilador mecánico. Este entrainment, se puede observar cuando existe un acoplamiento estable de fase entre la frecuencia de estimulación –en este caso los ciclos ventilatorios de insuflación pasiva–- y la frecuencia del oscilador autónomo (ritmo respiratorio del paciente) asumiendo una relación periódica que sigue diferentes patrones de ocurrencia.
El entrainment respiratorio parece ser producido principalmente por el estiramiento de los receptores de adaptación lenta y una activación sostenida del reflejo de Hering-Breuer mediada por el nervio vago9. Experimentos en animales han demostrado que la abolición del reflejo de Hering-Breuer por enfriamiento o sección de los nervios vagos impide este tipo de interacción10. Se cree que la insuflación pasiva por parte del ventilador provoca el reflejo de Hering-Breuer por estímulo de los receptores de estiramiento en las vías respiratorias superiores, los pulmones y la pared torácica que brindan retroalimentación aferente al centro respiratorio, que luego iguala la frecuencia del estímulo externo11. Sin embargo, el TR también se ha descrito en pacientes con trasplante pulmonar bilateral a pesar de la resección de las aferencias vagales, lo que sugiere que la retroalimentación vagal puede ser suficiente para activar el TR pero no el único camino para producirlo. La fisiología del TR parece más compleja de lo que se pensaba, y existe la posibilidad de que uno o varios de estos mecanismos puedan estar involucrados en un paciente gravemente enfermo.
Patrones de entrainmentEl patrón de entrainment puede ser definido como la relación de acoplamiento entre las respiraciones neurales y los ciclos del ventilador. Un patrón 1:1 y 1:2 equivaldrían a una respiración del paciente en cada ciclo ventilatorio y a una respiración del paciente cada dos ciclos respiratorios, respectivamente. Los estudios fisiológicos y en pacientes ventilados mecánicamente han demostrado que la relación 1:1 es el patrón de entrainment más frecuente y estable, el cual es identificado principalmente en pacientes bajo sedación profunda o en período de transición al despertar con niveles de sedación más superficial5. Por otro lado, patrones de entrainment menos estables como 1:3, 1:4 y 2:3 se evocan con patrones ventilatorios alejados del patrón intrínseco del centro respiratorio. Estos son más inestables y pueden interrumpirse por patrones irregulares. En la actualidad se desconocen los factores que determinan un determinado patrón o como este entrainment puede variar dentro de un mismo paciente.
Ángulo de faseUno de los métodos para determinar la estabilidad del TR es el análisis del ángulo de fase, que no es más que una forma de cuantificar la latencia de la respuesta del centro respiratorio. El ángulo de fase puede ser calculado como:
donde D es la diferencia de tiempo entre el inicio de la actividad muscular del paciente y el inicio de la insuflación mecánica y Ttot es la duración del ciclo respiratorio. Ángulos de fase entre 0 y -180° reflejan que la inspiración del paciente se inicia en la primera mitad del Ttot y se pueden observar patrones 1:1, 1:2, 2:3 estables. Por otra parte, los ángulos de fase de 0° a 180° se obtienen cuando las relaciones de entrainment son caóticas o menos frecuentes12. Para verificar el ángulo de fase, se utiliza el coeficiente de variabilidad (desviación estándar del ángulo de fase/promedio ángulo de fase×100). Un coeficiente de variación inferior al 15% se considera compatible con el entrainment, descartando que los eventos observados sean sugerentes de respiraciones producto del azar u otros tipos de asincronía13.
Mecanismos que no involucran el centro respiratorioLa evidencia de entrainment en pacientes que se sometieron a un trasplante pulmonar, donde se resecaron las aferencias vagales, sugiere que otros mecanismos no mediados por el nervio vago podrían tener un rol en la presencia de TR14.
Un estudio en pacientes con muerte cerebral ha demostrado que las insuflaciones pasivas por parte del ventilador pueden generar una activación de los músculos respiratorios de manera retrasada, tal como ocurre en el caso de TR. En este contexto, la ausencia de impulso respiratorio desde el tronco del encéfalo sugiere que la activación de los músculos respiratorios después de la insuflación del ventilador podría estar mediada por la estimulación de mecanorreceptores torácicos, movimientos torácicos pasivos y/o activación por elongación de los músculos respiratorios15. Otras hipótesis, como los reflejos espinales o la presencia de un generador de patrones respiratorios espinales, podrían estar potencialmente involucradas11.
Fenotipos y variantes de trigger reversoEstudios recientes revelan que la presencia de TR puede exhibir distintos fenotipos16. Analizando la curva presión/volumen del diagrama de Campbell en pacientes con síndrome de distrés respiratorio agudo, Baedorf Kassis et al. describieron 4 fenotipos de acuerdo con la temporalidad de activación y relajación muscular dentro del ciclo respiratorio. En un primer fenotipo, se produce una activación rápida y relajación rápida (durante inspiración o antes de alcanzar el 50% de la fase de exhalación). En segundo lugar trigger reverso con una activación rápida en fase inspiratoria y una relajación lenta (hasta el 50% de la fase de exhalación) que culmina en la fase espiratoria. El fenotipo más frecuente ocurre con una activación rápida que produce el mayor pico de contracción durante la fase espiratoria. Finalmente, el TR que inicia y finaliza durante la fase espiratoria. Los efectos del TR pueden variar en relación a su temporalidad en el ciclo respiratorio, los fenotipos de TR que se manifiestan durante la inspiración podrían causar incrementos en el volumen y presión transpulmonar inspiratoria, mientras que la ocurrencia de TR durante la espiración podría resultar en un incremento de la presión transpulmonar espiratoria y exhalación incompleta.
Por otro lado y contrario a la forma clásica de TR durante ventilación mecánica controlada y sedación profunda, algunas series pequeñas de casos han descrito la presencia de TR en modos ventilatorios espontáneos (por ejemplo: presión de soporte y NAVA)17. En estos casos, la presencia de TR podría ocurrir debido a un autogatillo y fuga de la vía aérea18, o bien debido a la relajación de los músculos espiratorios que inducen la contracción de los músculos inspiratorios simulando un «pseudo trigger reverso»19,20. Estas variantes de TR requieren confirmación en futuras investigaciones.
Métodos de detección del TRLa detección de TR es clave para su optimización. Sin embargo es compleja y requiere entrenamiento. La tabla 1 resume las diferentes modalidades de detección.
Principales métodos de detección de trigger reverso
| Método | Identificación | Ventajas | Desventajas |
|---|---|---|---|
| Inspección visual | Ausencia de deflexión en la curva de presión-tiempo de la vía aérea al inicio de la presurización.Reducido flujo espiratorio peak comparado con otras respiracionesDeformación de la curva de flujo espiratorio (carece de una disminución exponencial normal)Modo volumen control: variación en la presión de pausa comparada con otras respiraciones en ausencia de fugas de flujo de aire.Modo presión control: caída en la presión y flujo durante el tiempo inspiratorio | Accesible en la práctica clínica utilizando las curvas del ventilador mecánico.No requiere equipamiento adicional | Necesidad de entrenamiento.Difícil de detectar sin doble ciclado |
| Presión esofágica (peso) | Cambio positivo en la señal de peso al inicio de la respiración, seguido de un swing negativo en la señal de peso después del inicio de la respiración | Detección del inicio de la contracción de los músculos inspiratorios.Permite distinguir fenotipos de trigger reverso (diagrama de Campbell).Permite determinar el ángulo de fase | Requiere equipamiento adicional.Es un método invasivo (requiere la inserción de un catéter esofágico)Requiere expertíz para su interpretación |
| Actividad eléctrica del diafragma (EAdi) | Ausencia de EAdi al inicio de la presurización seguido de un aumento en la señal de EAdi después del inicio de la presurización (peak mayor a 1μV) | Detección del inicio de la contracción de los músculos inspiratoriosPermite determinar el ángulo de fase | Requiere equipamiento adicional (catéter y ventilador específico).La actividad eléctrica del corazón puede generar artefactos en la señal de EAdi (falsos positivos) |
| Ultrasonografía | Movimiento pasivo del diafragma (elevación) debido a la insuflación pulmonar.Nueva elevación del diafragma (en modo M) correspondiente a la contracción involuntaria | Detección precisa del inicio de la contracción del diafragma.Tecnología disponible para la práctica clínica, no invasiva | Técnica operador dependienteDificultad para la sincronización de curvas (ventilador mecánico y US)Método relativamente nuevo que requiere validación |
| Detección automática | De acuerdo al método utilizado (curvas del ventilador, peso, EAdi) | Monitoreo continuoRegistros de mayor duración.No requiere un profesional de la salud durante la detección.Potencial uso en la toma de decisiones clínicas (big data) | Tecnología no disponible en la práctica clínicaAnálisis de datos off-line |
La inspección visual de las curvas del ventilador es el enfoque más comúnmente utilizado para evaluar la interacción entre el paciente y el ventilador en la práctica clínica. Sin embargo, la capacidad de los distintos profesionales de la salud para detectar la disincronía a partir de las curvas del ventilador es deficiente, poco factible por motivos de tiempo y el mayor problema es la baja reproducibilidad entre los evaluadores21,22. No obstante, existen varias características que permiten distinguir la presencia de TR y diferenciarla de otros esfuerzos espontáneos o tipos de disincronías.
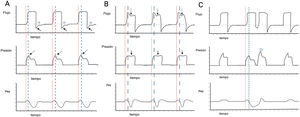
Independientemente del modo ventilatorio empleado, se debe identificar cómo inicia el ciclo ventilatorio (si es iniciado por el paciente o por el ventilador). Para que un TR sea considerado como tal, el ciclo debe ser mandatorio en ausencia de signos de un esfuerzo del paciente. El siguiente paso es identificar variaciones en la presión o en el flujo, dependiendo del modo ventilatorio. En el modo VC-CMV, podemos observar variaciones en la curva de presión, como disminución de la presión pico, así como pérdida del pico de flujo espiratorio con ascenso del flujo en la fase espiratoria en la curva de flujo-tiempo. Si existe una presión de pausa programada, esta se podría alterar ya sea eliminándose o cambiando su forma (fig. 2A). De manera similar, en el modo PC-CMV, podemos identificar variaciones en la curva de flujo-tiempo; por ejemplo, aumento del flujo durante el intervalo de tiempo de la fase inspiratoria en la curva desacelerada, que denota una contracción del diafragma, que puede corresponderse o no, al mismo tiempo con una caída leve en la curva de presión-tiempo. En la curva de flujo-tiempo se puede observar una amputación del pico flujo espiratorio y un ascenso del flujo en el primer tercio de la fase de ciclado (fig. 2B). Es importante notar que, si la contracción del diafragma es suficientemente potente y cercana a la fase final del ciclo inspiratorio, puede desencadenar un nuevo disparo independiente del modo ventilatorio, fenómeno que se conoce como doble ciclado causado por TR (fig. 2C).
Detección de trigger reverso mediante inspeción visual. Panel A) se observa una ventilación en modo VC, con la aparición de un TR de activación media y relajación tardía, con un patrón 1:1, las líneas rojas indican el inicio mandatorio y las líneas discontinuas azules la respuesta del diafragma. En la curva de flujo-tiempo las flechas continuas muestran la amputación del flujo espiratorio, la estrella muestra el intento de positividad del flujo durante la fase espiratoria. En la curva de presión-tiempo las flechas discontinuas señalan la caída de la presión pico. Panel B) se observa una ventilación en modo PC, con la aparición de un TR de activación media y relajación rápida, con un patrón 1:1, las líneas rojas indican el inicio mandatorio y las líneas discontinuas azules la respuesta del diafragma. En la curva de flujo-tiempo, las flechas discontinuas muestran un aumento del flujo durante la desaceleración del mismo, en la curva de presión-tiempo, las flechas continuas muestran una caída leve de la presión de la vía aérea. Panel C) se observa una ventilación en modo VC, con la aparición de un TR de activación media y relajación tardía, que desencadena un doble ciclado, las líneas rojas indican el inicio mandatorio y las líneas discontinuas azules la respuesta del diafragma. En la curva de presión-tiempo la estrella señala el doble ciclado. El color de la figura solo puede apreciarse en la versión electrónica del artículo.
PC: presión controlado; Pes: presión esofágica; TR: trigger reverso; VC: volumen controlado.
El estándar de referencia para la identificación del TR sigue siendo la utilización del balón esofágico (peso) o algún otro método que identifique la temporalidad de la activación de los músculos inspiratorios tales como la actividad eléctrica del diafragma (EAdi). Estos registros son muy útiles ya que pueden detectar la disincronía al comparar el tiempo de ocurrencia de los cambios en peso o Eadi con los de presión de vía aérea y curvas de flujo-tiempo en cada ciclo ventilatorio. Utilizando peso, el TR se detecta a través del desplazamiento negativo de la presión esofágica, después del inicio del ciclo ventilatorio mandatorio. De igual modo, la activación retrasada en la curva de Eadi podría ser interpretada como TR23. Ambos tipos de catéteres se han utilizado para detectar TR, sin embargo, su uso en la práctica clínica sigue siendo limitado ya que requiere entrenamiento avanzado y expertise técnica en la adquisición de las señales5.
Ecografía diafragmáticaLa ecografía diafragmática es un método emergente y no invasivo para la detección de asincronías. La observación directa del diafragma mediante su excursión permite identificar el momento de la contracción que en conjunto con la observación de las curvas del ventilador mecánico permite reconocer el TR24,25. Si bien es un método promisorio, su empleo requiere experiencia en el uso de esta herramienta y la sincronización entre los datos del ventilador y los trazados ecográficos es uno de los principales desafíos.
Métodos de detección automáticosEl principal interés de automatizar la detección de las asincronías radica en su alta incidencia y requerimiento de períodos de observación muy prolongados. Los métodos anteriormente descritos habitualmente ofrecen observaciones puntuales o de forma retrospectiva. En el caso del TR, se han validado en la actualidad cinco métodos automatizados que utilizan información proveniente de las curvas del ventilador26, peso27 y Eadi9,28. Los algoritmos utilizados se basan en reglas elaboradas a partir del conocimiento de las asincronías y más recientemente en el uso de redes neuronales computacionales29. El resumen de los diferentes algoritmos y modelos evaluados, así como su exactitud diagnóstica para detectar TR se describen en la tabla S1 (ver material electrónico suplementario).
Implicaciones clínicas del TRSe han propuesto potenciales efectos tanto a nivel pulmonar y diafragmático del TR, mientras que su asociación con los desenlaces de los pacientes aún se desconoce.
TR y consecuencias pulmonaresDiferentes mecanismos podrían explicar cómo el TR puede ser perjudicial para los pulmones. Primero, superponer un esfuerzo espontáneo a la respiración del ventilador tiene un efecto aditivo sobre la presión transpulmonar encargada de distender el parénquima y, por tanto, sobre el VT resultante principalmente en modos controlados por presión donde el flujo es variable. Baedorf Kassis et al., demostraron que el TR es capaz de aumentar en promedio el VT desde 51 hasta 128ml y la presión transpulmonar entre 3-7 cmH2O dependiendo del fenotipo cuando se compara con respiraciones pasivas16.
Segundo, la ocurrencia de TR podría estar asociada a doble ciclado y volumen corriente excesivo. Durante el TR el esfuerzo inspiratorio del paciente puede persistir más allá del final de la fase inspiratoria programada en el ventilador. Si el esfuerzo es lo suficientemente profundo y prolongado puede llevar a un doble ciclado, que es la ocurrencia de dos inspiraciones consecutivas sin una espiración entre medio, resultando en un mayor VT30. Estudios observacionales han revelado que el 35% de los doble ciclados pueden ser causados por TR y que podría aumentar hasta ∼200ml extra de volumen corriente30-32.
En tercer lugar, durante las respiraciones con TR puede producirse un fenómeno conocido como pendelluft, el cual produce un intercambio de aire desde las zonas pulmonares no dependientes hacia las zonas dependientes, causando una deformación tisular abrupta y un estiramiento local potencialmente excesivo de la región dependiente involucrada33. Yoshida et al, utilizando tomografía por impedancia eléctrica en un modelo animal de daño pulmonar, demostraron que este fenómeno de pendelluft puede producirse durante TR. Estos autores observaron que el intercambio de aire desde el pulmón no dependiente hacia las zonas más dependientes es capaz de provocar una sobredistensión local de hasta 2 veces mayor en comparación con el observado en la misma región durante la ventilación pasiva34.
Finalmente, y de manera contraria al efecto potencialmente injurioso, la presencia de TR podría estar asociada a un efecto beneficioso sobre la mantención del volumen de final de espiración debido a la activación excéntrica del diafragma. En un modelo experimental de falla respiratoria aguda, Pellegrini et al. estudiaron el impacto de la activación diafragmática durante la espiración donde observaron que la contracción diafragmática espiratoria reduce el colapso y aumenta la aireación pulmonar en comparación con la VM controlada sin actividad muscular respiratoria35. Estos resultados sugieren que el diafragma podría ejercer un efecto de control sobre la espiración, ayudando a preservar el volumen pulmonar al final de la espiración.
TR y consecuencias a nivel del diafragmaDurante el TR, el esfuerzo inspiratorio del paciente es activado por el ventilador y la mayoría de las veces parte del esfuerzo de este paciente tiene lugar en la fase espiratoria. En la fase espiratoria, los músculos inspiratorios (por ejemplo, el diafragma) se alargan a medida que disminuye el volumen pulmonar. Así, la activación de los músculos inspiratorios resulta en una activación muscular durante su elongación (contracción excéntrica)36,37.
El impacto de estas contracciones excéntricas del diafragma sobre su función y estructura podría ir en direcciones opuestas: por un lado, el TR podría ayudar a prevenir el desuso y la atrofia del diafragma ya que la contracción excéntrica se caracteriza por generar mayores fuerzas en comparación con otros tipos de contracciones ante una velocidad angular determinada. Además, se ha demostrado que las contracciones excéntricas requieren menos activación de unidades motoras y consumen menos oxígeno y energía para generar una fuerza muscular en comparación con las contracciones concéntricas38,39. Por otro lado, el TR puede ser perjudicial para el diafragma cuando las contracciones ocurren repetidamente durante la fase espiratoria concomitantemente con la disminución del volumen pulmonar y el estiramiento de los músculos inspiratorios. Estudios en modelos animales han demostrado que la contracción muscular intensa durante su elongación se asocia a una disminución en la contractilidad diafragmática y su capacidad para generar presión40. Del mismo modo, en un modelo experimental de daño pulmonar agudo, la ocurrencia de TR con un esfuerzo respiratorio elevado fue asociada a una función diafragmática significativamente menor y una alta proporción de fibras musculares anormales (por ejemplo, daño muscular) en comparación con la VM pasiva sin esfuerzo respiratorio41.
TR y desenlace en pacientes críticamente enfermosEl impacto del TR sobre los desenlaces centrados en el paciente son un tema de estudio e investigación en la actualidad. Algunos estudios observacionales han revelado que el TR podría estar asociado a algunos desenlaces positivos.
Mellado-Artigas et al. estudiaron la incidencia del TR de 39 sujetos durante las primeras 24 horas de VM utilizando la medición EAdi. Interesantemente, al dividir la cohorte de pacientes según la mediana de ocurrencia de TR, observaron que aquellos pacientes con mayor incidencia de TR tenían mejor oxigenación, más probabilidades de progresar a un modo de ventilación asistida o ser extubados dentro de las próximas 24 horas en comparación con los pacientes con baja frecuencia de TR9. Adicionalmente, Rodríguez et al. en un estudio epidemiológico en pacientes con SDRA, observaron que el TR se asoció con una disminución de la mortalidad hospitalaria (razón de riesgo, 0,65; IC del 95%, 0,57-0,73), lo que sugiere que puede ser un marcador de mejores resultados en pacientes con VM42. Actualmente, estudios de mayor magnitud están siendo realizados para poder entender de mejor manera el potencial impacto del TR y los desenlaces clínicos de los pacientes críticamente enfermos (NCT03447288).
Aproximación para el manejo del TREn la actualidad no existe evidencia sólida que sustente cuál es la mejor estrategia para el abordaje del TR. Dicho abordaje en la práctica clínica requiere entender cuáles son los determinantes que influyen en la ocurrencia de este fenómeno y qué consecuencias se pueden presentar durante este tipo de interacción tal como ha sido descrito en la sección previa. En este sentido, por ejemplo, una alta frecuencia de TR asociado a esfuerzos respiratorios excesivos o causantes de doble ciclado deberían ser abolidos. Una adecuada evaluación del nivel de esfuerzo respiratorio a través de medidas no invasivas al lado de la cama del paciente, tales como la presión de oclusión en los primeros 100 milisegundos (P0.1) y el cambio de presión en la vía aérea durante una pausa espiratoria (ΔPocc) son altamente recomendados para poder discriminar un potencial efecto injurioso del TR43,44.
Algunas variables ventilatorias tales como el volumen corriente y la frecuencia respiratoria podrían tener un impacto en la ocurrencia de entrainment. Así, la modificación de los parámetros ventilatorios puede ser una estrategia interesante para inducir o abolir la ocurrencia de TR. Del mismo modo, factores asociados a la patología de base y nivel de sedación también podrían influir la incidencia de TR.
La programación de la frecuencia respiratoria en el ventilador mecánico (frecuencia del oscilador) y su relación con la frecuencia intrínseca del paciente afecta directamente la ocurrencia de entrainment. Estudios en sujetos anestesiados han observado que la presencia de entrainment se presenta cuando la relación entre la frecuencia establecida del ventilador y la frecuencia del paciente es cercana a uno10. Similarmente, evidencia experimental sobre TR reveló que una frecuencia del ventilador ajustada entre dos a cinco respiraciones sobre la frecuencia intrínseca del animal facilita la ocurrencia de entrainment45. Así, en pacientes con un centro respiratorio activo y frecuencia respiratoria intrínseca, una reducción de la frecuencia respiratoria en el ventilador facilita que el paciente asuma parte del trabajo respiratorio. Rodríguez et al., demostraron que una reducción en 5 puntos de la frecuencia respiratoria se asoció a una disminución promedio de 2 eventos de TR por minuto. Sin embargo, se observaron una mayor cantidad de dobles ciclados. Por otro lado, el incremento de la frecuencia respiratoria no resultó en cambios en la incidencia de TR42. El impacto de un ajuste en la frecuencia respiratoria programada en ausencia de una frecuencia respiratoria intrínseca es desconocido y más complejo de dilucidar. Es probable que otras variables ventilatorias y factores relacionados con el paciente tales como aferencias vagales, activación del centro respiratorio y nivel de conciencia puedan tener un rol45.
La programación del volumen corriente también puede jugar un papel importante en la ocurrencia de TR, sin embargo, la evidencia aún es controversial. Diversos estudios clínicos han descrito la presencia de TR en un contexto de VM protectora con volúmenes corrientes cercanos a 6ml/kg del peso ideal6. Adicionalmente, en un modelo porcino de daño pulmonar agudo, una reducción desde 10ml/kg hasta 7ml/kg logró la inducción de TR de manera exitosa en todos los animales41. En pacientes adultos con SDRA, la ocurrencia de TR fue asociada de manera independiente con menores volúmenes corrientes42. A la luz de la evidencia actual, un aumento en el volumen corriente y subsecuentemente el volumen minuto podría abolir el TR debido a su efecto sobre el reflejo de Hering-Brauer, disminución del nivel de CO2 arterial y disminución de la magnitud y duración del esfuerzo inspiratorio46.
Es importante notar que, el impacto del volumen corriente y frecuencia respiratoria no pueden comprenderse como efectos aislados sino más bien como una interacción que afecta la ventilación minuto y que debe ser considerada en el abordaje del TR.
Adicionalmente, en pacientes con una frecuencia respiratoria intrínseca que se encuentran en una fase de transición desde la sedación profunda hacia una sedación más superficial, una reducción en el nivel de sedación podría facilitar la participación por parte del paciente, activar el centro respiratorio y acelerar el traspaso a la ventilación espontánea reduciendo la incidencia de TR. Actualmente se desconoce la interacción de los distintos tipos de drogas sedantes sobre la ocurrencia de TR. Finalmente, el uso de bloqueo neuromuscular puede ser utilizado ante la presencia de TR con esfuerzo excesivo y doble ciclado, específicamente cuando no logra ser abolido con la modificación de parámetros ventilatorios ni ajustes de sedación47. La tabla 2 describe los principales temas no resueltos sobre TR, los cuales constituyen futuras investigaciones en el área.
Preguntas sin resolver sobre trigger reverso
| ¿Cuáles y cómo afectan los distintos parámetros ventilatorios en la incidencia y magnitud del trigger reverso? |
| ¿Cuáles son los mecanismos fisiopatológicos que explican la ocurrencia y los distintos patrones de trigger reverso? |
| ¿Cómo es la interacción entre el nivel de sedación y los distintos tipos de drogas sedantes con la incidencia y magnitud de trigger reverso? |
| ¿Cuál es el efecto del trigger reverso sobre la función y estructura pulmonar y diafragmática en pacientes críticamente enfermos? |
| ¿Cuál es el impacto que tiene la incidencia y magnitud del trigger reverso sobre los desenlaces de los pacientes? |
La asincronía de TR constituye un fenómeno complejo, frecuente y muchas veces subdiagnosticado en los pacientes ventilados mecánicamente. Su fisiopatología y los mecanismos causales se desconocen en la actualidad, sin embargo, un mecanismo reflejo mediado por actividad vagal es la principal hipótesis propuesta. El TR puede tener efectos opuestos a nivel pulmonar y diafragmático dependiendo del nivel del esfuerzo respiratorio y las contracciones excéntricas del diafragma. Diversas variables como la frecuencia respiratoria, el VT y la sedación surgen como los principales factores moduladores de la incidencia de TR. Sin embargo, se necesita más investigación que puedan contribuir en el entendimiento de TR y su relación con el desenlace de los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
L. Felipe Damiani agradece el soporte parcial de la Agencia Nacional de Investigacion y Desarrollo (ANID), Proyecto Fondecyt Regular 2022 /Folio 1220853.