Resuscitation for patient with sepsis and septic shock
More infoSegún las recomendaciones de la Surviving Sepsis Campaign, entre otras, los tratamientos coadyuvantes podrían tener un papel en el propio tratamiento y el pronóstico de los pacientes sépticos. Los corticoides, el ácido ascórbico y la tiamina han sido identificados como tratamientos potenciales para estos pacientes, solos o en combinación. Desde hace muchos años, los corticoides a bajas dosis han sido propuestos para el tratamiento de estos pacientes. Sin embargo, todavía existen muchas controversias sobre su papel en el tratamiento. Recientes trabajos tanto experimentales como clínicos abogan sobre el efecto que el ácido ascórbico y la tiamina tendrían en el metabolismo mitocondrial disminuyendo la intensidad de la disfunción multiorgánica y la mortalidad, si bien todavía no existen datos concluyentes que avalen su uso. Este artículo es una revisión narrativa sobre la justificación fisiopatológica y la evidencia actual para el uso de estos tratamientos en estos pacientes.
In accordance with the recommendations of, among others, the Surviving Sepsis Campaign, adjunctive therapies may play a role in the treatment and the prognosis in sepsis patients. Corticosteroids, ascorbic acid, and thiamine has been identified as a potential therapy for septic shock alone or in combination. Since many years, low-dosis corticosteroids has been proposed as adjuvant therapies for these patients. However, there are still many controversies regarding the role of systemic low-dose corticosteroids as a part of the treatment of septic shock. In recent clinical and experimental investigations, mitochondrion-target therapy bic acid and thiamine) for sepsis has been suggested to reduce MODS severity and mortality although their clinical results are not yet convincing for their use. In the present article, we have performed a narrative review of the current literature including pathophysiologic rationale and the current evidence for such therapies in septic patients.
Es bien conocido que los tratamientos coadyuvantes no antibióticos en la sepsis pueden tener influencia en la mortalidad. Entre ellos destaca de forma histórica el uso de corticoides y recientemente de la vitamina C y la tiamina. A continuación se describe como revisión narrativa la justificación fisiopatológica y las evidencias y recomendaciones de su uso publicadas en los últimos 20 años.
2Justificación fisiopatológica del papel de los corticoides en la sepsis y el shock sépticoA partir del trabajo de Bone et al.1 en el que define el síndrome de respuesta inflamatoria sistémica, se han realizado múltiples estudios en los que se aboga por el poder antiinflamatorio de los corticoides en un primer momento, y posteriormente como tratamiento de la insuficiencia suprarrenal relativa que podría aparecer en estos pacientes. Estos trabajos, hasta el día de hoy, han tenido resultados muy dispares2. Actualmente se considera el uso de los corticoides en la situación de shock séptico, utilizados junto con fármacos vasoactivos, como una recomendación débil con moderada calidad del grado de evidencia3.
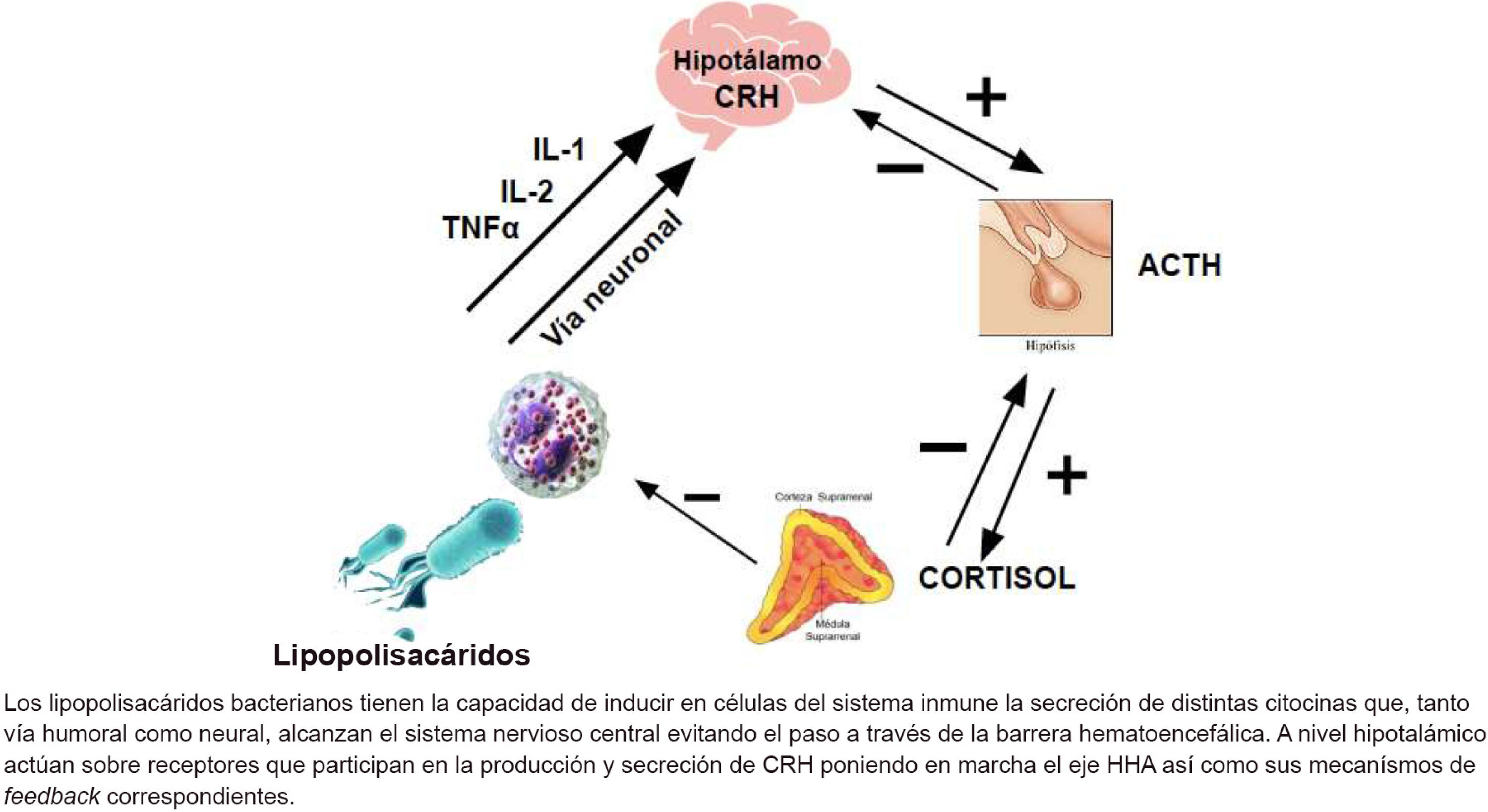
La respuesta del huésped a la agresión que supone la sepsis se vehiculiza básicamente por tres vías. En primer lugar se activa el eje hipotálamo-hipofiso-adrenal (HHA) mediante la secreción de hormona liberadora de corticotropina (CRH), hormona adrenocorticotropa (ACTH) y cortisol. Una segunda vía es la activación del sistema nervioso simpático, encargado de la secreción de catecolaminas. Finalmente, en la respuesta a la infección también participa la respuesta inmunitaria. Estos tres pilares serán los encargados de mantener la homeostasis cardiovascular y metabólica durante la sepsis. Su capacidad para establecer un equilibrio entre los procesos proinflamatorios y antiinflamatorios será la clave que determinará el pronóstico del paciente.
3Sepsis, inflamación y corticoidesTanto monocitos como macrófagos y células dendríticas presentan en su estructura los llamados receptores de reconocimiento de patrones (PRR), los cuales reconocen estructuras moleculares muy conservadas de los microorganismos invasores, denominadas patrones moleculares asociados a patógenos (PAMP), y moléculas provenientes de la degradación celular y la apoptosis, llamadas patrones moleculares asociadas a daño (DAMP)4. Entre los PRR, los receptores tipo toll (TLR) son los principales implicados. La interacción entre estos receptores y sus ligandos correspondientes activa la cascada inflamatoria y causa la liberación citoplásmica del factor de transcripción NF-κB (unido al complejo IKKαβ), que se trasloca al núcleo e induce la transcripción de los genes que codifican citocinas proinflamatorias5.
Los corticoides penetran en el citoplasma mediante unión a sus receptores específicos y posteriormente entran en el núcleo. Tras ingresar en el núcleo celular, se unen a la DNA transcriptasa modulando negativamente factores de la transcripción que llevan a la activación de genes que codifican citocinas, como es el caso del NF-κB. Este factor de codificación está implicado en la síntesis de la interleucina 1 (IL-1), la IL-6, el factor de necrosis tumoral alfa (TNFα) y la sintetasa inducible del óxido nítrico (iNOS). Los corticoides también actúan regulando negativamente genes proinflamatorios ya activados. En las células producen una disminución del recuento de linfocitos, macrófagos, eosinófilos, mastocitos y basófilos.
Con todo, parece claro que se consigue un efecto antiin-flamatorio de los corticoides por estas vías.
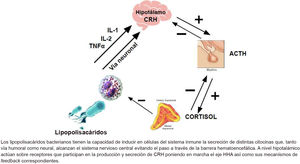
4Sepsis, eje hipotálamo-hipofiso-adrenal y corticoidesDurante la infección, los lipopolisacáridos bacterianos son capaces de provocar la liberación de citocinas a partir de las células inmunitarias. El acceso de estas citocinas en el cerebro se produce por diferentes rutas que evitan la acción de la barrera hematoencefálica6.
El cerebro muestra receptores para estas moléculas distribuidos en diferentes regiones anatómicas, aunque la mayor densidad de estos se localiza en el hipocampo. Del mismo modo, este tiene la capacidad de secretar in situ una amplia gama de citocinas, lo que lo convierte en un órgano susceptible estimulación tanto por las citocinas sistémicas como por las producidas in situ7.
Cuando las citocinas alcanzan una concentración 10nM, se unen a sus receptores específicos en el cerebro y, por medio de vías fisiológicas diferentes, inducen tres tipos de procesos: a) neuroinmunológicos, que activan la liberación de citocinas en el cerebro; b) neuroquímicos, comenzando con la liberación de neurotransmisores como la norepinefrina y la serotonina, y c) neuroendocrinos, con la secreción de CRH y la activación del eje HHA, lo que a su vez induce la liberación de cortisol y andrógenos anabolizantes, como es el caso de la deshidroepiandrosterona. El cortisol a concentraciones bajas actúa como inmunoestimulante durante periodos cortos estimulando a la subpoblación de linfocitos colaboradores tipo 2 (TH2), que participa de la respuesta humoral. La deshidroepiandrosterona estimula la actividad de los linfocitos colaboradores tipo 1 (TH1) que promueven una inmunidad de tipo celular. La diferencia entre las células TH1 y TH2 radica en el perfil de citocinas secretadas: de tipo proinflamatorio las TH1 y antiinflamatorio las TH28.
En el paciente crítico existe una insuficiencia corticoidea relativa. Los mecanismos implicados son varios. En primer lugar, se produce un daño estructural mediado por procesos hipóxico-isquémicos y hemorrágicos. A nivel molecular, la sobreexpresión de iNOS favorecida por la presencia de IL-1 y TNFα lleva a apoptosis celular. Finalmente, a nivel adrenal, la capacidad de almacenamiento de cortisol es muy limitada y, en situación de riesgo, las concentraciones plasmáticas se hallan en su punto máximo, por lo que no existe margen de respuesta frente a una noxa superior. Asimismo, la síntesis de corticoides se halla alterada tanto por incapacidad para la captación de precursores (fundamentalmente lipídicos) como por el bloqueo de vías metabólicas necesarias para su síntesis. Finalmente, un nuevo mecanismo para inhibir la síntesis de cortisol está relacionado con la unión de los mediadores inflamatorios a los receptores de ACTH de la corteza adrenal, inhibiendo el feedback (+) necesario para iniciar la síntesis9. En la Fig. 1 se describen básicamente los mecanismos fisiopatológicos y el mecanismo de acción de los corticoides.
El hallazgo de que la mortalidad del paciente séptico no está relacionada con la concentración plasmática de cortisol total10 o cortisol libre11 a incrementado las dudas sobre la participación del eje HHA en el proceso. Actualmente se apunta a una síntesis bimodal de cortisol12, un incremento plasmático en la fase aguda relacionado con una respuesta adaptativa al estrés seguida de un descenso en la concentración plasmática de incierto origen, posiblemente atribuible a una inhibición de la secreción de ACTH iniciada en la fase aguda, prolongada en el tiempo debido al mantenimiento de la situación crítica. Relacionado con ello, Boonen et al.13 observaron que los pacientes críticos que fallecen tras superar la fase aguda de la enfermedad presentan en la cápsula suprarrenal una mayor desestructuración y atrofia, con menores peso y concentración de colesterol que los pacientes críticos que fallecen durante la fase aguda o los pacientes no críticos.
Con base en estos mecanismos, los corticoides pueden tener un papel crucial en el tratamiento de sustitución en el contexto de la insuficiencia suprerrenal relativa presente en los pacientes con sepsis.
5Sepsis, vasomodulación y corticoidesLa fisiopatología de la vasodilatación es mutifactorial e incluye la activación de vías vasodilatadoras intrínsecas y una falta de respuesta a vasopresores14. Estos mecanismos pueden resumirse en tres tipos: neuroinmunitario, acoplados a receptores de proteína G y mediante la alteración de segundos mensajeros.
En el mecanismo neuroinmunitario, el tono vasomotor se controla a través de la activación del sistema simpático en el locus coeruleus y el eje HHA en el núcleo paraventricular por el estímulo de quimiorreceptores y barorreceptores, así como de citocinas proinflamatorias. Además, la vasopresina y la angiotensina, a través de los receptores de proteína G (receptores de vasopresina, adrenérgicos y de angiotensina I), actúan sinérgicamente en la célula vascular incrementando la entrada de calcio. La activación sostenida en el tiempo lleva a una desensibilización por fosforilación de estos receptores y se produce vasodilatación. De igual modo, los receptores adrenérgicos se ven afectados por moléculas como la endotoxina.
La expresión de la iNOS se incrementa en las células musculares lisas de los vasos durante la sepsis, con lo que se incrementa la producción de óxido nítrico (NO), el cual activa la producción de guanosina monofosfato cíclico (cGMP) y canales sensibles al calcio, entre otros, lo que produce vasodilatación15.
El incremento de la presión arterial tras la administración de corticoides se debe a un triple efecto. En la célula vascular lisa, los corticoides aumentan la entrada de calcio intracelular el cual activa la ATPasa, inhibida durante la sepsis, bloqueo que origina la vasodilatación. Mediante inhibición de la iNOS, disminuye la síntesis de NO. Los corticoides resensibilizan los receptores adrenérgicos desensibilizados e incluso incrementan su densidad16. No obstante, estos resultados parecen estar mediados por la interacción tanto de los glucocorticoides como de catecolaminas y adrenorreceptores. En los riñones, incrementan el filtrado glomerular, la retención de sodio y la eliminación de potasio17.
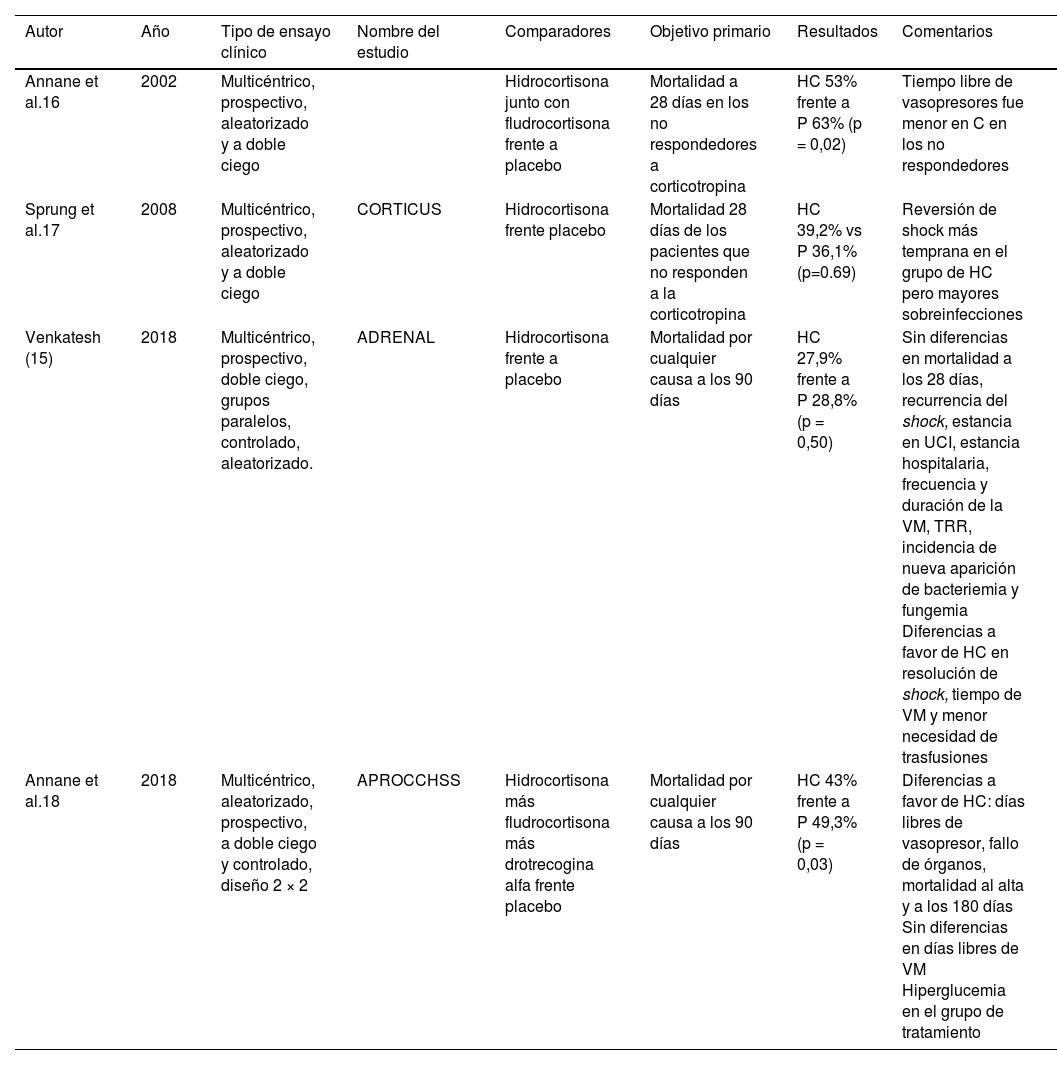
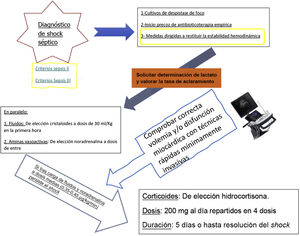
6Evidencia de la administración de corticoides para la resucitación en la sepsis y el shock sépticoTras varios estudios previos con resultados deletéreos del uso de corticoides a dosis antiinflamatorias en estos pacientes, en 2002 el grupo francés de Annane et al.18 publicó en JAMA un estudio multicéntrico prospectivo, aleatorizado, a doble ciego y controlado con placebo, cuyo objetivo primario era identificar diferencias de mortalidad a los 28 días en pacientes con shock séptico en función de que se administrara tratamiento corticoideo o no. Se incluyó a 300 adultos diagnosticados de shock séptico, 149 al grupo de corticoides y 151 al grupo de placebo. Como particularidad y con base en la hipótesis de la insuficiencia suprarrenal que induce la sepsis, se somete a los pacientes a test de corticotropina para identificar a los respondedores. De esta forma, en ambos brazos existe un número homogéneo de respondedores y no respondedores. Para el tratamiento se administran 200mg de hidrocortisona fraccionada en 4 dosis (50mg/6h) durante 7 días y, como elemento diferenciador con respecto a los estudios publicados hasta la fecha, utiliza una combinación con un mineralocorticoide añadiendo a la terapia del grupo de tratamiento 50μg de fludrocortisona. Los autores concluyen que no hay diferencias estadísticamente significativas en la mortalidad a 28 días entre los pacientes que reciben corticoides y los que no. Sin embargo, en el estudio de subgrupos objetivan que existe una menor mortalidad a los 28 días en el grupo de no respondedores a test de corticotropina tratados con corticoides exógenos, y se identifica a estos pacientes como el subgrupo con insuficiencia suprarrenal relativa, que hipotéticamente podrían beneficiarse de la administración exógena de corticoide. Igualmente, tanto en respondedores como en no respondedores, los pacientes tratados están más días libres de vasopresores de manera estadísticamente significativa.
Tras este estudio, se adoptó como estrategia terapéutica la identificación de pacientes con insuficiencia suprarrenal con test de corticotropina para indicar la administración de corticoides.
En 2008, un grupo internacional encabezado por Sprung y en colaboración con Annane et al.19 publicó los resultados del estudio CORTICUS, de diseño multicéntrico prospectivo, aleatorizado, a doble ciego y controlado con placebo, con el objetivo primario de identificar diferencias de mortalidad a los 28 días en pacientes con shock séptico sin respuesta al test corto de corticotropina en función de la administración de terapia corticoidea. En este estudio se aleatorizó a 498 pacientes, 250 a 200mg de hidrocortisona (50mg/6h) al día durante 5 días y 248 que recibieron placebo. El estudio concluye en que no existen diferencias en la mortalidad a los 28 días en ningún subgrupo de pacientes. Aunque lo más relevante fue que se desterrara el uso del test corto de corticotropina, ya que no existe diferencia de mortalidad entre respondedores y no respondedores, pacientes con insuficiencia suprarrenal y/o insuficiencia suprarrenal relativa. Los criterios de inclusión de uno y otro estudio eran muy diferentes, por lo que la diferencia de resultados positivos se podía justificar en ello.
Posteriormente se realizaron múltiples ensayos con tamaños muestrales más pequeños que no consiguieron demostrar el objetivo primario de disminución de la mortalidad en los pacientes sépticos tratados con glucocorticoides. No fue hasta 2018, cuando se publicaron 2 nuevos estudios aleatorizados, controlados por placebo y a doble ciego de 2 grupos distintos (ADRENAL y APROCCHSS). A pesar de que el reclutamiento coincidió con la nueva definición de sepsis-3, se hizo con base en criterios uniformes y definiciones homogéneas.
El estudio ADRENAL17 cuenta con un importante tamaño muestral (3.800 pacientes en shock séptico, todos en ventilación mecánica). Se los aleatorizó en 2 brazos; el grupo de tratamiento recibió infusión continua de 200mg de hidrocortisona durante un máximo de 7 días o hasta el alta de UCI y/o el fallecimiento (lo que ocurriese primero) y el grupo de control recibió placebo. Se aplicaba como objetivo primario la mortalidad por cualquier causa a los 90 días de la inclusión. Crearon múltiples subgrupos en función de afección, gravedad del proceso o variables demográficas. El estudio concluye en que no existen diferencias estadísticamente significativas en mortalidad ni en los objetivos secundarios valorados por subgrupos.
En paralelo, el grupo de Annane et al. desarrolló un estudio multicéntrico, aleatorizado, controlado y a doble ciego con un esquema a priori similar (estudio APROCCHSS)20. Aleatorizaron a un total de 1.241 pacientes en 2 brazos, con un diseño factorial 2×2. El grupo de control entre 2008 y 2011 recibió simultáneamente drotrecogina alfa. Al grupo de intervención se le administraron 200mg de hidrocortisona fraccionados en 4 dosis de 50mg/6h junto con 50μg de fludrocortisona por vía enteral. Como objetivo primario se estableció la mortalidad a 90 días. Concluye que los tratados con corticoides tuvieron menor mortalidad tanto a los 90 días como al alta de UCI y el alta hospitalaria, pero no a los 28 días. Del mismo modo, tuvieron menos días de asistencia vasopresora en las primeras 4 semanas y más días sin fallo de órganos.
De nuevo, la población de estudio no resultó homogénea en todos los estudios referidos, dado que no hay homogeneidad en el tipo de sepsis (posquirúrgica frente a foco primario), el número de pacientes en ventilación mecánica, etc., lo que quizá sea una de las principales razones por las que se podrían criticar los resultados que se publican y que hacen que tengamos que valorar a estos pacientes de manera individualizada.
En la Tabla 1 se describen las principales características de estos estudios.
Evidencia de la resucitación metabólica con corticoides en la sepsis y el shock séptico
| Autor | Año | Tipo de ensayo clínico | Nombre del estudio | Comparadores | Objetivo primario | Resultados | Comentarios |
|---|---|---|---|---|---|---|---|
| Annane et al.16 | 2002 | Multicéntrico, prospectivo, aleatorizado y a doble ciego | Hidrocortisona junto con fludrocortisona frente a placebo | Mortalidad a 28 días en los no respondedores a corticotropina | HC 53% frente a P 63% (p = 0,02) | Tiempo libre de vasopresores fue menor en C en los no respondedores | |
| Sprung et al.17 | 2008 | Multicéntrico, prospectivo, aleatorizado y a doble ciego | CORTICUS | Hidrocortisona frente placebo | Mortalidad 28 días de los pacientes que no responden a la corticotropina | HC 39,2% vs P 36,1% (p=0.69) | Reversión de shock más temprana en el grupo de HC pero mayores sobreinfecciones |
| Venkatesh (15) | 2018 | Multicéntrico, prospectivo, doble ciego, grupos paralelos, controlado, aleatorizado. | ADRENAL | Hidrocortisona frente a placebo | Mortalidad por cualquier causa a los 90 días | HC 27,9% frente a P 28,8% (p = 0,50) | Sin diferencias en mortalidad a los 28 días, recurrencia del shock, estancia en UCI, estancia hospitalaria, frecuencia y duración de la VM, TRR, incidencia de nueva aparición de bacteriemia y fungemia Diferencias a favor de HC en resolución de shock, tiempo de VM y menor necesidad de trasfusiones |
| Annane et al.18 | 2018 | Multicéntrico, aleatorizado, prospectivo, a doble ciego y controlado, diseño 2 × 2 | APROCCHSS | Hidrocortisona más fludrocortisona más drotrecogina alfa frente placebo | Mortalidad por cualquier causa a los 90 días | HC 43% frente a P 49,3% (p = 0,03) | Diferencias a favor de HC: días libres de vasopresor, fallo de órganos, mortalidad al alta y a los 180 días Sin diferencias en días libres de VM Hiperglucemia en el grupo de tratamiento |
HC: hidrocortisona; P: placebo; TRE: tratamiento de reemplazo renal; VM: ventilación mecánica.
Los 2 metanálisis más recientes2,19,20 que incluyen trabajos de metodología más homogénea, con demostrada validez tanto interna como externa y una gran muestra acumulada, concluyen de forma unánime que existe una relación directa entre la administración de corticoides a dosis bajas, precoz y durante un tiempo corto y la mortalidad a los 28 días en los pacientes en shock séptico. Sin embargo, esta tendencia no se mantuvo a los 90 ni a los 120 días. Igualmente coinciden en que sí se ha demostrado que los corticoides tienen relación directa con un mayor número de días libres de aminas y la más rápida resolución del estado de shock, ambos de manera estadísticamente significativa.
En este punto, y a la vista de que las guías actuales recomiendan la vasopresina para el shock refractario, cabe mencionar el artículo ya clásico de Russell et al.22, un estudio post hoc de pacientes en shock séptico que requieren administración de aminas vasoactivas con objetivo primario de mortalidad por cualquier causa a los 28 días y como secundarios disfunción orgánica, uso de vasopresores y valores plasmáticos de vasopresina. Con estas premisas, se aleatorizó a los pacientes a recibir vasopresina o noradrenalina en esquema ciego y se añadieron corticoides según la evolución y el juicio del clínico durante un periodo de observación de 28 días. La mortalidad se redujo de manera estadísticamente significativa en el grupo de pacientes que recibieron vasopresina junto con corticoides. Sin embargo, los pacientes fallecían en mayor número si recibían vasopresina sin corticoide, lo que deja la puerta abierta a nuevos estudios que aporten mayores y mejores evidencias en la administración combinada de corticoides y vasopresina23.
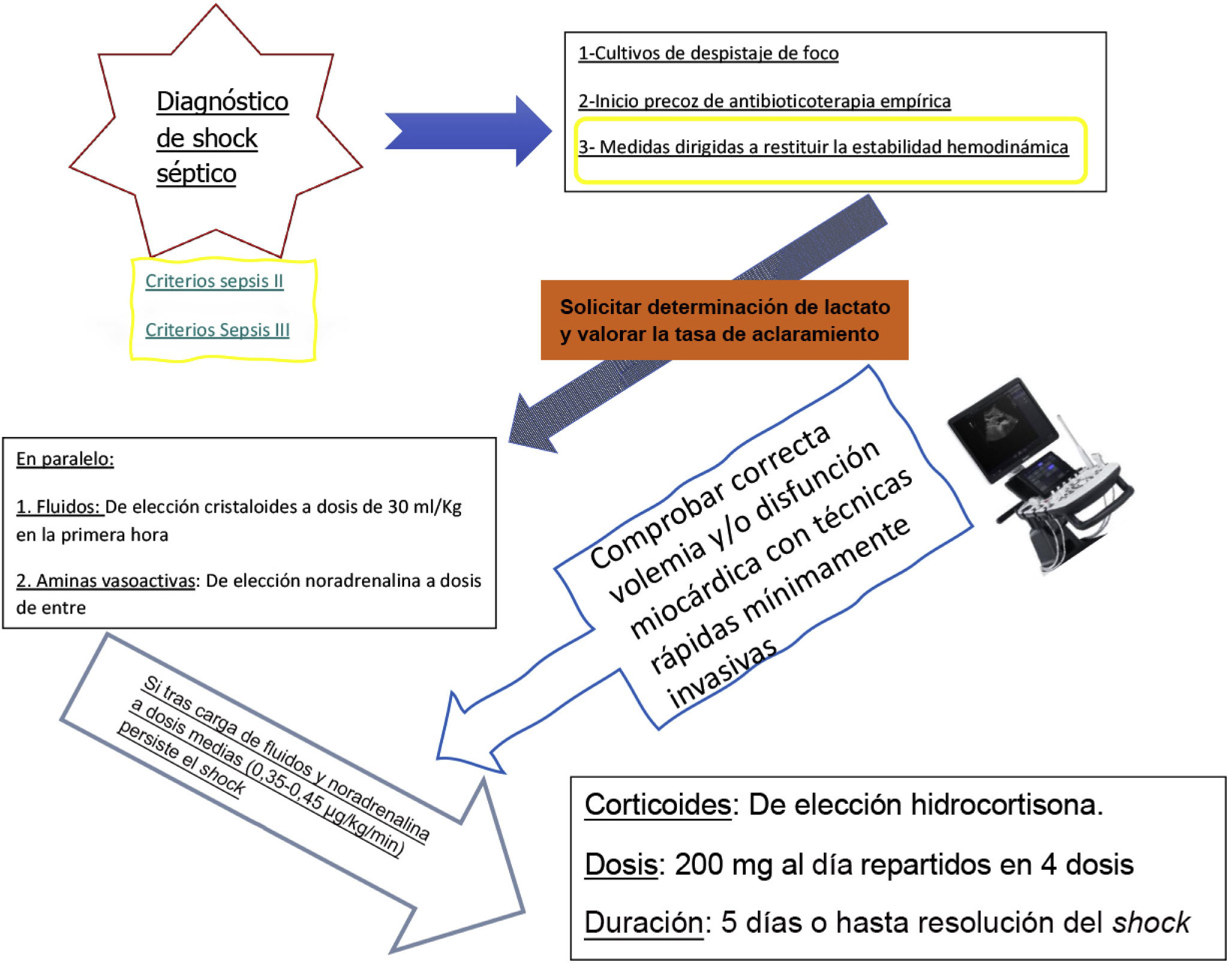
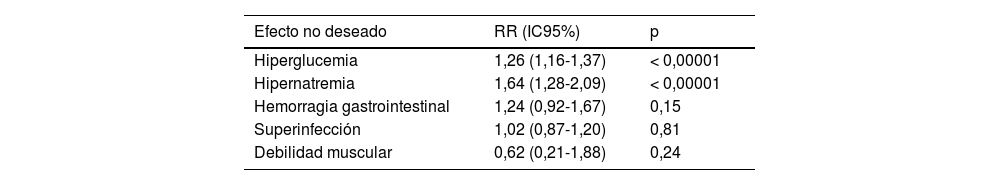
A la vista de la evidencia, se puede concluir que la administración de corticoides es segura, pues en los estudios descritos se ha analizado la aparición de complicaciones inherentes a la utilización de corticoides, a saber24: hiperglucemia, hipernatremia, sangrado gastrointestinal, debilidad muscular y superinfeccion, y hay evidencia de peso estadístico sobre la aparición de hiperglucemia e hipernatremia que no se relacionan con peores resultados clínicos (Tabla 2); por lo tanto, se concluye que deben administrarse a pacientes en shock séptico independientemente del foco inicial del cuadro y solo cuando se haya asegurado una adecuada resucitación con fluidoterapia volumétrica y soporte vasoactivo a dosis ≥ 0,25μg/kg/min, tal y como indica la guía de la Surviving Sepsis Campaign recientemente actualizada3. En estos estudios se han empleado du rante un periodo corto de tratamiento, de no más de 5 días, o hasta el momento de recuperación hemodinámica que permita reducir la dosis de vasopresores administrada y siguiendo un esquema de administración en bolos con dosis diaria de 200mg repartidos en 4 dosis (Fig. 2). Sin embargo, y como es lógico pensar, dada la complejidad del tratamiento de estos pacientes, se ha intentado dilucidar la conveniencia de administrar los corticoides en bolos o en infusión continua. Es sobradamente conocido que la secreción de corticoides por las glándulas suprarrenales no es lineal, sino que se rige por un ciclo circadiano que se modifica por condicionantes externos, como pueden ser la luz, la temperatura, el ciclo sueño-vigilia, etc. Desde esta premisa, parece lógico pensar que lo mas fisiológico es la administración en bolos, pero es difícil valorar cada cuánto han de administrarse esos bolos y en qué condiciones. Es por ello que se ha valorado si existen diferencias de resultados clínicos condicionadas por la forma de administración del corticoide necesario en los pacientes sépticos; de manera resumida y concisa, se puede decir que no hay diferencias en mortalidad o días libres de aminas en función de la modalidad de administración de fármaco y sí que parece existir una tendencia a una menor hiperglucemia en los pacientes con corticoide en infusión continua, aunque sin relevancia clínica atribuible.
Efectos no deseados de los corticoides en la sepsis24
| Efecto no deseado | RR (IC95%) | p |
|---|---|---|
| Hiperglucemia | 1,26 (1,16-1,37) | < 0,00001 |
| Hipernatremia | 1,64 (1,28-2,09) | < 0,00001 |
| Hemorragia gastrointestinal | 1,24 (0,92-1,67) | 0,15 |
| Superinfección | 1,02 (0,87-1,20) | 0,81 |
| Debilidad muscular | 0,62 (0,21-1,88) | 0,24 |
Múltiples trabajos25–28 han demostrado progresión de la apoptosis y el daño tisular durante la sepsis en ausencia de hipoperfusión y con un transporte de oxígeno adecuado o incluso supraóptimo. Un mayor conocimiento de sus fundamentos bioquímicos ha mostrado nuevos efectos intracelulares, entre ellos los que se producen en el interior de la mitocondria29. Esta disfunción mitocondrial causa, entre otros, alteración de los procesos de producción de energía, desacoplamiento de la fosforilación oxidativa que conduce al conocido como estrés oxidativo. Este estrés oxidativo se muestra con un incremento de moléculas reactivas de oxígeno (ROS) y moléculas reactivas de nitrógeno (RNS), bioproductos de la fosforilación oxidativa que producen daño en la membrana celular y las uniones intercelulares, disfunción de la barrera endotelial por daño del glucocáliz30, alteración del tono vascular e incremento de la permeabilidad capilar, con cierto grado de refractariedad a la acción de las catecolaminas31.
A la vista de sus efectos biológicos intracelulares y dado que durante la sepsis disminuye la concentración plasmática por incremento de su consumo y la imposibilidad de síntesis en humanos, desde hace décadas se propone la utilización de ácido ascórbico, vitamina A y tiamina como parte del tratamiento complementario de la sepsis, en la llamada “resucitación metabólica”.
8Vitamina CEl ácido ascórbico es una vitamina hidrosoluble esencial para mantener la homeostasis. Existen 2 importantes formas biológicas de vitamina C; la forma reducida o ácido ascórbico, y la forma oxidada, ácido deshidroascórbico (DHA). La forma reducida o ácido ascórbico se transporta a nivel intracelular a través de los transportadores SVCT (sodium dependent vitamin C transporters). El DHA se transporta por los GLUT (transportador de la glucosa) por la semejanza química entre la glucosa (C6H12O6) y la vitamina C (C6H8O6)32. La forma oxidada de vitamina C (DHA), una vez alcanza el medio intracelular, sufre una reversión espontánea a su forma reducida o ácido ascórbico por la acción del glutatión.
Entre las múltiples funciones que ejerce, su capacidad antioxidante es la que ha centrado los principales estudios relacionados con la sepsis.
8.1Función antioxidanteEs el principal antioxidante soluble en agua en el organismo. Protege las membranas celulares, el ácido desoxirribonucleico (DNA), las proteínas de la célula y los lípidos contra los efectos oxidantes de radicales libres y ROS. Cuando el DHA ingresa en las mitocondrias, es importante su reducción a ácido ascórbico, ya que durante la sepsis se requieren mecanismos antioxidantes en respuesta a los subproductos prooxidantes de la fosforilación oxidativa33.
Un antioxidante, por definición, es aquel que tiene la capacidad de donar electrones al radical libre que se encuentra inestable con el fin de prevenir la oxidación de otros compuestos. Cuando dona sus electrones, se convierte en un radical libre, pero no tiene capacidad reactiva. En este sentido la vitamina C, tras donar un electrón, se convierte en el radical ascorbilo (o ácido semideshidroascórbico), el cual es relativamente estable y poco reactivo. Tras la pérdida de su segundo electrón es cuando se forma el DHA. La reducción a ácido ascórbico es la más estable. Actúa como cofactor de las enzimas relacionadas con la oxidación estabilizándolas en su forma reducida, lo que permite que mantengan su actividad.
Como antioxidante es dador específico de electrones, con lo que captura radicales libres y previene la generación de nuevos radicales actuando sobre la vía de la NADPH oxidasa (NOX) inhibiéndola, así como a la iNOS aumentando la tetrahidrobiopterina, lo que previene el desacoplamiento de la vía de la fosforilación oxidativa bloqueando directamente tanto derivados de las ROS y RNS como otras sustancias que no son radicales libres pero sí tóxicos intracelulares, como el ácido hipocloroso, las nitrosaminas y el ozono29.
8.2Otros efectos relacionadosLa hipotensión arterial refractaria a catecolaminas es el paradigma del shock séptico. La vitamina C está presente en concentraciones relativamente altas en la corteza suprarrenal. Actúa como cofactor donando electrones a 8 diferentes tipos de enzimas, entre ellas 3 que participan directamente en procesos mediados por la dopamina-β-hidroxilasa y relacionados con la producción de noradrenalina desde la dopamina y el cortisol34.
En los leucocitos interviene en la quimiotaxis de neutrófilos y monocitos, la proliferación de linfocitos y la actividad de células natural killer. En un contexto experimental, ha mostrado un efecto bacteriostático cuando se administra a altas dosis (100–1000μM).
9TiaminaAl igual que la vitamina C, la tiamina es una vitamina hidrosoluble no sintetizable en humanos, por lo que mantener la concentración plasmática requiere el aporte exógeno. Durante la sepsis los valores decrecen por incremento del consumo, y su déficit es una de las causas de acidosis láctica. El transporte se realiza por dos transportadores: la hTHTR-1 y la hTHTR-2, y la excreción es vía renal34.
9.1FuncionesEntre sus funciones, actúa como cofactor de múltiples enzimas relacionadas con el metabolismo de los carbohidratos y en la producción de energía. Estabiliza la piruvato deshidrogenasa que cataliza la conversión de piruvato en acetil CoA; la α-cetoglutarato deshidrogenasa que transforma el α-cetoglutarato en succinil CoA en el ciclo de Krebs y, al igual que la vitamina C, genera NADPH y estabiliza la transcetolasa que participa en la vía de pentosa-fosfatos35.
10Vitamina ALa vitamina A pertenece a un grupo de compuestos orgánicos liposolubles que tienen un papel importante en la agudeza visual, la proliferación y la diferenciación celular; también tiene acción antioxidante y actividad inmunológica. El retinol es fundamental contra los ROS y protege al organismo del estrés oxidativo36.
La sepsis incrementa las pérdidas urinarias de retinol, y la concentración en sangre de este y de betacaroteno están disminuidos. La deficiencia de vitamina A, según se ha comprobado en estudios animales, predispone a la infección por Staphylococcus aureus secundaria a la disminución de la actividad lítica del complemento. Estos estudios han determinado que la suplementación con esta vitamina aumenta el aclaramiento de las endotoxinas37.
11Evidencia sobre la resucitación metabólica en la resucitación de la sepsis y el shock sépticoEl potencial papel de la vitamina C en la sepsis y su suplementación sola o acompañada de corticoides se han discutido mucho. Recientemente se ha publicado el CITRIS-ALI38, ensayo clínico aleatorizado y a doble ciego que intentó demostrar que dosis altas de vitamina C pueden disminuir el fallo de órganos (SOFA score), los biomarcadores de inflamación y la lesión vascular en los pacientes con sepsis y síndrome de distrés respiratorio agudo (SDRA) de menos de 24h de evolución frente a placebo. No hubo diferencias estadísticamente significativas en el grupo que recibió elevadas dosis de vitamina C frente a placebo respecto a la disfunción de órganos. Tampoco en cuanto a las concentraciones de proteína C y trombomodulina.
En un ensayo prospectivo, aleatorizado y a doble ciego38, se demostró que la suplementación con vitamina A no disminuye la mortalidad en UCI a los 14 y 28 días; tampoco disminuyó la estancia ni los días libres de vasopresores y ventilación mecánica. Los parámetros clínicos de sepsis no variaron, salvo un aumento en los valores de seroalbúmina el día 14 de estudio.
Respecto a la suplementación con tiamina, un ensayo clínico, a doble ciego y aleatorizado evidenció que la administración de tiamina a dosis de 200mg no se asocia con un descenso del lactato en pacientes con sepsis y shock séptico40. Unos años más tarde se publicó un estudio retrospectivo de cohortes sobre la administración de tiamina a pacientes críticos con antecedentes de alcoholismo y en situación de shock séptico. Demostró una disminución de la mortalidad entre los que recibieron la suplementación, aunque se trata de un estudio retrospectivo, unicéntrico y con un tamaño muestral reducido41,42.
Un único ensayo clínico multicéntrico, aleatorizado y a doble ciego (ATESS)43 no pudo demostrar que la suplementación de vitamina C más tiamina disminuya el fallo de órganos (SOFA score) secuencial tras su administración temprana.
En resumen, las deficiencias vitamínicas en la sepsis están descritas, no así la evidencia de la suplementación en el paciente con sepsis y shock séptico. Los diferentes ensayos clínicos realizados administrando un suplemento de vitamina A, B1 o C frente a placebo no han demostrado diferencias estadísticamente significativas en los objetivos primarios y secundarios evaluados.
La resucitación metabólica de los enfermos con sepsis deja a un lado los suplementos únicos con vitaminas y se interesa por las vías metabólicas que comparten con los glucocorticoides. El estudio publicado por Marik et al.44, con un número de pacientes escaso, demuestra que la administración temprana de vitamina C, tiamina y corticoides es efectiva para frenar la disfunción progresiva de órganos en la sepsis, incluido el fallo renal, y reduce eficazmente la mortalidad de los pacientes con sepsis y shock séptico.
Este estudio abrió la puerta a trabajos posteriores que no pudieron corroborar estos resultados. Los ensayos publicados no muestran beneficios con el empleo combinado de vitaminas y corticoides. La evidencia trata de medir mortalidad a corto y largo plazo, estancias en UCI y hospitalaria, reducción del fallo de órganos (SOFA score), días libres de vasopresores, días libres de ventilación mecánica, prevención del fallo renal, reducción de la necesidad de técnicas de reemplazo renal y disminución de biomarcadores de inflamación.
Los resultados de Marik et al. no se han podido reproducir quizá porque en su trabajo, dada su metodología, análisis retrospectivo, no consideró las cifras de vitamina C y tiamina previos en la población diana. Así, no se ajustaron las dosis de vitaminas, lo que ha demostrado a posteriori diferentes resultados y efectos secundarios. A pesar de algún parámetro estudiado con resultado exitoso, no hay evidencia de beneficio en subgrupos de pacientes determinados.
El ensayo clínico multicéntrico VITAMINS45, aleatorizado y a doble ciego, monitorizó 2 grupos de pacientes con shock séptico. El grupo de intervención recibió vitamina C (1,5g/6h), hidrocortisona (50mg/6h) y tiamina (200mg/12h), conocida como terapia HAT. Los pacientes del grupo de control recibieron hidrocortisona (50mg/6h). Los objetivos eran la supervivencia y la ausencia de vasopresores a los 7 días. Las diferencias no fueron estadísticamente significativas.
En un estudio semejante publicado más tarde, el ORANGES46, aleatorizado y a doble ciego, sí se evidenció una diferencia estadísticamente significativa en los días libres de vasopresores en el grupo con HAT. No hubo diferencias en el SOFA score ni en los objetivos secundarios medidos, como la mortalidad en UCI y hospitalaria.
Posteriormente, se publicó el ensayo clínico ACTS47, aleatorizado, multicéntrico y enmascarado, que comparó la administración de vitamina C, tiamina y corticoides a las mismas dosis que su estudio predecedente en pacientes con shock séptico frente a placebo. El objetivo fue medir la escala SOFA secuencial desde el momento de la inclusión hasta las 72h. No solo las diferencias en la puntuación en la escala no fueron estadísticamente significativas, sino que se detectaron eventos adversos como hiperglucemia, hipernatremia e infección nosocomial.
El último ensayo clínico aleatorizado, multicéntrico y a doble ciego es el VICTAS48. Se seleccionaron 2 grupos de pacientes con sepsis e insuficiencia respiratoria y/o disfunción cardiovascular. Al grupo de intervención se le administró vitamina C (1,5g), tiamina (100mg) e hidrocortisona succinato (50mg) a las 4h de la aleatorización y, después, cada 6h hasta las 96h, la muerte o el alta de la UCI. Al grupo de control, placebo. El objetivo primario fue calcular los días sin ventilación mecánica ni soporte vasoactivo durante los primeros 30 días tras la aleatorización y el secundario, la mortalidad en el mismo periodo de tiempo. No aumentaron los días libres de ventilación mecánica o vasopresores. Este ensayo se interrumpió por cuestiones administrativas, motivo por el que los autores justifican los resultados.
Un metanálisis49 que merece ser destacado por su revisión no exclusivamente de corticoides, sino del llamado “cocktail de resucitación metabólica” (hidrocortisona, ácido ascórbico y tiamina), no llegó a un resultado de peso estadístico en cuanto a mortalidad. Sin embargo, sí que demostró que la combinación de estos 3 fármacos mejora el fallo orgánico (medido por el ΔSOFA en las primeras 72h de tratamiento), así como la necesidad de aminas vasoactivas (reduce el tiempo de exposición de los pacientes que reciben la combinación de los 3 fármacos).
En la Tabla 3 se resumen las principales características de estos estudios.
Evidencia de la resucitación metabólica con vitaminas en la sepsis y el shock séptico
| Autor | Año | Tipo de estudio | Nombre del estudio | Comparadores | Objetivo primario | Resultados | Comentarios |
|---|---|---|---|---|---|---|---|
| Sevranski | 2021 | Ensayo | VICTAS | HAT frente | Días libres | HAT, 25 frente | Finalización temprana |
| et al.46 | multicéntrico aleatorizado y a doble ciego | a placebo | de vasopresores y VM | a P, 26 (p=0,85) | administrativa Mortalidad similar | ||
| Moskovitz | 2020 | Ensayo | ACTS | HAT frente | ΔSOFA score | HAT,–4,7 | Sin diferencias en |
| et al.45 | multicéntrico aleatorizado y a doble ciego | a placebo | ingreso-72h | frente a P, 4,1 (p=0,12) | fallo renal o mortalidad a 30 días | ||
| Fujji | 2020 | Ensayo | VITAMINS | HAT frente | Tiempo (h) vivo | HAT, 122,1 | Ensayo abierto, |
| et al.43 | multicéntrico aleatorizado abierto | a corticoides | y libre de vasopresores | frente a C, 124,6 (p=0,83) | sin diferencias en mortalidad a los 90 días | ||
| Iglesias | 2020 | Ensayo | ORANGES | HAT frente | Resolución | HAT, 27±22 | Reducido tamaños |
| et al.44 | multicéntrico aleatorizado y a doble ciego | a placebo | del shock (h) ΔSOFA score | frente a 53±38 (p<0,001) Sin significación | de la cohorte Sin diferencias en mortalidad a 28 días ni en estancia | ||
| Fowler | 2019 | Ensayo | CITRIS-ALI | Vitamina C | ΔSOFA score | VC, 3 frente | Administración |
| et al.39 | multicéntrico aleatorizado y a doble ciego | frente a placebo | Biomarcadores de inflamación Lesión vascular | a P, 3,5 (p=0,86) Sin diferencias | temprana de dosis altas de vitamina C, no en situación de SDRA Población heterogénea | ||
| Marik | 2017 | Estudio | Terapia HAT | Mortalidad | HAT, 4% frente | Reducido tamaño | |
| et al.42 | retrospectivo antes-despues | frente a placebo | hospitalaria | a P, 40,4% (p<0,001) | muestral Diseño unicéntrico | ||
| Donnino | 2016 | Ensayo en | Tiamina | Lactato 24h tras | Mediana: T, | Tiempo de resolución | |
| et al.36 | 2 centros, a doble ciego y aleatorizado | frente a placebo | la primera dosis | 2,5mmol/l [1,5–3,4] frente a P, 2,6mmol/l [1,6–5,1] (p=0,40) | del shock, gravedad y mortalidad En el subgrupo de pacientes con déficit de tiamina, la suplementación disminuye el lactato y la mortalidad de manera significativa |
C: corticoides; HAT: hidrocortisona, acido ascórbico, tiamina; IRA: insuficiencia renal aguda; P: placebo; SOFA: secuencial organ failure assessment; T: tiamina; TRE: terapia de reemplazo renal; VC: vitamina C; VM: ventilación mecánica.
Por todo ello, la actualización de la guía Surviving Sepsis Campaign, publicada recientemente, hace una recomendación en contra del empleo de vitamina C intravenosa en pacientes con sepsis y shock séptico e ignora la tiamina y otras vitaminas3.
Con base en todo lo expuesto, se puede aseverar que, aun siendo un concepto novedoso y atractivo basado en una hipótesis que se sustenta en una base fisiopatológica sólida, en el momento actual no se dispone de estudios de calidad suficiente que recomienden la utilización conjunta de corticoides, vitamina C y tiamina, tal y como preconizaban Marik et al. en su estudio. Los últimos estudios aleatorizados y controlados ponen en duda y no son capaces de demostrar el beneficio de esta combinación farmacológica, y da la impresión de que en los que hay una tendencia a la mejoría es atribuible al efecto propio del corticoide y no al de las vitaminas añadidas. En contrapartida, es cierto que tanto el ácido ascórbico como la tiamina son fármacos asequibles y que no han demostrado efectos adversos relevantes (aunque preocupa el potencial incremento del consumo de oxígeno asociado con la administración de tiamina), por lo que quizá se pueda permitir cierta flexibilidad en su uso a la espera de más resultados.
Conflicto de interesesLos autores no tienen conflictos de intereses que declarar con respecto a los contenidos de este artículo.
Nota al suplementoEste artículo forma parte del suplemento «Resucitación del paciente con sepsis y shock séptico», que cuenta con el patrocinio de AOP HEALTH IBERIA.
Referencias no citadas21.