La mayoría de los pacientes que requieren ventilación mecánica durante más de 24 h y que mejoran de la causa que motivó el soporte ventilatorio pueden ser extubados tras una primera prueba de respiración espontánea. El reto es cómo mejorar la desconexión de los pacientes que fracasan en esa prueba. Hasta el momento disponíamos de los métodos, que podemos denominar tradicionales, como son el tubo en T, la presión de soporte o la ventilación mandatoria intermitente sincronizada (SIMV). En los últimos años se han descrito nuevas aplicaciones de técnicas habituales como la ventilación no invasiva, nuevos métodos de ventilación como la compensación automática del tubo (ATC), la ventilación minuto mandatoria (MMV), la ventilación adaptativa de soporte (ASV) o estrategias automáticas de desconexión de la ventilación mecánica basadas en la presión de soporte. Queda por definir su posible papel en la desconexión de la ventilación mecánica en los enfermos con desconexión difícil o prolongada.
Most patients who require mechanical ventilation for longer than 24hours, and who improve the condition leading to the indication of ventilatory support, can be weaned after passing a first spontaneous breathing test. The challenge is to improve the weaning of patients who fail that first test. We have methods that can be referred to as traditional, such as the T-tube, pressure support or synchronized intermittent mandatory ventilation (SIMV). In recent years, however, new applications of usual techniques as noninvasive ventilation, new ventilation methods such as automatic tube compensation (ATC), mandatory minute ventilation (MMV), adaptive support ventilation or automatic weaning systems based on pressure support have been described. Their possible role in weaning from mechanical ventilation among patients with difficult or prolonged weaning remains to be established.
La desconexión de la ventilación mecánica es uno de los procedimientos más frecuentes en las Unidades de Cuidados Intensivos. En estudios epidemiológicos internacionales1–3, se observa que algo más de la mitad de los enfermos que requieren ventilación mecánica llegan a ser extubados tras un proceso de desconexión. De ellos, un 57% son extubados tras una primera prueba de respiración espontánea mientras que el 43% restante precisan una mediana de 3 días para ser extubados. En global, este proceso supone un 40% del tiempo total de soporte ventilatorio2,4.
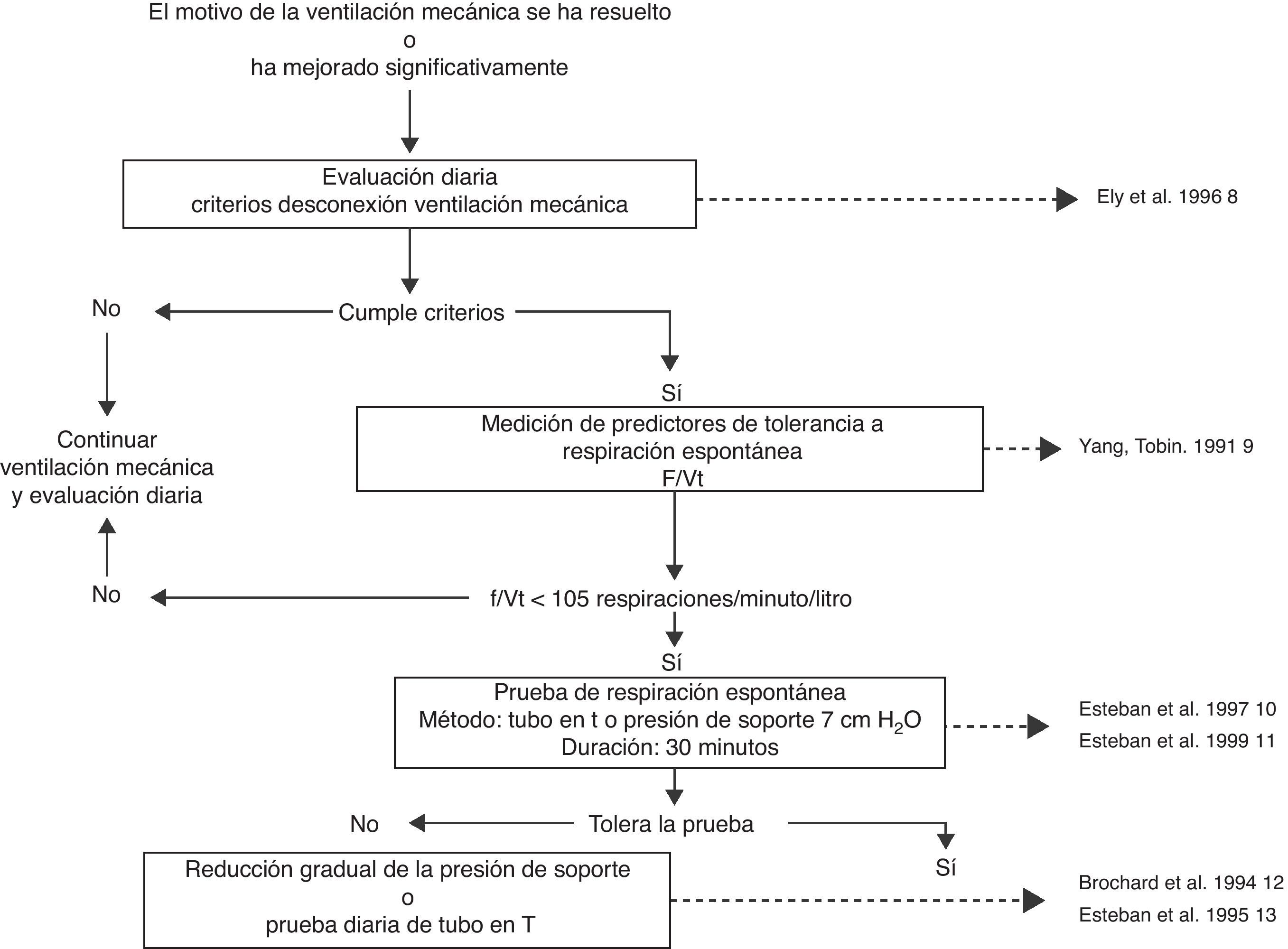
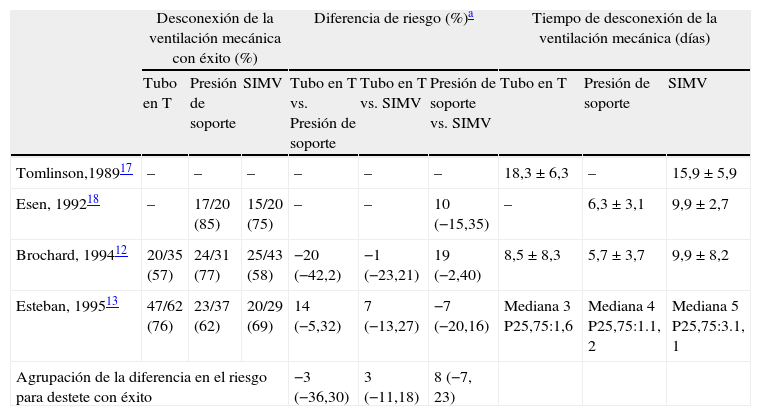
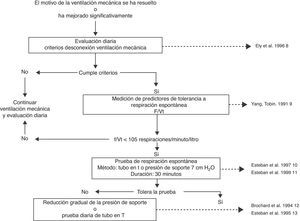
El hecho de que sea un procedimiento habitual y de que ocupe un tiempo significativo de la actividad diaria de médicos y personal de enfermería puede ser la razón por la que la desconexión de la ventilación mecánica sea uno de los procedimientos más evaluados y más basados en la evidencia científica5,6. Brevemente, la desconexión de la ventilación mecánica es un proceso que se inicia con la identificación diaria de los pacientes que pueden realizar una prueba de respiración espontánea y se continúa por la realización de 3 pruebas diagnósticas consecutivas7: medición de predictores de tolerancia a la prueba de respiración espontánea, una prueba de respiración espontánea y una prueba de extubación (fig. 1). Con esta estrategia, hay un grupo de enfermos que van a poder ser extubados en el primer intento de respiración espontánea, lo que se ha denominado weaning simple o fácil6, pero alrededor de un 45% de enfermos14 van a precisar una desconexión progresiva de la ventilación mecánica14–16. Para ello disponemos de los métodos tradicionales de desconexión: tubo en T, presión positiva continua en la vía aérea (CPAP), ventilación mandatoria intermitente sincronizada (SIMV) y presión de soporte (PS). Estos métodos han sido evaluados comparativamente en varios trabajos12,13,17,18 los cuales, a su vez, han sido analizados en una revisión sistemática19. Las diferencias en el diseño de los protocolos, en lo referente a la manera de ir disminuyendo el soporte ventilatorio con la SIMV y la presión de soporte, y en los criterios de extubación, hace que en esta revisión no haya sido posible identificar una técnica superior entre los 3 modos comparados, pero lo que sí parece confirmarse es que la SIMV puede prolongar la desconexión más que el tubo en T o la reducción gradual de la presión de soporte (tabla 1).
Algoritmo para la desconexión de la ventilación mecánica.
Comparación de los resultados de los ensayos clínicos donde se comparan los modos tradicionales de desconexión de la ventilación mecánica
| Desconexión de la ventilación mecánica con éxito (%) | Diferencia de riesgo (%)a | Tiempo de desconexión de la ventilación mecánica (días) | |||||||
| Tubo en T | Presión de soporte | SIMV | Tubo en T vs. Presión de soporte | Tubo en T vs. SIMV | Presión de soporte vs. SIMV | Tubo en T | Presión de soporte | SIMV | |
| Tomlinson,198917 | – | – | – | – | – | – | 18,3±6,3 | – | 15,9±5,9 |
| Esen, 199218 | – | 17/20 (85) | 15/20 (75) | – | – | 10 (−15,35) | – | 6,3±3,1 | 9,9±2,7 |
| Brochard, 199412 | 20/35 (57) | 24/31 (77) | 25/43 (58) | −20 (−42,2) | −1 (−23,21) | 19 (−2,40) | 8,5±8,3 | 5,7±3,7 | 9,9±8,2 |
| Esteban, 199513 | 47/62 (76) | 23/37 (62) | 20/29 (69) | 14 (−5,32) | 7 (−13,27) | −7 (−20,16) | Mediana 3 P25,75:1,6 | Mediana 4 P25,75:1.1, 2 | Mediana 5 P25,75:3.1, 1 |
| Agrupación de la diferencia en el riesgo para destete con éxito | −3 (−36,30) | 3 (−11,18) | 8 (−7, 23) | ||||||
Adaptada de19. SIMV: ventilación mandatoria sincronizada intermitente.
Las diferencias de riesgo se expresan como la diferencia en los porcentajes de pacientes desconectados con éxito entre los diferentes modos. Los números negativos indican una tasa de éxito menor y los números positivos una tasa de éxito mayor. Entre paréntesis se indica el intervalo de confianza al 95%.
En los últimos años, se han descrito nuevas aplicaciones de técnicas habituales y nuevos métodos de ventilación que pudieran tener algún papel en la desconexión de la ventilación mecánica en los enfermos con desconexión difícil o prolongada.
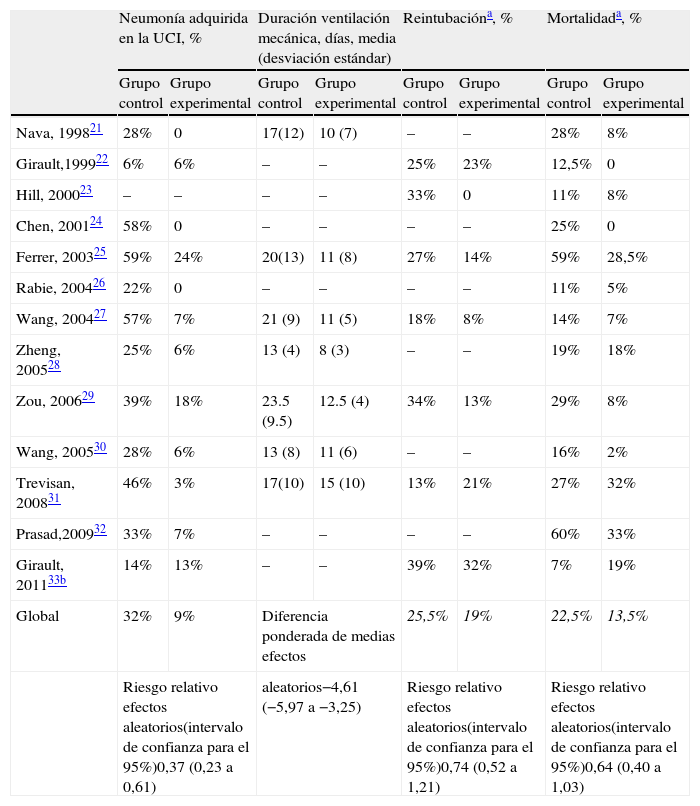
Modos alternativos y nuevos modos para la desconexión de la ventilación mecánicaVentilación no invasivaEn un intento de disminuir las complicaciones asociadas a la ventilación mecánica prolongada, algunos autores han explorado el papel de la ventilación no invasiva en la desconexión de la ventilación mecánica. En esencia, el proceso consiste en que los enfermos que fracasan una prueba de respiración espontánea son extubados e inmediatamente conectados a ventilación no invasiva. Desde la primera experiencia descrita por Udwadia et al. en 199220 se han publicado varios ensayos clínicos21–33 evaluando esta técnica como modo de desconexión de la ventilación mecánica. Las limitaciones de estos estudios para su aplicabilidad y generalización son varias. En primer lugar, el pequeño tamaño muestral de casi todos los estudios. En segundo lugar, muchos de los estudios publicados incluyen mayoritariamente22,25 o exclusivamente21,24,26,31–33 pacientes con una enfermedad pulmonar crónica, población donde está especialmente indicada la ventilación no invasiva por su capacidad para disminuir la fatiga respiratoria, aumentar el volumen corriente y disminuir la presión positiva al final de la inspiración (PEEP) intrínseca. Si otras causas de insuficiencia respiratoria se podrían beneficiar de la desconexión con ventilación no invasiva estaría pendiente de determinar. En tercer lugar, hubo una gran heterogeneidad en las estrategias utilizadas para la desconexión tanto en el grupo de desconexión invasiva como en el grupo de desconexión no invasiva. Los pacientes asignados a desconexión invasiva fueron desconectados preferentemente con presión de soporte pero con diferentes estrategias en la reducción gradual de la misma: 2 observaciones diarias con una prueba de respiración espontánea opcional22, disminución de 2 cmH2O cada 4 h según tolerancia clínica32, disminución de 2-4 cmH2O diarios26, disminución gradual de la presión de soporte hasta una presión de soporte de 7 cmH2O33. En la mayoría de los estudios se intercalaron o alternaron pruebas de respiración espontánea con tubo en T de diferente duración21–26,31,33. Igualmente, en los enfermos asignados a desconexión con ventilación no invasiva, la aplicación de la misma y los criterios para la desconexión total de la ventilación no invasiva fueron heterogéneos. Tras la extubación, la aplicación de la ventilación no invasiva fue continua en 5 estudios21,23–25,32, en un estudio intermitente22, en otro estudio durante al menos 2 h29 y, en otro, dependiendo de la tolerancia durante 20-22 h con periodos de descanso para la comida26. El nivel de soporte y la duración de los periodos de ventilación fueron gradualmente reducidos pero también con diferentes protocolos: disminución de la presión de soporte 2 cmH2O cada 4 h32 o disminución 2-4 cmH2O diarios26 según la tolerancia de los enfermos hasta una presión inspiratoria de 8 cmH2O y una espiratoria de 4 cmH2O32 o un presión inspiratoria menor de 10 cmH2O28,29 o hasta que la diferencia entre presión inspiratoria y espiratoria fuese menor de 5 cmH2O32. Por último, los resultados reportados (tablas 2 y 3) en el grupo control de algunos de los estudios no reflejan la práctica clínica habitual34. Teniendo en cuenta estas limitaciones, la conclusión de los estudios es que la ventilación no invasiva puede ser una técnica prometedora para la desconexión de la ventilación mecánica, pero se necesitarían más estudios para evaluar completamente los beneficios clínicos y los riesgos asociados al fracaso de la extubación35.
Estudios que han evaluado la ventilación no invasiva como método de desconexión de la ventilación mecánica. Población y estrategias comparadas
| Población incluida | Estrategias comparadas | |||
| Grupo control | Grupo experimental | |||
| Nava, 199821 | Pacientes con reagudización de enfermedad pulmonar obstructiva crónica | N = 25Presión de soporte invasivaPrueba de respiración espontánea con tubo en T o CPAP menor de 5 cmH2O | N = 25Presión de soporte no invasiva aplicada a través de mascara facial | |
| Girault, 199922 | Pacientes con reagudización de enfermedad pulmonar crónica (obstructiva, restrictiva o mixta) | N = 16Presión de soporte invasiva | N = 17Presión de soporte no invasiva aplicada a través de mascara facial o nasal | |
| Hill, 200023a | Pacientes con insuficiencia respiratoria aguda | N = 9Presión de soporte invasivaPrueba de respiración espontánea con tubo en T | N = 12Ventilación no invasiva utilizando un ventilador específico (VPAP®) en modo ST-A | |
| Chen, 200124 | Pacientes con reagudización de enfermedad pulmonar obstructiva crónica | N = 12Presión de soporte invasivaPrueba de respiración espontánea con tubo en T | N = 12BiPAP | |
| Ferrer, 200325 | Pacientes con Insuficiencia respiratoria aguda que fracasan tres pruebas de respiración espontánea(77% enfermos con patología pulmonar crónica) | N = 22Presión de soporte invasivaPrueba de respiración espontánea con tubo en T o CPAP menor de 5 cmH2O | N = 21Ventilacion no invasiva en modo S/T aplicada a través de mascara facial o nasal. | |
| Rabie, 200426a | Pacientes con reagudización de enfermedad pulmonar obstructiva crónica | N = 18Presión de soporte invasiva | N = 19Proportional Assist Ventilation/Timed Mode a través de mascara facial o nasal | |
| Wang, 200427 | Pacientes con enfermedad pulmonar obstructiva crónica e infección broncopulmonar | N = 14SIMV+PSPrueba de respiración espontánea con tubo en T | N = 14Presión de soporte no invasiva aplicada a través de máscara no especificada. | |
| Zheng, 200528 | Pacientes con enfermedad pulmonar obstructiva crónica e infección broncopulmonar | N = 16Presión de soporte invasiva | N = 17BiPAP aplicada a través de mascara facial o nasal | |
| Zou, 200629 | Pacientes con enfermedad pulmonar obstructiva crónica e infección broncopulmonar | N = 38SIMV+PS | N = 38BIPAP en modo ST aplicada a través de mascara facial o oronasal. | |
| Wang, 200530 | Pacientes con enfermedad pulmonar obstructiva crónica e infección broncopulmonar | N = 43SIMV+PS | N = 47BiPAP | |
| Trevisan, 200831 | Pacientes con ventilación mecánica mayor de 48 horas (35% enfermos con patología pulmonar crónica) | N = 37Presión de soporte invasivaPrueba de respiración espontánea con tubo en T | N = 28BiPAP a través de máscara facial | |
| Prasad, 200932 | Pacientes con reagudización de enfermedad pulmonar obstructiva crónica | N = 15Presión desoporte invasiva | N = 15BiPAP a través de máscara facial | |
| Girault, 201133 | Pacientes con reagudización de enfermedad pulmonar crónica (obstructiva, restrictiva o mixta) | N = 69Presión de soporte invasivaPrueba de respiración espontánea con tubo en T o presión de soporte | N=70 Oxigenoterapia sin soporte ventilatorio | N = 70Presión de soporte no invasiva a través de máscara facial |
Abreviaturas: BiPAP: Bilevel positive airway pressure; SIMV: Ventilación mandatoria sincronizada intermitente; PS: presión de soporte.
Desenlaces evaluados
| Neumonía adquirida en la UCI, % | Duración ventilación mecánica, días, media (desviación estándar) | Reintubacióna, % | Mortalidada, % | |||||
| Grupo control | Grupo experimental | Grupo control | Grupo experimental | Grupo control | Grupo experimental | Grupo control | Grupo experimental | |
| Nava, 199821 | 28% | 0 | 17(12) | 10 (7) | – | – | 28% | 8% |
| Girault,199922 | 6% | 6% | – | – | 25% | 23% | 12,5% | 0 |
| Hill, 200023 | – | – | – | – | 33% | 0 | 11% | 8% |
| Chen, 200124 | 58% | 0 | – | – | – | – | 25% | 0 |
| Ferrer, 200325 | 59% | 24% | 20(13) | 11 (8) | 27% | 14% | 59% | 28,5% |
| Rabie, 200426 | 22% | 0 | – | – | – | – | 11% | 5% |
| Wang, 200427 | 57% | 7% | 21 (9) | 11 (5) | 18% | 8% | 14% | 7% |
| Zheng, 200528 | 25% | 6% | 13 (4) | 8 (3) | – | – | 19% | 18% |
| Zou, 200629 | 39% | 18% | 23.5 (9.5) | 12.5 (4) | 34% | 13% | 29% | 8% |
| Wang, 200530 | 28% | 6% | 13 (8) | 11 (6) | – | – | 16% | 2% |
| Trevisan, 200831 | 46% | 3% | 17(10) | 15 (10) | 13% | 21% | 27% | 32% |
| Prasad,200932 | 33% | 7% | – | – | – | – | 60% | 33% |
| Girault, 201133b | 14% | 13% | – | – | 39% | 32% | 7% | 19% |
| Global | 32% | 9% | Diferencia ponderada de medias efectos | 25,5% | 19% | 22,5% | 13,5% | |
| Riesgo relativo efectos aleatorios(intervalo de confianza para el 95%)0,37 (0,23 a 0,61) | aleatorios−4,61 (−5,97 a −3,25) | Riesgo relativo efectos aleatorios(intervalo de confianza para el 95%)0,74 (0,52 a 1,21) | Riesgo relativo efectos aleatorios(intervalo de confianza para el 95%)0,64 (0,40 a 1,03) | |||||
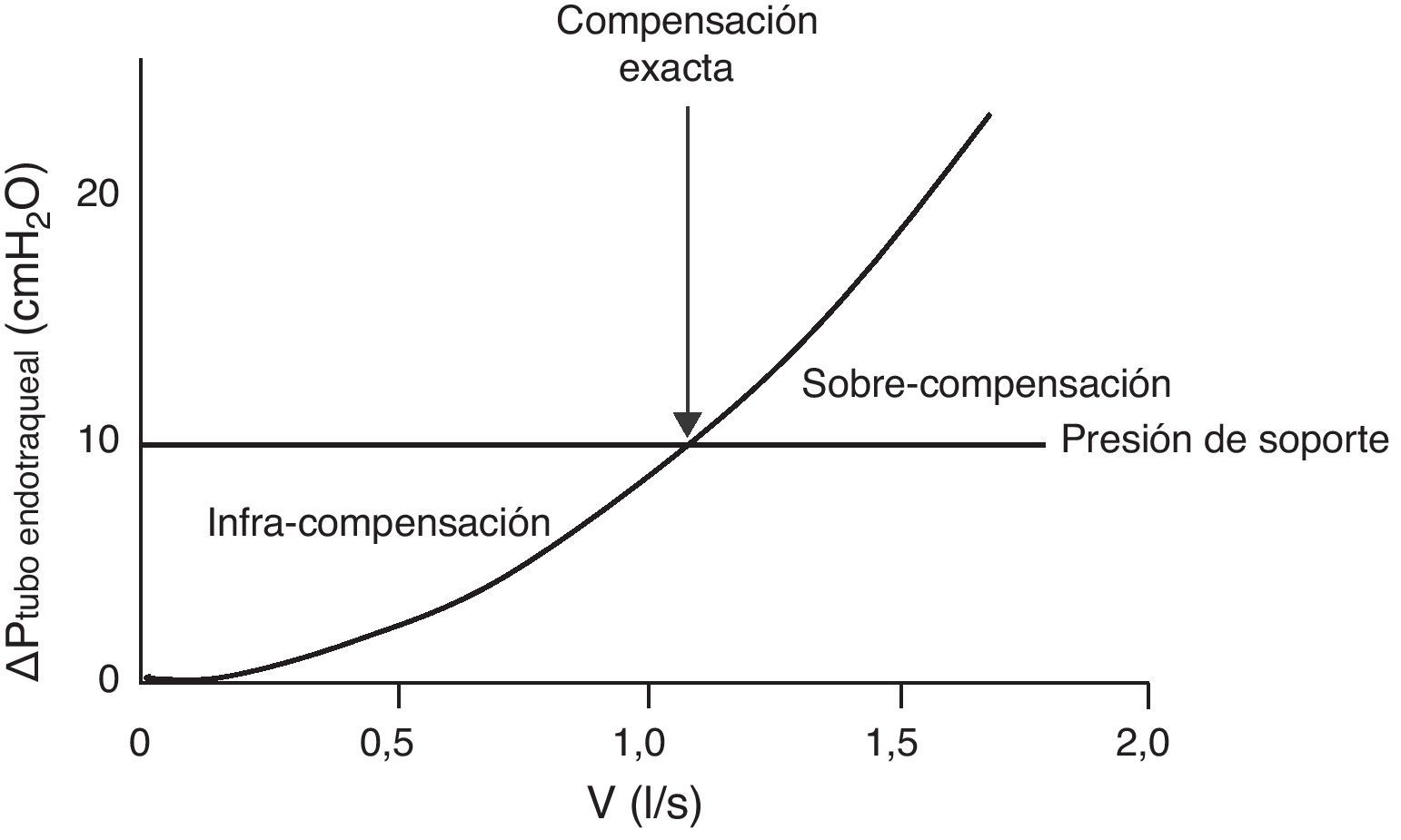
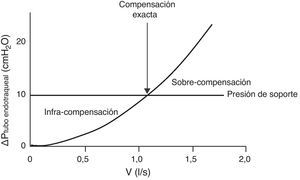
El tubo endotraqueal impone una resistencia inspiratoria durante la prueba de respiración espontánea36. Para su compensación se ha propuesto el uso de niveles bajos de presión de soporte (5-8 cmH2O)37. Desafortunadamente, no es fácil determinar o predecir el nivel exacto de presión de soporte requerido para compensar la carga inspiratoria impuesta en un paciente individual. Con el mismo nivel de soporte, se puede producir un fracaso de la prueba de respiración espontánea por una insuficiente compensación del trabajo impuesto o una sobrecompensación que puede permitir a un paciente pasar con éxito una prueba de respiración espontánea pero no permite calibrar con exactitud si el paciente es verdaderamente capaz de respirar sin apoyo. Todo ello depende del tamaño del tubo endotraqueal y del flujo inspiratorio (fig. 2).
Curva flujo/presión inspiratoria en un enfermo con un tubo endotraqueal de 7,5mm de diámetro interno (modificada de referencias 38 y 39). Debido a las variaciones en el patrón del flujo en respiración espontánea, la resistencia impuesta por el tubo es variable. Si aplicamos una presión de soporte constante de 10cmH2O (línea horizontal) nos podemos encontrar con 3 situaciones: 1) con flujos inspiratorios bajos, la presión de soporte infra-compensa la resistencia del tubo, 2) con flujos inspiratorios medios, la presión de soporte compensa la resistencia (intersección entre la curva de la presión de resistencia del tubo (ΔPtuboendotraqueal) y la línea de presión de soporte), y 3) con flujos altos la presión de soporte sobre-compensa la resistencia.
La compensación automática del tubo (ATC), disponible en los ventiladores Evita 4, Evita XL (Draeger Medical) y 840 Puritan Bennett (Covidien), es un modo donde el ventilador realiza de manera continua la medida de la caída de presión que ocurre a través del tubo endotraqueal programando, a continuación, el nivel de presión de soporte que compensa esa caída de presión39,40. Los estudios que han comparado ATC con presión de soporte sugieren que la ATC es más efectiva en la compensación del trabajo respiratorio, más comoda y con menos asincronías paciente-ventilador39,41. Para su programación es necesario introducir el tamaño del tubo endotraqueal y el porcentaje de compensación deseado (generalmente 100%).
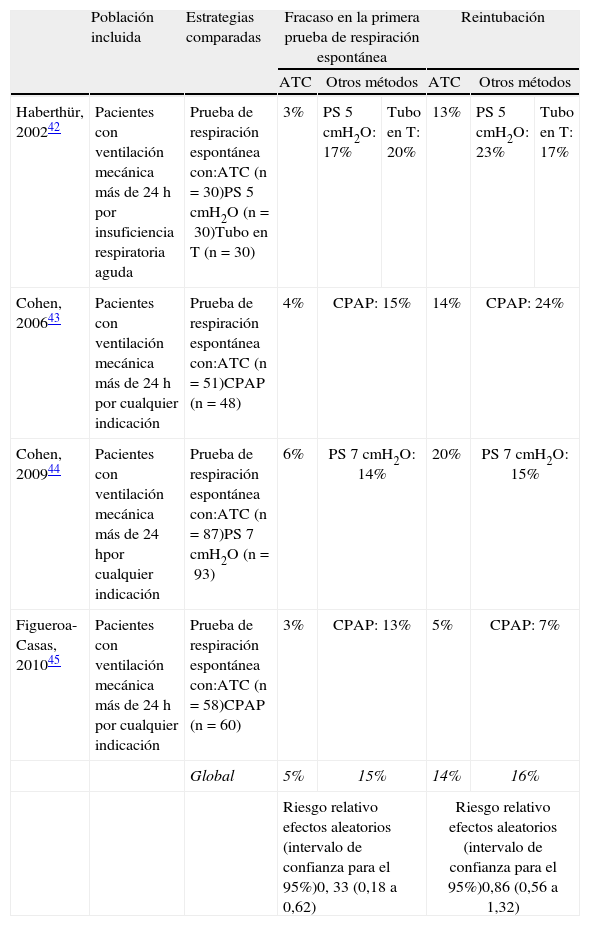
La ATC ha sido evaluada, como método para la prueba de respiración espontánea, en varios ensayos clínicos42–45 con resultados muy favorables en la tasa de éxito en la primera prueba de respiración espontánea pero con tasas de reintubación similares a los del grupo control (tabla 4). Por otra parte, otro estudio46 ha evaluado el tiempo de desconexión comparando la reducción gradual de la presión de soporte con ATC frente a la reducción gradual de la presión de soporte en solitario. Este trabajo incluye a 41 pacientes que requieren ventilación mecánica por insuficiencia respiratoria aguda secundaria a envenenamiento por mordedura de serpiente. En el grupo de presión de soporte con ATC la mediana de tiempo de desconexión fue de 8 h (rango intercuartílico 7-12) vs. 12 h (rango intercuartílico 7-17) en el grupo de presión de soporte (p=0,12).
Ensayos clínicos donde se compara la compensación automática del tubo (ATC) con otros métodos para la prueba de respiración espontánea
| Población incluida | Estrategias comparadas | Fracaso en la primera prueba de respiración espontánea | Reintubación | |||||
| ATC | Otros métodos | ATC | Otros métodos | |||||
| Haberthür, 200242 | Pacientes con ventilación mecánica más de 24 h por insuficiencia respiratoria aguda | Prueba de respiración espontánea con:ATC (n=30)PS 5 cmH2O (n=30)Tubo en T (n=30) | 3% | PS 5 cmH2O: 17% | Tubo en T: 20% | 13% | PS 5 cmH2O: 23% | Tubo en T: 17% |
| Cohen, 200643 | Pacientes con ventilación mecánica más de 24 h por cualquier indicación | Prueba de respiración espontánea con:ATC (n=51)CPAP (n=48) | 4% | CPAP: 15% | 14% | CPAP: 24% | ||
| Cohen, 200944 | Pacientes con ventilación mecánica más de 24 hpor cualquier indicación | Prueba de respiración espontánea con:ATC (n=87)PS 7 cmH2O (n=93) | 6% | PS 7 cmH2O: 14% | 20% | PS 7 cmH2O: 15% | ||
| Figueroa-Casas, 201045 | Pacientes con ventilación mecánica más de 24 h por cualquier indicación | Prueba de respiración espontánea con:ATC (n=58)CPAP (n=60) | 3% | CPAP: 13% | 5% | CPAP: 7% | ||
| Global | 5% | 15% | 14% | 16% | ||||
| Riesgo relativo efectos aleatorios (intervalo de confianza para el 95%)0, 33 (0,18 a 0,62) | Riesgo relativo efectos aleatorios (intervalo de confianza para el 95%)0,86 (0,56 a 1,32) | |||||||
Abreviaturas: ATC: compensación automática del tubo; CPAP: presión positiva continua en la vía aérea; PS: presión de soporte.
A pesar de los buenos resultados observados en los estudios publicados hasta el momento, serían necesarios estudios con un mayor número de enfermos y, sobre todo, con enfermos con dificultad para pasar la primera prueba de respiración espontánea para poder recomendar la ATC como el método de elección para la realización de la prueba de respiración espontánea47,48.
Weaning automático con sistemas de circuito cerradoVentilación minuto mandatoriaEste modo de ventilación, descrito por Hewlett et al.49, fue el primero en el cual el ventilador modificaba el soporte basado en la respuesta del paciente o el primer modo de control computarizado de la ventilación. Actualmente, este modo de ventilación se encuentra disponible en los ventiladores Evita 4, Evita XL (Draeger Medical), CPU-1 Intensive Care ventilator (Ohmeda Medical), Sechrist IV-100B (Sechrist Industries Inc) y Hamilton Veolar ventilator (Hamilton Medical). En esta modalidad, se programa el volumen tidal y una frecuencia mandatoria definiendo, por lo tanto, un objetivo de ventilación minuto. El ventilador adapta la frecuencia mandatoria al objetivo de ventilación minuto teniendo en cuenta la frecuencia respiratoria espontánea del paciente. La diferencia con la SIMV es que mientras en esta modalidad la frecuencia mandatoria es fija en la MMV la frecuencia mandatoria es variable. Si la respiración espontánea de un paciente, que se realiza con una presión de soporte previamente fijada, alcanza o sobrepasa el objetivo prefijado, el ventilador no da ninguna respiración mandatoria. Por el contrario, si la ventilación minuto del paciente cae por debajo del nivel pedeterminado el ventilador ofrece las respiraciones necesarias para alcanzar el objetivo. Una de las principales limitaciones es que el ventilador hace los ajustes solo de acuerdo a la ventilación minuto determinada. Esto es, no diferencia un volumen tidal de 500ml con una frecuencia respiratoria de 12 respiraciones por min (patrón ventilatorio normal) de un volumen tidal de 200ml con una frecuencia respiratoria de 30 respiraciones por min (patrón de respiración rápida y superficial).
Hay muy pocos trabajos, la mayoría de ellos realizados en la población de neonatos, que hayan evaluado la MMV como método alternativo de desconexión de la ventilación mecánica. En adultos solo hay un ensayo clínico50. En este estudio, se asignaron de forma aleatoria a 22 pacientes a desconexión con MMV y a 18 pacientes a desconexión con IMV. La MMV disminuyó significativamente el tiempo de desconexión (5 h vs. 33 h; p<0,001) sin aumento en la tasa de fracaso de extubación a las 4 h de la extubación (89 vs. 86%).
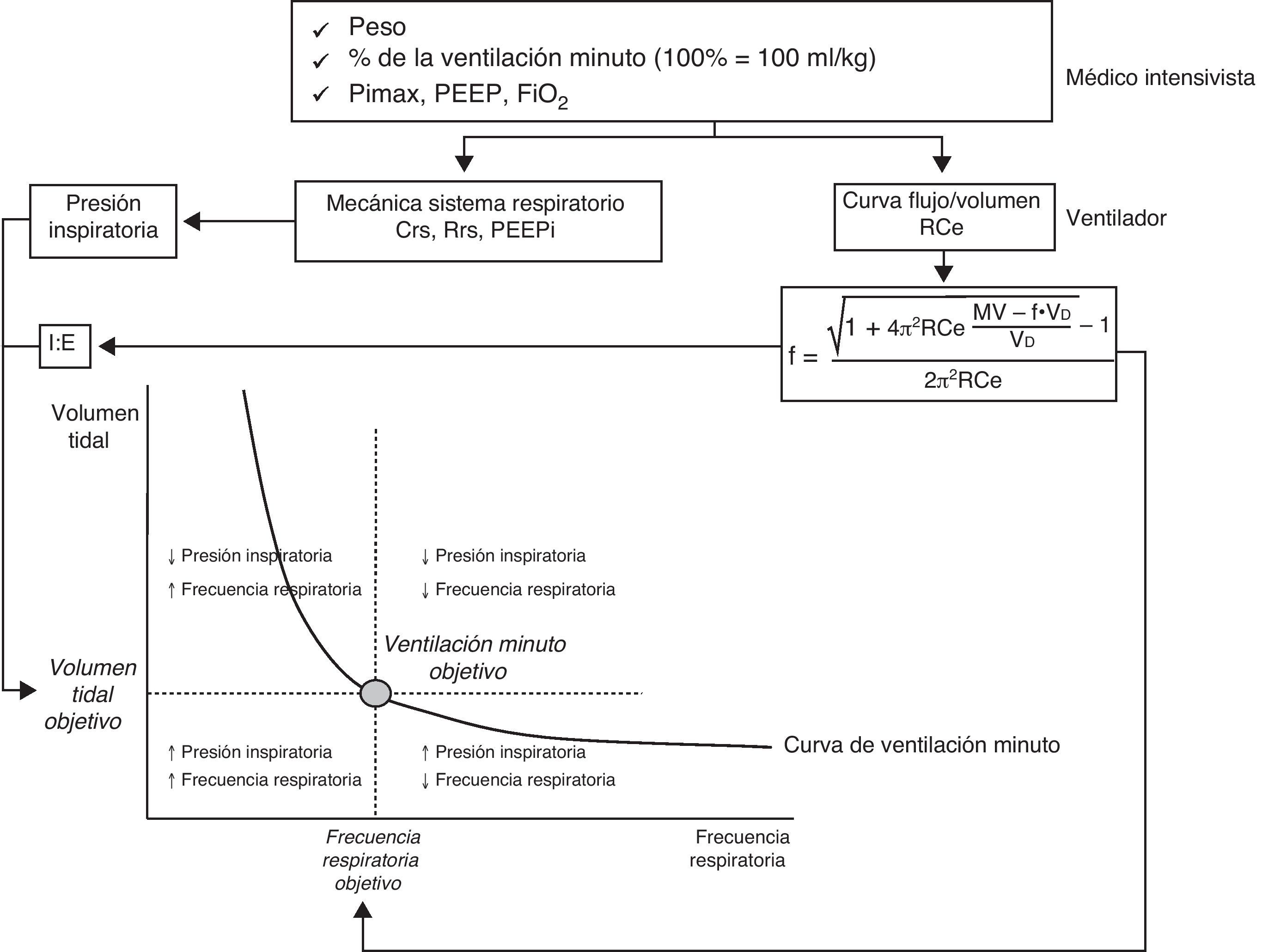
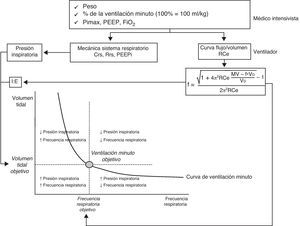
Ventilación adaptativa de soporteEsta modalidad fue descrita inicialmente, como ventilación adaptativa pulmonar, por Laubscher en 199451,52. Se trata de un modo asistido, controlado por presión, con un sistema automático de regulación de los parámetros ventilatorios en respuesta a cambios en la mecánica del sistema respiratorio y del patrón de ventilación espontánea. Se encuentra disponible en los respiradores Galileo, Raphael, Hamilton S1, Hamilton C2, Hamilton G5 (Hamilton Medical). El principio básico de su funcionamiento se basa en la fórmula de Otis53. Mediante esta ecuación se calcula la frecuencia respiratoria ideal, que es la que se asocia con un menor gasto energético, para lo que se tiene en cuenta el espacio muerto, la ventilación minuto y la constante de tiempo espiratoria. Inicialmente se introduce en el ventilador los datos de peso del paciente, el porcentaje deseado de ventilación minuto (100% es igual a 100ml/kg/min), la fracción inspirada de oxígeno, la presión al final de la espiración (PEEP) y la presión máxima inspiratoria (Pimax). A continuación, el sistema determina la constante de tiempo espiratoria mediante el análisis de la curva de flujo-volumen espiratoria. Posteriormente, el algoritmo automático ajusta la presión inspiratoria, la relación de tiempo inspiratorio/espiratorio y la frecuencia respiratoria para mantener el objetivo de ventilación minuto (fig. 3), dentro de un rango establecido para evitar la respiración rápida y superficial o un volumen de inflación excesivo. Para la determinación de la frecuencia respiratoria óptima, el ventilador asume un espacio muerto, según el nomograma de Radford55, de 2,2ml/kg. En los pacientes en fase de desconexión de la ventilación mecánica, el algoritmo de la ASV irá reduciendo progresivamente y automáticamente la presión inspiratoria. La desconexión es completa cuando todas las respiraciones sean espontáneas y el enfermo mantenga un adecuado interecambio gaseoso durante unas horas con una presión inspiratoria menor de 8cmH2O.
Representación esquemática de los principios básicos de funcionamiento de la ventilación adaptativa de soporte (ASV). (Modificado de referencia 54).
Abreviaturas
Crs: compliance del sistema respiratorio; f: frecuencia respiratoria; FiO2: fracción inspirada de oxígeno; MV: ventilación minuto; PEEP: presión positiva al final de la espiración; PEEPi: presión positiva intrínseca al final de la espiración; PiMax: presión inspiratoria máxima; Rce: constante tiempo espiratoria; Rrs: Resistencia del sistema respiratorio; VD: espacio muerto anatómico.
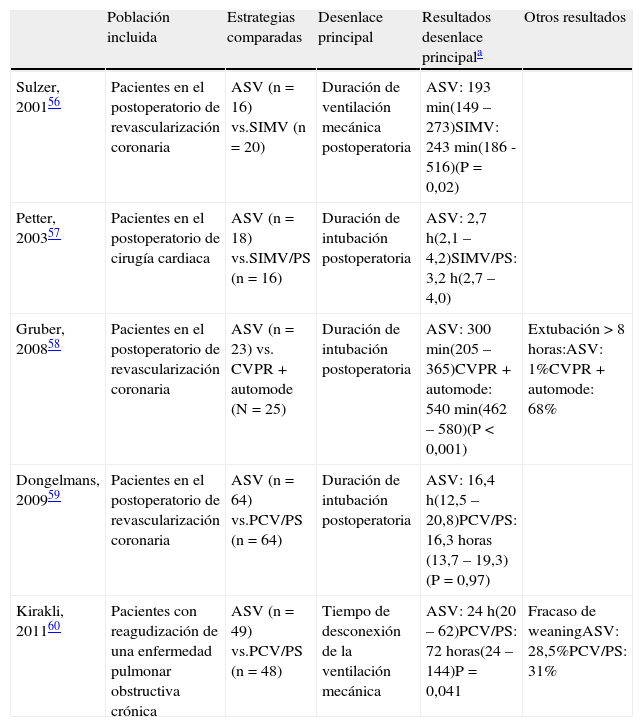
Los estudios que han evaluado la ASV como método de desconexión56–60 sugieren que podría simplificar el manejo ventilatorio y reducir el tiempo hasta la extubación (tabla 5). Las limitaciones de estos estudios son que se han realizado en grupos pequeños de enfermos predominantemente postoperatorios con una duración corta de la ventilación mecánica.
Ensayos clínicos que han evaluado la ventiación adaptativa de soporte (ASV) como método de desconexión de la ventilación mecánica
| Población incluida | Estrategias comparadas | Desenlace principal | Resultados desenlace principala | Otros resultados | |
| Sulzer, 200156 | Pacientes en el postoperatorio de revascularización coronaria | ASV (n=16) vs.SIMV (n=20) | Duración de ventilación mecánica postoperatoria | ASV: 193 min(149 – 273)SIMV: 243 min(186 -516)(P=0,02) | |
| Petter, 200357 | Pacientes en el postoperatorio de cirugía cardiaca | ASV (n=18) vs.SIMV/PS (n=16) | Duración de intubación postoperatoria | ASV: 2,7 h(2,1 – 4,2)SIMV/PS: 3,2 h(2,7 – 4,0) | |
| Gruber, 200858 | Pacientes en el postoperatorio de revascularización coronaria | ASV (n=23) vs. CVPR+automode (N=25) | Duración de intubación postoperatoria | ASV: 300 min(205 – 365)CVPR+automode: 540 min(462 – 580)(P<0,001) | Extubación>8 horas:ASV: 1%CVPR+automode: 68% |
| Dongelmans, 200959 | Pacientes en el postoperatorio de revascularización coronaria | ASV (n=64) vs.PCV/PS (n=64) | Duración de intubación postoperatoria | ASV: 16,4 h(12,5 – 20,8)PCV/PS: 16,3 horas (13,7 – 19,3)(P=0,97) | |
| Kirakli, 201160 | Pacientes con reagudización de una enfermedad pulmonar obstructiva crónica | ASV (n=49) vs.PCV/PS (n=48) | Tiempo de desconexión de la ventilación mecánica | ASV: 24 h(20 – 62)PCV/PS: 72 horas(24 – 144)P=0,041 | Fracaso de weaningASV: 28,5%PCV/PS: 31% |
ASV: ventilación adaptativa de soporte; CVPR: ventilación controlada por volumen regulada por presión; PS: presión de soporte; PCV: ventilación controlada por presión; SIMV: ventilación mandatoria sincronizada intermitente.
A diferencia de los 2 métodos previamente descritos los sistemas de weaning automatizados disponibles no son nuevos modos de ventilación sino estrategias automáticas de desconexión de la ventilación mecánica basadas en un modo de ventilación ya existente como es la presión de soporte. Actualmente disponemos de 2 sistemas de weaning automatizados: SmartCare®61 disponible en el ventilador Evita XL (Draeger Medical) y el sistema mandatory rate ventilation (MRV) disponible en el ventilador Taema Horus (Air Liquid).
El sistema SmartCare® aplica continuamente un protocolo de desconexión con cambios en la presión de soporte basados en mediciones de la frecuencia respiratoria, del volumen tidal y de la presión parcial de CO2 al final de la espiración (etCO2). Para iniciar el funcionamiento del sistema, el médico introduce información del paciente (peso, antecedentes de enfermedad pulmonar crónica y/o enfermedad neurológica), tipo de vía aérea artificial (tubo endotraqueal o traqueostomía) y tipo de humidificación (intercambiador de calor-humedad o humidificados de calor activo). Tras ello se inicia el proceso de desconexión, inicialmente el sistema se adapta para mantener al paciente en un estado de confort respiratorio (ventilación normal) para lo cual adapta la presión de soporte, aumentando o disminuyendo entre 2 y 4 cmH2O, según los datos de frecuencia respiratoria (límites normales 15-30rpm, en enfermos con patología neurológica aumenta el límite superior a 34rpm), volumen tidal (límites normales>300ml) y etCO2 (límites normales<55mmHg, en enfemos con enfermedad pulmonar obstructiva crónica sube el límite a 65mmHg) cuyo promedio se calcula cada 2-5 min. Una vez que el paciente se encuentra en la situación de ventilación normal, el sistema reduce o aumenta la presión de soporte, dependiendo de las necesidades del enfermo, cada 15, 30 o 60 min dependiendo del nivel previo de presión de soporte hasta llegar a una presión de soporte variable dependiendo del tipo de vía aérea artificial y del tipo de humidificación (5 cmH2O para humidificador de calor activo y traqueotomía, 7 cmH2O para humificador de calor activo y tubo endotraqueal, 9 cmH2O para humificador de calor-humedad y traqueotomía, 12 cmH2O para humificador de calor-humedad y tubo endotraqueal). Una vez que se llega a este nivel de soporte se considera que el enfermo inicia una prueba de respiración espontánea cuya duración es determinada por el patrón respiratorio y el nivel de presión de soporte al que inició el proceso de desconexión. Si durante ese tiempo el enfermo presenta un patrón respiratorio diferente a la ventilación normal o a la hiperventilación el sistema considera que ha fracasado la prueba de respiración espontánea y aumenta la presión de soporte hasta obtener un patrón de ventilación normal. En caso de estabilidad del patrón respiratorio, el respirador mostrará un mensaje indicando que el enfermo está preparado para ser extubado.
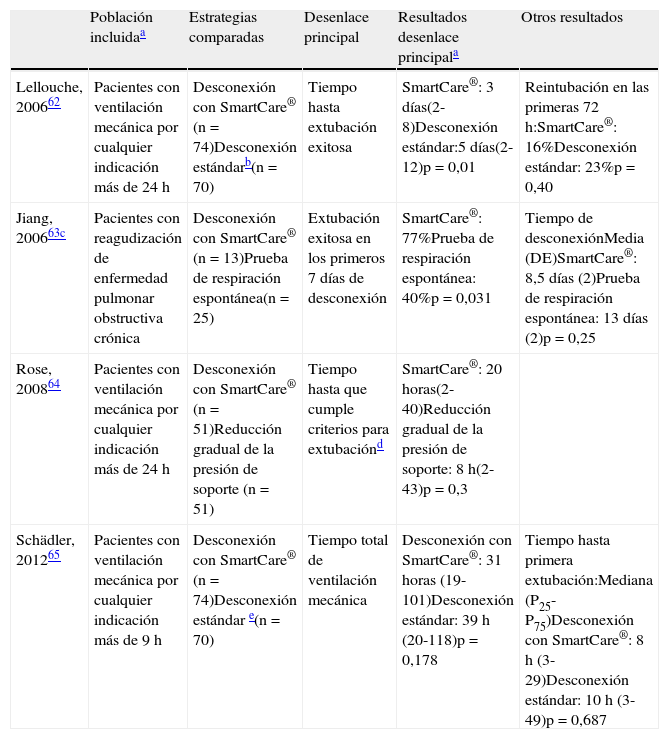
Este sistema, que no se recomienda en enfermos con patología neurológica que afecte al control de la respiración, en enfermos sobre-sedados, en pacientes con broncoespasmo grave, en enfermos con delirio/agitación y en enfermos con polineuropatia/miopatia grave, ha sido evaluado en varios ensayos clínicos62–65 con diferentes resultados (tabla 6) debido a la evaluación de diferentes desenlaces y a diferencias en el protocolo de desconexión de la ventilación mecánica en el grupo de desconexión no-automática.
Ensayos clínicos que han evaluado el sistema SmartCare® como método de desconexión de la ventilación mecánica
| Población incluidaa | Estrategias comparadas | Desenlace principal | Resultados desenlace principala | Otros resultados | |
| Lellouche, 200662 | Pacientes con ventilación mecánica por cualquier indicación más de 24 h | Desconexión con SmartCare® (n=74)Desconexión estándarb(n=70) | Tiempo hasta extubación exitosa | SmartCare®: 3 días(2-8)Desconexión estándar:5 días(2-12)p=0,01 | Reintubación en las primeras 72 h:SmartCare®: 16%Desconexión estándar: 23%p=0,40 |
| Jiang, 200663c | Pacientes con reagudización de enfermedad pulmonar obstructiva crónica | Desconexión con SmartCare® (n=13)Prueba de respiración espontánea(n=25) | Extubación exitosa en los primeros 7 días de desconexión | SmartCare®: 77%Prueba de respiración espontánea: 40%p=0,031 | Tiempo de desconexiónMedia (DE)SmartCare®: 8,5 días (2)Prueba de respiración espontánea: 13 días (2)p=0,25 |
| Rose, 200864 | Pacientes con ventilación mecánica por cualquier indicación más de 24 h | Desconexión con SmartCare® (n=51)Reducción gradual de la presión de soporte (n=51) | Tiempo hasta que cumple criterios para extubaciónd | SmartCare®: 20 horas(2-40)Reducción gradual de la presión de soporte: 8 h(2-43)p=0,3 | |
| Schädler, 201265 | Pacientes con ventilación mecánica por cualquier indicación más de 9 h | Desconexión con SmartCare® (n=74)Desconexión estándar e(n=70) | Tiempo total de ventilación mecánica | Desconexión con SmartCare®: 31 horas (19-101)Desconexión estándar: 39 h (20-118)p=0,178 | Tiempo hasta primera extubación:Mediana (P25-P75)Desconexión con SmartCare®: 8 h (3-29)Desconexión estándar: 10 h (3-49)p=0,687 |
La desconexión estándar consiste en: evaluación diaria de los criterios de desconexión, prueba de respiración espontánea (tubo en T o con presión e soporte) en el momento de cumplir criterios y extubación tras pasar la prueba de respiración espontánea.
Definido en el artículo original como ‘tiempo hasta separación’ que es el tiempo desde que se randomiza al enfermo (inmediatamente después de pasar con éxito una prueba de 30 min con presión de soporte de hasta 20 cmH2O) hasta que pasan una prueba de 1 h de duración con presión de soporte de 7 cmH2O y PEEP de 5 cmH2O.
Por su parte, el sistema MRV va disminuyendo progresivamente la presión de soporte basándose en un objetivo de frecuencia respiratoria. Esta frecuencia respiratoria representa la frecuencia respiratoria que se espera realice el enfermo. En cada ciclo, el ventilador compara la frecuencia respiratoria deseada con el promedio de frecuencia respiratoria realizado en los 4 ciclos previos. Si el promedio es mayor que el objetivo de frecuencia respiratoria, la presión de soporte aumenta automáticamente 1 cmH2O. Si el promedio de frecuencia respiratoria es menor que la frecuencia respiratoria deseada, el sistema disminuirá la presión de soporte 1 cmH2O. Este sistema solo ha sido evaluado en un estudio 66 que incluye a 106 pacientes en el postoperatorio que son asignados a desconexión con reducción gradual de la presión soporte (53 pacientes) o a desconexión con el sistema MRV (53 pacientes). En el análisis por intención de tratar la duración media hasta la extubación fue de 221±192 min en el grupo de reducción gradual de la presión soporte vs. 271±369 min en el grupo de MRV (p=0,375).
En resumen, aunque los sistemas automáticos de desconexión de la ventilación mecánica suponen un importante avance, serán necesarios más estudios para poder precisar qué población de enfermos ventilados se pueden beneficiar de estos sistemas frente a los modos convencionales de desconexión.
Otros modosBasados en el mismo concepto que algunos de los modos previamente descritos (‘el ventilador se adapta al paciente en lugar del paciente al ventilador’) existen otros nuevos modos de ventilación como el patrón espontáneo amplificado (PEA)67, la ventilación asistida proporcional (PAV)68, la ventilación asistida ajustada neuralmente (NAVA)69, automode70, sin estudios suficientes para poder establecer su posible papel en la desconexión de la ventilación mecánica.
En conclusión, parece que, por el momento, todos los modos que están apareciendo para la desconexión de la ventilación mecánica son métodos alternativos. Por ello, nosotros pensamos que lo más eficaz y sencillo es la realización de una prueba diaria de respiración espontánea, de unos treinta minutos de duración, con tubo en T.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo de revisión pertenece a la serie «Puesta al día en Ventilación Mecánica» del Grupo de Trabajo de Insuficiencia respiratoria aguda (GT-IRA).