El daño renal agudo (DRA) es un síndrome frecuente en el paciente hospitalizado. Los factores de riesgo asociados a su desarrollo y evolución clásicamente aceptados se encuentran en relación con el ambiente o la enfermedad de base del paciente. Sin embargo, en los últimos años se ha reconocido la influencia de los factores genéticos.
ObjetivoAnalizar la influencia de los polimorfismos genéticos en el riesgo de presentar y en la evolución del DRA. Fuente de datos: búsqueda electrónica en MEDLINE. Selección de estudios: manuscritos redactados en idioma inglés o español, publicados entre el 1/1/1995 y el 31/5/2011 y que analizaron la asociación entre polimorfismos genéticos y: (a) susceptibilidad a DRA entre pacientes versus controles sanos o entre diferentes grupos de pacientes; (b) gravedad del DRA. Criterios de exclusión: estudios publicados solo en forma de resumen, casos clínicos o estudios que incluyeran pacientes menores de 16 años, en diálisis crónica o con trasplante renal. Extracción de datos: al menos uno de los investigadores analizó cada artículo mediante formulario predefinido.
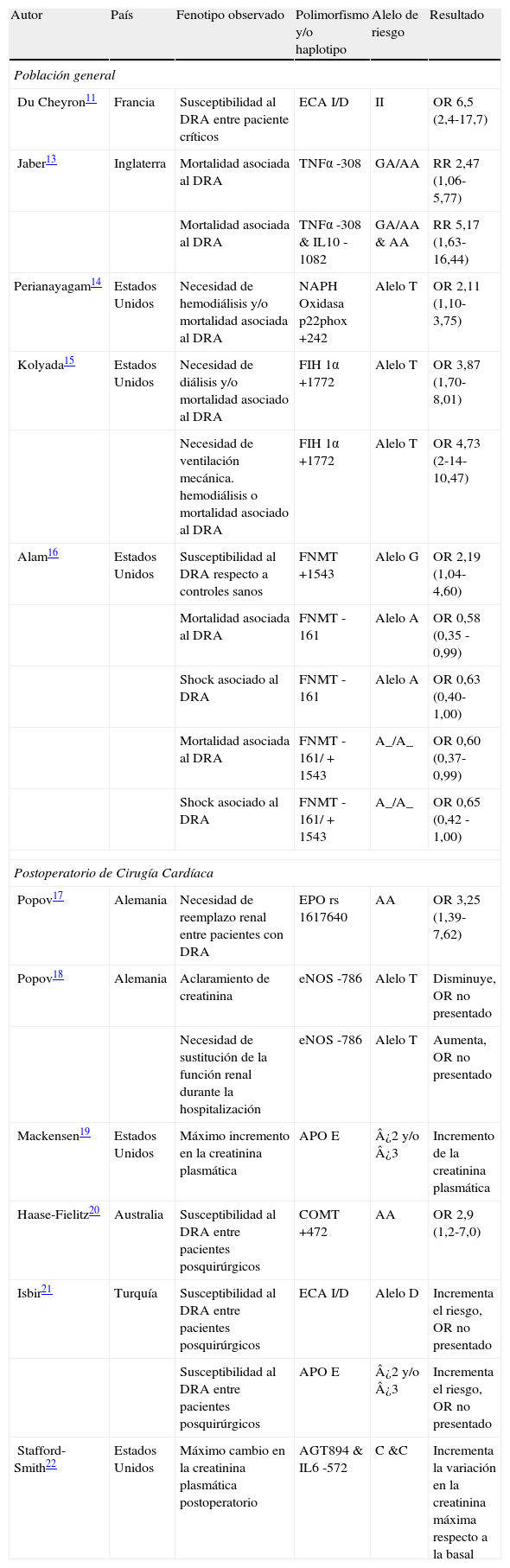
ResultadosSe encontraron 12 trabajos que incluyeron 4.835 pacientes. Once genes contienen polimorfismos asociados a la susceptibilidad o gravedad del DRA. Hemos clasificado estos genes de acuerdo con su función en aquellos que participan en la respuesta hemodinámica (ACE, eNOS, FNMT y COMT), respuesta inflamatoria (TNFα, IL10, IL6, HIP-1A, EPO), estrés oxidativo (NAPH oxidasa) y en el metabolismo lipídico (APOE). Solo los genes de APOE, ACE y receptor AT1 han sido analizados en más de un estudio.
ConclusiónLa susceptibilidad y gravedad del DRA están relacionadas con factores genéticos que están implicados en distintos mecanismos fisiopatológicos.
Acute renal damage (ARD) is a frequent syndrome in hospitalized patients. It is well accepted that ARD susceptibility and outcome are related to environmental risk factors and to the patient premorbid status. Recently, host factors have also been recognized as important in ARD predisposition and evolution.
ObjectiveTo analyze genetic influences related to the risk and severity of ARD. Data source: MEDLINE search. Selection of studies: articles published in English or Spanish between 1/1/1995 and 31/5/2011, analyzing the association between genic polymorphisms and (a) ARD susceptibility in patients versus healthy controls or within groups of patients; or (b) ARD severity. Exclusion criteria: studies published only in abstract form, case reports or including patients less than 16 years of age, on chronic dialysis or having received a renal transplant. Data extraction: at least one investigator analyzed each manuscript and collected the information using a predefined form.
ResultsWe identified 12 relevant studies that included 4835 patients. Eleven genes showed polymorphisms related to ARD susceptibility or severity. They were related to cardiovascular regulation (ACE I/D, eNOS, FNMT and COMT), inflammatory response (TNFα, IL10, IL6, HIP-1α, EPO), oxidative stress (NAPH oxidase) and lipid metabolism (APO E). Only APO E, ACE and AT1 receptor have been analyzed in more than one study.
ConclusionARD susceptibility and severity is influenced by genetic factors, which are multiple and involve different physiopathological mechanisms.
El daño renal agudo (DRA) es una entidad grave y frecuente en el enfermo crítico. Su expresión clínica es muy variable, desde una leve elevación de la concentración sérica de la creatinina hasta la anuria y necesidad de técnicas de reemplazo de la función renal1. Su incidencia entre los pacientes hospitalizados es del 7% aproximadamente2, alcanzando el 40% en pacientes críticos con sepsis3. En España, Herrera-Gutiérrez et al.4 en un estudio multicéntrico realizado en 1999 (FRAMI) encontraron que su incidencia al ingreso del paciente en la UCI fue del 5,7%.
La respuesta del huésped ante los estímulos ambientales es específica para cada individuo y está influida por su estructura genética. Dos personas no cosanguíneas comparten el 99,9% de la secuencia nucleotídica. Sin embargo, el relativamente pequeño 0,1% que las diferencia es suficiente para determinar el carácter individual dentro de la especie5. La base de esta variabilidad reside en los polimorfismos genéticos, que son variantes en la cadena de ADN en una posición específica (locus) que determina la existencia de al menos dos alelos distintos6. Por convención, el más frecuente es denominado nativo, y el resto polimórficos. Estas variantes pueden ser: (a) de un solo nucleótido, constituyendo un polimorfismo de nucleótido simple (single nucleotide polymorphism, SNP); (b) de una secuencia, en cuyo caso el polimorfismo está definido por la inserción o deleción del fragmento; (c) variantes en el número de repeticiones de una determinada secuencia6–9.
La influencia de los polimorfismos se ejerce: (a) directamente, debido a la modificación del riesgo por el polimorfismo; (b) como grupo «ligado» o haplotipo, debido a la modificación del riesgo por un conjunto de polimorfismos que se localizan en regiones próximas de la secuencia del ADN y por lo tanto no se recombinan; (c) como grupo «no ligado» o combinación de polimorfismos, debido a la modificación del riesgo por variantes genéticas que no se heredan de forma conjunta ni están cercanas en la cadena de ADN, pero que determinan un riesgo particular si coinciden en el genoma de la misma persona10.El objetivo de la presente revisión sistemática es analizar la evidencia disponible sobre la influencia que ejercen los polimorfismos genéticos en el riesgo de presentar y en la evolución del DRA.
Material y métodosSe incluyeron artículos publicados en inglés o español que analizaron la asociación entre polimorfismos y: (a) susceptibilidad al DRA entre pacientes versus individuos sanos, y entre diferentes grupos de pacientes; (b) gravedad del DRA. Se excluyeron estudios publicados solo en forma de resumen, casos clínicos o que incluyeron pacientes menores de 16 años, en diálisis crónica o con trasplante renal.
Estrategia de búsquedaSe realizó la búsqueda en el US National Institute of Health, National Library of Medicine (MEDLINE) de los estudios publicados entre el 1 de enero del 1995 y el 31 de mayo del 2011, utilizando los siguientes términos MeSH: «Acute Kidney Injury/genetics»; «Acute Kidney Injury» and «Genes»; «Acute Kidney Injury» and «Polymorphism, Genetic»; «Acute Kidney Injury» and «Disease Susceptibility»; «Acute Kidney Injury» and «Genetic Predisposition to Disease»; «Acute Kidney Injury» and «Genetic Testing»; «Renal Replacement Therapy» and «Genes».
Se seleccionaron todos los títulos y resúmenes que potencialmente podrían cumplir los criterios de inclusión para un análisis manual del texto completo. Posteriormente, se revisó la bibliografía incluida en los artículos seleccionados con el fin de identificar potenciales estudios adicionales.
En virtud de las características particulares de la cirugía cardíaca (momento del insulto conocido, factor desencadenante siempre quirúrgico y convalecencia posquirúrgica habitualmente en unidades especiales) se decidió organizar el análisis en 2 grupos de estudios: (a) población general y (b) postoperatorio de cirugía cardíaca.
De cada artículo seleccionado se extrajo la siguiente información: primer autor, fecha de publicación, número de participantes, procedencia de la población, diseño del estudio, criterios de inclusión y exclusión, polimorfismo analizado, carácter observado y estimaciones de los desenlaces estudiados (odds ratio, riesgo relativo).
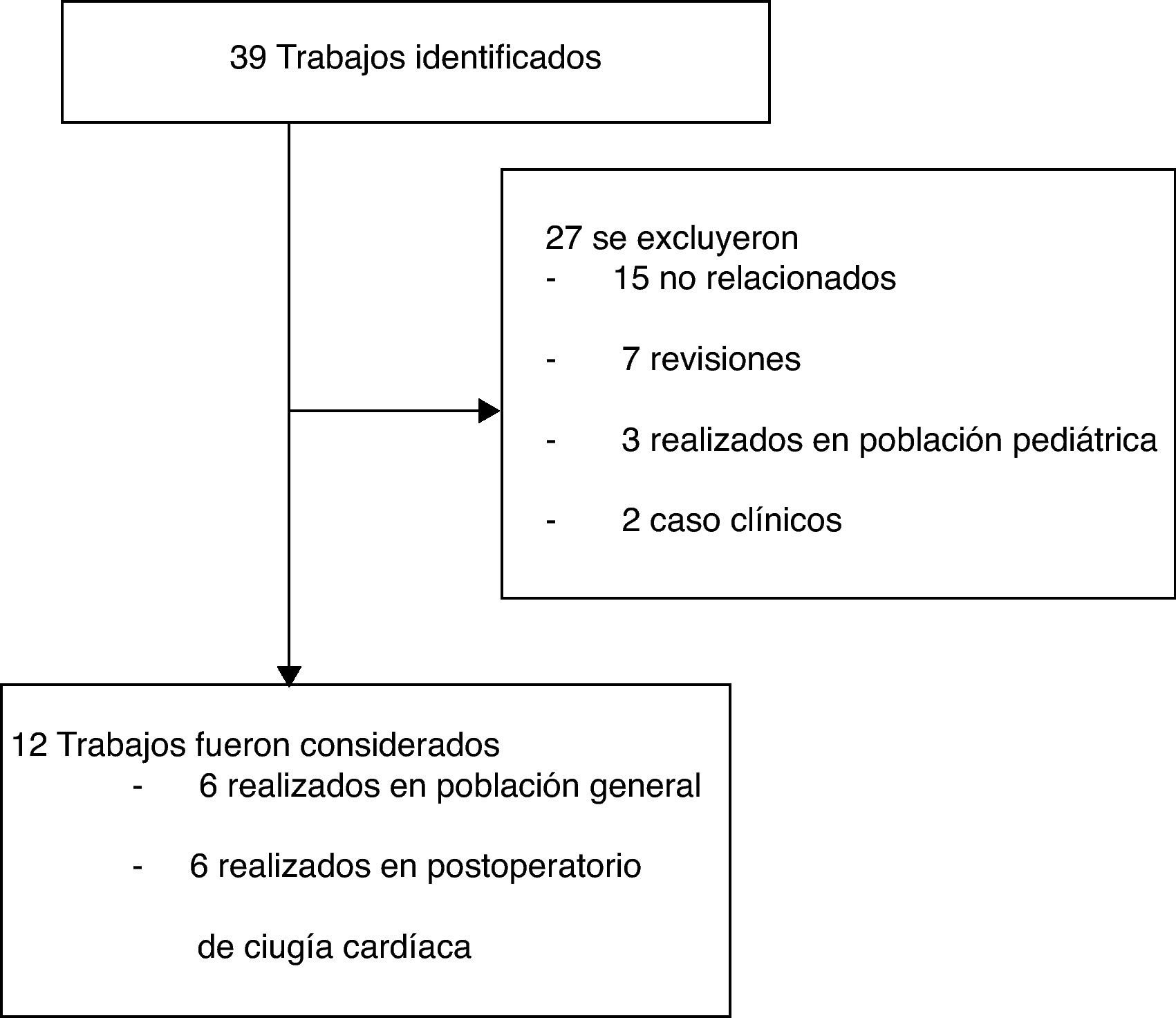
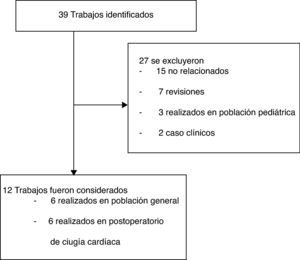
ResultadosSe identificaron 39 trabajos; se excluyeron 27 y se analizaron 12 (fig. 1). Los polimorfismos asociados con la susceptibilidad o evolución del DRA se presentan en la tabla 1.
Polimorfismos genéticos asociados a daño renal agudo
| Autor | País | Fenotipo observado | Polimorfismo y/o haplotipo | Alelo de riesgo | Resultado |
| Población general | |||||
| Du Cheyron11 | Francia | Susceptibilidad al DRA entre paciente críticos | ECA I/D | II | OR 6,5 (2,4-17,7) |
| Jaber13 | Inglaterra | Mortalidad asociada al DRA | TNFα -308 | GA/AA | RR 2,47 (1,06-5,77) |
| Mortalidad asociada al DRA | TNFα -308 & IL10 -1082 | GA/AA & AA | RR 5,17 (1,63-16,44) | ||
| Perianayagam14 | Estados Unidos | Necesidad de hemodiálisis y/o mortalidad asociada al DRA | NAPH Oxidasa p22phox +242 | Alelo T | OR 2,11 (1,10-3,75) |
| Kolyada15 | Estados Unidos | Necesidad de diálisis y/o mortalidad asociado al DRA | FIH 1α +1772 | Alelo T | OR 3,87 (1,70- 8,01) |
| Necesidad de ventilación mecánica. hemodiálisis o mortalidad asociado al DRA | FIH 1α +1772 | Alelo T | OR 4,73 (2-14-10,47) | ||
| Alam16 | Estados Unidos | Susceptibilidad al DRA respecto a controles sanos | FNMT +1543 | Alelo G | OR 2,19 (1,04-4,60) |
| Mortalidad asociada al DRA | FNMT -161 | Alelo A | OR 0,58 (0,35 - 0,99) | ||
| Shock asociado al DRA | FNMT -161 | Alelo A | OR 0,63 (0,40- 1,00) | ||
| Mortalidad asociada al DRA | FNMT -161/+1543 | A_/A_ | OR 0,60 (0,37-0,99) | ||
| Shock asociado al DRA | FNMT -161/+1543 | A_/A_ | OR 0,65 (0,42 - 1,00) | ||
| Postoperatorio de Cirugía Cardíaca | |||||
| Popov17 | Alemania | Necesidad de reemplazo renal entre pacientes con DRA | EPO rs 1617640 | AA | OR 3,25 (1,39- 7,62) |
| Popov18 | Alemania | Aclaramiento de creatinina | eNOS -786 | Alelo T | Disminuye, OR no presentado |
| Necesidad de sustitución de la función renal durante la hospitalización | eNOS -786 | Alelo T | Aumenta, OR no presentado | ||
| Mackensen19 | Estados Unidos | Máximo incremento en la creatinina plasmática | APO E | ¿2 y/o ¿3 | Incremento de la creatinina plasmática |
| Haase-Fielitz20 | Australia | Susceptibilidad al DRA entre pacientes posquirúrgicos | COMT +472 | AA | OR 2,9 (1,2-7,0) |
| Isbir21 | Turquía | Susceptibilidad al DRA entre pacientes posquirúrgicos | ECA I/D | Alelo D | Incrementa el riesgo, OR no presentado |
| Susceptibilidad al DRA entre pacientes posquirúrgicos | APO E | ¿2 y/o ¿3 | Incrementa el riesgo, OR no presentado | ||
| Stafford-Smith22 | Estados Unidos | Máximo cambio en la creatinina plasmática postoperatorio | AGT894 & IL6 -572 | C &C | Incrementa la variación en la creatinina máxima respecto a la basal |
AGT: angiotensinógeno; APO E: apolipoproteina E; COMT: catecol-O-metiltranferasa; ECA: enzima convertidora de angiotensina; eNOS: sintasa de óxido nítrico endotelial; EPO: eritropoyetina; FIH: factor inducible por la hipoxia; FNMT: feniletanolamina N metiltransferasa; IL6: interleuquina 6; IL10: interleuquina 10; NADPH oxidasa: nicotinamida adenina dinucleótido fosfato oxidasa; TNFα: factor de necrosis tumoral alfa.
Du Cheyron et al.11 analizaron la influencia del polimorfismo inserción (I)/deleción (D) de la ECA en un grupo de enfermos mayores de 18 años, de raza blanca, sin enfermedad renal crónica, admitidos a la UCI por diversas patologías (cardiovascular, n= 36; neurológica, n= 42; pulmonar, n= 52; traumática, n= 8; gastrointestinal, n= 20; y no especificada, n= 20). El análisis multivariado demostró que la edad mayor de 75 años, el SAPS II, la presencia de infección, la necesidad de vasopresores al ingreso en la unidad de cuidados intensivos (UCI) y el genotipo ii (homocigoto «inserción») se asociaron independientemente al desarrollo de DRA. Con el propósito de evaluar la funcionalidad de la variante génica se midió la actividad de la ECA en suero obtenido durante las primeras 24 horas del ingreso en la UCI. Encontraron que los enfermos con genotipo ii e ID presentaban niveles similares de ECA (20±14 vs 22±18 U; diferencia no significativa) pero significativamente menores a los hallados en pacientes DD (30± 23 U, P: <0,05 respecto a los otros grupos). Recientemente, Pedroso et al.12 analizaron la asociación entre los polimorfismos de la ECA I/D y el -262 A/T con la evolución del DRA, evaluada mediante el SOFA renal en un grupo de 153 pacientes mayores de 18 años admitidos en la UCI. Se excluyeron pacientes HIV positivos, embarazadas o en período de lactancia, o recibiendo tratamiento inmunosupresor. No encontraron asociación entre ninguno de los genotipos y la evolución del DRA ni en la necesidad de terapia de reemplazo renal.
CitoquinasJaber et al.13 analizaron la influencia de los SNP -308G/A del gen del factor de necrosis tumoral (TNF) α, y -1082 G/A del gen de la interleuquina (IL) 10 en la evolución de 67 pacientes hospitalizados que requirieron diálisis como tratamiento del DRA. El porcentaje de pacientes vivos a los 28 días del ingreso en función de la combinación de genotipos fue el siguiente: 71% para TNFα GG y IL 10 AA; 57% para TNFα GG y IL10 GG; 45% para TNFα AA o GA y IL10 GG y TNFα GA o AA y IL10 AA 17%. La influencia de los genotipos en la secreción de citoquinas fue evaluada ex vivo mediante estimulación de leucocitos obtenidos de los pacientes con endotoxina de Escherichia coli. Encontraron que los genotipos TNFα GA o AA se asociaron con una mayor concentración de TNFα respecto al GG (508 vs 161pg/ml; P: 0,002); de forma similar la concentración fue superior en pacientes con genotipo IL10 GG respecto al IL10 AA (41 vs 77pg/ml; P: 0,03).
Estrés oxidativoEn 200 individuos consecutivamente hospitalizados por DRA y en los cuales se consultó al nefrólogo, Perianayagam et al.14 analizaron la asociación entre los polimorfismos de la nicotinamida adenina dinucleótido fosfato oxidasa (NADPH oxidasa) p22phox +242C/T y la catalasa -262C/T respecto a la evolución clínica. Se excluyeron del estudio los pacientes en diálisis crónica, embarazo, que habían recibido un trasplante de órganos en el último año o que sufrían uropatía obstructiva. Hallaron que el alelo T (TT o CT) en la posición +242 del gen NADPHp22phox se asoció a una duración de la estancia hospitalaria más prolongada (17 vs 11 días, P: 0,02) y una mayor frecuencia del desenlace combinado hemodiálisis y/o mortalidad (ajustado por raza, sexo, edad, SAPS II e insuficiencia renal crónica). Contrariamente, el -262 de la catalasa no se asoció a ninguno de los eventos analizados. En plasma obtenido al momento del enrolamiento se encontró que las concentraciones de nitrotirosina eran mayores en los portadores del genotipo NADPH oxidasa p22phox +242 TT respecto a los portadores de genotipo CC.
Factor inducible por la hipoxia 1α (FIH)Kolyada et al.15analizaron la relación entre el SNP HIF1α +1772C/T y la evolución clínica en 241 pacientes hospitalizados por DRA. Los criterios de inclusión y exclusión fueron los mismos que en el trabajo previo de Perianayagam et al.14. El alelo T (CT o TT) se asoció a un incremento en los desenlaces combinados (a) riesgo de muerte y/o diálisis; y (b) muerte, diálisis y/o ventilación mecánica. Los niveles séricos del factor de crecimiento vascular derivado del endotelio (VEGF)-A en el momento de ser reclutado el paciente (54±7 vs 34±4pg/ml; p=0,008) también fueron mayores en el alelo mencionado.
Feniletanolamina N metiltransferasa (FNMT)Alam et al.16 estudiaron la influencia de los polimorfismos FNMT -161 G/A y +1543A/G en la susceptibilidad al DRA. Compararon 194 pacientes hospitalizados por DRA y en los cuales se consultó al nefrólogo versus 767 pacientes no hospitalizados sin afectación renal. Todos fueron adultos caucásicos. Se excluyeron pacientes embarazadas, en diálisis crónica, trasplantados en el último año o con evidencia de uropatía obstructiva. El alelo G del SNP FNMT +1543 se asoció a un incremento en la susceptibilidad de padecer DRA, aun cuando no influyó en la evolución. Contrariamente, el SNP -161A (AA o GA) se asoció a un mejor pronóstico (menor mortalidad). Los individuos portadores del haplotipo -161A/+1543A presentaron un menor riesgo de shock y de muerte. El genotipo FNMT -161 AA se asoció a una reducción en la concentración de adrenalina urinaria (AA 3,5ng/mg, GA 6,7ng/mg y GG 6,8ng/mg, P: 0,04). El nivel medio de noradrenalina tendió a ser mayor en el mismo genotipo (AA 29,1ng/mg; GA 16,7ng/mg y GG 11,8ng/mg, P: 0,94).
Pacientes sometidos a cirugía cardíacaEritropoyetina (EPO)Popov et al.17 analizaron la asociación entre el SNP rs1617640 de la EPO y la susceptibilidad del DRA en 481 pacientes caucásicos sometidos a cirugía cardiaca, sin antecedentes de reemplazo renal. Los pacientes homocigotos TT en el análisis univariado presentaron una mayor necesidad de reemplazo renal.
Sintasa de óxido nítrico endotelial (eNOS)Popov et al.18 encontraron en 497 pacientes de raza blanca, adultos, sometidos a cirugía de revascularización miocárdica, que el alelo C del SNP eNOS -786 se asoció a una disminución en el aclaramiento de creatinina postoperatoria (55,8±31,3 vs 62,1±35,8; P: 0,004) y a un aumento en la necesidad de técnicas de reemplazo renal. En este estudio se excluyeron los individuos mayores de 80 años con enfermedad neoplásica conocida, en diálisis crónica o trasplantados.
Apolipoproteina E (APO E)Mackensen et al.19 estudiaron la influencia del genotipo APOE y de la severidad de la ateromatosis aórtica en el desarrollo de DRA tras cirugía de revascularización miocárdica electiva en 130 pacientes. Excluyeron los individuos operados de emergencia, portadores de hepatopatía severa, accidente cerebro-vascular o enfermedad renal crónica. Las variables de función renal fueron similares entre los genotipos diferentes del ¿4 (¿2 o ¿3) y los ¿4. Sin embargo, la interacción entre APOE y severidad de la ateromatosis aórtica influyó en el máximo de creatinina sérica durante el postoperatorio. Es decir, a igual severidad en la ateromatosis aórtica evaluada por eco doppler esofágico, los portadores de genotipos APO distinto ¿4 tienen mayor concentración sérica de creatinina.
Catecol-O-metiltranferasa (COMT)Haase-Fielitz et al.20 estudiaron la influencia del SNP COMT +472 G/A en 260 pacientes caucásicos sometidos a cirugía cardíaca electiva. Se excluyeron los individuos medicados con inhibidores de la COMT o de la monoamino-oxidasa tipo A o B, nitritos, nitroprusiato sódico intravenoso o altas dosis de corticoides; pacientes con disfunción renal crónica; y pacientes sometidos a cirugía cardíaca de urgencia. Encontraron que el genotipo homocigoto AA se asoció a un mayor incremento de la concentración sérica de creatinina y en la necesidad de reemplazo renal en el postoperatorio. Los niveles séricos de adrenalina y noradrenalina a las 6 horas de la intervención fueron superiores entre los portadores del genotipo AA, a pesar de que no existían diferencias entre los 3 grupos en el preoperatorio.
Múltiples polimorfismos pertenecientes a distintas víasIsbir et al.21 hallaron que el alelo D de la ECA y los alelos distintos al ¿4 (¿2 o ¿3) en el gen de la APOE se asociaron, en el análisis univariado, a un incremento en el riesgo de padecer DRA en 248 pacientes tras el postoperatorio de revascularización miocárdica electiva. Sin embargo el SNP +1166 del gen que codifica para el receptor de angiotensina 1 (AT1) no influyó en el riesgo de DRA. También encontraron que los portadores del alelo ECA D presentaron concentraciones séricas significativamente mayores de ECA en el momento de la inducción de la anestesia y a las 12 horas de finalizada la intervención quirúrgica.
Stafford-Smith et al.22 publicaron un subanálisis del Perioperative Genetics and Safety Outcome Study. Excluyeron a los pacientes en diálisis crónica, de raza distinta a la caucásica o afroamericana y a 307 participantes por falta de datos clínicos. Incluyeron a 1.464 pacientes caucásicos y a 207 afroamericanos sometidos a cirugía de revascularización miocárdica electiva, analizando 12 polimorfismos pertenecientes a los genes ECA, angiotensinógeno (AGT), receptor de angiotensina (AT) 1, eNOS, IL6, TNFα y APOE. Tras ajustar el nivel de significación en función de las comparaciones múltiples, encontraron que en población caucásica la combinación de los polimorfismos AGT+842C y IL6 -572C se asoció a un mayor incremento en la diferencia de creatinina respecto a la preoperatoria. En población afroamericana ninguna diferencia llegó a la significación estadística.
DiscusiónEn la presente revisión encontramos que polimorfismos de 11 genes distintos se asocian a la susceptibilidad, gravedad o pronóstico del DRA en diferentes poblaciones, mientras que 4 entre los genes analizados no presentaron asociación. Se estudiaron 4.835 pacientes, con una media de participantes por estudio de 402. Solo 2 investigaciones16,22 incluyeron más de 900 participantes. La reproducibilidad de los polimorfismos analizados es escasa, limitándose al gen de la APO E19,21,22, ECA I/D con su receptor AT121,22, y ECA aisladamente11,12. Los resultados son difíciles de interpretar, pues los criterios de inclusión, los eventos finales observados, el tamaño muestral y el análisis estadístico son diferentes. Por ejemplo, 2 de los 3 estudios que incluyen a la APO E concluyen que los alelos distintos de ¿4 se asocian a una peor evolución. El tercer trabajo, cuyo número de participantes es casi 4 veces mayor, no encontró asociación. De forma similar, de los 4 trabajos que estudiaron al polimorfismo ACE I/D, uno encontró que el genotipo ii es el de riesgo11, otro que el alelo D es el de riesgo21, y en 2 no se encontró asociación12,22.
Las principales aplicaciones potenciales del análisis genético en la práctica clínica son:
- a.
Objetivación y cuantificación de riesgo. La aplicación de la información genómica en la estimación del riesgo de desarrollar DRA actualmente no es de uso rutinario a pesar que la fuerza de asociación (por ejemplo, evaluada mediante la odds ratio) de los factores genéticos y clínicos son relativamente similares. Por ejemplo, el rango de OR para los factores genéticos oscila entre 0,58 y 6,50, dependiendo del polimorfismo y evento analizado. Por otro lado, en un reciente trabajo que incluyó a 1.345 pacientes sometidos a cirugía torácica23 se encontró que los 4 factores clínicos independientemente asociados al DRA fueron (i) categoría de riesgo anestésico 3 o 4 de la Asociación Americana de Anestesia (OR 2,60 [1,03–6,55]), (ii) volumen espiratorio forzado en el primer segundo(OR 0,55 [0,32 - 0,96]), (iii) necesidad de vasopresores (OR 1,02 [1,0-1.03]) y (iv) duración de la anestesia (OR 1,04 [1,00–1,08]).
- b.
Generación de nuevos conocimientos etiológicos y fisiopatológicos. Identificar los polimorfismos que se asocian al DRA y cómo influyen en la expresión de los genes respectivos aumentará el conocimiento sobre la etiología y fisiopatología del DRA.
- c.
Terapia génica. Aún en fase experimental, ya se han probado varios procedimientos para conseguir la inserción de copias funcionales de genes defectuosos o ausentes en el genoma de un individuo24. Por ejemplo, la transfección del gen Bcl-2 en riñón de ratas con el objetivo de reducir el daño inducido por isquemia/reperfusión mediante la modulación de la vías de la apoptosis y la necrosis25.
- d.
Farmacogenética. El análisis de la variabilidad de la respuesta a un fármaco en función del genotipo del individuo puede ayudar a alcanzar el mayor beneficio terapéutico y minimizar los efectos adversos10. Por ejemplo, el último paso en la formación de la adrenalina desde la noradrenalina está mediado por la enzima FNMT. Alam et al.16 encontraron que el alelo A del SNP -161 FNMT se asocia a una menor mortalidad y que los homocigotos AA presentaron menores niveles urinarios de adrenalina y mayores de noradrenalina. Por tanto, se podría plantear que los individuos portadores del polimorfismo SNP -161AA en el gen FNMT se beneficiarían del uso de fármacos vasoactivos no catecolaminérgicos en lugar de fármacos catecolaminérgicos. El SNP COMT +472 G/A, que determina la sustitución del aminoácido valina por metionina en el codón 158, disminuye la concentración de la enzima y propicia su transformación en una forma termolábil22,26. Dado que la COMT es esencial para la degradación de las catecolaminas en el riñón, el hallazgo de Haase-Fielitz et al.20 de que el genotipo AA se asocia a mayor riesgo de DRA y shock, podría estar asociado al fenómeno de desensibilización de las catecolaminas. Esta interpretación está apoyada por el hecho de que la concentración sérica de adrenalina y noradrenalina a las 6 horas de la cirugía fueron mayores. La asociación génica descrita y la hipótesis fisiopatológica planteada, de confirmarse, también sería relevante, pues los pacientes con este tipo de genotipos podrían formar otro grupo que se beneficiase del uso de vasopresores no catecolaminérgicos.
A pesar de las potenciales aplicaciones de este nuevo conocimiento genético, la información aún es parcial y difícil de interpretar. Por ejemplo, el estrés oxidativo es un importante mecanismo etiopatogénico en el DRA. El SNP p22phox +242C/T, que determina la sustitución del aminoácido histidina por tirosina en la posición 72 del polipéptido, modula la afinidad de unión al grupo hem y por tanto la actividad de la enzima27–29. El alelo T se asocia a una menor actividad respiratoria en células endoteliales28 y en neutrófilos humanos29. Sin embargo, los estudios que han analizado la influencia del SNP +242 en los biomarcadores de lipoperoxidación han encontrado resultados disímiles. La nitrotirosina es el producto de la nitración de la tirosina por especies reactivas del nitrógeno tales como el anión peroxinitrito y dióxido de nitrógeno, por lo cual es considerada un marcador del estrés oxidativo dependiente del óxido nítrico. Paradójicamente, en el estudio de Perianayagam et al.14 se encontró que el genotipo NADPH oxidasa p22phox +242 TT se asoció a mayores niveles de nitrotirosina. El grupo de investigadores plantearon como posible explicación la existencia de un ligamiento entre este SNP y otro polimorfismo, desconocido en el momento actual, que fuese realmente el responsable de ejercer la influencia genética.
Un segundo ejemplo de las dificultades existentes en la interpretación de los resultados lo constituye el SNP FIH 1α +1772. La hipoxia representa un papel en el desarrollo del DRA. El FIH 1α se activa ante el déficit de oxígeno y estimula un conjunto de genes cuyo objetivo es aumentar la resistencia celular ante la hipoxia30. El SNP HIF1α +1772C/T, que determina la sustitución del aminoácido prolina por serina en la posición 582 de la proteína, está asociado a un aumento en la transcripción del gen. El hallazgo de Kolyada et al.15 es inesperado dado que a priori el aumento en la expresión de este grupo de genes debería aumentar la resistencia ante la hipoxia. Es posible que el aumento en la expresión del gen genere una respuesta excesiva que podría perdurar en el tiempo aún después de resuelta la isquemia, y por lo tanto terminaría comportándose como una respuesta adversa o mal adaptativa.
La investigación clásica se centra en la identificación de los componentes de los sistemas biológicos31. El vertiginoso desarrollo tecnológico ha permitido un cambio en el paradigma hacia uno holístico, en el cual se consideran redes biomoleculares complejas en conjunto y se intenta explicar las patologías o los fenotipos en virtud de la interacción entre genoma, expresión génica y ambiente, de acuerdo con un abordaje de biología de sistemas. La aproximación por genes candidatos fue la estrategia empleada en todas las publicaciones consideradas. Esta metodología, de gran fortaleza al momento de interpretar los resultados, consiste en analizar la asociación entre polimorfismos de genes que integran las vías fisiopatológicas con un carácter observable. Sin embargo, los estudios se limitan a relativamente pocos polimorfismos. Los estudios que analizan todo el genoma (genome-wide association studies, GWAS) permiten la exploración global de las variantes incluidas en la secuencia nucleotídica y han sido exitosos para identificar asociaciones con numerosas enfermedades complejas32. Esta estrategia no ha sido empleada todavía en el DRA.
En los últimos años, los desafíos que presentan los estudios genéticos y genómicos se han expandido. En el DRA se requerirá el conocimiento de secuencias genómicas y exómicas y su caracterización funcional; del orden y magnitud de activación/inhibición de determinados genes; y de su interacción con los niveles de regulación epigenéticos y con el ambiente33–35.
ConclusionesLa estructura genética del paciente influye en la susceptibilidad del DRA así como en su gravedad y evolución una vez establecida. Este nuevo conocimiento podría ser empleado en la práctica clínica para (a) objetivar y cuantificar el riesgo, (b) generar nuevo conocimiento etiológico y fisiopatológico, (c) diseñar nuevos tratamientos basados en la terapia génica y (d) predecir la respuesta a determinados fármacos.
Actualmente, todos los trabajos publicados utilizan una aproximación por genes candidatos, lo cual limita sustancialmente la interpretación de los resultados. En el futuro, la realización de investigaciones capaces de analizar miles de polimorfismos de todo el genoma (GWAS) en gran número de personas, de distintas edades, razas y áreas geográficas podría mejorar el conocimiento actualmente disponible.
FinanciaciónLa investigación que ha dado lugar a estos resultados ha recibido financiación del Séptimo Programa Marco de la Unión Europea PM7/2010 en virtud del acuerdo de subvención n.° 26486 y la colaboración del: Instituto de Salud Carlos III (FIS 08/1726), Fundación Mutua Madrileña (AP /67842009) y Fundación Lilly-España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El Dr. Pablo Cardinal-Fernández es becario del Programa Marie Curie (PI-NET: ITTN 264864).