1) Evaluar la prevalencia de dolor durante 2 procedimientos de enfermería, y 2) analizar la utilidad de ciertos signos vitales y del índice biespectral (BIS) para detectar dolor.
MétodosEstudio prospectivo, observacional y analítico de medidas repetidas en pacientes con ventilación mecánica y sedación. Los procedimientos evaluados fueron la aspiración endotraqueal y la movilización con giro. El dolor se evaluó mediante la Behavioral Pain Scale. Valores≥3 se consideraron dolorosos. Se registraron distintos signos fisiológicos y los valores del BIS. Una variación porcentual>10% se consideró clínicamente relevante.
ResultadosSe analizaron 146 procedimientos en 70 pacientes. La prevalencia de dolor durante los procedimientos fue del 94%. Los signos vitales y los valores del BIS aumentaron significativamente durante los procedimientos respecto el reposo, pero solo la variación del BIS alcanzó relevancia clínica. En un subgrupo de pacientes que recibieron analgesia preventiva antes de los procedimientos, el dolor disminuyó significativamente respecto a los pacientes que no recibieron analgesia preventiva (−2 [RIQ: {−5}-0] vs. 3 [RIQ: 1-4]; p<0,001, respectivamente).
ConclusionesLos procedimientos evaluados son dolorosos. La variación de los signos vitales no es un buen indicador de dolor. La variación del BIS podría ser útil, pero precisa nuevas investigaciones. La administración de analgesia preventiva disminuye la prevalencia de dolor durante los procedimientos.
1) To assess the prevalence of pain during nursing care procedures, and 2) to evaluate the usefulness of certain vital signs and the bispectral index (BIS) in detecting pain.
MethodsA prospective, observational analytical study was made of procedures (endotracheal aspiration and mobilization with turning) in critically ill sedated patients on mechanical ventilation. The Behavioral Pain Scale was used to assess pain, with scores of ≥3 indicating pain. Various physiological signs and BIS values were recorded, with changes of >10% being considered clinically relevant.
ResultsA total of 146 procedures in 70 patients were analyzed. Pain prevalence during the procedures was 94%. Vital signs and BIS values increased significantly during the procedures compared to resting conditions, but only the changes in BIS were considered clinically relevant. In the subgroup of patients receiving preemptive analgesia prior to the procedure, pain decreased significantly compared to the group of patients who received no such analgesia (−2 [IQR: {−5}-0] vs. 3 [IQR: 1-4]; P<.001, respectively).
ConclusionsThe procedures evaluated in this study are painful. Changes in vital signs are not good indicators of pain. Changes in BIS may provide useful information about pain, but more research is needed. The administration of preemptive analgesia decreases pain during the procedures.
Entre el 50 y el 70% de los pacientes ingresados en los servicios de Medicina Intensiva (SMI) presentan dolor1,2. El dolor tiene consecuencias relevantes en el paciente crítico. Al margen de consideraciones éticas, el dolor es el recuerdo más desagradable que los pacientes refieren al alta del SMI3. Además, la presencia de dolor durante el ingreso en el SMI se asocia con una mayor incidencia de dolor crónico4, síndrome de estrés postraumático5 y, en general, peor calidad de vida6.
El dolor puede ser secundario a distintas causas: la enfermedad de base, las técnicas de monitorización y/o los procedimientos de enfermería, que son frecuentes e inevitables. Puntillo et al.7 evaluaron la percepción del dolor en más de 6.000 pacientes críticos conscientes sometidos a 6 procedimientos: movilización con giro, colocación de catéteres venosos centrales, retirada de drenajes torácicos, cura de heridas, aspiración endotraqueal y retirada de catéteres arteriales femorales. Concluyeron que todos estos procedimientos eran dolorosos y que la movilización era el que más.
El principal motivo para que el dolor no sea diagnosticado y, por lo tanto, tratado, es su falta de detección1,2. En el paciente consciente, la mejor manera de evaluar el dolor es la autoevaluación8. Sin embargo, muchos pacientes ingresados en los SMI no pueden comunicarse por distintos motivos: alteración del nivel de consciencia, uso de ventilación mecánica y/o uso de sedantes o bloqueantes neuromusculares. En estos pacientes, la autoevaluación del dolor no es viable y deben utilizarse otras herramientas. Actualmente disponemos de distintas escalas validadas9–14. La utilización sistemática de estas escalas ha demostrado un mejor manejo del dolor, un menor consumo de medicamentos analgésicos sedantes y mejores desenlaces clínicos15,16. Sin embargo, en pacientes con sedación profunda o bloqueantes neuromusculares, las conductas dolorosas no son fácilmente evaluables. Por ello, se ha propuesto la evaluación de distintos signos vitales, tales como la presión arterial y la frecuencia cardiaca (FC), para evaluar el dolor. Los resultados de los estudios son contradictorios17,18, por lo que en la actualidad no se recomienda su uso1,2.
Recientemente se ha propuesto el índice biespectral (BIS) como método objetivo para evaluar el dolor en pacientes no comunicativos. El BIS es un valor derivado del electroencefalograma que indica reactividad cerebral19. Algunos estudios evidencian que el BIS fluctúa en respuesta al dolor, incluso en pacientes profundamente sedados, lo que apoya su potencial utilidad para la detección de dolor en pacientes no comunicativos20.
La investigación del dolor durante los procedimientos de enfermería en pacientes críticos sedados es escasa, y la utilidad de los signos vitales y del BIS como indicadores de dolor no está bien definida. Con estas premisas, nos planteamos la realización de este estudio, cuyos objetivos fueron: 1) evaluar la prevalencia de dolor durante 2 procedimientos frecuentes de enfermería, y 2) evaluar la utilidad de los signos vitales y del BIS para detectar dolor durante los procedimientos mencionados.
Pacientes y métodosSe trata de un estudio prospectivo, observacional y analítico de medidas repetidas en una serie de pacientes médico-quirúrgicos. El estudio se realizó entre septiembre del año 2010 y abril del año 2011 en el SMI del Hospital de la Santa Creu i Sant Pau de Barcelona. El estudio fue aprobado por el Comité Ético de Investigación Clínica del hospital, y se llevó a cabo siguiendo las normas éticas establecidas en la Declaración de Helsinki de 201321. Dado que los pacientes no podían comunicarse, un miembro del equipo investigador obtuvo el consentimiento informado escrito de los representantes legales.
PacientesLos criterios de inclusión fueron: 1) mayores de 18 años; 2) ingresados en el SMI; 3) necesidad de ventilación mecánica y sedación farmacológica, y 4) precisar aspiración endotraqueal y/o movilización con giro.
Los criterios de exclusión fueron: 1) lesión cerebral aguda; 2) déficit cognitivo diagnosticado o enfermedad psiquiátrica descompensada; 3) tratamiento con bloqueantes neuromusculares; 4) limitación del esfuerzo terapéutico o muerte cerebral, y 5) sedación profunda (puntuación en la Richmond Agitation Sedation Scale [RASS] −5)22.
ProcedimientosLos 2 procedimientos que se evaluaron fueron: la aspiración endotraqueal y la movilización con giro. La selección de estos 2 procedimientos se basó en resultados obtenidos en estudios anteriores7,9, en los que se puso de manifiesto que se trataba de procedimientos potencialmente dolorosos.
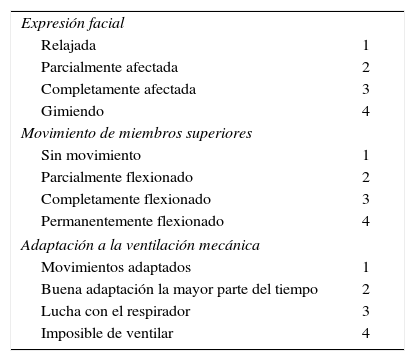
Variables e instrumentosLa presencia de dolor se evaluó mediante la escala Behavioral Pain Scale (BPS)9 (tabla 1). Se trata de una escala compuesta por 3 indicadores de comportamiento: la expresión facial, el movimiento de las extremidades superiores y la adaptación a la ventilación mecánica. Cada indicador tiene un rango de puntuación de entre 1 y 4. La puntuación total de la escala oscila entre 3 (ausencia de dolor) y 12 (máximo de dolor). Una puntuación de BPS >3 indica dolor y una puntuación de BPS≥5 indica dolor significativo23.
Behavioral Pain Scale
| Expresión facial | |
| Relajada | 1 |
| Parcialmente afectada | 2 |
| Completamente afectada | 3 |
| Gimiendo | 4 |
| Movimiento de miembros superiores | |
| Sin movimiento | 1 |
| Parcialmente flexionado | 2 |
| Completamente flexionado | 3 |
| Permanentemente flexionado | 4 |
| Adaptación a la ventilación mecánica | |
| Movimientos adaptados | 1 |
| Buena adaptación la mayor parte del tiempo | 2 |
| Lucha con el respirador | 3 |
| Imposible de ventilar | 4 |
Presencia de dolor con BPS >3. Presencia de dolor significativo con BPS ≥5.
Los signos vitales evaluados fueron los siguientes: presión arterial sistólica, presión arterial media, FC y frecuencia respiratoria (FR). Dichos signos se evaluaron a través de la monitorización continua a pie de cama (General Electric MD 15T®, Finlandia, General Electric Company. Solar TM 8000 M/i, Spanish), programada para un registro cada minuto.
El BIS es un sistema de monitorización no invasiva que mide diferentes índices electrocorticales a través de unos electrodos colocados en la frente del paciente. Su valor puede oscilar entre 0 (supresión completa del EEG) y 100 (completamente despierto), en función del nivel de consciencia del paciente. Concretamente, un valor BIS entre 90 y 100 se correlaciona con un buen estado de vigilia, valores entre 70 y 80 se correlacionan con una sedación leve, valores entre 60 y 70, con una sedación moderada, y puntuaciones entre 30 y 60, con una sedación profunda similar a la observada durante una anestesia general19. Los valores numéricos de BIS se obtuvieron de un monitor BIS VISTA™ (Aspect Medical Systems Inc., Newton, MA, EE. UU.). El monitor BIS VISTA™ convierte los datos en valores numéricos a intervalos de 5s.
El nivel de sedación se evaluó mediante la RASS22. Se trata de una escala validada para medir la profundidad de la sedación y la agitación en pacientes adultos con ventilación mecánica. La RASS tiene un rango de valores que oscila entre −5 (paciente que no responde a estímulos) y +4 (paciente que se muestra combativo).
ProtocoloLa inclusión de pacientes se realizó en función de la disponibilidad de la investigadora principal (IP). Todas las evaluaciones fueron realizadas por la IP del estudio, enfermera previamente entrenada en el uso de la escala BPS en más de 100 pacientes. Las enfermeras responsables del cuidado del paciente llevaron a cabo los procedimientos de acuerdo con las necesidades de este y siguiendo los protocolos de actuación del SMI. En ciertos casos, y en función de la situación clínica de los pacientes, se administró medicación analgésica y sedante antes de los procedimientos.
Se evaluaron un máximo de 4 procedimientos por paciente y se estableció un periodo mínimo de reposo de 30min entre 2 procedimientos evaluables realizados a un mismo paciente.
Los pacientes fueron evaluados en 3 tiempos. Se realizó una evaluación basal en reposo al menos 30min antes de iniciar el procedimiento de enfermería (T0). Se realizó una nueva evaluación 5min antes del inicio del procedimiento, que consideramos preprocedimiento (T1), y se realizó una tercera evaluación durante el procedimiento (T2).
La IP registró la hora exacta en que se realizó el registro de cada tiempo de estudio.
En el tiempo T0 se recogieron los datos demográficos (edad, sexo) y las variables relacionadas con el régimen terapéutico, incluyendo el nivel de sedación (RASS) y los fármacos analgésicos y sedantes administrados en perfusión continua y/o en bolo intermitente durante las 4h anteriores a la recogida de datos. Este periodo se consideró el tiempo medio de semivida de eliminación de los fármacos incluidos en el protocolo de analgesia y sedación del SMI. Siguiendo las instrucciones del fabricante, la IP preparó la piel de la frente del paciente con alcohol isopropílico y colocó los sensores del BIS. Una vez asegurada la impedancia de los electrodos y una buena calidad de la señal, se conectó el monitor BIS para la recopilación de datos.
Para la evaluación de conductas dolorosas con la BPS, en el T0 y en el T1 la IP observó previamente al paciente durante un minuto, y en el T2, la evaluación de las conductas dolorosas se realizó durante el procedimiento.
Al finalizar el procedimiento se registró la media de los valores absolutos de presión arterial sistólica, presión arterial media, FC y FR a través de los datos obtenidos de la monitorización continua, y se transfirieron los datos del índice BIS a un ordenador con un cable de puerto serie. Los datos del BIS se seleccionaron a partir del registro de la hora de evaluación, calculando un retraso de un minuto entre el momento de la estimulación y el valor del índice BIS.
Análisis de datosLa normalidad en la distribución de las variables se verificó mediante la prueba de Kolmogórov-Smirnov.
Las variables categóricas (sexo, diagnóstico, tipo de analgesia y sedación, y analgesia y sedación preventiva) se expresaron como porcentajes y número de casos. Las variables cuantitativas (BPS, presión arterial sistólica, presión arterial media, FC, FR y BIS) se expresaron como medianas y rango intercuartil (RIQ1-RIQ3).
Para evaluar si se puede predecir la presencia de dolor a través de la observación de los indicadores de comportamiento doloroso y de los indicadores fisiológicos se compararon las puntuaciones de la BPS, los valores absolutos de los signos vitales y los valores del BIS, antes (T1) y durante (T2) los procedimientos, mediante la prueba U de Mann-Whitney.
Para evaluar el efecto del dolor presente antes de los procedimientos sobre el dolor durante los procedimientos se creó una nueva variable: la diferencia media en las puntuaciones de la escala BPS entre el T1 y el T2. Los valores se expresaron como mediana y RIQ.
Para evaluar la relevancia clínica de las diferencias se analizó la variación de los signos vitales y del BIS en forma de cambio porcentual. Los valores se expresaron como mediana y RIQ. Con base en resultados previos de otros estudios24, decidimos a priori que se consideraría clínicamente relevante un cambio porcentual igual o mayor al 10%.
La comparación de los signos vitales y del BIS entre T1 y T2 se realizó mediante el test de Wilcoxon.
Finalmente, se realizó un análisis de subgrupos para comparar los efectos de la administración o no, de analgesia y sedación preventiva. Para ello, se compararon las puntuaciones de la escala BPS y los cambios porcentuales del BIS entre los pacientes que habían recibido analgesia y sedación preventiva y los que no la habían recibido mediante la prueba U de Mann-Whitney.
Se utilizó una aproximación bilateral y se estableció un nivel de significación estadística de 5% (α=0,05). Los datos fueron analizados mediante el programa SPSS® versión 21.0.
ResultadosCaracterísticas basales de los pacientesLas características basales de los pacientes se muestran en la tabla 2. Se evaluaron un total de 146 procedimientos (84 aspiraciones endotraqueales y 62 movilizaciones) en 70 pacientes. No se observaron diferencias estadísticamente significativas entre la aspiración endotraqueal y la movilización. El tiempo medio de duración del procedimiento de aspiración de secreciones fue de 8s y el tiempo medio de la movilización fue de 4min.
Características basales de la población (n=70)
| Edad en años, mediana (RIQ) | 71 (62-79) |
| Sexo, n (%) | |
| Mujeres | 25 (36) |
| Varones | 45 (64) |
| Motivo de ingreso, n (%) | |
| Médico | 7 (10) |
| Quirúrgico | 63 (90) |
| BPS, n (%) | |
| =3 | 27 (39) |
| >3 | 43 (61) |
| ≥5 | 23 (33) |
| RASS, n (%) | |
| ≥+1 | 11 (15) |
| De 0 a −2 | 22 (32) |
| De −3 a −4 | 37 (53) |
| BIS, mediana (RIQ) | 62 (50-72) |
| Analgesia, n (%) | |
| Sin analgesia | 4 (6) |
| Morfina pc | 42 (60) |
| Remifentanilo pc | 3 (4) |
| Analgesia en bolo | 11 (16) |
| Paracetamol o AINE | 14 (20) |
| Otros | 4 (6) |
| Sedación, n (%) | |
| Propofol pc | 37 (53) |
| Midazolam pc | 31 (44) |
| Sedación en bolo | 28 (40) |
| Combinación de varios medicamentos | 2 (3) |
AINE: antiinflamatorios no esteroideos; BIS: índice biespectral; BPS: Behavioral Pain Scale; pc: perfusión continua; RASS: Richmond Agitation Sedation Scale; RIQ: rango intercuartil.
El 61% de los pacientes presentaban dolor en reposo (T0), con una BPS mediana de 4 (RIQ: 3-5). El 33% de los pacientes presentaban dolor significativo (BPS≥5).
El dolor durante los procedimientosEn un 94% de los procedimientos evaluados se observaron conductas dolorosas, con una BPS mediana de 6 (RIQ: 5-8). En el 86% de los procedimientos, el dolor se calificó como significativo (BPS≥5). No hubo diferencias significativas respecto a la BPS entre la movilización con giro y las aspiraciones endotraqueales (6 [5-8] vs. 7 [6-8]; p=0,146, respectivamente).
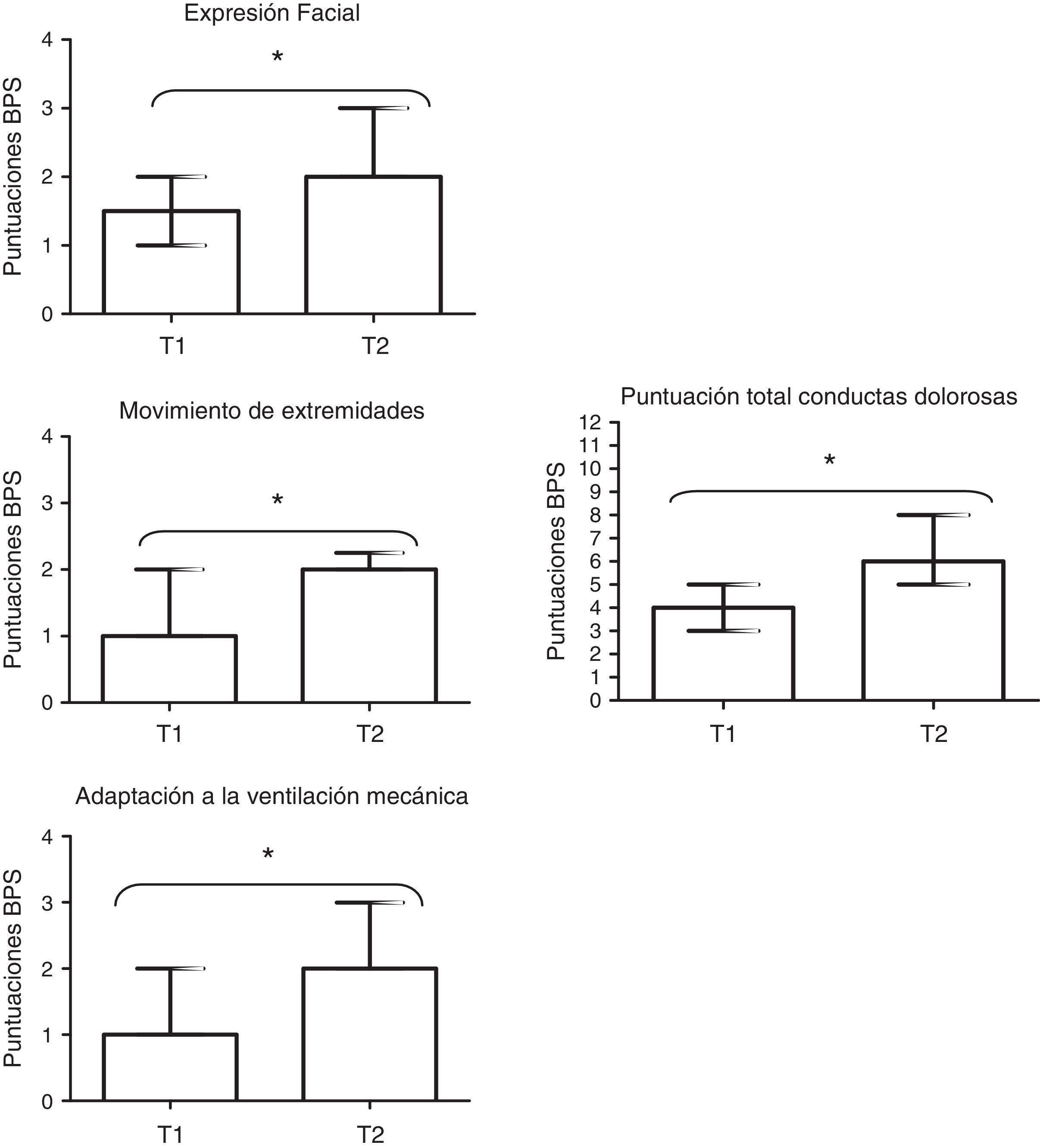
La comparación de las puntuaciones conductuales del dolor antes (T1) y durante (T2) los procedimientos se muestran en la figura 1. Tanto la comparación global (4 [3-5] vs. 6 [5-8]; p<0,001, respectivamente) como las comparaciones parciales; la expresión facial (2 [1-2] vs. 2 [2-3]; p<0,001, respectivamente), el movimiento de las extremidades (1 [1-2] vs. 2 [2-2]; p<0,001, respectivamente) y la adaptación a la ventilación mecánica (1 [1-2] vs. 2 [2-3]; p<0,001, respectivamente) fueron estadísticamente significativas.
Los pacientes que presentaban dolor (BPS>3) en reposo (T0) refirieron más dolor durante los procedimientos (T2) que aquellos que no lo presentaban (BPS=3) (7 [6-8] vs. 6 [5-8]; p=0,012, respectivamente).
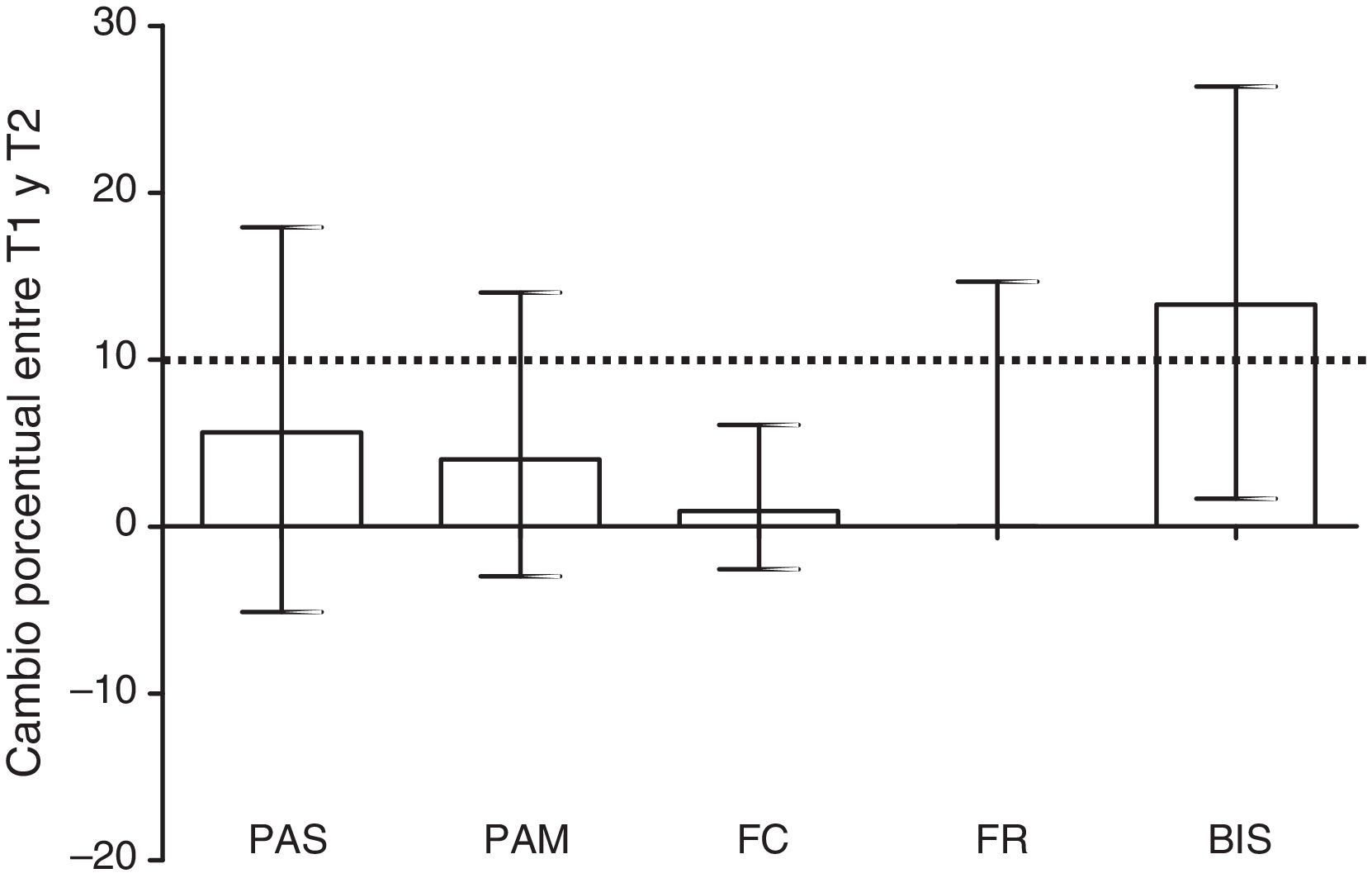
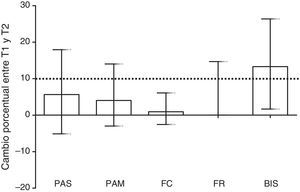
Signos vitales y Indice Biespectral durante los procedimientosLos signos vitales (presión arterial sistólica, presión arterial media, FC y FR) y el BIS aumentaron significativamente de T1 a T2 (108 [94-121] vs. 118 [102-132]; p<0,001, 73 [62-80] vs. 76 [67-85]; p<0,001, 88 [76-108] vs. 90 [80-108]; p=0,002, 16 [12-20] vs. 17 [13-22]; p<0,001, 58,5 [47-72] vs. 71 [59-80]; p<0,001, respectivamente). Sin embargo, el cambio porcentual solo fue clínicamente relevante (≥10%) para los valores del BIS (13% [RIQ: 2-26%]) (fig. 2). La variación del BIS fue ≥10% en un 72% de las observaciones de conductas dolorosas.
Cambio porcentual de los distintos signos vitales y del BIS entre el tiempo preprocedimiento (T1) y el procedimiento (T2).
La línea discontinua marca el 10%, que es el valor que se consideró a priori como clínicamente relevante. Tan solo los valores del BIS fueron clínicamente relevantes. Los valores se expresan como mediana y rango intercuartil.
BIS: índice biespectral; FC: frecuencia cardiaca; FR: frecuencia respiratoria; PAM: presión arterial media; PAS: presión arterial sistólica.
Antes de los procedimientos, y de acuerdo con el criterio de la enfermera y/o el médico responsable, se administró analgesia preventiva en un 7% de los procedimientos y sedación preventiva en un 21% (tabla 3).
Efectos de la analgesia y la sedación preventiva sobre el dolor y el índice biespectral
| Analgesian=10 (7%) | Sin analgesian=136 (93%) | p | |
|---|---|---|---|
| BPS basal | 5 (3-6) | 4 (3-5) | 0,179 |
| BPS preprocedimiento (T1) | 7 (5-9) | 4 (3-5) | 0,001 |
| BPS procedimiento (T2) | 4 (4-6) | 6 (6-8) | <0,001 |
| Diferencia T1-T2 | −2 ([−5]-0) | 3 (1-4) | <0,001 |
| Cambio % BIS T1-T2 | 5 ([−40]-18) | 16 (3-37) | 0,021 |
| Sedaciónn=31 (21%) | Sin sedaciónn=115 (79%) | p | |
|---|---|---|---|
| BPS basal | 4 (3-5) | 4 (3-5) | 0,086 |
| BPS preprocedimiento (T1) | 5 (4-7) | 4 (3-5) | <0,001 |
| BPS procedimiento (T2) | 6 (4-7) | 6 (6-8) | <0,82 |
| Diferencia T1-T2 | 1 ([−3]-3) | 3 (1-4) | 0,001 |
| Cambio % BIS T1-T2 | −5 ([−40]-7) | 20 (9-37) | <0,001 |
BPS: Behavioral Pain Scale.
Valores expresados como mediana (rango intercuartil).
Respecto a la analgesia, los pacientes que recibieron un bolo preventivo de analgesia antes de los procedimientos presentaron una disminución significativa de dolor entre T1 y T2 respecto a aquellos que no recibieron analgesia preventiva (−2 [RIQ: {−5}-0] vs. 3 [RIQ: 1-4]; p<0,01, respectivamente).
Así mismo, los pacientes que recibieron un bolo preventivo de analgesia antes de los procedimientos presentaron una variación del BIS estadísticamente menor y clínicamente no relevante respecto a aquellos que no recibieron analgesia (5% [RIQ: {−40}-18%] vs. 16% [RIQ: 3-37%]; p=0,021, respectivamente).
Respecto a la sedación, los pacientes que recibieron un bolo adicional de sedación antes de los procedimientos presentaron un aumento del dolor entre T1 y T2, pero significativamente menor que aquellos que no recibieron sedación preventiva (1 [RIQ: {−3}-3] vs. 3 [RIQ: 1-4]; p<0,001, respectivamente).
Así mismo, los pacientes que recibieron un bolo adicional de sedación antes de los procedimientos también presentaron una variación del BIS estadísticamente menor y clínicamente no relevante respecto a aquellos que no recibieron analgesia (−5% [RIQ: {−40}-7%) vs. 20% [RIQ: 9-37%]; p<0,001, respectivamente).
DiscusiónLos resultados principales de este estudio son: 1) los pacientes en nuestro SMI presentan dolor en reposo; 2) la movilización con giro y la aspiración endotraqueal son 2 procedimientos dolorosos; 3) los signos fisiológicos no son de utilidad para evaluar el dolor; 4) la variación del BIS podría ser de utilidad para evaluar el dolor, y 5) la analgesia preventiva podría disminuir el dolor durante los procedimientos.
El dolor en reposoEn nuestra serie de pacientes, el 61% presentan dolor (BPS>3) en reposo y el 33% presentan dolor significativo (BPS≥5). Este elevado porcentaje no es sorprendente y difiere poco del mostrado en la literatura sobre prevalencia de dolor en reposo en pacientes críticos que no pueden comunicarse. Chanques et al.15 reportan un 63% de pacientes con dolor significativo en reposo en una serie de pacientes quirúrgicos. Esta cifra se reduce a un 42% tras la implementación de una intervención educativa para enfermeras y médicos en la que se mejoró la detección de dolor y la administración de tratamiento analgésico. Otros estudios han demostrado que un control objetivo de la analgesia, la sedación y el delirio mejora su detección y tratamiento25.
A pesar de que el uso de estas escalas es sencillo, su implementación en la práctica clínica habitual es escasa23 y la incidencia de dolor en reposo sigue siendo elevada. Los estudios muestran diferencias importantes entre la práctica clínica y las recomendaciones actuales1,2. Además, cabe preguntarse si los profesionales estamos bien instruidos para evaluar las conductas dolorosas. En un estudio reciente26, los autores evaluaron la fiabilidad interobservador de la escala BPS en reposo y durante un procedimiento doloroso. En sus resultados, la subescala de expresión facial en reposo mostró una mala concordancia y una baja correlación. Estos resultados evidencian la necesidad de una formación previa suficiente y un nivel mínimo de experiencia para una valoración adecuada del dolor a través de indicadores de conductas.
Por lo tanto, este enfoque podría ser útil para desarrollar programas educativos apropiados, así como futuras directrices, para la gestión de la sedación y la analgesia en los SMI. Se debería hacer hincapié en la necesidad de evaluar el dolor con las escalas validadas de que disponemos para identificarlo y tratarlo9–14.
El dolor durante los procedimientos de enfermeríaLos pacientes críticos son sometidos a múltiples procedimientos diagnósticos y terapéuticos realizados por enfermería, y la mayoría de ellos refieren experiencias de dolor durante los procedimientos incluso varios años después27. Nuestros resultados muestran que los procedimientos que estudiamos fueron dolorosos en la mayoría de los pacientes. Este porcentaje concuerda con los resultados reportados recientemente en el estudio Europain®28. Los autores evaluaron el dolor en 3.850 pacientes conscientes de 192 UCI en 28 países. Sus resultados muestran un aumento significativo del dolor desde el inicio hasta el momento de realización de los 12 procedimientos estudiados, incluyendo la movilización y la aspiración endotraqueal. Además, mostraron cómo el dolor preprocedimiento era un factor de riesgo asociado a una mayor intensidad de dolor durante los procedimientos. Los autores concluyen que un buen control del dolor en reposo podría disminuir el dolor durante los procedimientos.
Utilidad de los signos vitales y el índice biespectral en la evaluación del dolorEn los pacientes que no pueden comunicarse con los profesionales, varios signos vitales se han planteado para evaluar el dolor. Sin embargo, los signos vitales no son específicos de dolor y pueden estar influidos por la administración de fármacos (por ejemplo, vasopresores, betabloqueantes, antiarrítmicos) o la enfermedad (sepsis). De hecho, varios estudios han demostrado que estos parámetros aumentan tanto durante procedimientos dolorosos como no dolorosos29 y/o permanecen sin cambios durante procedimientos evaluados como dolorosos con escalas validadas30. Nuestros resultados muestran cambios significativos en todos los signos vitales y las puntuaciones del BIS, pero solo estos últimos fueron clínicamente relevantes. Por lo tanto, nuestros datos refuerzan la evidencia de no recomendar la utilización de los signos vitales aisladamente para evaluar las conductas dolorosas en pacientes que no pueden comunicarse verbalmente1,2.
El BIS se ha utilizado para monitorizar los niveles de consciencia en pacientes bajo sedación y anestesia19. Estudios anteriores en pacientes críticos han mostrado que los incrementos transitorios de entre el 5 y el 20% de los valores del BIS pueden estar asociados con dolor17,18. Sin embargo, múltiples factores (por ejemplo, los estímulos táctiles o los auditivos) pueden interferir en esta variación. Algunos autores apoyan la idea de que si se controlan estos factores, el BIS podría ser útil18. Aun así, nuestros resultados concuerdan con los ya publicados y apoyan la idea de que la variación del BIS puede ser una herramienta útil en la evaluación del dolor, aunque se requieren nuevos estudios que confirmen este planteamiento.
Analgésicos y sedantes adicionales antes de los procedimientosLa mayoría de los pacientes ingresados en un SMI reciben algún tipo de medicamento analgésico. Según un estudio francés23, en el segundo día de ingreso, el 72% de los pacientes recibían algún medicamento analgésico, en el cuarto día el porcentaje era del 55%, y en el sexto día, del 50%. En nuestra serie de pacientes, prácticamente todos recibieron algún tipo de analgesia. Sin embargo, las dosis de medicación utilizadas no parecen suficientes para calmar el dolor en reposo y son claramente insuficientes para evitar el dolor durante los procedimientos de enfermería.
Por este motivo, la analgesia preventiva antes de realizar un procedimiento podría ser una buena estrategia. En nuestra serie, solo en el 7% de los procedimientos la enfermera o el médico decidieron administrar analgesia preventiva. Esta práctica poco extendida en nuestro medio está en concordancia con distintos estudios observacionales multicéntricos y multinacionales7,28.
Según nuestro conocimiento, la eficacia de la analgesia preventiva solo se ha evaluado en 3 procedimientos: la retirada del catéter femoral31, la aspiración de secreciones32 y la retirada del drenaje torácico33–36. Los resultados de estos estudios no son concluyentes.
Fulton et al.31 evaluaron la eficacia de la administración de morfina, fentanilo, lidocaína subcutánea o placebo antes de la retirada del catéter arterial femoral en 130 pacientes sometidos a un cateterismo cardiaco. No encontraron diferencias respecto a la percepción del dolor. Concluyeron que el procedimiento no era lo suficientemente doloroso para que la analgesia preventiva mostrara sus beneficios.
Brocas et al.32 evaluaron el efecto de la administración preventiva de alfentanilo antes de la aspiración a través del tubo endotraqueal sobre el BIS en 10 pacientes críticos con ventilación mecánica. El valor del BIS aumentó significativamente en las aspiraciones realizadas sin analgesia preventiva respecto a las realizadas tras la administración preventiva de alfentanilo. Los autores concluyeron que la analgesia preventiva era eficaz en la disminución del dolor evaluada mediante el BIS.
Puntillo y Ley33 evaluaron la eficacia de la administración de morfina, ketorolaco o la información sobre el procedimiento al paciente antes de la retirada del drenaje torácico en 75 enfermos sometidos a cirugía cardiaca. Tampoco encontraron diferencias entre los distintos grupos respecto a la percepción de dolor, y también concluyeron que probablemente el proceso no era lo suficientemente doloroso para que la analgesia preventiva pudiera mostrar sus beneficios. Sin embargo, en otros estudios, los pacientes que antes de la retirada de los drenajes torácicos habían recibido morfina intravenosa más ejercicios de relajación34, sulfentanilo o fentanilo35 o valdecoxib tópico36, manifestaron puntuaciones de dolor estadísticamente más bajas.
Es fácil pensar que los pacientes ingresados en los SMI querrían tratar su dolor de manera preventiva farmacológicamente o no farmacológicamente antes de otros procedimientos dolorosos. De ahí que actualmente se recomiende la analgesia preventiva y/o las intervenciones no farmacológicas para aliviar el dolor en pacientes adultos antes de la retirada de un drenaje torácico, y que se aconseje su uso para otros procedimientos potencialmente dolorosos1. Además, debemos tener presente que la administración de medicación analgésica, principalmente opioides y AINE, pueden presentar efectos secundarios.
Bajo estas dos consideraciones, distintos autores han propuesto el concepto de analgesia dinámica. Esta podría permitir la disminución de la dosis de analgesia en reposo y su aumento antes de los procedimientos potencialmente dolorosos. La idea sería parecida a la utilizada para evitar la acumulación de medicamentos sedantes. Estrategias como «sedación secuencial», «sedación dinámica» o «interrupción diaria de la sedación» han mostrado su eficacia en la prevención de las complicaciones relacionadas con la sedación prolongada1,2.
Respecto al uso de medicación sedante antes de los procedimientos, nuestros resultados muestran que no es tan eficaz como la analgesia para evitar el dolor. El dolor puede causar agitación o inquietud en el paciente crítico y su tratamiento debería ser la analgesia y no la sedación.
Limitaciones del estudioEl estudio presenta varias limitaciones. En primer lugar, se trata de un estudio monocéntrico en pacientes sedados con ventilación mecánica y mayoritariamente quirúrgicos, por lo que los resultados no pueden ser aplicados a otro tipo de pacientes. En segundo lugar, no se evaluó un procedimiento no doloroso que nos sirviera de grupo control. Este nos hubiera ayudado a discriminar entre el efecto del procedimiento per se y el simple efecto de interaccionar con el paciente. En tercer lugar, no se realizó una evaluación después de finalizar los procedimientos, datos que nos podrían haber ayudado a ver la evolución del dolor asociado a los procedimientos. En cuarto lugar, el número de pacientes que recibieron analgesia preventiva fue pequeño, por lo que no podemos extraer conclusiones definitivas sobre estos resultados parciales.
ConclusionesLos pacientes críticos sin capacidad de comunicarse siguen presentando dolor en reposo. Además, la movilización con giro y la aspiración endotraqueal son 2 procedimientos dolorosos. La detección y el tratamiento del dolor basal, potenciado con maniobras rutinarias, confirma la utilidad de las escalas clínicas y aconseja el uso de analgesia preventiva y el uso extendido del BIS.
FinanciaciónEste estudio no tiene ningún tipo de financiación.
Conflicto de interesesNo existen conflictos de interés.
Damos las gracias a Kathleen Puntillo, RN, PhD, FAAN, FCCM, profesora emérita y de investigación del Departamento Científico de Enfermería Fisiológica de la Universidad de California, San Francisco (UCSF), por sus valiosos comentarios sobre este artículo.