El traumatismo craneoencefálico grave es una entidad clínica con gran repercusión en términos socioeconómicos y de salud pública. Pese a los avances obtenidos en el ámbito del diagnóstico y tratamiento, no se han consolidado modelos predictivos suficientemente fiables que permitan desarrollar ensayos clínicos e impulsen estrategias terapéuticas efectivas que mejoren su pronóstico. En este sentido, durante las últimas décadas se han estudiado diversos biomarcadores de lesión cerebral con el fin de establecerlos como herramientas diagnósticas y pronósticas de la lesión traumática cerebral. Sin embargo, todos ellos presentan alguna limitación que impide su aplicación universalizada. Es necesario analizar las propiedades de los biomarcadores conocidos hasta la fecha, tanto los que tradicionalmente han demostrado correlación con la gravedad y pronóstico como aquellos que recientemente se anuncian prometedores. Para ello, convendría diseñar nuevos estudios que definan sus propiedades de forma aislada y que diluciden el papel de su uso combinado.
Severe head injuries have a great socioeconomic and public health impact. Despite progress in diagnosis and treatment, no sufficiently reliable predictive models have been established for developing clinical trials and promoting effective therapeutic strategies capable of improving the prognosis. In the last decades, several brain damage biomarkers have been studied as potential diagnostic and prognostic tools in traumatic brain injury. However, all of them have limitations that preclude their universalized application. The properties of the known biomarkers –both those traditionally shown to correlate with severity and prognosis, and those recently announced as promising options– should be analyzed. New studies are needed to define their properties, both isolatedly and in combined use.
El traumatismo craneoencefálico (TCE) grave continúa siendo un problema importante de salud pública debido a la elevada tasa de resultados desfavorables en los que deriva (muerte y secuelas invalidantes) y a los altos costes que genera su atención sanitaria, las indemnizaciones, las pensiones vitalicias y la pérdida de años trabajados, puesto que incide sobre un grupo poblacional fundamentalmente activo1,2.
Considerándose la lesión cerebral traumática una entidad extremadamente compleja3, son muchos los avances logrados en los últimos años en el campo del diagnóstico, la monitorización y el tratamiento4,5. No obstante, dada la heterogeneidad del TCE grave, quedan importantes lagunas en el conocimiento de la fisiopatología y en la obtención de modelos predictivos fiables que nos indiquen de forma precoz la evolución posterior de los pacientes, con el objeto de perfeccionar las estrategias diagnósticas y terapéuticas de una manera individualizada. Asimismo, son necesarios modelos pronósticos válidos en el TCE grave para fijar objetivos de eficacia a la hora de ensayar nuevos fármacos o estrategias de tratamiento, ya que los objetivos primarios habituales de muerte y discapacidad, como muchos autores han señalado, no son adecuados para esta afección y pueden explicar el fracaso de ciertos fármacos promisorios6.
Por ello, al igual que en otros procesos como la cardiopatía isquémica, se investigan marcadores biológicos que pudiesen expresar con más precisión la extensión y la gravedad de la lesión cerebral traumática, independientemente del substrato biológico previo y de otras circunstancias que acompañen al TCE grave, homogeneizando de esta forma distintas categorías de pacientes. Ello facilitaría no solo la individualización de la intensidad y la precocidad del manejo, sino el desarrollo de terapias dirigidas a evitar la instauración de dicha lesión y a potenciar un efecto neuroprotector que evite o minimice el daño secundario.
En el presente artículo hacemos una revisión crítica de los principales biomarcadores cerebrales estudiados hasta la fecha actual.
Biomarcadores de lesión cerebralSe entiende por biomarcador aquel indicador biológico cuantificable específico de un estado fisiológico o patológico. Vos concluye que el uso de biomarcadores contribuye al mejor conocimiento de la fisiopatología del daño cerebral, aportando información complementaria esencial para el diagnóstico y la predicción pronóstica de estos pacientes7. Sin embargo, la definición de un marcador de lesión cerebral precisa de una serie de matices que lo diferencian de otras afecciones, pues el sistema nervioso central (SNC) es una entidad compleja que puede presentar múltiples tipos de lesión, que, a su vez, pueden afectar a diversas células diana con diferentes estratos de gravedad. Además, la existencia de la barrera hematoencefálica (BHE) condiciona las características estructurales de dichos biomarcadores, que deben atravesarla para poder ser liberados al torrente sanguíneo.
Hace ya más de 20 años se describió el marcador ideal para el TCE, definiéndolo como aquel que presente alta especificidad y sensibilidad por el tejido cerebral, siendo liberado únicamente tras una lesión irreversible del tejido cerebral y mostrándose en líquido cefalorraquídeo (LCR) y sangre rápidamente tras el daño. Debe reflejar, además, la extensión y la gravedad de dicha lesión siguiendo un curso temporal conocido. A su vez, las variaciones entre los grupos de edad y sexo han de ser mínimas. Las herramientas para el análisis y la detección inmediata deben estar disponibles y ser reproducibles. Por último, y con mayor importancia, su determinación debe tener relevancia clínica. Cabe resaltar que los biomarcadores son elementos dinámicos con cambios que responden a diferentes estados inflamatorios, fenómenos de necrosis tisular y lesiones por estrés oxidativo3. Por tanto, es necesario realizar mediciones seriadas en lugar de determinaciones aisladas para que adquieran significación.
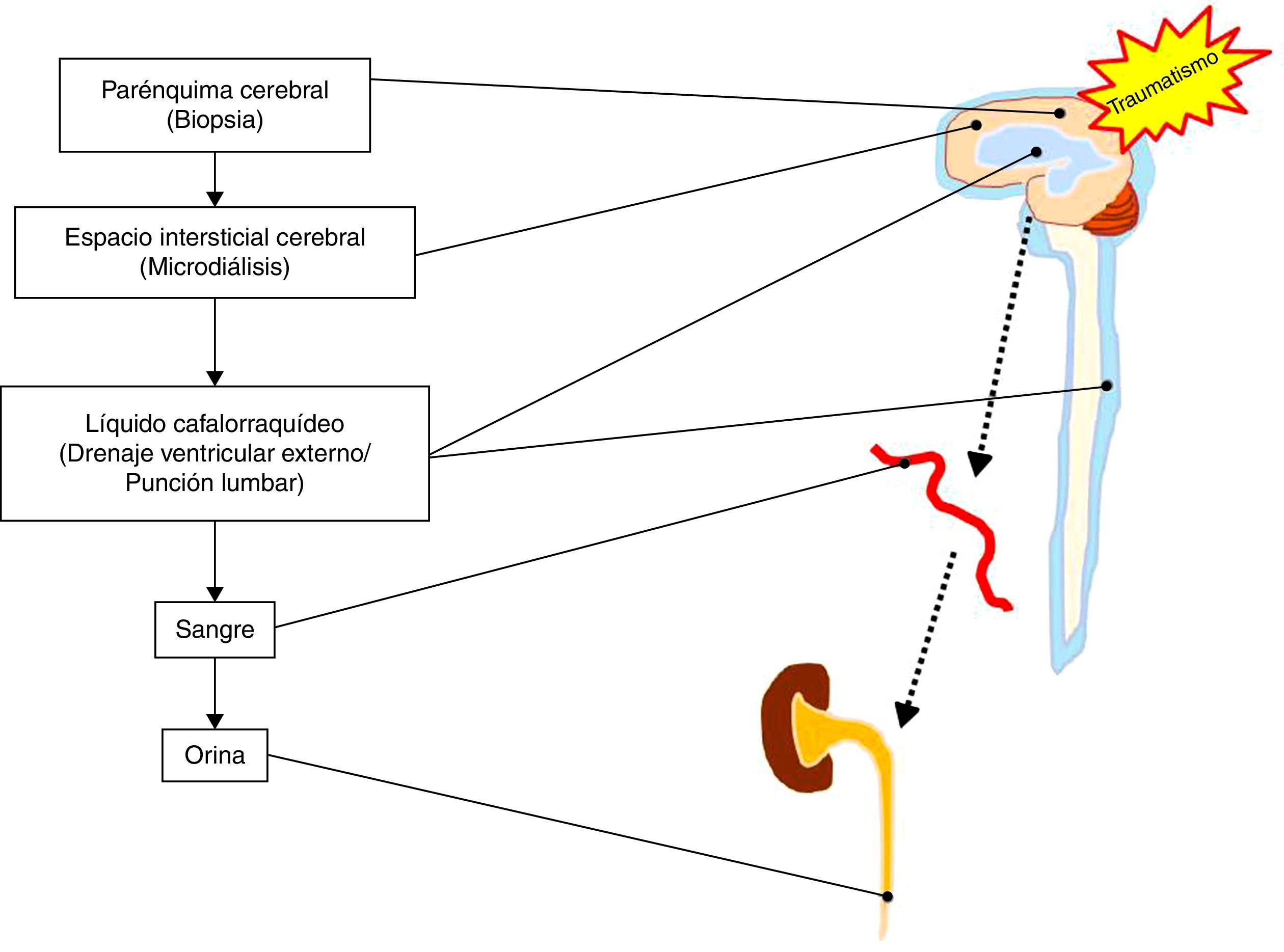
Por otra parte, existe cierta controversia en cuanto al tipo de líquido biológico objeto de análisis. La toma de una muestra directa del parénquima cerebral lesionado o en riesgo no es una opción plausible, aunque sería la única fuente de biomarcadores con información inequívoca y directa sobre los cambios que acontecen tras el TCE grave. El resto de las determinaciones se encuentran subrogadas a los comportamientos de liberación de los biomarcadores (pasiva o activa), paso a través de membranas (celulares, BHE, etc.), así como el fenómeno de dilución una vez alcanzado el compartimento sistémico8. En este sentido, existen técnicas como la microdiálisis, que permiten la determinación de metabolitos y biomarcadores del espacio intersticial cerebral9. Por otro lado, el LCR se encuentra más próximo a la zona lesionada, por lo que las determinaciones a este nivel no se ven condicionadas por la integridad de la BHE. Sin embargo, la toma de muestras de LCR es de difícil acceso y disponibilidad, precisando de maniobras cruentas para su obtención, con frecuencia contraindicadas en sujetos con TCE grave. Es por ello que la mayoría de los biomarcadores son estudiados en sangre periférica, al tratarse de una técnica sencilla, accesible y reproducible. Considerando lo anterior, un biomarcador de lesión cerebral que se libere al torrente sanguíneo es el más apropiado para poder realizar determinaciones seriadas de forma simple y mínimamente invasiva. A su vez, es interesante el estudio de la determinación de biomarcadores en los fluidos orgánicos vehículos de su aclaramiento, como, por ejemplo, la orina10 (ver fig. 1).
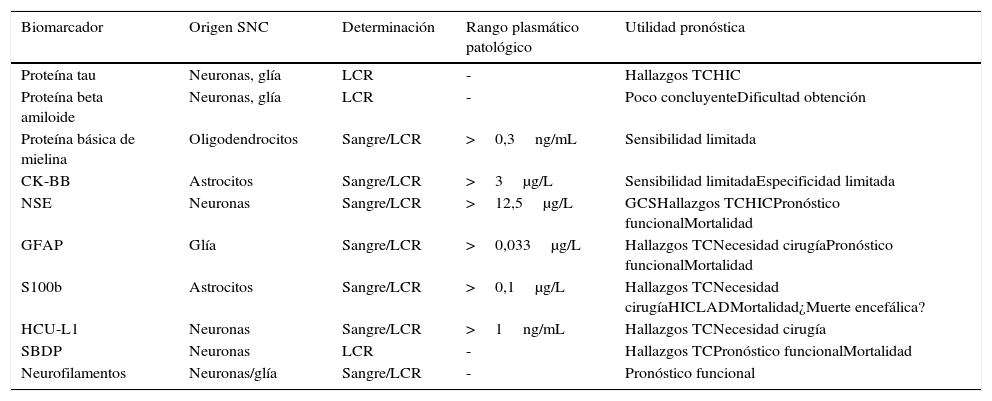
Pasamos a continuación a describir los principales biomarcadores de lesión cerebral, el tejido en el que se originan, el compartimento donde se obtienen las muestras para su determinación, la concentración sérica patológica y los principales aspectos pronósticos (ver tabla 1).
Principales biomarcadores de lesión del sistema nervioso central
| Biomarcador | Origen SNC | Determinación | Rango plasmático patológico | Utilidad pronóstica |
|---|---|---|---|---|
| Proteína tau | Neuronas, glía | LCR | - | Hallazgos TCHIC |
| Proteína beta amiloide | Neuronas, glía | LCR | - | Poco concluyenteDificultad obtención |
| Proteína básica de mielina | Oligodendrocitos | Sangre/LCR | >0,3ng/mL | Sensibilidad limitada |
| CK-BB | Astrocitos | Sangre/LCR | >3μg/L | Sensibilidad limitadaEspecificidad limitada |
| NSE | Neuronas | Sangre/LCR | >12,5μg/L | GCSHallazgos TCHICPronóstico funcionalMortalidad |
| GFAP | Glía | Sangre/LCR | >0,033μg/L | Hallazgos TCNecesidad cirugíaPronóstico funcionalMortalidad |
| S100b | Astrocitos | Sangre/LCR | >0,1μg/L | Hallazgos TCNecesidad cirugíaHICLADMortalidad¿Muerte encefálica? |
| HCU-L1 | Neuronas | Sangre/LCR | >1ng/mL | Hallazgos TCNecesidad cirugía |
| SBDP | Neuronas | LCR | - | Hallazgos TCPronóstico funcionalMortalidad |
| Neurofilamentos | Neuronas/glía | Sangre/LCR | - | Pronóstico funcional |
CK-BB: isoenzima creatincinasa cerebral; GCS: Glasgow Coma Scale; GFAP: proteína ácida fibrilar glial; HCU-L1: hidrolasa de carboxilo terminal de ubiquitina L1; HIC: hipertensión intracraneal; LAD: lesión axonal difusa; LCR: líquido cefalorraquídeo; NSE: enolasa neuroespecífica; SBDP: productos de degradación de la espectrina; SNC: sistema nervioso central; S100b: proteína S100 beta; TC: tomografía computarizada.
Se trata de una proteína estabilizadora del citoesqueleto axonal que constituye uniones tubulares, elementos estructurales del citoesqueleto y elementos cruciales para el flujo de proteínas neuronales. Existen 6 isoformas diferentes, sobre las cuales la acción de las proteasas –inducidas tras la lesión traumática– liberan fragmentos de proteína tau a suero y al LCR en su forma cleaved tau (c-tau), cuyo peso molecular es de 30-50kDa11. Estudios en humanos han objetivado que los niveles de c-tau en el LCR aumentan durante las primeras 24h tras el TCE grave. Fue el grupo de Zemlan et al. el que correlacionó la proteína c-tau con el desarrollo de HIC, así como con el pronóstico funcional de los pacientes a corto plazo12. Otros trabajos han asociado la concentración de c-tau en el LCR con los hallazgos radiológicos iniciales y con el pronóstico funcional de los pacientes al año de evolución (Glasgow Outcome Scale-extended)13. Sin embargo, su papel no ha quedado claramente definido, teniendo en cuenta que los resultados significativos se han obtenido con base en determinaciones en el LCR, con la complejidad logística que ello supone.
Proteína beta amiloideLa proteína precursora amiloide participa en procesos de adhesión celular, existiendo, por tanto, concentraciones elevadas de dicha proteína a nivel de la unión sináptica neuronal. Su forma precursora es la diana de un determinado tipo de caspasa que la degrada en una serie de productos. Estos últimos se acumulan sobre somas y axones, fenómeno partícipe en ciertos desórdenes neurodegenerativos como la enfermedad de Alzheimer, la enfermedad de Creutzfeldt-Jakob y la esclerosis lateral amiotrófica14. Un estudio realizado sobre 29 pacientes con TCE grave evidenció niveles bajos de esta proteína en el LCR, concluyéndose que podría explicarse por la reabsorción de la proteína en forma de placas de amiloide15. En contraposición, el grupo de Emmerling et al. objetivaron niveles incrementados en el LCR tras el daño traumático, postulando como posibles explicaciones la génesis de lesión axonal secundaria o la pérdida de integridad de la BHE16. Estos hallazgos contradictorios, que pueden estar en relación con los distintos métodos de determinación de las muestras de LCR (lumbar, ventricular, etc.), han perfilado a la proteína beta amiloide como biomarcador poco reproducible y con un papel no concluyente.
Proteína básica de mielinaCon un peso molecular de 18,5kDa, se encuentra a nivel de la oligodendroglia, siendo una proteína específica de la mielina liberada a la sangre en situaciones de daño cerebral y enfermedades desmielinizantes17. En cuanto a su utilidad en el TCE, algunos trabajos han relacionado los niveles séricos con la gravedad y el pronóstico, aunque nos referimos a un número reducido de estudios anticuados, con un tamaño muestral pequeño y con resultados que poseen una elevada especificidad pero una sensibilidad limitada18.
Isoenzima creatincinasa cerebralExisten 3 isoformas de creatincinasa: muscular, cardíaca y específica de tejido cerebral. Esta última, con un peso molecular de 40-53kDa, está localizada en los astrocitos, aunque también se ha determinado en tejido intestinal, prostático, uterino y vascular. Tras el TCE grave se produce un pico sérico de creatincinasa de tejido cerebral durante las primeras horas de evolución, que decrece progresivamente salvo en los sujetos con lesiones potencialmente graves, en los que permanece elevada durante días19. Se trata de un marcador con una sensibilidad y una especificidad reducidas, principal limitante para establecerlo como biomarcador de uso rutinario17.
Enolasa neuroespecíficaSe trata de una enzima glucolítica catalizadora, con un peso molecular de 78kDa y una vida media de 48h20. Su isoforma γ-γ es específica del tejido neuronal, mientras que la isoforma α-γ está presente en células endocrinas, eritrocitos y plaquetas21. El rango normal en sangre es inferior a 10ng/mL17,22. Se han detectado niveles incrementados de enolasa neuroespecífica (NSE) en el suero de pacientes tras presentar otros fenómenos de lesión cerebral no traumáticos, como accidentes isquémicos, hemorragias intracerebrales o maniobras de reanimación cardiopulmonar con hipoxia cerebral secundaria23. Modelos experimentales traumáticos correlacionan los niveles séricos de NSE con la gravedad lesional en el TCE24. En nuestra experiencia, desarrollamos un modelo murino de lesión tipo masa, en el cual tenía lugar una liberación lineal de la NSE tras la génesis controlada de HIC25. En relación con los estudios clínicos, se ha señalado una correlación inversa entre la concentración plasmática de NSE y la puntuación en la GCS. Por otra parte, se ha asociado a los hallazgos radiológicos iniciales y propuesto como un potente predictor de mal pronóstico y mortalidad26,27. Hay trabajos que relacionan dicho biomarcador con la génesis de LAD, mientras que no queda bien definido su comportamiento en humanos ante la presencia de HIC28.
Pese a que se perfiló inicialmente como un biomarcador de gravedad en el TCE muy prometedor al ser más específico de tejido neuronal que de células gliales, hasta la fecha los resultados publicados sobre NSE son contradictorios, dado que algunos trabajos no han encontrado correlación con el pronóstico clínico de los sujetos con TCE grave29. Por otra parte, su larga vida media cuestiona la aplicabilidad en la monitorización del curso cronológico de las lesiones en progresión, así como su utilidad para validar la eficacia terapéutica. A pesar de haberse considerado inicialmente específica de sistema nervioso, a posteriori se confirmó su génesis extracraneal en procesos como el shock hemorrágico, la fractura de huesos largos, la hemólisis, la cirugía cardíaca, las lesiones por isquemia-reperfusión y en tumores pulmonares malignos, hecho que supone una limitación en la interpretación de sus niveles30. Actualmente, entre sus aplicaciones clínicas, su papel como biomarcador de procesos tumorales es una realidad31.
Proteína ácida fibrilar glialSe trata de una proteína derivada del tejido astrocitario, cuya expresión y liberación es específica del cerebro, cualidad que la hace exclusiva como biomarcador de lesión cerebral en situaciones diversas: daño traumático, eventos isquémicos y ciertos trastornos neurodegenerativos32. Es una proteína monomérica con un peso molecular de 52kDa, liberada a sangre a través de la BHE y cuya integridad se ve afectada tras la lesión traumática, con un pico plasmático precoz en el primer día33. Tras esto, decrece progresivamente durante la primera semana a partir del tercer día de evolución. Los niveles plasmáticos superiores a 0,033μg/L se consideran patológicos33. Missler et al. fueron el primer grupo en proponer su posible utilidad como identificador de daño cerebral en determinaciones séricas seriadas34. Estudios posteriores confirmaron que la concentración sérica de esta proteína no está condicionada por lesiones extracraneales35. Se ha relacionado con el mal pronóstico en la fase aguda del TCE grave, las lesiones radiológicas objetivadas en la tomografía, la necesidad de neurocirugía urgente, el pronóstico funcional a largo plazo y la mortalidad36,37. Todas estas premisas hacen pensar en la proteína ácida fibrilar glial como un posible biomarcador de lesión cerebral ideal, siendo necesarios estudios multicéntricos futuros para poder corroborarlo.
Proteína S100 betaEs el biomarcador de lesión cerebral más estudiado. Se trata de una proteína de unión a calcio con bajo peso molecular (20kDa). Existen 3 subtipos derivados de la combinación dimérica de las cadenas α y β. El subtipo beta queda definido por la cadena β en modo de heterodímero αβ u homodímero ββ, con un peso molecular de 10-12kDa, sintetizándose en los astrocitos del SNC y las células de Schwann de los nervios periféricos38. La función biológica de esta proteína aún no está totalmente definida. Es conocida su participación en fenómenos de neurogénesis, astrocitosis, elongación axonal, transducción de señal a través de la inhibición de proteínas de fosforilación, regulación de actividad enzimática, homeostasis del calcio, interacción con elementos del citoesqueleto (regulando la morfología celular) y en mecanismos de protección del daño celular oxidativo3,39. A bajas concentraciones en el espacio extracelular, actúa favoreciendo la diferenciación y el crecimiento celular, mientras que concentraciones elevadas son inductoras de fenómenos de apoptosis39. Por otra parte, su síntesis y presencia pueden darse fuera del SNC, como en adipocitos, condrocitos, melanocitos y células hematopoyéticas40. Es metabolizada por el riñón, siendo eliminada a través de la orina, con una vida media aproximada de 30-113min, sin verse afectada por fenómenos de hemólisis41. La máxima concentración sérica se alcanza transcurridos 20min de la lesión cerebral, por tanto, es detectable prácticamente desde el ingreso del paciente en el hospital42. El rango de normalidad de esta proteína para detectar lesión intracraneal fue establecido en 0,1μg/L por el grupo de Biberthaler et al., mediante un estudio multicéntrico en pacientes con TCE leve43. Compilando la información proporcionada por otros trabajos, podemos considerar patológicos los niveles plasmáticos superiores al rango 0,13-0,20μg/L44. Las determinaciones de S100b en el LCR pueden verse influidas por la edad y el sexo de los sujetos, hecho que no ocurre en las muestras de suero, lo que confiere una ventaja añadida a estas últimas45.
Encontramos modelos experimentales que han mostrado la utilidad de la proteína S100b como marcador de lesión cerebral25,46. En cuanto a su utilidad clínica, se ha descrito su comportamiento en procesos neurológicos agudos, como en el ictus isquémico y el hemorrágico, así como en otros fenómenos en los que pudiera existir una afectación cerebral secundaria, como sucede durante la cirugía cardíaca y la rotura aneurismática espontánea47.
En relación con el TCE grave, se ha documentado la asociación de los niveles séricos de dicha proteína con la gravedad clínica, radiológica y el pronóstico desfavorable6,44. Algunos estudios han determinado su utilidad como factor predictor de mortalidad, estableciendo puntos de corte séricos orientativos para predecir la evolución a muerte o hacia un pronóstico desfavorable48. Por otra parte, se ha correlacionado con la presencia de lesión secundaria, la extensión del daño cerebral difuso, así como con modificaciones de la presión intracraneal siguiendo diversos patrones de liberación49,50. Otra de las posibles utilidades propuestas de la proteína S100b es el patrón temporal que comporta según la gravedad del caso. Existen trabajos en los que se documentan concentraciones séricas persistentemente elevadas en pacientes que no sobreviven, mientras que los niveles plasmáticos decrecen a partir de las 36h de evolución en los supervivientes36. Asimismo, se ha evidenciado la aparición de picos séricos secundarios al inicial en aquellos pacientes con un pronóstico más desfavorable36. En relación con lo anterior, existe cierta controversia acerca del papel que juega la BHE en este aspecto, ya que modificaciones en su permeabilidad secundarias al TCE pudieran explicar patrones de liberación según el curso cronológico, de tal forma que la pérdida de integridad traumática de la BHE no es el único mecanismo fisiopatológico implicado8. Adicionalmente, la proteína S100b se postula como una herramienta para monitorizar la eficacia terapéutica, puesto que se ha constatado que tras procedimientos neuroquirúrgicos efectivos, la concentración en el torrente sanguíneo disminuye48. Otros trabajos han obtenido resultados destacables en términos de pronóstico funcional a largo plazo29,51.
En nuestra experiencia, la proteína S100b ha demostrado su utilidad a la hora de identificar sujetos con lesiones intracerebrales en la TC y buen grado neurológico inicial44, además de obtener resultados relevantes en cuanto a su capacidad pronóstica a largo plazo en pacientes con TCE grave52. En un estudio recientemente publicado, establecimos un punto de corte plasmático determinado durante las primeras 6h de la lesión cerebral con capacidad predictora de mortalidad, alcanzando una sensibilidad del 90%. Adicionalmente, definimos un punto de corte en muestras de orina, aunque con menor significación que la muestra sanguínea10. Cabe señalar nuestros resultados novedosos en pacientes con TCE grave que evolucionaron a muerte encefálica53, estudio que pudiera ser un importante preliminar para futuras líneas de investigación dirigidas al diseño de estrategias terapéuticas precoces y eficaces, así como al despistaje de potenciales donantes.
Pese a su elevada sensibilidad y valor predictivo negativo, la proteína S100b no es un marcador específico de SNC. Hay que señalar que el paciente politraumatizado sin TCE puede presentar una elevación de la proteína S100b en sangre, aunque estas concentraciones disminuyen hasta normalizarse transcurridas 6h del trauma54. Por otra parte, los individuos con traumatismo craneal y lesiones extracaneales asociadas presentan con frecuencia una serie de situaciones fisiopatológicas a su ingreso (hipotensión, hipotermia, coagulopatía, fármacos inotrópicos, sedantes, corticoides, etc.) que pueden alterar la valoración precoz de S100b, dado que estará progresando el daño cerebral secundario. Por tanto, hay que destacar que en pacientes con lesiones extracraneales asociadas a TCE debe evitarse la determinación precoz de esta proteína53.
Nuevos biomarcadores de interésHidrolasa de carboxilo terminal de ubiquitina L1Es una proteína de origen neuronal, que constituye aproximadamente el 5% de las proteínas solubles cerebrales. Está implicada en la eliminación de proteínas degradadas y desnaturalizadas tras fenómenos oxidativos. En la actualidad disponemos de ciertos estudios publicados favorables para considerarla un biomarcador prometedor de daño cerebral, pues algunos han mostrado resultados indicativos de su capacidad para predecir la presencia de lesiones en la TC, la necesidad de neurocirugía y el pronóstico en pacientes con TCE55. Mondello et al. han mostrado resultados interesantes acerca de su posible capacidad para distinguir la lesión focal del daño difuso cerebral56. Es, además, un marcador que puede detectarse en sangre, con elevación de los niveles séricos de forma precoz tras el trauma craneal. Puede determinarse durante aproximadamente 168h, aunque en situaciones de mayor gravedad o desarrollo de lesión secundaria permanece elevado durante más tiempo55. Por el momento, la mayor parte de la información disponible proviene de un único grupo de investigación, y dada la relevancia de los resultados, sería necesario continuar investigando para corroborar las propiedades de esta proteína como biomarcador de lesión cerebral.
Productos de degradación de la espectrinaLa espectrina es una proteína estructural, componente principal del citoesqueleto cortical de los eritrocitos. Está constituida por 2 cadenas α y 2 cadenas β. Es una proteína susceptible de proteólisis por parte de calpaína y caspasa-3, las cuales desencadenan procesos de necrosis y apoptosis, respectivamente57. A nivel del SNC, se ha descrito la presencia de productos de degradación de la espectrina en axones y terminales neuronales presinápticos. Diversos autores han demostrado un incremento de productos de degradación de la espectrina determinado en LCR en el contexto de un TCE, destacando su papel como biomarcador predictor de gravedad y mortalidad en este tipo de pacientes58.
NeurofilamentosLos neurofilamentos ligeros (68kDa) forman parte del citoesqueleto axonal. Ante una situación de daño axonal, dicha proteína se libera tanto al LCR como al torrente sanguíneo. Son varios los trabajos de investigación que han destacado su papel como biomarcador de daño axonal y discapacidad neurológica en enfermedades neurodegenerativas y neuroinflamatorias59. En cuanto a su papel en el TCE, se ha demostrado un aumento de su concentración como consecuencia del daño axonal, así como una correlación con el pronóstico del paciente60.
ConclusionesDado que todos los biomarcadores de lesión cerebral presentan alguna limitación que impide su aplicación de forma universal en el manejo del TCE grave, siguen sin formar parte de nuestra rutina asistencial. Algunos de ellos, como la NSE y la proteína S100b, han demostrado tener una buena correlación con la gravedad clínica, la extensión del daño cerebral, la respuesta a la terapéutica y la capacidad de predecir el resultado final. Sin embargo, las limitaciones derivadas de la propia rentabilidad clínica de la molécula o del grado de invasividad para su obtención no han permitido su uso generalizado en dicha afección.
Por otra parte, son necesarios nuevos estudios para comprender el papel que juegan estas proteínas en la fisiología del SNC y en la fisiopatología del TCE grave, así como dilucidar la utilidad de aquellos biomarcadores que se presumen prometedores en este campo. Hay que señalar en este contexto la proteína ácida fibrilar glial específica de tejido nervioso, así como los biomarcadores que actualmente se encuentran en auge: la hidrolasa de carboxilo terminal de ubiquitina L1, los neurofilamentos ligeros y los productos de degradación de la espectrina. Dado que ofrecen una información aislada de algunos de los muchos elementos implicados en la fisiopatología del TCE, pensamos que el camino a seguir es su análisis de forma combinada. De este modo se podría establecer no un biomarcador exclusivo de lesión cerebral, sino un panel de biomarcadores que, en conjunción y considerando las características propias de cada uno, aporte información sobre la gravedad, el potencial beneficio de su modulación y el curso evolutivo de las lesiones tras el TCE grave. Solo de esta forma será posible disponer en un futuro de una herramienta complementaria a las tradicionales, sencilla, incruenta, reproducible y de extraordinaria utilidad para el enfoque y el manejo de esta dolencia crítica.
FinanciaciónNinguna.
Conflicto de interesesLos autores no presentan ningún conflicto de interés con respecto al trabajo presentado.