La integración de la función ventricular en la toma de decisiones del paciente sometido a electroestimulación cardiaca resulta fundamental para comprender la estructuración de las nuevas guías sobre estimulación cardiaca y terapia de resincronización. Para argumentar la importancia de la función ventricular en la electroestimulación cardiaca es necesario conocer: a)el efecto deletéreo de la estimulación desde el ápex del ventrículo derecho; b)el efecto del bloqueo completo de rama izquierda sobre la función ventricular izquierda, y c)la disfunción ventricular izquierda como sustrato arritmogénico. Así, cuando decidimos el modo de electroestimulación cardiaca a aplicar debemos conocer el porcentaje de estimulación ventricular que precisará y su función ventricular. Si esta es normal, permitirá estimular desde el ápex del ventrículo derecho o desde sitios alternativos al ápex. Por el contrario, si es menor del 50% es recomendable la resincronización cardiaca (CRT-P) acompañada de desfibrilación (CRT-D) si la FEVI es menor del 35%.
The integration of the ventricular function is essential when making decisions over a patient subjected to cardiac electrostimulation in order to understand the structure followed in the new cardiac stimulation and resynchronising therapy guides. To support the importance of ventricular function in cardiac electrostimulation it is important to know: (i)the deleterious effect of stimulation on the right ventricle apex; (ii)the effect over the left ventricular function produced by complete blockage of the left branch, and (iii)left ventricular disfunction as arrythmogenic substrate. When it comes to decide what type of cardiac electrostimualtion to apply we will know: the percentage of ventricular stimulation needed and its ventricular function. A normal ventricular function will enable electrostimulation from the right ventricle apex or alternative site. On the contrary, if this value is lower than 50% the most recommended electrostimulation is cardiac resynchronisation (CRT-P), which will be accompanied by defibrillation (CRT-D) if FEVI is lower than 35%.
La integración de la función ventricular en la toma de decisiones del paciente sometido a electroestimulación cardíaca resulta fundamental para comprender la estructuración de las nuevas guías sobre estimulación cardíaca y terapia de resincronización1. Para poder desarrollar esta revisión hay que recordar que, cuando nos referimos a la disfunción ventricular izquierda, entendemos como tal la disfunción sistólica del ventrículo izquierdo y no la disfunción diastólica del ventrículo izquierdo, también fuente de síntomas cardiovasculares. Además, la electroestimulación cardíaca no solo incluye los marcapasos convencionales sino también los desfibriladores automáticos internos (DAI) y a la terapia de resincronización cardiaca sin desfibrilación (CRT-P) como con desfibrilador (CRT-D). Por otro lado, la electroestimulación cardiaca ha superado actualmente el concepto de «estimulación de supervivencia», que tiene como objetivo conseguir una determinada frecuencia cardiaca que se considera adecuada, para convertirse en «estimulación fisiológica», cuyo objetivo es conseguir una adecuada funcionalidad cardiaca, que podemos analizar mediante la aplicación de los conceptos «sincronía auriculoventricular» y «sincronía intraventricular».
Además, es necesario partir de 3 premisas que nos permitan argumentar la «importancia de la función ventricular en la electroestimulación cardíaca».
A. Efecto deletéreo de la estimulación desde el ápex del ventrículo derechoEs conocido desde los años ochenta, en estudios realizados en humanos2, que la estimulación en ritmo sinusal presenta una secuencia de estimulación en el ventrículo izquierdo con unas zonas de despolarización precoz que se inician a nivel del septo inferior y la cara anterior, y otras de despolarización tardía a nivel del ápex y segmentos basales de la región inferolateral. Sin embargo, cuando la estimulación se realiza desde el ápex del ventrículo derecho se produce un retraso significativo en la activación del ventrículo izquierdo, observándose unas zonas de estimulación precoz localizadas en el septo medio y otras de activación tardía en la base inferolateral. El tiempo total de activación del ventrículo izquierdo se prolonga, lo que supone «pérdida de la normal secuencia de activación del ventrículo izquierdo» que remeda un bloqueo completo de rama izquierda, provocando repercusiones clínicas.
Existen varios estudios clínicos que han puesto de manifiesto los inconvenientes de la estimulación desde el ápex del ventrículo derecho.
Andersen et al.3, en pacientes con enfermedad del seno, estimulan a un grupo exclusivamente en aurícula (AAI), modo de estimulación que conserva la «secuencia de activación del ventrículo izquierdo», y a otro grupo exclusivamente desde el ápex del ventrículo derecho (VVI), modo de estimulación que pierde la «secuencia de activación del ventrículo izquierdo», observando en este segundo grupo un incremento de la mortalidad de origen cardiovascular y un mayor número de episodios de fibrilación auricular.
En el estudio MOST4, también realizado en pacientes con enfermedad del seno, se procede a 2 modos de estimulación: a)bicameral (DDD), electrodo en aurícula derecha y otro en ápex del ventrículo derecho, modo que pierde la secuencia de activación del ventrículo izquierdo con un elevado porcentaje de estimulación ventricular (% estimulación), y b)monocameral con un electrodo en ápex del ventrículo derecho (VVI) programado con un bajo límite inferior de frecuencia, lo que supone un bajo porcentaje de estimulación ventricular. Se observa un mayor número de hospitalizaciones por insuficiencia cardiaca y/o episodios de fibrilación auricular en aquellos pacientes con un mayor porcentaje de estimulación ventricular cuando esta superaba el 80%.
Finalmente, el estudio DAVID5, realizado en pacientes con disfunción ventricular izquierda a los que se les implanta un DAI para prevención primaria: el grupo de pacientes con estimulación DDD (reciben un alto porcentaje de estimulación ventricular) y el grupo estimulado en VVI (reciben un bajo porcentaje de estimulación ventricular), se vio obligado a la suspensión precoz del ensayo al observar una elevada mortalidad en el grupo con mayor porcentaje de estimulación.
Además de estos hallazgos clínicos se han descrito las siguientes alteraciones funcionales relacionadas con la estimulación desde el ápex del ventrículo derecho:
- -
Movimiento paradójico del septo6.
- -
Disminución de los tiempos de relajación y llenado7.
- -
Regurgitación mitral8.
- -
Aumento del tamaño de la aurícula izquierda9.
- -
Disminución de la fracción de eyección del ventrículo izquierdo global y regional10.
Así como alteraciones estructurales11 y moleculares12 que reafirman al efecto deletéreo de la estimulación desde el ápex del ventrículo derecho como una entidad propia, para la que se ha acuñado el término «miocardiopatía inducida por estimulación»13.
B. Efecto del bloqueo completo de rama izquierda sobre la función ventricular izquierdaEl bloqueo completo de rama izquierda (BCRI) produce un retraso en la contracción de la pared lateral del ventrículo izquierdo respecto al ventrículo derecho y el septo ventricular, lo que provoca una contracción ineficiente que disminuye el gasto cardiaco y la fracción de eyección del ventrículo izquierdo (FEVI). Esto define un perfil clínico de paciente caracterizado por: BCRI (QRS>120ms), FEVI<35% y clase funcional New York Heart Association (NYHA)II-III que se benefician de un modo específico de electroestimulación cardiaca conocida como terapia de resincronización cardiaca (CRT)14.
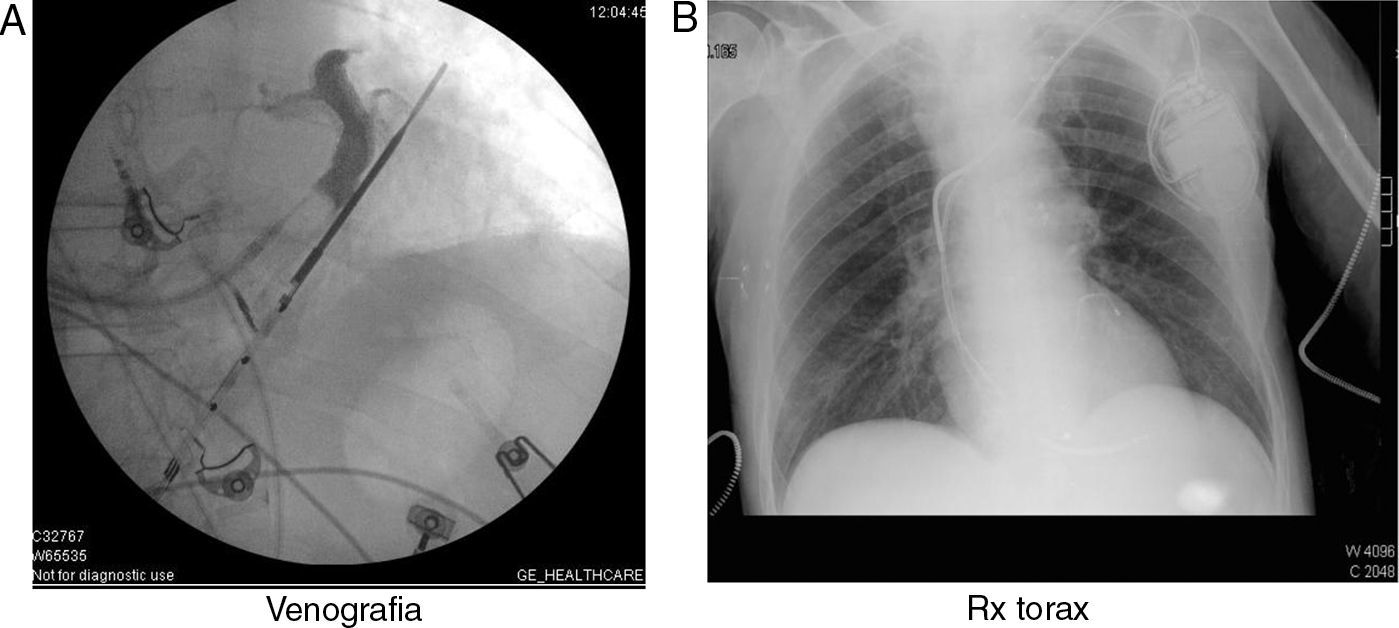
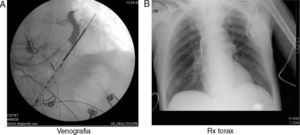
La técnica utilizada habitualmente consiste en que sobre la base de un marcapasos DDD (si el paciente no está en fibrilación auricular permanente) se coloca un electrodo desde el endocardio a través de seno coronario hasta llevarlo al epicardio del ventrículo izquierdo, preferentemente en los segmentos basales inferolateral y lateral. Durante el procedimiento realizamos una venografía retrógrada oclusiva a través de seno coronario que nos permite visualizar el árbol venoso coronario y elegir la vena adecuada. La estimulación sincronizada desde esta posición neutraliza el retraso provocado por el BCRI (fig. 1).
El ensayo clínico MIRACLE14 compara un grupo de pacientes con el perfil clínico anteriormente descrito a un tratamiento médico convencional y otro con terapia de resincronización, observándose en este último un porcentaje significativo de pacientes libres de síntomas.
Actualmente conocemos que los pacientes que responden a la terapia de resincronización tienen una mayor duración del QRS, y aquellos que duran más de 150ms son los más respondedores. Cuando se objetiva mediante estudio ecocardiográfico el retraso de los segmentos inferolaterales respecto al septo (disincronía ventricular), pero no se acompaña de una prolongación del QRS, no está indicada la terapia de resincronización15.
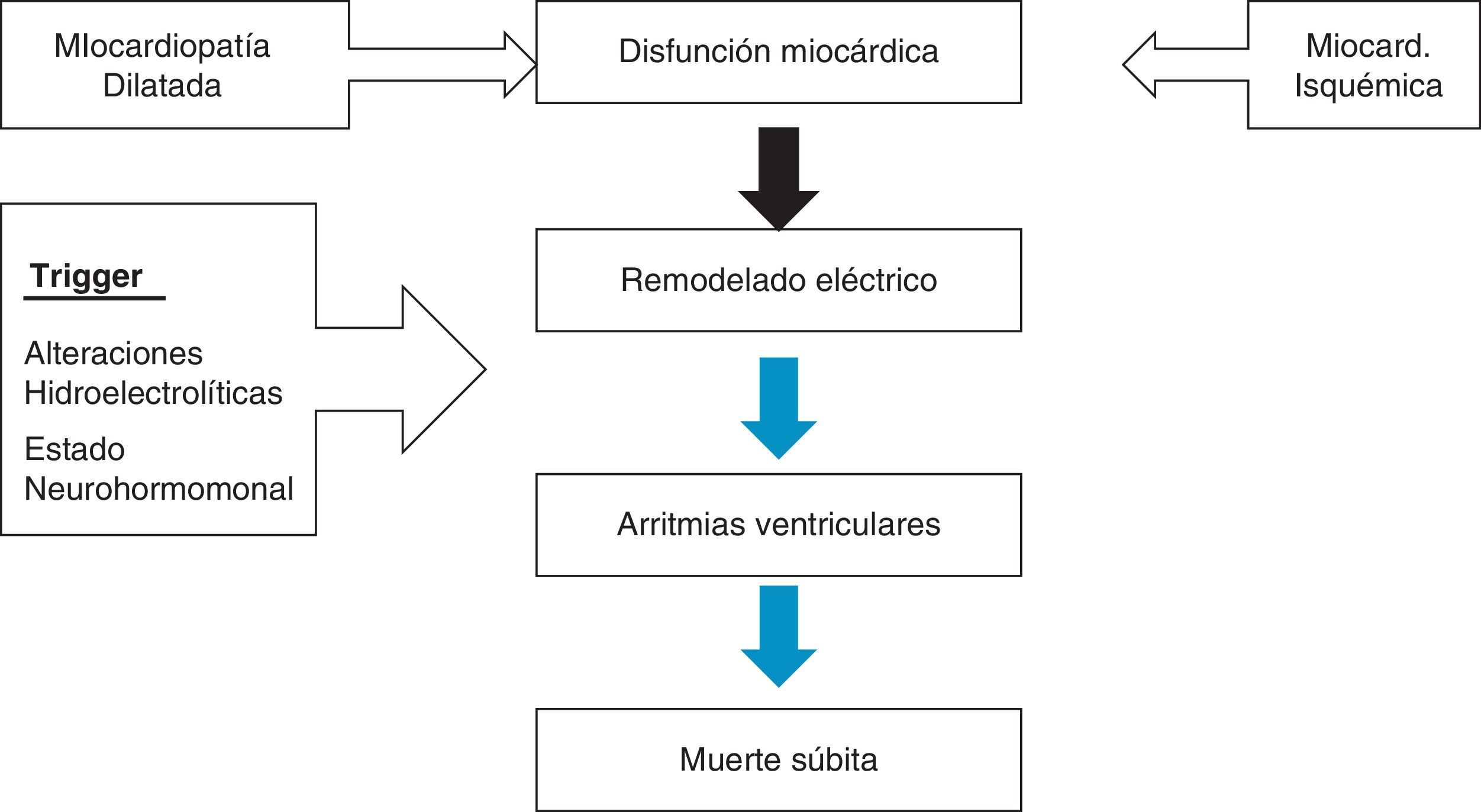
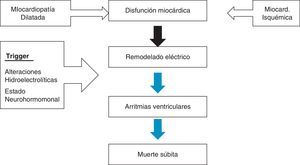
C. Disfunción ventricular izquierda como sustrato arritmogénicoLa disfunción miocárdica produce un remodelado eléctrico, independientemente de que el origen sea isquémico o no isquémico. Cuando sobre ese sustrato actúa un trigger (alteraciones electrolíticas, neurohormonales, alcohol, etc.), se desencadenan arritmias ventriculares que pueden acabar en muerte súbita (fig. 2). Estos hallazgos son conocidos desde los años ochenta, objetivándose un aumento de la mortalidad en el grupo con disfunción miocárdica16, motivado por la aparición de arritmias ventriculares (taquicardia ventricular y fibrilación ventricular)17. Por tanto la colocación de un desfibrilador a pacientes con este perfil clínico podría disminuir la mortalidad (fig. 3).
El estudio MADITII18 demostró que en pacientes con disfunción ventricular izquierda de origen isquémico que tienen una FEVI<35%, y sin necesidad de ningún otro dato adicional, los pacientes a los que se les implanta un DAI presentan una menor mortalidad que los tratados exclusivamente con antiarrítmicos.
Por otro lado, según el estudio DEFINITIVE19, realizado en pacientes con disfunción ventricular de origen no isquémico y FEVI<35%, en los pacientes a los que se les implanta un desfibrilador se observa también un descenso de la mortalidad, aunque en este grupo de pacientes el beneficio es menor al presentar una mayor mortalidad por fallo de bomba cardiaca y menos por arritmias.
Los pacientes con disfunción ventricular izquierda por bloqueo completo de rama izquierda también se benefician, en términos de mortalidad, cuando a la terapia de resincronización se añade además la función de desfibrilación20.
Los 3 perfiles descritos responden a una indicación de DAI por prevención primaria de muerte súbita. Además, entre el 15-20% de estos pacientes precisan de terapia antibradicardia. Actualmente está en pleno debate utilizar la FEVI como único criterio para implantarles un desfibrilador21. Por una parte hay pacientes con FEVI moderada que presentan episodios de muerte súbita, que identificados previamente se podrían beneficiar de esta terapia. Por otra, en el grupo de pacientes con función ventricular severamente deprimida (FEVI<35%) portadores de un DAI, aproximadamente un 60% no reciben ninguna terapia durante los 3 primeros años tras el implante. La cardiorresonancia con realce tardío de gadolinio, realizada tras los primeros días después de un infarto agudo de miocardio, se vislumbra como la técnica que aportara nuevos criterios para definir el perfil de pacientes que más se beneficien del implante de un DAI como prevención primaria22,23.
ComentarioAnalizadas estas 3 premisas, se han buscado alternativas para neutralizar o evitar el efecto deletéreo provocado por la estimulación desde el ápex del ventrículo derecho.
Por un lado, partiendo de la hipótesis de que «la estimulación desde el ápex del ventrículo derecho remeda al bloqueo completo de rama izquierda», y este último se corrige mediante terapia de resincronización cardiaca, esta sería eficaz para neutralizar ese efecto deletéreo. Así, el estudio PACE24, realizado en pacientes con FEVI normal y bradicardia, compara 2 modos de estimulación: un grupo mediante resincronización y otro estimulado desde el ápex del ventrículo derecho, objetivando al año de seguimiento un descenso medio de la FEVI en el grupo de pacientes estimulados desde el ápex que se mantiene tras 2años de seguimiento25. Sin embargo, al realizar un análisis individual en el grupo de pacientes estimulados desde el ápex tan solo un 9% presentan una FEVI deprimida (<50%).
El estudio DANPACE26, diseñado para comparar el beneficio de la estimulación bicameral en pacientes con enfermedad del seno y FEVI conservada, no ha observado diferencias clínicas en términos de hospitalización por fibrilación auricular o insuficiencia cardiaca entre pacientes estimulados desde el ápex y aquellos con bajo porcentaje de estimulación.
Analizando la prevalencia de disfunción ventricular en pacientes estimulados desde el ápex del ventrículo derecho que partían de una FEVI normal (>50%), encontramos: 9% de disfunción ventricular tras un año de estimulación24, 13% en pacientes estimulados durante 15años26 y 15% cuando prolongamos el seguimiento a 24años13. Por consiguiente, podemos afirmar que el efecto deletéreo de la estimulación desde el ápex del ventrículo derecho en pacientes con una FEVI normal (>50%) se produce en un reducido número de pacientes, en términos generales uno de cada 10, y no existen criterios que nos permitan identificarlos previamente.
La situación es distinta cuando los pacientes parten de una FEVI<50%. Así, el estudio BLOCK27 estudia pacientes con FEVI<50% y bloqueo completo auriculoventricular (que precisarán altos porcentajes de estimulación ventricular) sometidos a 2 terapias de electroestimulación cardiaca (estimulación desde el ápex del ventrículo derecho/resincronización cardiaca), observando una mayor mortalidad, ingresos por insuficiencia cardiaca e incremento del volumen telesistólico del ventrículo izquierdo (VTSVI) en el grupo de pacientes estimulados desde el ápex del ventrículo derecho.
Otra posibilidad que se ha propuesto para minimizar el efecto deletéreo de la estimulación desde el ápex del ventrículo derecho es hacerlo desde un punto del sistema de conducción que no se pierda la «normal secuencia de activación del ventrículo izquierdo» conocida como «estimulación desde sitios alternativos al ápex del ventrículo derecho». Se han propuesto 2 puntos de estimulación: a)septo ventricular, que incluye el tracto de salida del ventrículo derecho (TSVD) en diferentes niveles (alto y medio), y b)haz de His. Hay publicados múltiples estudios con un número reducido de pacientes28-32. En términos generales se ha observado que cuando los pacientes tienen una FEVI normal (>50%) no presentan beneficio respecto a la estimulación desde el ápex. Cuando la FEVI está deprimida (<50%), esta sufre un menor deterioro que si se estimula desde el ápex, pero no se objetivan mejoras clínicas en términos de capacidad de ejercicio, calidad de vida o supervivencia.
Por otro lado, la implantación en el His o en zonas parahisianas es una técnica con baja efectividad, puesto que se consigue estimular en torno al 50% de pacientes y con umbrales elevados33. Y la estimulación desde el TSVD tan solo en un tercio de los pacientes se encuentra el electrodo realmente en el septo, localizándose en el resto de ocasiones en la pared anterior o pared libre del ventrículo derecho. Las posiciones del electrodo en pared anterior o pared lateral del ventriculo derecho no aportan beneficios funcionales34.
Finalmente, en los pacientes estimulados desde el ápex del ventrículo derecho que precisan la realización de un «recambio» se considera que los que presentan FEVI deprimida, porcentajes de estimulación del ventrículo derecho elevados (>80%) y síntomas de insuficiencia cardiaca ausentes o moderados se podrían beneficiar de un up-grade a terapia de resincronización, observándose mejorías en términos tanto funcionales (mejora de FEVI) como clínicos (mejora de capacidad funcional y calidad de vida)35.
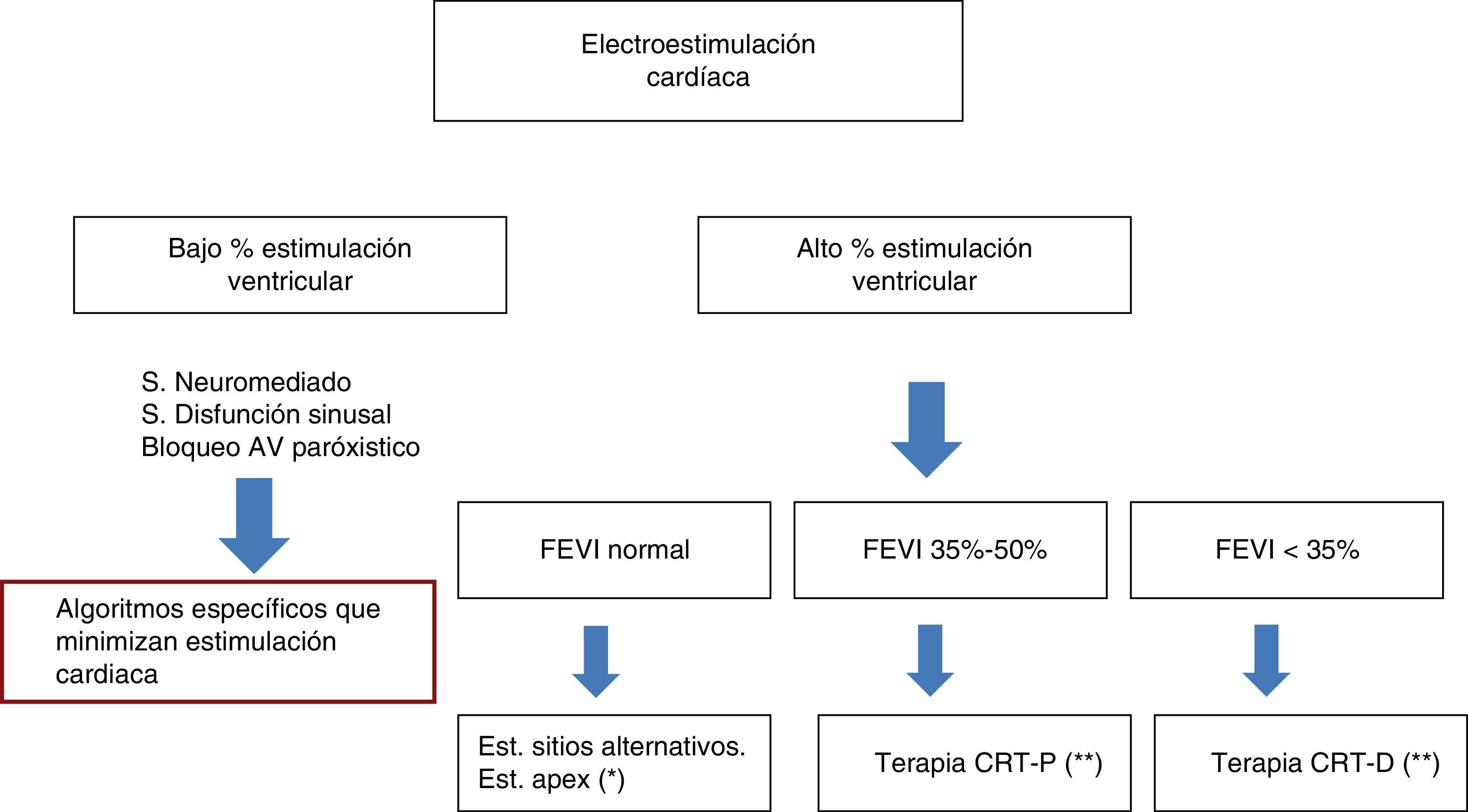
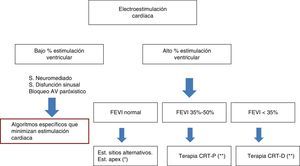
En resumen, cuando hemos de decidir el modo de electroestimulación cardiaca al que vamos a someter un paciente, tenemos en primer lugar que analizar el porcentaje de estimulación ventricular que precisará. Si este porcentaje es bajo, como ocurre en síndromes neuromediados, síndrome de disfunción sinusal o bloqueo AV paroxístico, podemos estimular desde el ápex del ventrículo derecho utilizando algoritmos que minimicen la estimulación ventricular (que no han sido objeto de esta revisión).
Cuando esperamos un elevado porcentaje de estimulación (superior al 60-80%) hay que valorar la función ventricular. Si esta es normal (FEVI>50%), podemos estimular desde el ápex del ventrículo derecho, teniendo en cuenta que en torno a un 10% de pacientes desarrollarán disfunción ventricular izquierda, y habrá que identificarlos mediante estudio ecocardiográfico al año y plantearnos la posibilidad de up-grade a resincronización, o podemos estimular desde lugares alternativos: septo ventricular (siempre que estemos seguros que nos encontramos en esta localización) o estimulación hisiana o parahisiana.
Sin embargo, en pacientes con una FEVI menor de 50% y mayor de 35% podemos estimular mediante terapia de resincronización cardiaca. En pacientes con cardiopatía isquémica es recomendable realizar cardiorresonancia para asegurarnos de que en los segmentos del ventrículo izquierdo que vamos a estimular no existe una escara, lo que minimizaría el número de «no respondedores». Por último, si la FEVI<35%, además de terapia de resincronización hay que proteger del riesgo de muerte súbita mediante la asociación de un DAI. Hay que recordar que estas indicaciones deben individualizarse teniendo en cuenta la expectativa de vida del paciente en función de su morbilidad no cardiaca. Se recomienda que dicha expectativa de vida sea superior a un año (fig. 4).
Elección del modo de electroestimulación cardíaca. *Seguimiento durante el primer año detectar al grupo de pacientes que desarrollan disfunción ventricular. **En revisión actualmente pendiente de introducir nuevos criterios fundamentalmente basados en imagen cardiaca (resonancia gadolinio con realce tardío). CRT-D: resincronización cardiaca con desfibrilación; CRT-P: resincronización cardiaca sin desfibrilación; FEVI: fracción de eyección del ventrículo izquierdo.
Los autores declaran no tener ningún conflicto de intereses.