La infección por SARS-CoV-2 (COVID-19) se caracteriza por producir en las formas graves, un cuadro de insuficiencia respiratoria que puede evolucionar hacia neumonía y síndrome de distrés respiratorio agudo (SDRA), presentar complicaciones como fenómenos trombóticos y disfunción cardiaca, lo que motiva el ingreso en la Unidad de Cuidados Intensivos (UCI). La ecografía, convertida en una herramienta de uso habitual en la UCI, puede ser muy útil durante la pandemia por COVID-19 ya que la información obtenida por el clínico puede ser interpretada e integrada en la valoración global durante la exploración del paciente. Este documento describe algunas de sus aplicaciones, adaptadas al paciente crítico con COVID-19, con el objetivo de proporcionar una guía a los médicos responsables. Alguna de sus aplicaciones desde el ingreso en la UCI incluyen: confirmar la correcta posición del tubo endotraqueal, facilitar la inserción segura de las vías e identificar complicaciones y fenómenos trombóticos. Además, la ecografía pleuropulmonar puede ser una alternativa diagnóstica válida que permite evaluar el grado de afectación pulmonar, mediante el análisis de patrones ecográficos específicos, la identificación de derrame pleural y barotrauma. La ecocardiografía proporciona información acerca de la afectación cardiaca, detección del cor pulmonale y estados de shock.
The clinical picture of SARS-CoV-2 infection (COVID-19) is characterized in its more severe form, by an acute respiratory failure which can worsen to pneumonia and acute respiratory distress syndrome (ARDS) and get complicated with thrombotic events and heart dysfunction. Therefore, admission to the Intensive Care Unit (ICU) is common. Ultrasound, which has become an everyday tool in the ICU, can be very useful during COVID-19 pandemic, since it provides the clinician with information which can be interpreted and integrated within a global assessment during the physical examination. A description of some of the potential applications of ultrasound is depicted in this document, in order to supply the physicians taking care of these patients with an adapted guide to the intensive care setting. Some of its applications since ICU admission include verification of the correct position of the endotracheal tube, contribution to safe cannulation of lines, and identification of complications and thrombotic events. Furthermore, pleural and lung ultrasound can be an alternative diagnostic test to assess the degree of involvement of the lung parenchyma by means of the evaluation of specific ultrasound patterns, identification of pleural effusions and barotrauma. Echocardiography provides information of heart involvement, detects cor pulmonale and shock states.
La enfermedad por SARS-CoV-2 (COVID-19) se caracteriza por producir un cuadro neumónico, con fiebre y tos, acompañado de opacificaciones pulmonares multifocales en vidrio deslustrado, que puede evolucionar a síndrome de distrés respiratorio agudo (SDRA) y requerir ingreso en un Servicio de Medicina Intensiva (SMI) en un porcentaje elevado de pacientes1. Por otro lado, la infección por SARS-CoV-2 puede provocar fenómenos trombóticos y alteraciones graves a nivel de otros órganos como el corazón.
La ecografía podría ser una herramienta muy útil en la pandemia COVID-19 debido a que permite obtener imágenes en tiempo real, a pie de cama, y de manera no invasiva en pacientes ingresados en Unidades de Cuidados Intensivos (UCI)2-4. Además, ha demostrado aumentar la seguridad en los procedimientos invasivos. En este contexto, la información obtenida mediante las diferentes modalidades de ultrasonografía podría ser interpretada e integrada en la valoración global, durante la exploración del paciente. Recientemente, han sido publicados diversos artículos sobre el papel de la ecografía en la valoración de la función pulmonar y cardiovascular de los pacientes infectados por SARS-CoV-25-8.
El Comité para Formación y Acreditación de Ecografía de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC), ha elaborado este documento con algunas de las múltiples aplicaciones de la ecografía con el objetivo de proporcionar una guía útil a los médicos responsables de la atención a pacientes con COVID-19, particularmente durante el ingreso en la UCI (tabla 1).
Principales aplicaciones de la ecografía durante la atención de la pandemia de coronavirus en los Servicios de Medicina Intensiva
| Técnica | Problema | Zona de estudio | Hallazgos | |
|---|---|---|---|---|
| Control de la vía aérea | Ecografía traqueal | Intubación esofágica | Plano transversal en la región anterior del cuello | - Intubación correcta: línea hiperecogénica con forma de U invertida, con artefacto posterior en cola de cometa |
| - Intubación esofágica: aparición de segundo artefacto en cola de cometa a un nivel lateral y más profundo que la tráquea | ||||
| Ecografía pleural | Intubación bronquial selectiva inadvertida (IBSI) | Puntos superior e inferior del protocolo BLUE | - Intubación correcta: sliding pulmonar bilateral | |
| - IBSI: ausencia de sliding pulmonar unilateral | ||||
| Diagnóstico y seguimiento de la afectación pulmonar | ||||
| Ecografía pleuropulmonar | Hipoxemia | Puntos del protocolo BLUE | - Patrones de aireación pulmonar | |
| - Lung ultrasound score (LUS) | ||||
| Modelo de 12 zonas | ||||
| - Ausencia sliding pulmonar | ||||
| Ecografía pleuropulmonar | Neumotórax | Puntos del protocolo BLUE | - Patrón de líneas A | |
| Complicaciones de la enfermedad | - Punto pulmonar (lung point) | |||
| Derrame Pleural | Punto PLAPS del protocolo BLUE | - Detección y ecogenicidad líquido pleural | ||
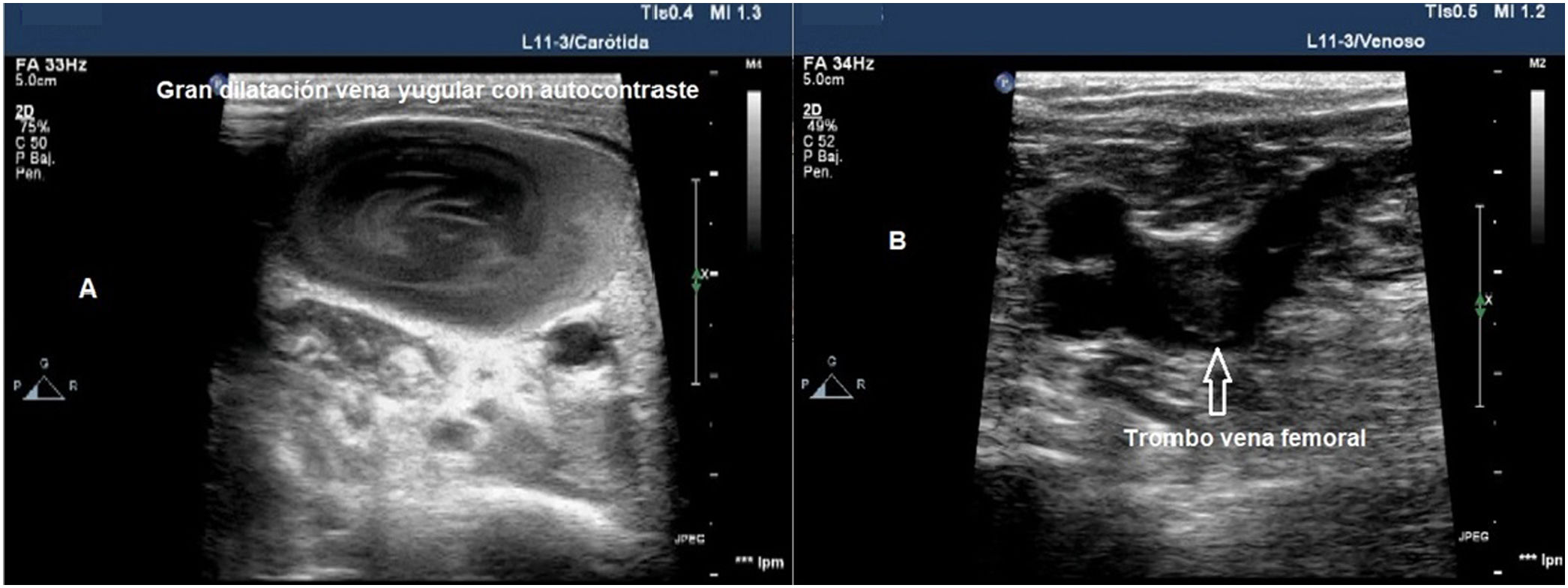
| Ecografía vascular | Fenómenos trombóticos | Venas de extremidades | - Compresibilidad del vaso | |
| - Contenido ecogénico en el vaso | ||||
| - Engrosamiento de las paredes ventriculares | ||||
| - Alteraciones de la contractilidad segmentaria | ||||
| Ecocardiografía | Miocarditis | Planos ecocardiográficos convencionales | - FEVI deprimida | |
| - Dilatación de VI | ||||
| - Derrame pericárdico | ||||
| - Función sistólica de VI | ||||
| Shock | Planos ecocardiográficos convencionales | - Integral velocidad-tiempo (IVT) del tracto de salida de VI (TSVI) | ||
| - Dilatación del ventrículo derecho | ||||
| - Movimiento paradójico septal / septo en D | ||||
| Cor pulmonale agudo | Planos ecocardiográficos convencionales | - Dilatación de la vena cava inferior | ||
| - Hipertensión pulmonar | ||||
| - Disfunción sistólica del VD |
VD: ventrículo derecho; VI: ventrículo izquierdo; FEVI: fracción de eyección de ventrículo izquierdo; BLUE: bedside lung ultrasound in emergency; punto PLAPS: pointposterolateral alveolar and pleural síndrome.
La fabricación de equipos ecográficos portátiles ha hecho posible su disponibilidad en la mayoría de los SMI. Además, la existencia de sondas de ultrasonido con conexión inalámbrica o conexión USB a una tablet o smartphone, aunque proporcionan estudios de menor calidad que los equipos de mayor tamaño, son adecuadas para obtener imágenes ecográficas en pacientes con COVID-19. Presentan ventajas respecto a las consolas portátiles como son el menor tamaño y peso, su facilidad en el transporte, rápido arranque y grado de asepsia, al poderse cubrir fácilmente con fundas plásticas de un solo uso, lo que reduce el riesgo de contaminación e infección nosocomial y facilita procedimientos de limpieza y esterilización7,9.
Se aconseja la utilización de ecógrafos portátiles dedicados en exclusiva a pacientes con COVID-19, con precauciones de asepsia y esterilidad para disminuir infecciones cruzadas, y se recomienda utilizar cubiertas en la sonda y el teclado10.
La limpieza del equipo se debe realizar según las recomendaciones ante la pandemia11,12 (anexo 1 de material electrónico suplementario [MES]).
Ecografía en el control de la vía aéreaEl control de la vía aérea mediante intubación orotraqueal (IOT) y conexión a ventilación mecánica (VM) es un procedimiento habitual en el manejo del paciente con insuficiencia respiratoria aguda (IRA) grave secundaria a enfermedad por SARS-CoV-2. La IOT es una técnica que puede generar aerosoles, por lo que debe llevarse a cabo por un profesional adecuadamente entrenado, preferiblemente utilizando videolaringoscopia, y con el equipo de protección individual (EPI) recomendado13.
La confirmación de una correcta posición del tubo orotraqueal (TOT) tras la IOT es fundamental, habitualmente se basa en la capnografía y la exploración física (visualización directa del paso del TOT a través de las cuerdas vocales, elevación simétrica de ambos hemitórax, ausencia de ruidos a nivel epigástrico, auscultación de murmullo vesicular y condensación en el tubo con la ventilación)14-16. El acceso subóptimo a recursos como la capnografía y la interferencia que supone el EPI para realizar una exploración física completa, convierten a la ecografía en una herramienta muy útil en este contexto.
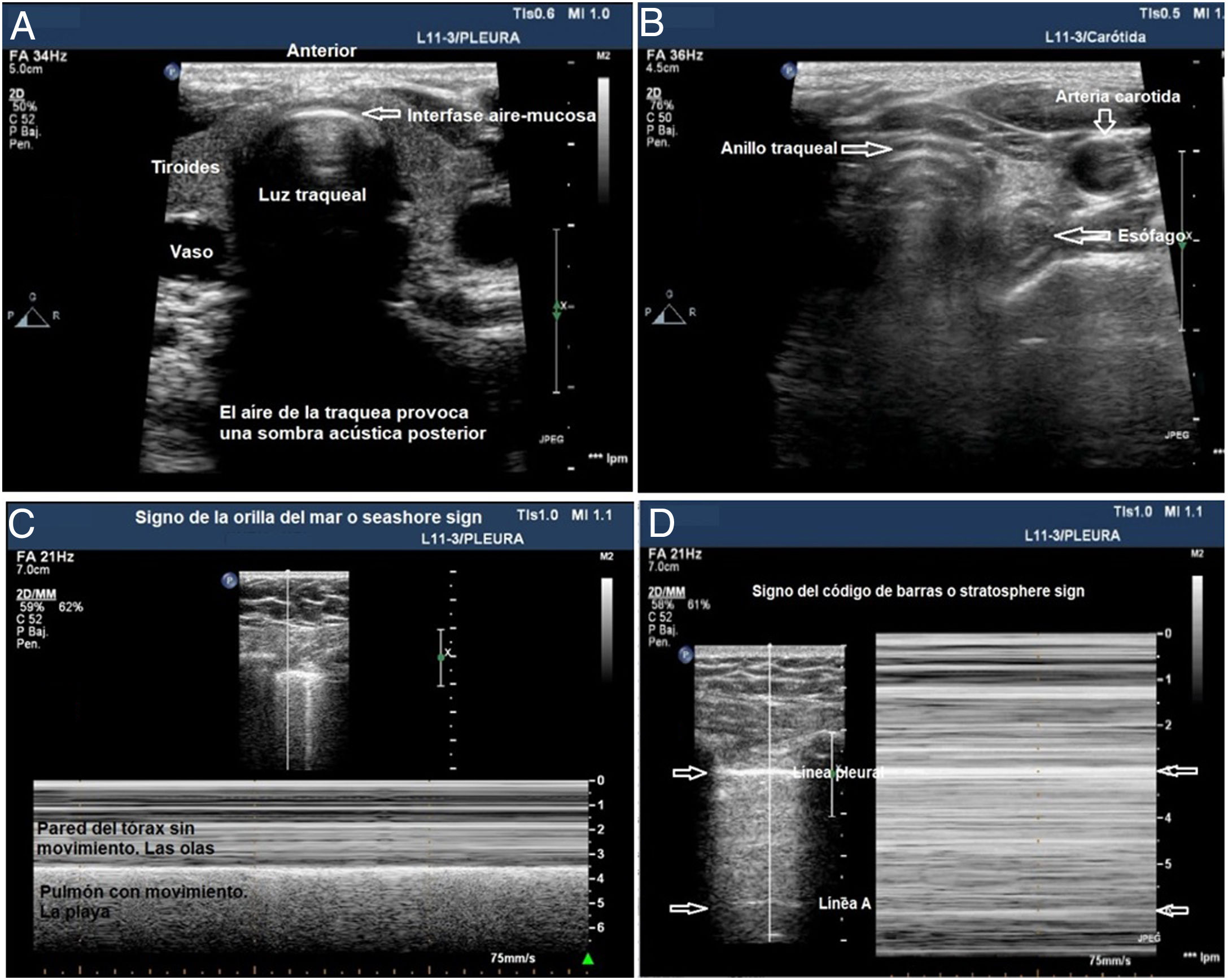
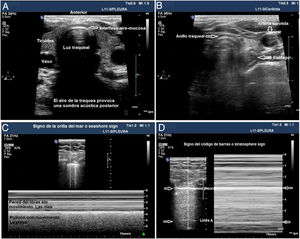
La ecografía traqueal ha mostrado tener el mismo valor que la capnografía para la exclusión de la intubación esofágica17. Para ello, es necesario utilizar una sonda lineal o convex y adquirir un plano transversal en la región anterior del cuello, en la línea media, encima de la escotadura esternal. En este plano, la tráquea se identifica como una línea hiperecogénica con forma de U invertida, generada por la interfase mucosa-vía aérea, y un artefacto posterior en cola de cometa (fig. 1A). La intubación correcta de la tráquea no produce cambios en la imagen descrita, dado que no se genera una nueva interfase entre la vía aérea del paciente y el TOT (ambas contienen aire) y, porque además, el TOT se encuentra detrás del artefacto generado por la tráquea (lo que limitaría su visualización). La intubación inadvertida del esófago se identifica ecográficamente porque produce una nueva interfase entre la mucosa esofágica y el aire contenido en el interior del TOT, que da lugar a un segundo artefacto en cola de cometa que nace a un nivel más profundo que la tráquea, y lateral a ésta (fig. 1B). La principal ventaja de esta exploración es que no precisa iniciar la ventilación para detectar la posición incorrecta del TOT, evitando la posibilidad de aspiración de contenido gástrico; las limitaciones son la imposibilidad para visualizar el TOT de forma directa en el interior de la vía aérea y las posibles alteraciones anatómicas que presente el paciente.
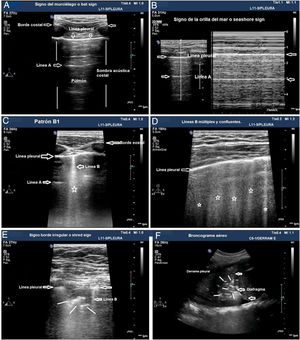
Utilidad de la ecografía traqueal y pleural para la comprobación de la IOT. A) Imagen de ecografía traqueal donde se visualiza la tráquea con su sombra acústica posterior y rodeada por la tiroides. B) Imagen de ecografía traqueal con el trasductor desplazado hacia la zona izquierda del cuello, la flecha señala cómo identificar el esófago. C) Imagen de ecografía pleural con patrón de aireación normal que indica que el pulmón está insuflado. D) Imagen de ecografía pleural con signo de código de barras que indica que el pulmón no está insuflado, posible intubación selectiva contralateral.
La ecografía pleural proporciona información anatómica directa sobre la expansión pulmonar y la entrada de aire en los pulmones18. Puede sustituir a la auscultación y a la radiografía de tórax como métodos para excluir la intubación bronquial selectiva inadvertida (IBSI). Para ello, es necesario utilizar una sonda lineal o convex y examinar, al menos, los puntos superior e inferior del protocolo BLUE en ambos hemitórax19. En estos planos, en ecografía 2D, la pleura se identifica como una línea hiperecogénica horizontal, que presenta un movimiento generado por el deslizamiento de la superficie de la pleura parietal sobre la visceral con los movimientos respiratorios, denominado lung sliding o signo del deslizamiento pulmonar20. En modo M se puede registrar también de forma estática cortando la línea pleural, lo que produce una imagen denominada seashore sign o signo de la orilla de la playa. La presencia de ambos signos en cada hemitórax es indicativa de insuflación bipulmonar (fig. 1C). La IBSI tiene como consecuencia la ausencia de aireación del pulmón contralateral, que se detecta mediante la ausencia de lung sliding, y un patrón en «código de barras» o signo estratosfera en modo M (fig. 1D). La transformación de un patrón en código de barras unilateral en un patrón de deslizamiento pulmonar normal, asociado a la retirada parcial del TOT, confirma que la posición inicial del tubo correspondía a una IBSI del pulmón contralateral (Algoritmo 1). Las principales ventajas de esta exploración son la posibilidad de demostrar aireación pulmonar sin utilizar fonendoscopio e inmediatez frente a la radiografía de tórax (Rx), la principal limitación deriva de la existencia de diagnósticos diferenciales del signo de la estratosfera (ausencia de ventilación, neumotórax, tumores, etc.).
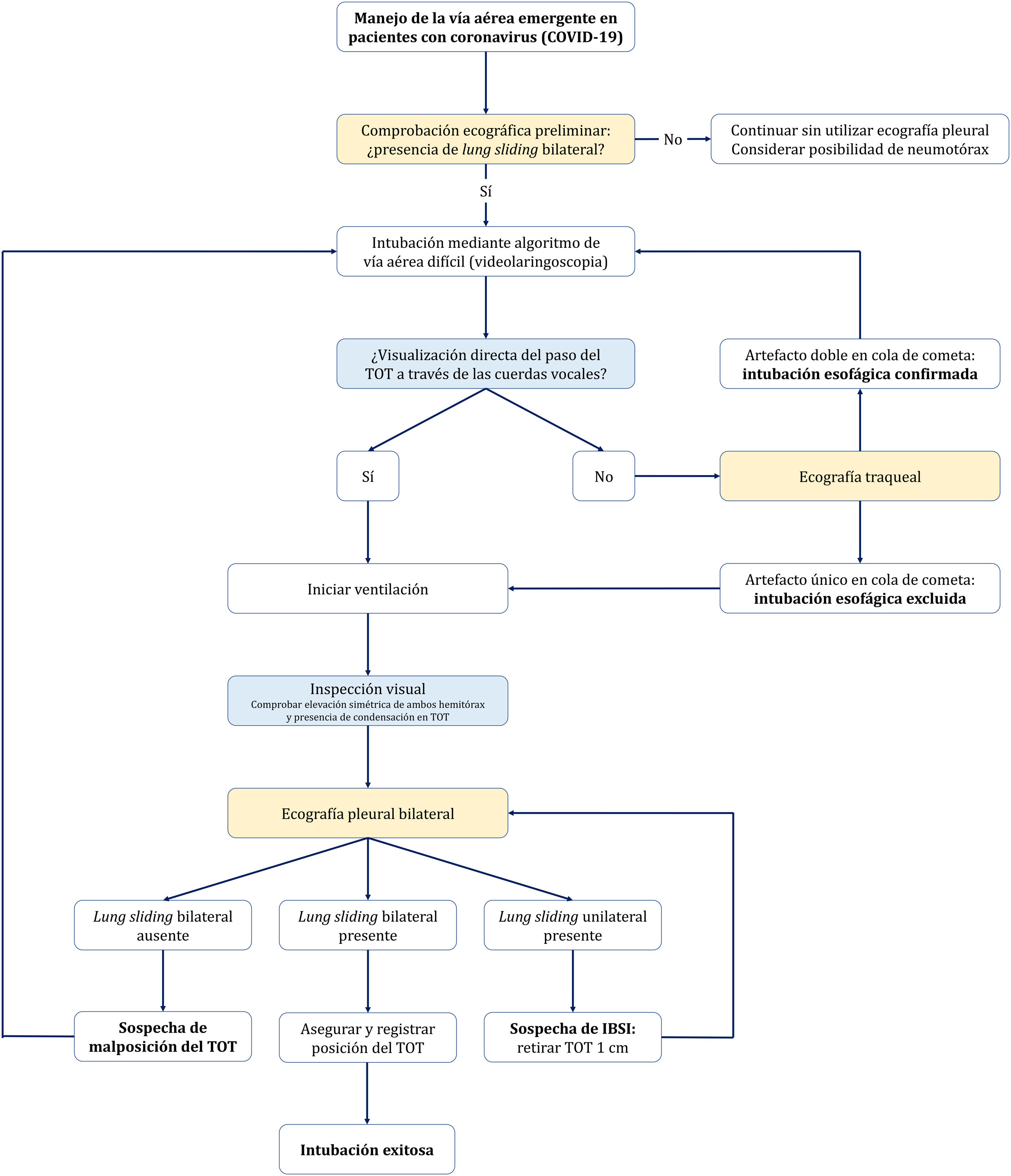
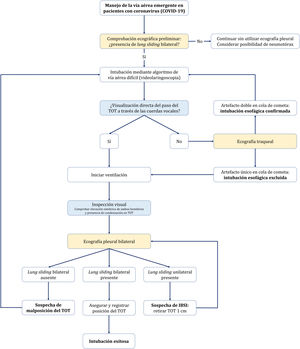
Manejo de la vía aérea emergente en pacientes con coronavirus.
Algoritmo de manejo de la vía aérea emergente en pacientes con coronavirus, mediante un abordaje integral que incluye la inspección visual y la aplicación de la ecografía. Antes de iniciar la intubación, es necesario asegurar la presencia de lung sliding bilateral. Tras la comprobación preliminar, se iniciará la IOT aplicando el algoritmo de vía aérea difícil de cada centro, siendo recomendable utilizar la videolaringoscopia como primer dispositivo. La visualización directa del paso del TOT a través de las cuerdas vocales permite iniciar la ventilación, proceder a identificar signos visuales de una adecuada intubación y ajustar la posición del TOT mediante ecografía pleural bilateral. La no visualización del paso del TOT a través de las cuerdas vocales obliga a excluir la posibilidad de intubación esofágica antes de iniciar la ventilación, con la finalidad de evitar aspiración bronquial de contenido gástrico.
En la pandemia COVID-19 el rasgo característico en los pacientes graves es el desarrollo de neumonía que progresa hacia SDRA, con un patrón característico y diagnóstico en la tomografía computarizada (TC)1.
La evaluación de los pacientes con IRA a través del protocolo BLUE (bedside lung ultrasound in emergency) es una de las aplicaciones bien conocidas y consolidadas de la ecografía pulmonar19. Aunque la bibliografía disponible sobre la utilidad del ultrasonido pulmonar (UP) para evaluar a los pacientes con sospecha de infección por SARS-CoV-2 y sus potenciales aplicaciones es aún escasa, existen datos que evidencian la buena correlación entre los hallazgos de UP vs. TC torácico6.
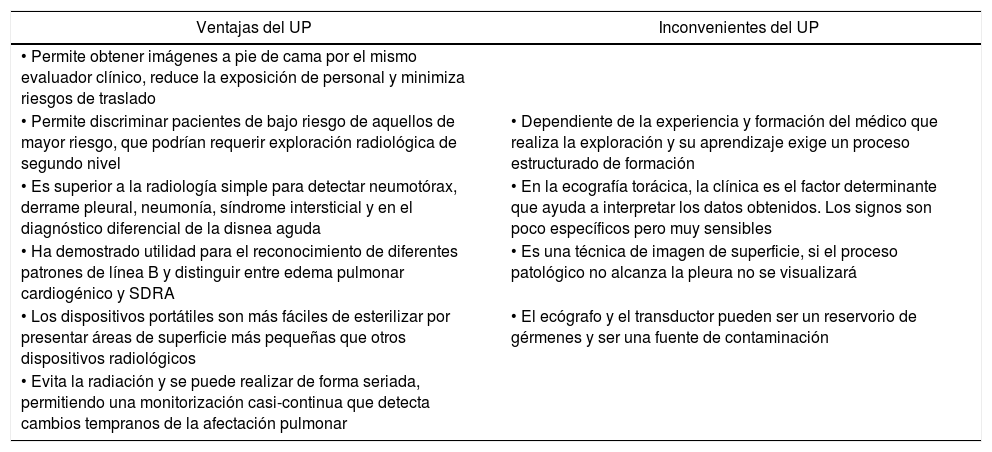
Las dificultades de movilización, alto riesgo de difusión del microorganismo durante el traslado, y la desinfección posterior de las salas de radiología hacen que, aunque TC sea la modalidad de imagen recomendada, el UP sea una alternativa diagnóstica válida que permite evaluar el grado de afectación pulmonar a pie de cama mediante el análisis de patrones ecográficos específicos21. El UP no debe entenderse de forma aislada sino que se complementa con la ecocardiografía en muchas de las patologías del paciente crítico22,23. Las ventajas y limitaciones del UP se presentan en la tabla 2.
Principales ventajas e inconvenientes de la ecografía pulmonar
| Ventajas del UP | Inconvenientes del UP |
|---|---|
| • Permite obtener imágenes a pie de cama por el mismo evaluador clínico, reduce la exposición de personal y minimiza riesgos de traslado | |
| • Permite discriminar pacientes de bajo riesgo de aquellos de mayor riesgo, que podrían requerir exploración radiológica de segundo nivel | • Dependiente de la experiencia y formación del médico que realiza la exploración y su aprendizaje exige un proceso estructurado de formación |
| • Es superior a la radiología simple para detectar neumotórax, derrame pleural, neumonía, síndrome intersticial y en el diagnóstico diferencial de la disnea aguda | • En la ecografía torácica, la clínica es el factor determinante que ayuda a interpretar los datos obtenidos. Los signos son poco específicos pero muy sensibles |
| • Ha demostrado utilidad para el reconocimiento de diferentes patrones de línea B y distinguir entre edema pulmonar cardiogénico y SDRA | • Es una técnica de imagen de superficie, si el proceso patológico no alcanza la pleura no se visualizará |
| • Los dispositivos portátiles son más fáciles de esterilizar por presentar áreas de superficie más pequeñas que otros dispositivos radiológicos | • El ecógrafo y el transductor pueden ser un reservorio de gérmenes y ser una fuente de contaminación |
| • Evita la radiación y se puede realizar de forma seriada, permitiendo una monitorización casi-continua que detecta cambios tempranos de la afectación pulmonar |
UP: ultrasonido pulmonar.
La exploración se realiza en la posición de decúbito supino, dividiendo cada hemitórax en cuadrantes24. Los artículos que evalúan la utilidad de valorar diferentes patrones ecográficos de aireación del pulmón para obtener una puntuación analizan seis áreas en cada hemitórax delimitadas por tres líneas longitudinales (eje largo de clavícula a diafragma) a nivel esternal, axilar anterior y axilar posterior como referencias anatómicas que delimitan tres áreas diferentes: anterior (uno y dos), lateral (tres y cuatro) y posterior (cinco y seis). Trazando una línea transversal a nivel de la mamila estas áreas se dividen en superior e inferior. De esta forma se establecen seis zonas de exploración, para analizar las mismas regiones cuando se realiza de forma evolutiva y que en un estudio piloto reciente ha demostrado no ser inferior a los protocolos que utilizan más cuadrantes25. El derrame pleural (DP) y la presencia de consolidación se analizan en la zona seis o equivalente al punto PLAPS (posterolateral alveolar and/or pleural syndrome) del protocolo BLUE24 (Anexo 2 de MES).
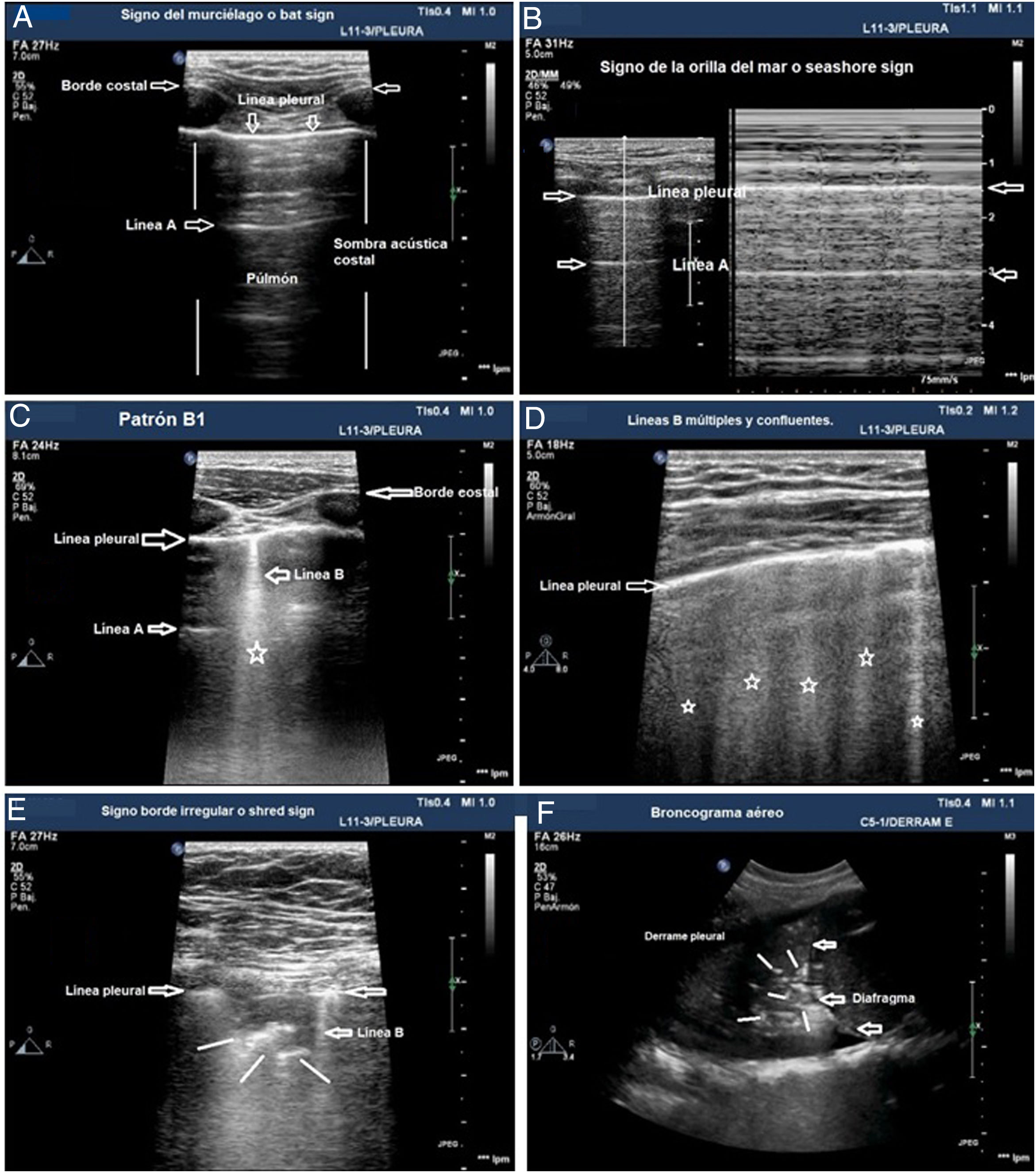
Los patrones de aireación de cada región pulmonar son (fig. 2):
- •
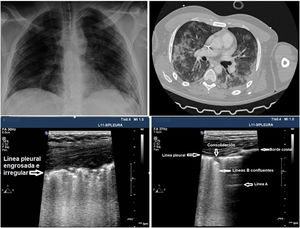
Patrón A: patrón típico de aireación normal. Línea pleural con deslizamiento conservado, presencia de líneas A y ≤ 2 líneas B bien espaciadas (fig. 2A y B).
- •
Patrón B1: presencia de más de dos líneas B bien espaciadas, difusas en las distintas áreas del tórax, denominadas septal rockets (fig. 2C).
- •
Patrón B2: líneas B confluentes separadas entre ellas por ≤ 3 mm (ground-glass rockets) debido a pérdida más severa de pulmón aireado (fig. 2D).
- •
Patrón C: consolidación pulmonar, que sugiere pérdida importante de pulmón aireado por acúmulo de líquido y/o células en los alveolos. La consolidación puede detectarse en cualquier punto del hemitórax, pero la aplicación del transductor en el punto PLAPS detecta el 95% de los casos (fig. 2E y F).
Patrones de aireación pulmonar. A) Patrón típico de aireación normal (perfil A en el protocolo BLUE) mostrando imagen en 2D. B) Patrón A en modo M. C) Patrón B1. D) Patrón B2. E) Consolidación pulmonar (perfil C en el protocolo BLUE), mostrando signo del borde irregular o shred sign. F) Broncograma aéreo. A, B, C, D y E: estudio con sonda lineal; F: sonda convex.
Los patrones A, B1 y B2 incluyen la presencia de deslizamiento pulmonar (anexo 3 de MES).
En el caso de los pacientes con COVID-19 los hallazgos característicos dependen de la fase evolutiva de la enfermedad. Las primeras manifestaciones en el UP están representadas por una distribución irregular de líneas B focales y posteriormente confluentes que se extienden a múltiples áreas de la superficie pulmonar. La evolución posterior está representada por la aparición de pequeñas consolidaciones subpleurales con línea pleural engrosada e irregular con áreas asociadas de pulmón blanco, presencia de áreas parcheadas de patrón A y áreas con anomalías sin presencia de grandes DP. La evolución será hacia un patrón de consolidación, especialmente en zonas declives, con o sin broncograma aéreo, y su extensión creciente en la superficie pulmonar indica progresión hacia la fase de IRA que puede requerir VM.
La relación aire/líquido determina la apariencia ecográfica del pulmón y proporciona diferentes patrones según el grado de parénquima aireado, lo que permite asignar una puntuación diferente a cada una de las zonas de estudio.
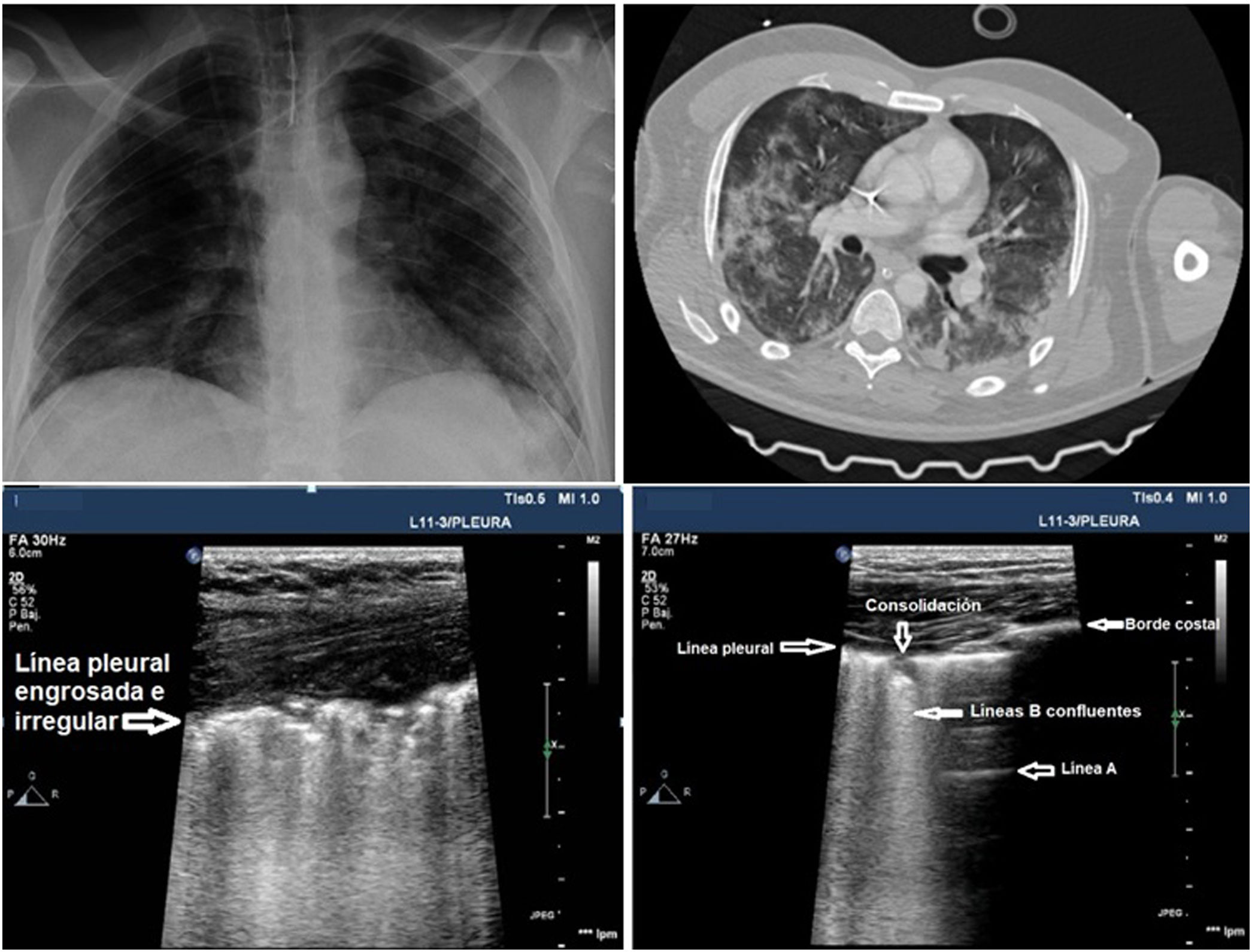
El UP puede ser útil para monitorizar la evolución de la enfermedad mediante la utilización del Lung Ultrasound Score (LUS)26,27. En este sistema de puntuación se utiliza el modelo de exploración de 12 regiones (anexo 4 de MES). La puntuación se calcula sobre la base del peor patrón de ultrasonido detectado en cada una de las 12 regiones examinadas, asignando un valor de: patrón A = 0 puntos; B1 = 1 punto; B2 = 2 puntos; C = 3 puntos. La puntuación total es la suma de los puntos asignados a cada región (desde 0, puntuación que denotaría el pulmón totalmente aireado, a un máximo de 36, que se traduciría en un pulmón totalmente condensado). Durante la evolución de la infección por SARS-CoV-2 en la UCI los pacientes presentan habitualmente mejoría de los infiltrados en la Rx de tórax, pero el UP evidencia hallazgos patológicos que persisten más tiempo, con engrosamiento de la línea pleural y abundantes líneas B, que podrían predecir dificultad para la desconexión de la VM y fracaso en el weaning27 (fig. 3). La puntuación LUS ayuda a conocer la masa pulmonar aireada y puede aportar información clínica y pronóstica, por lo que este score podría utilizarse para predecir los pacientes que requieren ingreso hospitalario tras acudir con fiebre y disnea a los servicios de urgencias y, además, detectar pacientes que pueden fracasar en el destete de la VM en la UCI. Son necesarios estudios para validar esta puntuación en los pacientes con neumonía por SARS-CoV-2.
Otras patologías pulmonares, aunque no son frecuentes en la fase precoz de la neumonía por SARS-CoV-2, pueden aparecer durante la evolución de la enfermedad, como el neumotórax o el derrame pleural.
NeumotóraxLa detección de neumotórax es importante en la evaluación de barotrauma asociado a la VM o el iatrogénico tras maniobras de reclutamiento o canalización de vías centrales (CVC). El UP se confirma como una alternativa a la Rx de tórax en el diagnóstico del neumotórax con una especificidad alrededor del 98% y sensibilidad en torno al 75%28,29.
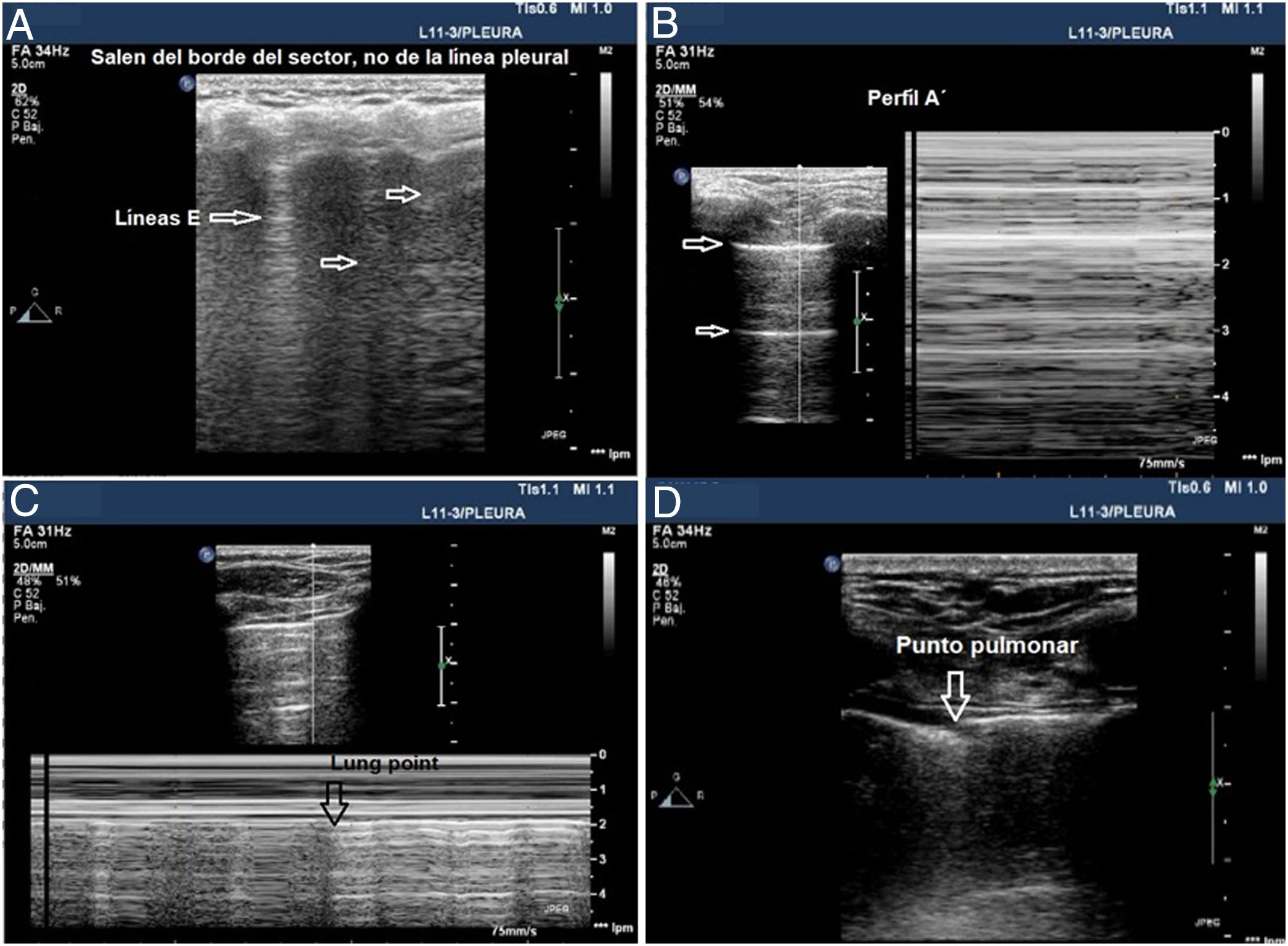
Aunque se pueda realizar un estudio sistemático en un paciente inestable en decúbito supino y dado que el aire tiende a ocupar la parte anterior del tórax, se debe comenzar explorando los campos anteriores. Una sonda lineal o microconvex es suficiente para el análisis de la línea pleural y para evaluar los artefactos pulmonares (fig. 4).
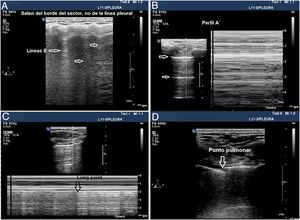
Signos en la ecografía pleural de barotrauma. A) Líneas E, artefacto vertical que no salen de la línea pleural en relación con enfisema subcutáneo. B) Patrón de líneas A y ausencia de deslizamiento pleural, que se confirma con el modo M, en la parte de la izquierda, que representa el signo de la estratosfera. C) Imagen confirmatoria de neumotórax y señala el punto de despegamiento de ambas pleuras visceral y parietal (lung point) en modo M. D) Imagen en 2D del punto pulmonar, zona de despegamiento de ambas pleuras.
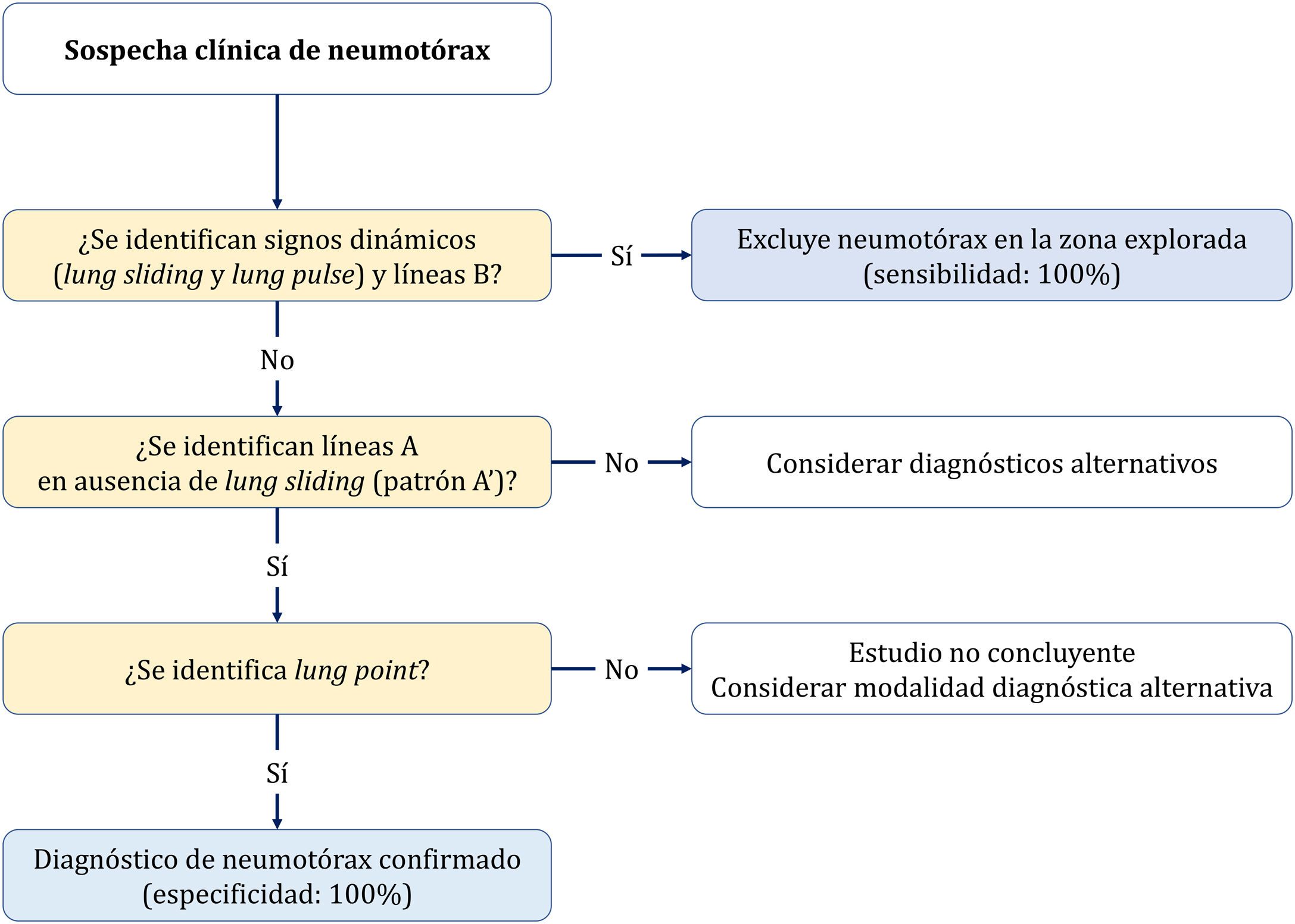
Tres signos excluyen neumotórax20,30:
- •
La presencia de deslizamiento (lung sliding) indica que ambas capas pleurales están en contacto, excluye neumotórax (VPN 100%) en el espacio donde el transductor está colocado. Sin embargo, su ausencia no lo confirma por su baja especificidad.
- •
Visualizar una sola línea B indica que ambas capas están adheridas, lo excluye con VPN 100%. Mucha precaución en no confundirlas con las líneas E (líneas hiperecoicas verticales, que se inician en los tejidos blandos de la pared torácica en presencia de enfisema subcutáneo) (fig. 4A).
- •
Presencia del signo del latido pulmonar (lung pulse): movimiento pulsátil de la línea pleural sincrónico con los latidos del corazón en ausencia de deslizamiento pulmonar indica que la pleura parietal y visceral están en contacto, pero la ventilación regional está alterada (por ejemplo, atelectasia) debido a que el aire entre las capas pleurales impide su transmisión.
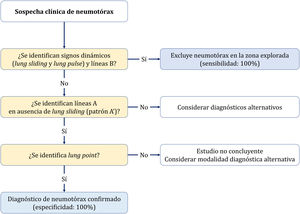
El diagnóstico se establece de forma secuencial con dos signos (Algoritmo 2).
- •
Deslizamiento pulmonar (lung sliding) abolido con presencia de líneas A (perfil A’ en el protocolo BLUE) (fig. 4B).
- •
Localizar el punto de contacto entre el pulmón colapsado y la colección de aire del neumotórax (punto pulmonar o lung point) (fig. 4C y D). Es un signo dinámico que muestra la alternancia de deslizamiento normal y abolido durante la ventilación en 2D o por la sucesión de imágenes normales (signo de la orilla) durante la inspiración y líneas horizontales (signo de la estratosfera o código de barras) durante la espiración en modo M. Es un signo específico con una sensibilidad del 66% y una especificidad del 100% para diagnosticar neumotórax30. Cuanto más lateral e inferior está el punto pulmonar en la pared torácica, mayor es su extensión. Un punto pulmonar muy posterior o ausente sugiere un neumotórax masivo con atelectasia completa del pulmón31.
El derrame pleural (DP) es una complicación poco frecuente en el COVID-19. Cabe recordar que la Conferencia Internacional de Consenso sobre Ultrasonido Pulmonar establece que «para la detección de DP, el UP es más preciso que la Rx en supino y es tanto como la TC» (nivel A)32.
El DP tiende a acumularse por gravedad en las partes declives de tórax por lo que la exploración debe comenzar cerca del diafragma, usando una sonda convex, siendo el punto PLAPS donde mejor se detecta. El DP se visualiza como un espacio libre de ecos, a menudo anecoico, entre las capas parietal y visceral de la pleura y situado siempre por encima del diafragma33. El diafragma permite diferenciar entre el DP y la ascitis.
La apariencia del DP deberá interpretarse dentro del contexto clínico y no valorar su apariencia de forma aislada para tomar decisiones terapéuticas, ya que un DP anecoico puede corresponder tanto a un exudado como a un trasudado34 (anexo 5 de MES).
Ecografía vascularUno de los hallazgos más frecuentes en la enfermedad grave por el SARS-CoV-2 es una profunda alteración de la hemostasia, cuya aparición tiene implicaciones pronósticas. Más de dos tercios de los pacientes que fallecen por esta enfermedad cumplen los criterios diagnósticos de coagulación intravascular diseminada (CID) propuestos por la ISTH (International Society on Thrombosis and Haemostasis), mientras que la frecuencia entre los supervivientes es del < 1%35.
El componente predominante de la alteración hemostática no es la diátesis hemorrágica, sino un estado protrombótico, que se asocia a fenómenos tromboembólicos venosos y de trombosis microvascular, con niveles elevados de dímero D y fibrinógeno. En los pacientes críticos, estos fenómenos implican una mayor incidencia de trombosis en dispositivos intravasculares y de fenómenos oclusivos vasculares35,36.
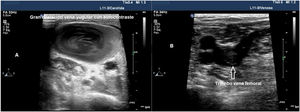
La ecografía vascular permite identificar algunos fenómenos trombóticos e iniciar una estrategia terapéutica dirigida a su control y prevención, lo que podría mejorar el pronóstico37. Para su estudio es necesario el uso de una sonda lineal de alta frecuencia (7-15 MHz), que permite explorar el territorio venoso, con énfasis en las zonas de inserción de los CVC y completar el estudio en los vasos venosos de ambas piernas hasta la vena poplítea. Se ha estimado que el 90% de los émbolos de los pacientes con tromboembolismo pulmonar proceden de las venas proximales de las extremidades inferiores. Los trombos se visualizan como material ecogénico en el interior del vaso, pero los trombos inmaduros pueden no ser ecogénicos y, en ocasiones, son compresibles parcialmente debido a su consistencia gelatinosa. Por tanto, el criterio diagnóstico principal es la ausencia de comprensibilidad del vaso y no la visualización de un coágulo.
El uso de la ecografía vascular aumenta la seguridad y la efectividad durante la inserción de los CVC, en comparación con técnicas basadas en referencias anatómicas38-40. Previo al inicio de la punción, debemos explorar los accesos vasculares para determinar el más adecuado y detectar las variables anatómicas vasculares41. En caso de trombosis venosa y/o alteración anatómica, se debe cambiar la vena de acceso42 (fig. 5). El tamaño del vaso objetivo a canalizar es importante y, en condiciones ideales, el diámetro externo del catéter debe corresponder como máximo a un tercio del diámetro interno de la vena (por ejemplo, un catéter de 4 French necesita una vena de 4 mm). El riesgo de trombosis aumenta cuando el calibre del catéter utilizado es mayor al recomendado43. Es necesario mantener las medidas de asepsia, incluyendo el uso de gel estéril y funda protectora de la sonda para disminuir el riesgo de bacteriemia asociada a catéter.
Se recomiendan dos abordajes: ecoguiado, se realiza la ecografía previa a la punción para estudio del vaso objetivo, analizando su tamaño, profundidad, permeabilidad y punción vascular, según técnica de Seldinger, que visualiza la punta de la aguja durante su inserción en el interior del vaso durante el procedimiento, así como el avance de la guía metálica y posterior posición del catéter y ecodirigido: tras la comprobación del tamaño del vaso y ausencia de trombos en su interior, la punción se realiza sin visualización de la aguja con el ecógrafo39 (anexo 6 de MES).
EcocardiografíaLa afectación cardiovascular y cardiaca por SARS-CoV-2 parece asociarse a mayor mortalidad. La lesión miocárdica se evidencia por la elevación de biomarcadores de daño miocárdico (troponina I o T o péptidos natriuréticos), que ha sido reportada con una incidencia elevada (7-28%)44-48, estando relacionada con un mayor porcentaje de ingresos en SMI, mayor necesidad de VM, coagulopatía, fracaso renal agudo y mayor mortalidad44-47.
El mecanismo de daño miocárdico es complejo, pero la lesión directa mediada por la enzima convertidora de angiotensina 2 (ECA2), la hipoxia y posibilidad de una tormenta inflamatoria de citocinas se han postulado en su patogenia49,50. Existen dos tipos de patrón de lesión miocárdica:
- •
Subagudo: consiste en un aumento progresivo de los biomarcadores de daño miocárdico y de inflamación (dímero D, ferritina, lactato, etc.) con una evolución lenta y deterioro progresivo de las funciones orgánicas, en probable relación con una lesión secundaria a una tormenta de citocinas o una linfohistiocitosis hemofagocítica, que produce la muerte del paciente aproximadamente entre la segunda y tercera semana desde el inicio de los síntomas.
- •
Agudo: afectación de aparición súbita, con evolución desfavorable que produce una disfunción miocárdica fulminante en pocas horas, siendo compatible con una miocarditis o una miocardiopatía por estrés. Con base en la evidencia actual este segundo patrón aparentemente es poco frecuente51-53.
La ecocardiografía, tanto en un nivel básico como avanzado, resulta fundamental para el manejo de los pacientes infectados por SARS-CoV-2 con shock o daño miocárdico y la detección de cor pulmonale agudo (CPA) (tabla 3). Es necesario conocer las interacciones producidas entre el pulmón y el corazón de los pacientes en VM, y las de éstos con fármacos vasoactivos e inotrópicos y sistemas de oxigenación de membrana extracorpórea (ECMO)54,55.
Indicaciones de la ecocardiografía en el paciente con COVID-19
| • Elevación progresiva de biomarcadores de daño miocárdico (troponina T o I, hs-cTn, BNP, NT-proBNP) |
| • Electrocardiograma con signos sugestivos de isquemia o hallazgos de aparición reciente respecto a electrocardiogramas previos |
| • Requerimiento de drogas vasoactivas a dosis elevadas o en ascenso, sin causa filiada. |
| • Inestabilidad hemodinámica súbita |
| • Empeoramiento respiratorio súbito con inestabilidad hemodinámica |
| • Sospecha de cor pulmonale agudo |
| • Niveles de dímero D elevados, que hagan sospechar tromboembolismo pulmonar |
| • Estudio de función cardiaca previo al inicio de soporte ECMO |
ECMO: oxigenador con membrana extracorpórea.
Se deben realizar los estudios ecocardiográficos según las recomendaciones internaciones de cuantificación cardiaca56. Ante la elevada carga asistencial derivada de la situación de pandemia es importante minimizar el tiempo dedicado a cada estudio, por lo que es preferible realizar ecocardiografías orientadas que proporcionen respuesta a preguntas sencillas57.
En los pacientes con elevación de biomarcadores de daño miocárdico se debe realizar estudio diferencial de infarto agudo de miocardio (IAM), miocarditis o tromboembolismo pulmonar (TEP).
La función sistólica del ventrículo izquierdo (VI) es el elemento más estudiado de la ecocardiografía y constituye un aspecto esencial de la exploración. Mantener un gasto cardiaco adecuado no sólo depende de la contractilidad cardiaca, sino de la precarga, la postcarga, la frecuencia cardiaca y de una sincronía adecuada en la contractilidad segmentaria. Se debe tener en cuenta el efecto de todos estos factores a la hora de interpretar los hallazgos ecocardiográficos.
La fracción de eyección del ventrículo izquierdo (FEVI) se calcula habitualmente por el método biplano. Sin embargo, una estimación visual cualitativa o semicuantitativa ha demostrado una buena correlación con el método estándar en los pacientes críticos, debido a la peor definición del borde endocárdico en esta población, por lo que puede ser una alternativa válida2,58. Cabe destacar que la FEVI está ampliamente influenciada por la contractilidad y la postcarga del VI59. Por consiguiente, no representa de forma adecuada la capacidad contráctil del VI en una situación aguda, sino la forma en que la cavidad se adapta a las condiciones de carga, que puede presentar cambios dinámicos muy importantes en los estados de shock60.
La enfermedad por SARS-CoV-2 produce frecuentemente afectación de la contractilidad segmentaria. Cuando estas alteraciones se identifican en el territorio teórico de una arteria coronaria debe sospecharse la posibilidad de isquemia aguda secundaria a IAM tipo 1, en especial si se asocia a cambios electrocardiográficos congruentes y elevación de biomarcadores de daño miocárdico. Sin embargo, estudios publicados durante la pandemia muestran mayor incidencia de IAM tipo 2. Cuando estas alteraciones son difusas o no se corresponden con el territorio de distribución teórico de una arteria coronaria, deben sospecharse diagnósticos alternativos, como la miocarditis o la miocardiopatía por estrés, sobre todo en pacientes inestables44,50,61.
La miocarditis es una entidad frecuentemente asociada a las infecciones por virus, con una amplia gama de presentaciones clínicas, que varían desde un cuadro leve a una situación de shock cardiogénico o arritmias ventriculares que pueden ocasionar la muerte del paciente. El coronavirus SARS-CoV-2 podría lesionar el miocardio por acción directa o indirecta, mediada por la respuesta inflamatoria que desencadena. El cuadro debe sospecharse en pacientes con alteraciones electrocardiográficas y elevación de biomarcadores cardiacos. Aunque el gold standard para el diagnóstico es la biopsia endomiocárdica, en la práctica clínica habitual se establece con base en los hallazgos de la resonancia magnética (RM) cardiaca. Sin embargo, los riesgos potenciales de trasladar a un paciente crítico a una RM para su diagnóstico, junto con la dificultad técnica que implica la VM, la convierte en una exploración poco viable en muchos pacientes. La ecocardiografía puede ayudar en el diagnostico de miocarditis fulminante al visualizar un engrosamiento agudo de las paredes ventriculares secundario a edema intersticial, acompañado de alteraciones de la contractilidad segmentaria, que condicionan una disminución de la FEVI y, ocasionalmente, dilatación del VI, disfunción del ventrículo derecho (VD) y derrame pericárdico sin signos de compromiso hemodinámico57.
La miocardiopatía por estrés, síndrome de balonización apical o síndrome de Tako-Tsubo es un síndrome clínico, desencadenado generalmente por un factor estresante (como puede ser la infección por SARS-CoV-2). Se caracteriza por una disfunción ventricular izquierda transitoria debida a alteraciones regionales de la contractilidad segmentaria, asociada a cambios electrocardiográficos y elevación de biomarcadores cardiacos62. Se han descrito hasta cuatro patrones de alteraciones segmentarias, aunque el más frecuente es la hipocinesia o acinesia de los segmentos medios y apicales, con hipercontractilidad compensadora de los basales, que confiere al VI el aspecto típico balonizado. El diagnóstico diferencial de los patrones menos frecuentes con un síndrome coronario agudo o una miocarditis aguda, requiere la realización de RM cardiaca63.
Ecocardiografía en el paciente con shockAunque la ecocardiografía no proporciona información continua sobre el estado hemodinámico de un paciente, es una excelente herramienta que permite caracterizar la causa del estado de shock, elegir la mejor opción terapéutica y valorar la respuesta a la misma4. Las Guías Europeas de Monitorización Hemodinámica en el Paciente Crítico64 recomiendan la realización de ecocardiografía como mejor método de estudio de la función cardiaca y se establece la cuantificación de la integral velocidad-tiempo del flujo en el tracto de salida del VI (IVTTSVI) como único parámetro para la estimación del volumen sistólico de estos pacientes, omitiendo el cálculo del área del TSVI, y de monitorizar sus cambios tras medidas terapéuticas como la administración de fluidos, inotrópicos y vasopresores60,64 (anexo 7 de MES).
En el caso de la función sistólica global del VI se recomienda la medición de la IVTTSVI y la estimación visual cualitativa de la FEVI, desaconsejándose otros parámetros por ser más complejos de obtener, consumir más tiempo o presentar mayores limitaciones60.
En los pacientes que precisen soporte ECMO, es necesario realizar una ecocardiografía que valore la función cardiaca previo a la canulación, para elegir la modalidad más adecuada: veno-veno o veno-arterial65-67.
Ecocardiografía para la detección y manejo del cor pulmonale agudoEl cor pulmonale agudo (CPA) se define como el fallo ventricular derecho producido como consecuencia de un trastorno pulmonar primario que origina un incremento súbito en las resistencias vasculares pulmonares54. Las causas más frecuentes de CPA en los pacientes ingresados en un SMI son el SDRA y el TEP68. Los hallazgos ecocardiográficos que definen el CPA son69:
- •
Dilatación del ventrículo derecho
- •
Movimiento paradójico septal
- •
Dilatación de la vena cava inferior (VCI)
- •
Hipertensión pulmonar
- •
Disfunción sistólica del VD
El CPA es una causa frecuente de fallo circulatorio en el SDRA y puede asociarse a un incremento de la mortalidad en sus formas más graves70. Su detección obliga a adoptar una estrategia ventilatoria «con parámetros protectores cardiopulmonares», que debe controlar los principales determinantes del aumento de la postcarga del VD: control adecuado de las presiones meseta (<27 cmH2O) y de distensión (<18 cmH2O), optimización de la oxigenación y corrección de la hipercapnia71,72.
Valoración del tamaño del ventrículo derechoLa exploración del VD debe comenzarse en el plano paraesternal eje largo de VI (PLAX), que muestra el tamaño del VD y su relación con el VI. El plano paraesternal eje corto (PSAX), a nivel de los músculos papilares o válvula mitral, muestra al VD abrazando al VI en forma de semiluna. Cuando el VD se encuentra dilatado, la pared anterolateral es difícil de visualizar, apreciándose una rotación de la cavidad en sentido horario. El plano apical de cuatro cámaras (A4C) es el que proporciona mayor información sobre el tamaño del VD, al permitir la comparación con el VI. Para ello, es necesario obtener un plano A4C centrado en el VD, asegurando que no se produce fenómeno de foreshortening (acortamiento) del mismo y que no se visualiza el tracto de salida del VI (anexo 8 de MES)73. Aunque se pueden realizar medidas estandarizadas del VD, con puntos de corte específicos, habitualmente se utiliza la relación entre ambos ventrículos para determinar la dilatación del VD69:
- •
VD/VI < 0,6 → tamaño de VD normal.
- •
VD/VI = 0,6 – 1 → dilatación leve de VD.
- •
VD/VI > 1 → dilatación severa de VD.
El septo interventricular (SIV) es una estructura compartida por ambos ventrículos, aunque funcionalmente forma parte del VI en condiciones normales. Habitualmente, el SIV es convexo hacia VD y cóncavo hacia VI, manteniendo esta morfología durante todo el ciclo cardíaco. Sin embargo, en el CPA, se identifica un SIV aplanado durante todo el ciclo cardiaco, lo que le confiere un aspecto característico en forma de D.
Valoración de la vena cava inferior (VCI)La VCI se estudia en el plano subcostal. En el CPA es esperable encontrar una VCI dilatada (>21 mm) y con escaso colapso respiratorio. Su tamaño y colapsabilidad es el método ecográfico usado para estimar la presión de la aurícula derecha.
Valoración de la hipertensión pulmonarLa valoración de la hipertensión pulmonar mediante ecocardiografía se realiza habitualmente mediante el cálculo de la presión sistólica de la arteria pulmonar (PSAP) a través del cálculo de gradiente de la insuficiencia tricuspídea (anexo 9 de MES). Cuando es de poca entidad o la ventana acústica es subóptima, puede registrarse una mejor señal administrando 10 mL de suero salino agitado intravenoso. La PAD puede medirse con un CVC o estimarse a partir del tamaño y variación respirofásica de la VCI. En situaciones agudas de sobrecarga de presión el VD no es capaz de adaptarse con rapidez por lo que las presiones detectadas es estos casos suelen ser relativamente bajas (<60 mmHg).
Cuando la estimación de la PSAP por el método anterior no resulta posible, se puede utilizar el tiempo de aceleración de la arteria pulmonar (TAc) (anexo 9 de MES).
Valoración de la función sistólica del ventrículo derechoLa cuantificación de la función sistólica del VD debe seguir las recomendaciones de las guías internacionales56,74. Los parámetros más utilizados son la excursión sistólica del anillo tricuspídeo (tricuspid annular plane systolic excursión,TAPSE) y la velocidad máxima de la onda sistólica a nivel lateral del anillo tricuspídeo medida por doppler tisular (onda St), dado que son parámetros fáciles de obtener, reproducibles y con una buena correlación con otros métodos más complejos para estudiar la función sistólica del VD54 (anexo 10 de MES).
Ecocardiografía en el paciente en decúbito pronoUn gran porcentaje de pacientes con COVID-19 desarrollan SDRA con requerimiento de VM y maniobra de decúbito prono por IRA por largos periodos de tiempo. Durante estos periodos, muchos pacientes requieren un examen ecocardiográfico por diversas causas, sin embargo, movilizar al paciente a decúbito supino únicamente para esta prueba puede suponer un empeoramiento de su insuficiencia respiratoria. Las alternativas son la utilización de una sonda transesofágica o la realización de ecocardiografía transtorácica (ETT) en decúbito prono, para ello se debe colocar al paciente en posición de nadador con el miembro superior izquierdo estirado por encima de la cabeza. Se deberá elevar el hombro izquierdo colocando una almohada, colocando el transductor a nivel del quinto espacio intercostal izquierdo línea medioclavicular, para obtener todas las mediciones relacionadas al plano apical75 (fig. 6).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.