La membrana de oxigenación extracorpórea (ECMO) es un tipo de asistencia circulatoria que asocia elevada mortalidad. Sin embargo, superar la fase inicial de soporte mecánico no implica supervivencia ni a corto ni a largo plazo. Objetivo: describir las características y evolución de los pacientes con shock cardiogénico refractario (SCR) asistidos con ECMO veno-arterial (ECMO-VA) en un hospital con programa de trasplante cardíaco.
DiseñoEstudio de cohortes y retrospectivo de centro único.
ÁmbitoUCI cardiológica de un hospital terciario.
PacientesUn total de 46 pacientes asistidos consecutivamente con una ECMO-VA durante 6 años.
IntervencionesAnálisis de la mortalidad hospitalaria tras la retirada del soporte mecánico, de la supervivencia global (SG) y de los factores asociados.
ResultadosQuince pacientes (33%) fallecieron con la ECMO-VA y 31 (67%) sobrevivieron a su retirada tras un soporte de 8 días (RIC: 5-15); 14 pacientes fueron trasplantados. La mortalidad hospitalaria en estos pacientes fue del 32% (10/31) y se relacionó con: edad (p=0,001), SAPS-II (p=0,009), sangrado de cánulas (p=0,01), indicación de SCR post-IAM (p=0,001). Con una mediana de seguimiento de 27 meses (RIC: 11-49), seguían vivos el 91% de los pacientes que fueron dados de alta del hospital. La SG tras la retirada de la ECMO-VA se relacionó con el tipo de indicación (p=0,002), teniendo peor pronóstico los pacientes con SCR postinfarto.
ConclusionesEn nuestra experiencia, la ECMO-VA es un tipo de asistencia mecánica que puede utilizarse en el manejo del SCR. Asocia una mortalidad precoz elevada, pero tras superar la fase hospitalaria la supervivencia de los pacientes es buena.
Extracorporeal membrane oxygenation (ECMO) affords mechanical circulatory assistance associated to high mortality. However, weaning from such mechanical support may not imply improved short- or long-term survival. This study describes the characteristics and evolution of patients with refractory cardiogenic shock (RCS) subjected to venoarterial ECMO (VA-ECMO) in a hospital with a heart transplant program.
DesignA single-center, retrospective cohort study was carried out.
SettingThe cardiovascular ICU of a tertiary hospital.
PatientsForty-six patients consecutively subjected to VA-ECMO over 6 years.
InterventionsHospital mortality after weaning from ECMO and overall survival (OS) were analyzed.
ResultsFifteen patients (33%) died with VA-ECMO and 31 (67%) were weaned after 8 days of support (IQR: 5-15). Fourteen patients under went transplantation. Hospital mortality in these patients was 32% (10/31), and was associated to age (P=.001), SAPS II score (P=.009), cannulation bleeding (P=.01) and post-acute myocardial infarction RCS (P=.001). After a median follow-up of 27 months (IQR: 11-49), 91% of the patients discharged from hospital were still alive. Overall survival after weaning from assistance was associated to the type of cardiac disease (P=.002). Patients with RCS after acute myocardial infarction had a poorer prognosis.
ConclusionsIn our experience, VA-ECMO can be used as mechanical assistance in the management of RCS. The technique is associated to high early mortality, though the long-term survival rate after hospital discharge is good.
La membrana de oxigenación extracorpórea (ECMO) es un tipo de asistencia circulatoria que ha sido desarrollada a partir del bypass cardiopulmonar1. Esta técnica es capaz de proporcionar soporte vital prolongado, desde días a semanas, a pacientes con shock cardiogénico refractario y/o insuficiencia respiratoria severa potencialmente reversible y refractaria a las terapias convencionales máximas2-6. Los pacientes con shock cardiogénico, que son tratados con fármacos vasoactivos e inotrópicos y asistidos con frecuencia con balón de contrapulsación intraaórtico (BCIA), cuando este tratamiento fracasa asocian una mortalidad elevada, entre el 40-60%7,8.
Respecto a la ECMO veno-arterial (ECMO-VA), los resultados de la experiencia en España son escasos9-11. A nivel internacional no existe ningún ensayo clínico aleatorizado, pero los estudios disponibles arrojan tasas de mortalidad a los 30 días del implante muy variables, entre el 35 y el 70% dependiendo del tipo de indicación2,3,12-16. Esta elevada mortalidad precoz de los pacientes asistidos con ECMO-VA se debe fundamentalmente al desarrollo de fracaso multiorgánico (FMO) refractario13. No obstante, sobrevivir a la fase inicial de soporte mecánico no implica necesariamente la supervivencia de los pacientes con shock cardiogénico refractario y, aunque pocos trabajos lo han analizado, la mortalidad hospitalaria de los enfermos que han sido destetados con éxito de la membrana de oxigenación extracorpórea sigue siendo elevada, entre el 31 y el 59%17,18.
Finalmente, analizar la evolución de los pacientes a largo plazo tras una enfermedad aguda es esencial para justificar el nivel de inversión realizado. De hecho, la supervivencia a largo plazo después de una enfermedad grave se ha reconocido como un «end-point» terapéutico importante en la evaluación de la eficacia de nuevas terapias19-21. En este sentido, los trabajos que analizan los resultados a largo plazo de los pacientes que han precisado de soporte mecánico con ECMO-VA recogen supervivencias al año entre el 26 y el 57% de los enfermos12-14.
Los objetivos del presente estudio fueron describir las características y analizar la evolución a corto plazo, medido como supervivencia a los 30 días y como mortalidad hospitalaria, y la evolución a largo plazo de los pacientes con shock cardiogénico refractario asistidos con ECMO-VA durante 6 años en nuestro centro, un hospital terciario que dispone de un programa de trasplante cardíaco.
Pacientes y métodosDiseño del estudioEstudio observacional que analiza, de forma retrospectiva, la evolución de una cohorte de pacientes ingresados en una UCI cardiológica por shock cardiogénico refractario y asistidos con ECMO-VA durante 6 años, desde enero de 2010 hasta diciembre de 2015. Los pacientes incluidos en el presente estudio fueron tratados de acuerdo con los protocolos de la UCI cardiológica, que se trata de una unidad médico-quirúrgica de 13 camas que atiende a enfermos con patología médica cardiovascular aguda grave y postoperados de cirugía cardíaca. El estudio fue aprobado por el Comité Ético de Investigación Clínica local.
PacientesHan sido incluidos todos los pacientes adultos que, de forma consecutiva, ingresaron o presentaron durante su ingreso en la UCI cardiológica un shock cardiogénico, y precisaron de soporte con ECMO-VA tipo Maquet CardioHelp®. El shock cardiogénico refractario se definió según criterios hemodinámicos previamente publicados22: presión arterial sistólica <90mm Hg o presión arterial media inferior a 30mm Hg respecto a la cifra basal, con volumen intravascular adecuado y evidencia de un índice cardíaco reducido (<1,8l/min/m2 o <2,2l/min/m2 con soporte vasoactivo). La colocación de la asistencia fue realizada por el equipo de cirugía cardíaca y se obtuvo el consentimiento informado escrito de todos los pacientes o familiares.
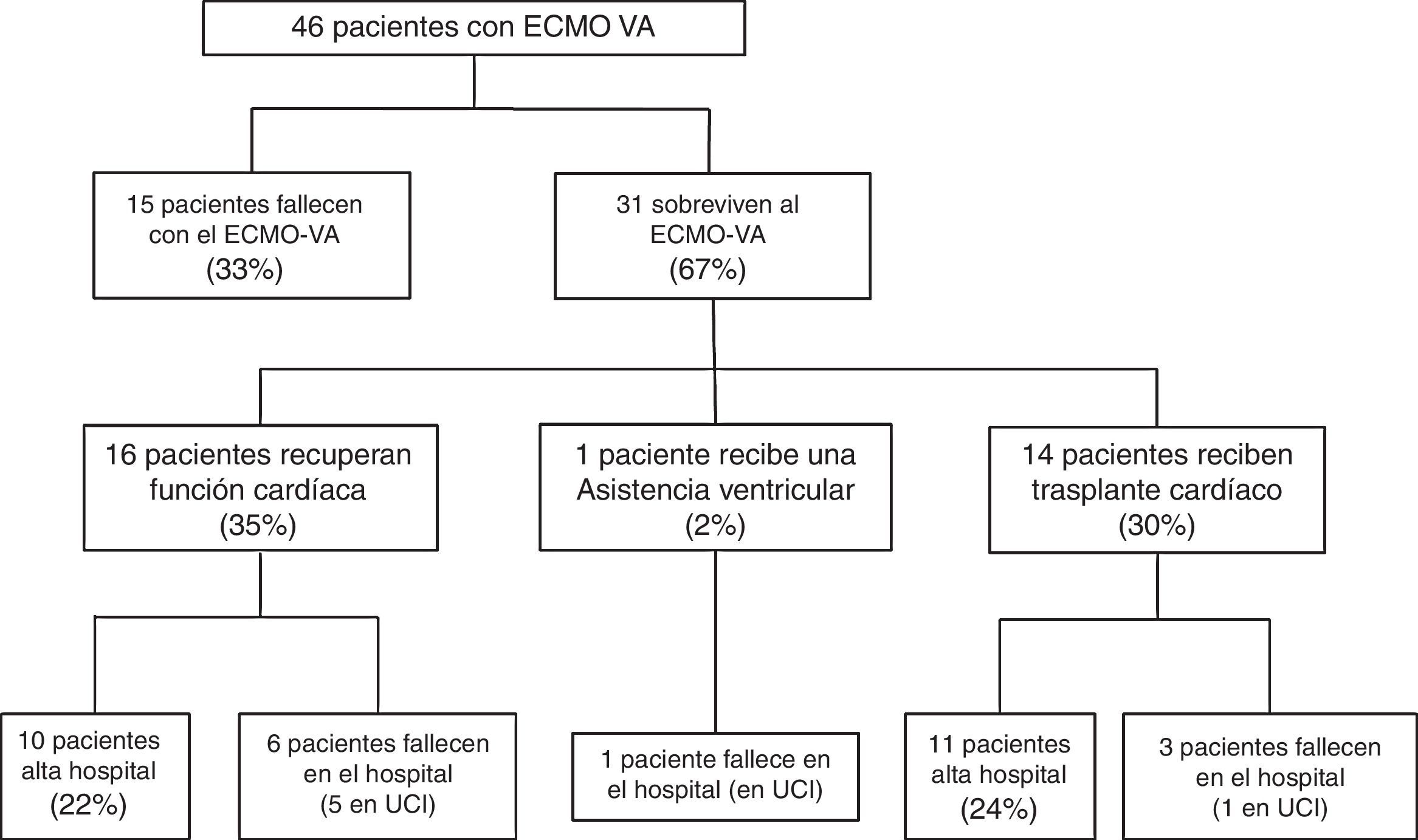
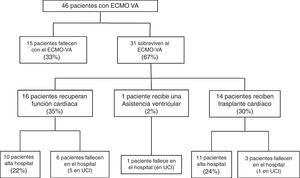
Tras el implante de la asistencia, un subgrupo de pacientes no superó la fase inicial de soporte mecánico y los pacientes fallecieron con el dispositivo. Por el contrario, otros enfermos tuvieron una evolución clínica favorable que permitió la retirada de la ECMO-VA tras la recuperación de la función cardíaca, tras recibir un trasplante cardíaco, o tras la colocación de otro tipo de dispositivo de asistencia. El diagrama de estudio se recoge en la figura 1. Los pacientes fueron analizados según su evolución clínica. Así, en una primera fase se comparó el subgrupo de pacientes que fallecieron con la asistencia con aquellos que consiguieron recuperar la función cardíaca. Posteriormente se realizó un segundo estudio de los pacientes que sobrevivieron a la ECMO-VA, analizando su evolución hospitalaria y a largo plazo. El seguimiento de todos los pacientes que fueron dados de alta del hospital continuó hasta el 30 de marzo de 2016.
VariablesLos registros se obtuvieron a través de la historia clínica electrónica y de la intranet hospitalaria (red informática interna del hospital). Posteriormente se elaboró una base de datos informatizada mediante la aplicación Access 2007® de Microsoft.
Las variables principales de medida fueron la mortalidad hospitalaria y la supervivencia global, estimada como el tiempo que transcurre desde la fecha del implante de la ECMO-VA hasta el fallecimiento por cualquier causa. Se recogieron las siguientes variables: a) del paciente: edad, sexo, comorbilidad (diabetes mellitus, hipertensión arterial, dislipidemia, fibrilación auricular, cardiopatía isquémica crónica, enfermedad pulmonar obstructiva crónica e insuficiencia renal crónica), superficie corporal, fracción de eyección del ventrículo izquierdo (FEVI) previa al implante y FEVI postimplante (previa al alta hospitalaria); b) relacionadas con la asistencia: tipo de acceso (central o periférico); tipo de indicación13 (infarto agudo de miocardio, miocardiopatía [MCP] aguda no isquémica, poscardiotomía, MCP dilatada en fase terminal —que incluye MCP dilatada idiopática, valvular, isquémica crónica y toxicidad por antraciclinas—, fallo agudo del injerto y miscelánea); días de asistencia; colocación en parada cardiorrespiratoria (PCR); necesidad de balón de contrapulsación intraaórtico previo a la ECMO-VA; realización de intervención coronaria percutánea (ICP); destete o retirada de la asistencia tras recuperación de la función cardíaca; necesidad de recibir un trasplante cardíaco, y necesidad de soporte con otra asistencia ventricular tipo Levitronix® Centrimag; c) variables de gravedad y pronóstico: Acute Physiology And Chronic Health Evaluation II (APACHE-II); Simplified Acute Physiologic Score II (SAPS-II); lactato previo al implante (en mmol/l); lactato a las 24h del implante; d) complicaciones: sangrado importante de las cánulas (con necesidad de trasfusión de 2 o más concentrado de hematíes en 24h o que requiere de revisión quirúrgica); isquemia de miembros inferiores; sangrado cerebral; fracaso renal agudo definido por la escala AKIN23; infección nosocomial (desarrollada a partir de las 48h del implante y que incluye: neumonía asociada a ventilación mecánica, bacteriemia secundaria a catéter o dispositivo, infección de partes blandas e infección urinaria); necesidad de terapias de reemplazo renal (TRR); necesidad de traqueostomía, y días de ventilación mecánica (VM); e) variables evolutivas: días de ingreso en UCI y días de ingreso hospitalario; estado al alta (vivo/muerto); fecha de la última visita hospitalaria y estado (vivo/muerto), y causa de fallecimiento (fracaso multiorgánico refractario, shock séptico, daño cerebral severo y otras causas).
Análisis estadísticoEl análisis estadístico se realizó con el paquete estadístico SPSS versión 18. Las variables cuantitativas se expresan como media y desviación estándar o mediana y rango intercuartílico, y las cualitativas como número y porcentaje. La comparación de las variables cuantitativas se realizó mediante el test t-Student para muestras independientes si la distribución era normal, o con el test U de Mann-Whitney en caso contrario. Las variables cualitativas se compararon mediante el test Chi-cuadrado o el test exacto de Fisher según procediera. La normalidad de la distribución se evaluó mediante la prueba de Kolmogorov-Smirnov. Se realizó un análisis multivariante mediante un modelo de regresión logística binaria (método forward conditional) para estudiar los factores asociados a la mortalidad hospitalaria, se incluyeron todas las variables que obtuvieron una p<0,2 en el estudio univariante. La supervivencia global se evaluó mediante curvas de Kaplan-Meier, que estiman la proporción de pacientes que siguen vivos durante el seguimiento, el cual se cerró el 30 de marzo de 2016. La significación estadística se definió como un valor de p<0,05.
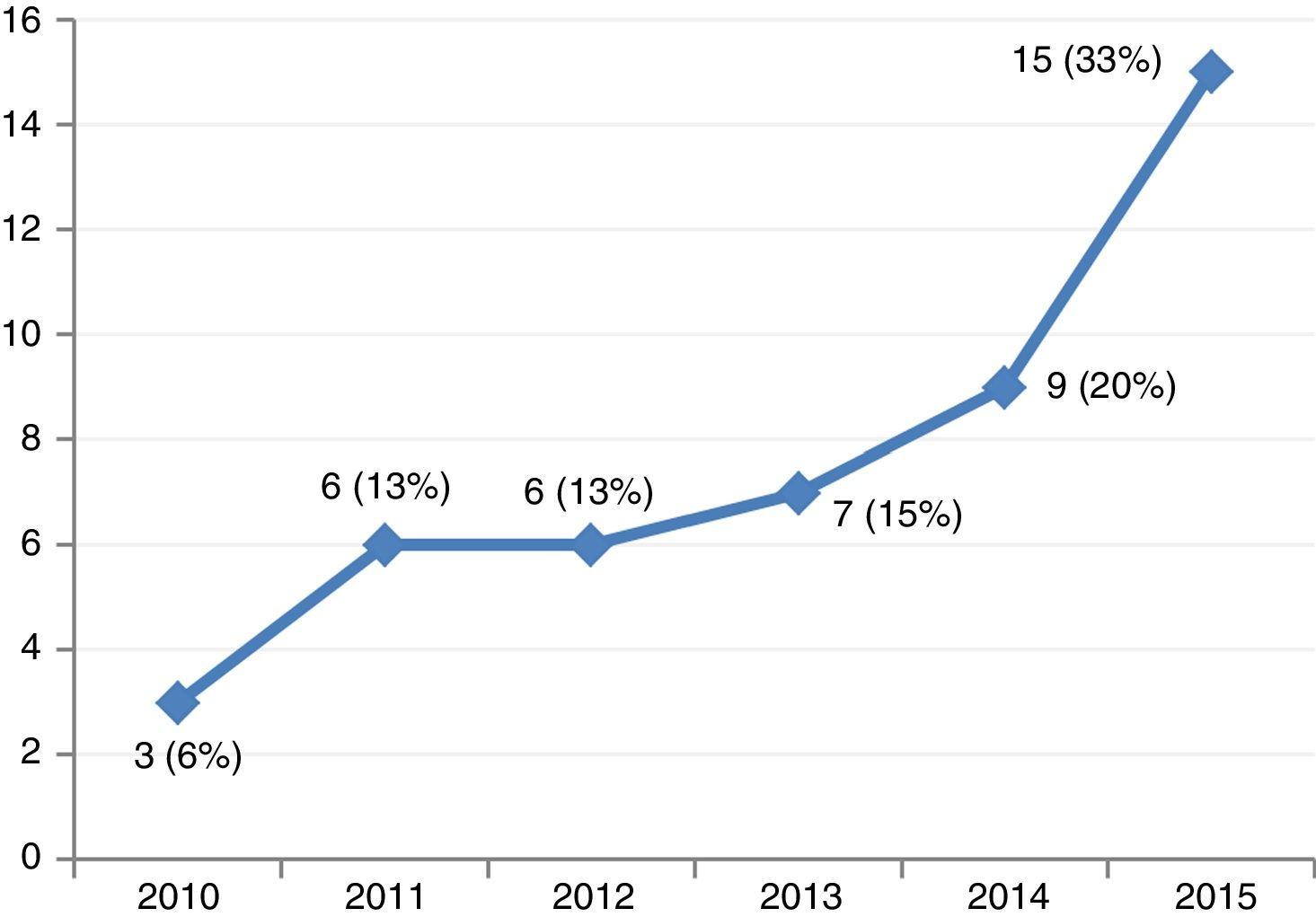
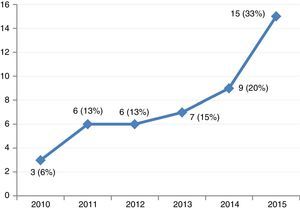
ResultadosSe incluyeron 46 pacientes que precisaron de soporte mecánico con ECMO-VA por shock cardiogénico entre enero de 2010 y diciembre de 2015. Durante este periodo, la colocación de este tipo de dispositivos en nuestro centro ha ido aumentando progresivamente (fig. 2). El acceso fue por vía periférica en 39 ocasiones (85%), en todos los casos se realizó de forma percutánea. Las indicaciones fueron: 1) MCP dilatada en fase terminal (13 pacientes, 28%), que incluye 6 casos de MCP dilatada idiopática, 3 de isquémica crónica, 2 valvulares y 2 de toxicidad por antraciclinas; 2) infarto agudo de miocardio (10 pacientes, 21%); 3) poscardiotomía (8 pacientes, 17%); 4) fallo agudo del injerto (7 pacientes, 15%); 5) MCP aguda no isquémica (6 pacientes, 13%), y 6) miscelánea (2 pacientes, 4%). Las características de los pacientes se recogen en la tabla 1.
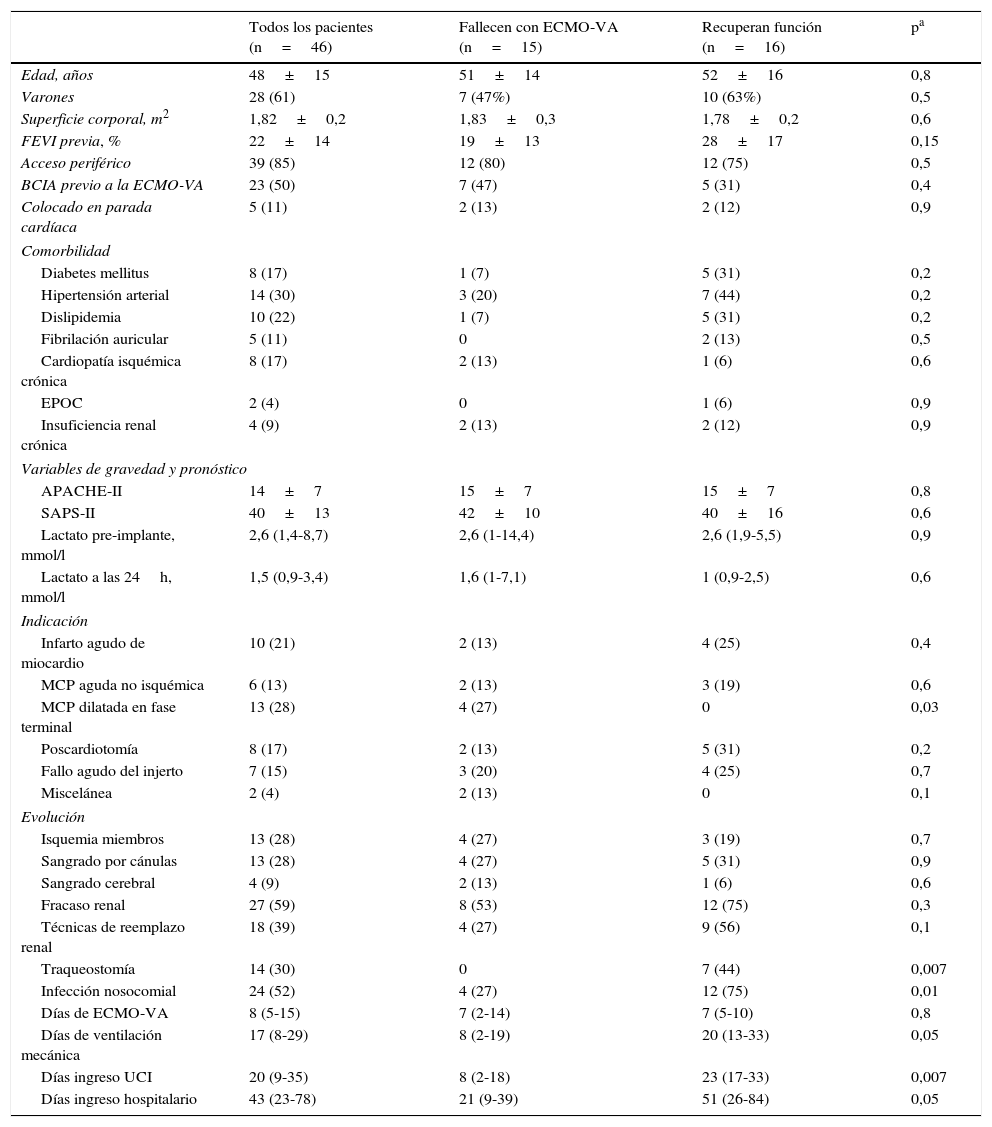
Características de todos los pacientes y comparación de los pacientes que recuperan función cardíaca y los que fallecen con la ECMO-VA
| Todos los pacientes (n=46) | Fallecen con ECMO-VA (n=15) | Recuperan función (n=16) | pa | |
|---|---|---|---|---|
| Edad, años | 48±15 | 51±14 | 52±16 | 0,8 |
| Varones | 28 (61) | 7 (47%) | 10 (63%) | 0,5 |
| Superficie corporal, m2 | 1,82±0,2 | 1,83±0,3 | 1,78±0,2 | 0,6 |
| FEVI previa, % | 22±14 | 19±13 | 28±17 | 0,15 |
| Acceso periférico | 39 (85) | 12 (80) | 12 (75) | 0,5 |
| BCIA previo a la ECMO-VA | 23 (50) | 7 (47) | 5 (31) | 0,4 |
| Colocado en parada cardíaca | 5 (11) | 2 (13) | 2 (12) | 0,9 |
| Comorbilidad | ||||
| Diabetes mellitus | 8 (17) | 1 (7) | 5 (31) | 0,2 |
| Hipertensión arterial | 14 (30) | 3 (20) | 7 (44) | 0,2 |
| Dislipidemia | 10 (22) | 1 (7) | 5 (31) | 0,2 |
| Fibrilación auricular | 5 (11) | 0 | 2 (13) | 0,5 |
| Cardiopatía isquémica crónica | 8 (17) | 2 (13) | 1 (6) | 0,6 |
| EPOC | 2 (4) | 0 | 1 (6) | 0,9 |
| Insuficiencia renal crónica | 4 (9) | 2 (13) | 2 (12) | 0,9 |
| Variables de gravedad y pronóstico | ||||
| APACHE-II | 14±7 | 15±7 | 15±7 | 0,8 |
| SAPS-II | 40±13 | 42±10 | 40±16 | 0,6 |
| Lactato pre-implante, mmol/l | 2,6 (1,4-8,7) | 2,6 (1-14,4) | 2,6 (1,9-5,5) | 0,9 |
| Lactato a las 24h, mmol/l | 1,5 (0,9-3,4) | 1,6 (1-7,1) | 1 (0,9-2,5) | 0,6 |
| Indicación | ||||
| Infarto agudo de miocardio | 10 (21) | 2 (13) | 4 (25) | 0,4 |
| MCP aguda no isquémica | 6 (13) | 2 (13) | 3 (19) | 0,6 |
| MCP dilatada en fase terminal | 13 (28) | 4 (27) | 0 | 0,03 |
| Poscardiotomía | 8 (17) | 2 (13) | 5 (31) | 0,2 |
| Fallo agudo del injerto | 7 (15) | 3 (20) | 4 (25) | 0,7 |
| Miscelánea | 2 (4) | 2 (13) | 0 | 0,1 |
| Evolución | ||||
| Isquemia miembros | 13 (28) | 4 (27) | 3 (19) | 0,7 |
| Sangrado por cánulas | 13 (28) | 4 (27) | 5 (31) | 0,9 |
| Sangrado cerebral | 4 (9) | 2 (13) | 1 (6) | 0,6 |
| Fracaso renal | 27 (59) | 8 (53) | 12 (75) | 0,3 |
| Técnicas de reemplazo renal | 18 (39) | 4 (27) | 9 (56) | 0,1 |
| Traqueostomía | 14 (30) | 0 | 7 (44) | 0,007 |
| Infección nosocomial | 24 (52) | 4 (27) | 12 (75) | 0,01 |
| Días de ECMO-VA | 8 (5-15) | 7 (2-14) | 7 (5-10) | 0,8 |
| Días de ventilación mecánica | 17 (8-29) | 8 (2-19) | 20 (13-33) | 0,05 |
| Días ingreso UCI | 20 (9-35) | 8 (2-18) | 23 (17-33) | 0,007 |
| Días ingreso hospitalario | 43 (23-78) | 21 (9-39) | 51 (26-84) | 0,05 |
Los resultados se expresan en media±DT, medina (RIQ) o número (porcentaje).
APACHE-II: Acute Physiology and Chronic Health Evaluation II; BCIA: balón de contrapulsación intraaórtico; ECMO-VA: membrana de oxigenación extracorpórea veno-arterial; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección de ventrículo izquierdo; MCP: miocardiopatía; SPAS-II: Simplified Acute Physiology Score II.
Quince pacientes (33%) fallecieron durante la fase de soporte mecánico y 31 pacientes (67%) sobrevivieron a la misma tras una mediana de asistencia de 8 días (RIC: 5-15). De los pacientes que sobrevivieron, en 16 casos el soporte mecánico se retiró tras la recuperación de la función cardíaca, en 14 ocasiones tras recibir un trasplante cardíaco y en un paciente tras la colocación de una asistencia ventricular izquierda tipo Levitronix® Centrimag (fig. 1). Las características de los pacientes que no mejoraron y fallecieron con la ECMO-VA y las características de aquellos que recuperaron función cardíaca se comparan en la tabla 1. No se encontraron diferencias entre ambos grupos que ayuden a predecir éxito en el destete o recuperación de la función cardíaca.
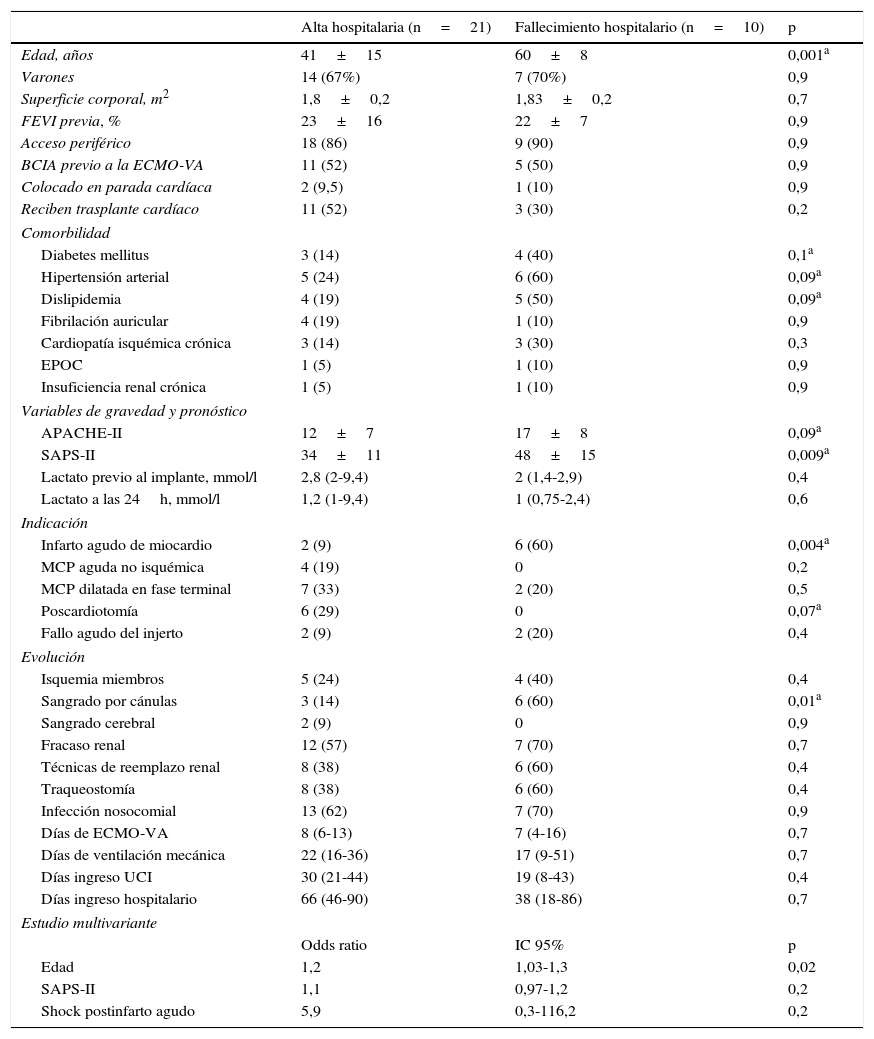
La mortalidad en la UCI fue del 48% (22/46) de los pacientes y la hospitalaria fue del 54% (25/46). Las causas de fallecimiento de toda la cohorte fueron las siguientes: fracaso multiorgánico refractario en 12 pacientes (48%), shock séptico en 5 (20%), daño cerebral severo en 5 (20%) y otras causas en 3 pacientes (12%). De los 31 pacientes que sobrevivieron a la retirada de la ECMO-VA, el 68% (21/31) fueron dados de alta del hospital. La FEVI al alta fue del 54±12% en los pacientes que recuperaron función y del 68±7% en los pacientes trasplantados. La tabla 2 compara, en función de la evolución hospitalaria, las características de estos 31 enfermos. De forma significativa, el estudio univariante mostró que los pacientes que fallecieron durante el ingreso hospitalario tras la retirada de la asistencia tenían mayor edad (60±8 vs. 41±15, p=0,001), mayor puntuación SAPS-II en el momento del implante (17±8 vs. 12±7, p=0,09), y mayor incidencia de sangrado de las cánulas durante la fase de soporte mecánico (60% vs. 14%, p=0,01). Además, habían sido asistidos con más frecuencia por un cuadro de shock cardiogénico postinfarto (60% vs. 9%, p=0,004). En el estudio multivariante, la edad fue la única variable independiente que se relacionó con una peor evolución hospitalaria de estos pacientes (OR 1,2; IC 95%: 1,03-1,3).
Diferencias entre pacientes que son dados de alta del hospital y los que fallecen tras retirarse la ECMO-VA
| Alta hospitalaria (n=21) | Fallecimiento hospitalario (n=10) | p | |
|---|---|---|---|
| Edad, años | 41±15 | 60±8 | 0,001a |
| Varones | 14 (67%) | 7 (70%) | 0,9 |
| Superficie corporal, m2 | 1,8±0,2 | 1,83±0,2 | 0,7 |
| FEVI previa, % | 23±16 | 22±7 | 0,9 |
| Acceso periférico | 18 (86) | 9 (90) | 0,9 |
| BCIA previo a la ECMO-VA | 11 (52) | 5 (50) | 0,9 |
| Colocado en parada cardíaca | 2 (9,5) | 1 (10) | 0,9 |
| Reciben trasplante cardíaco | 11 (52) | 3 (30) | 0,2 |
| Comorbilidad | |||
| Diabetes mellitus | 3 (14) | 4 (40) | 0,1a |
| Hipertensión arterial | 5 (24) | 6 (60) | 0,09a |
| Dislipidemia | 4 (19) | 5 (50) | 0,09a |
| Fibrilación auricular | 4 (19) | 1 (10) | 0,9 |
| Cardiopatía isquémica crónica | 3 (14) | 3 (30) | 0,3 |
| EPOC | 1 (5) | 1 (10) | 0,9 |
| Insuficiencia renal crónica | 1 (5) | 1 (10) | 0,9 |
| Variables de gravedad y pronóstico | |||
| APACHE-II | 12±7 | 17±8 | 0,09a |
| SAPS-II | 34±11 | 48±15 | 0,009a |
| Lactato previo al implante, mmol/l | 2,8 (2-9,4) | 2 (1,4-2,9) | 0,4 |
| Lactato a las 24h, mmol/l | 1,2 (1-9,4) | 1 (0,75-2,4) | 0,6 |
| Indicación | |||
| Infarto agudo de miocardio | 2 (9) | 6 (60) | 0,004a |
| MCP aguda no isquémica | 4 (19) | 0 | 0,2 |
| MCP dilatada en fase terminal | 7 (33) | 2 (20) | 0,5 |
| Poscardiotomía | 6 (29) | 0 | 0,07a |
| Fallo agudo del injerto | 2 (9) | 2 (20) | 0,4 |
| Evolución | |||
| Isquemia miembros | 5 (24) | 4 (40) | 0,4 |
| Sangrado por cánulas | 3 (14) | 6 (60) | 0,01a |
| Sangrado cerebral | 2 (9) | 0 | 0,9 |
| Fracaso renal | 12 (57) | 7 (70) | 0,7 |
| Técnicas de reemplazo renal | 8 (38) | 6 (60) | 0,4 |
| Traqueostomía | 8 (38) | 6 (60) | 0,4 |
| Infección nosocomial | 13 (62) | 7 (70) | 0,9 |
| Días de ECMO-VA | 8 (6-13) | 7 (4-16) | 0,7 |
| Días de ventilación mecánica | 22 (16-36) | 17 (9-51) | 0,7 |
| Días ingreso UCI | 30 (21-44) | 19 (8-43) | 0,4 |
| Días ingreso hospitalario | 66 (46-90) | 38 (18-86) | 0,7 |
| Estudio multivariante | |||
| Odds ratio | IC 95% | p | |
| Edad | 1,2 | 1,03-1,3 | 0,02 |
| SAPS-II | 1,1 | 0,97-1,2 | 0,2 |
| Shock postinfarto agudo | 5,9 | 0,3-116,2 | 0,2 |
Los resultados se expresan en media±DT, medina (RIQ) o número (porcentaje).
APACHE-II: Acute Physiology and Chronic Health Evaluation II; BCIA: balón de contrapulsación intraaórtico; ECMO-VA: membrana de oxigenación extracorpórea veno-arterial; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección de ventrículo izquierdo; MCP: miocardiopatía; SPAS-II: Simplified Acute Physiology Score II.
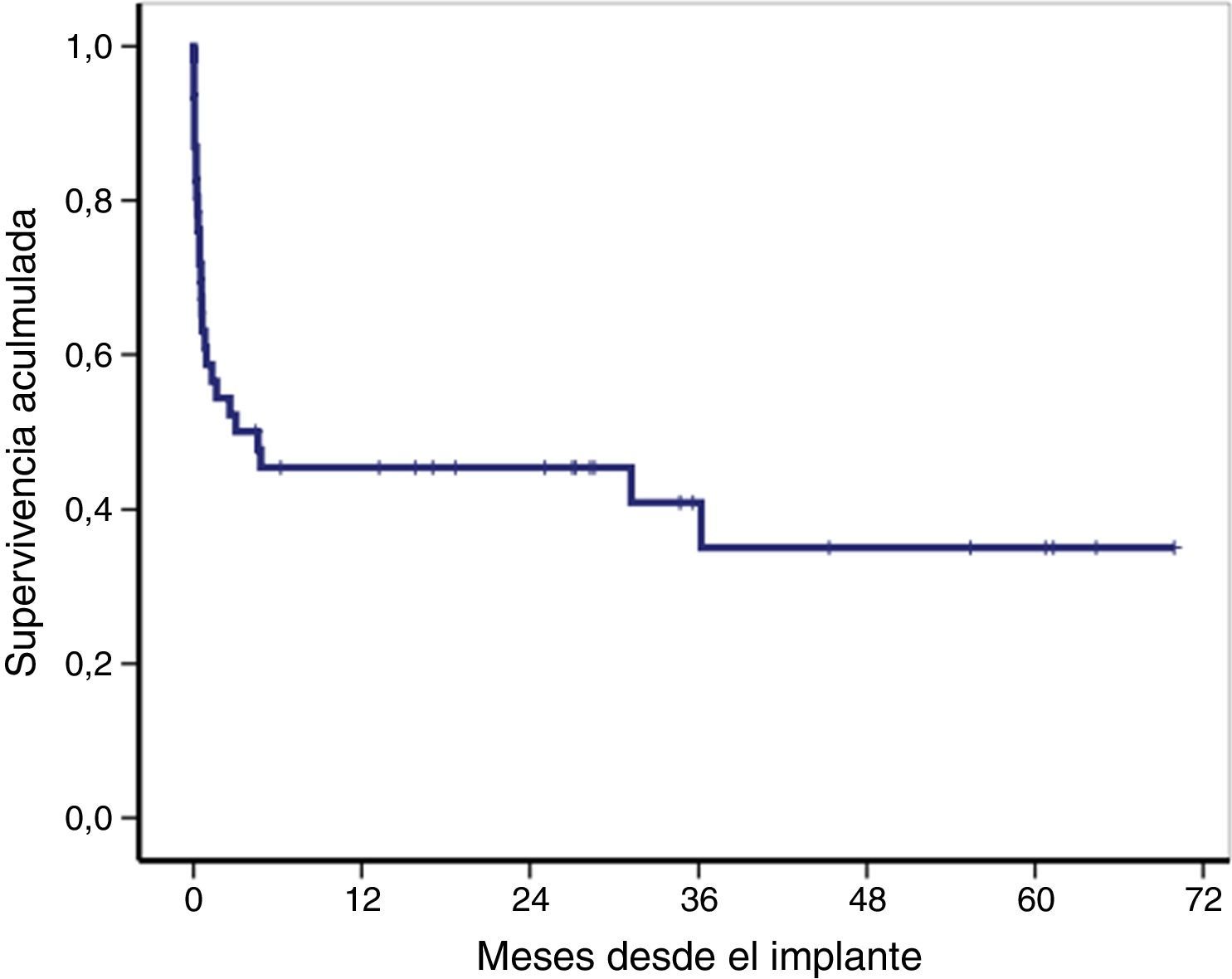
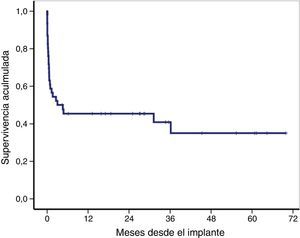
La supervivencia global de toda la cohorte tras el implante de la ECMO-VA se muestra en la figura 3, siendo la supervivencia global a los 30 días, 12 y 36 meses del 59, 46 y 41%, respectivamente. Veintiún pacientes (46%) fueron dados de alta del hospital, la mediana de seguimiento tras el alta fue de 27 meses (RIC: 11-49), y permanecían vivos el 91% (19/21) de los pacientes en el último seguimiento.
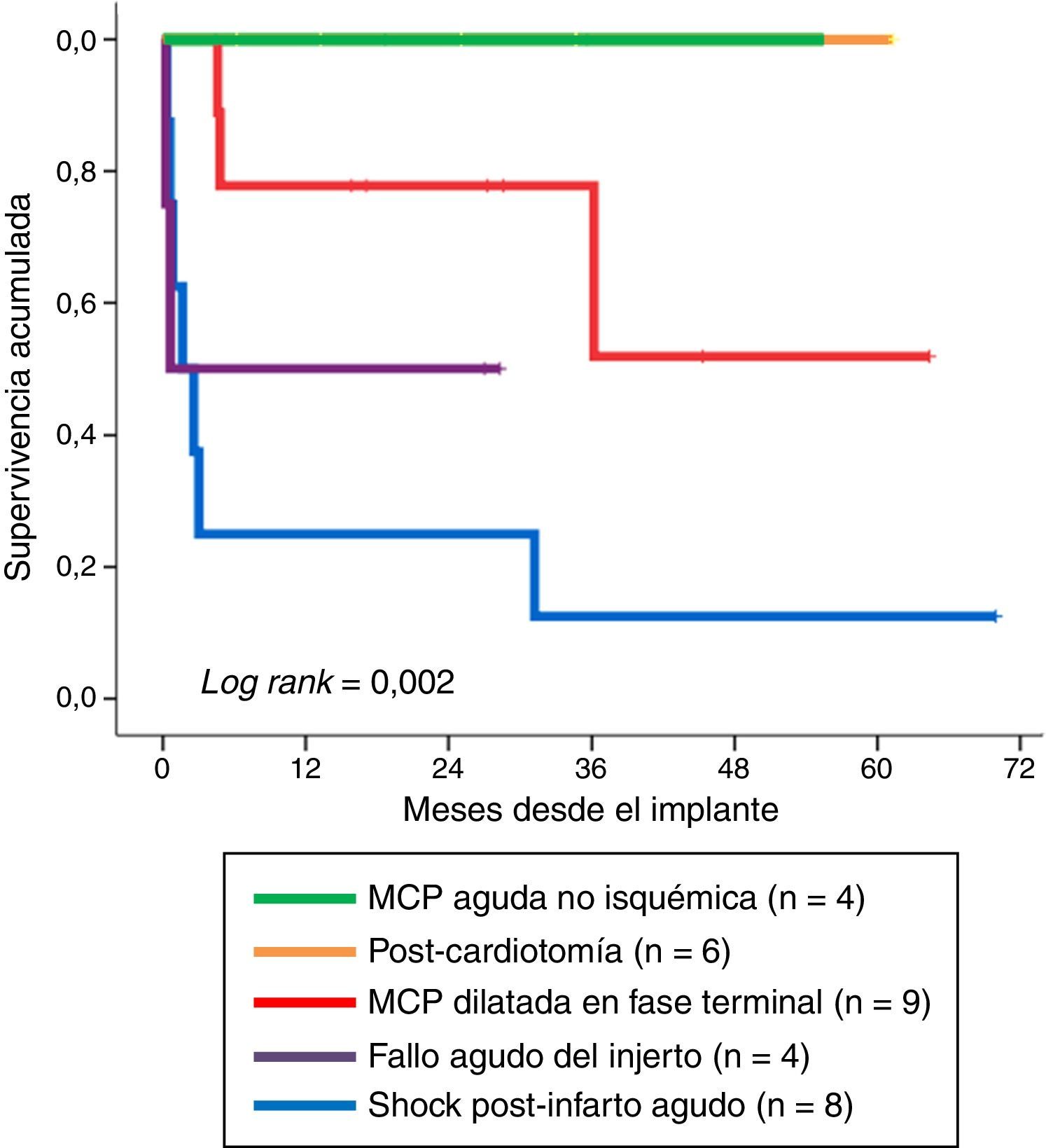
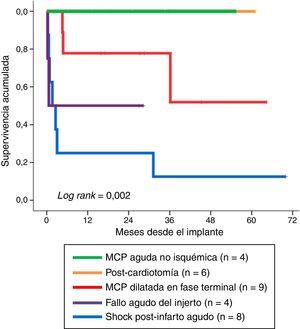
La figura 4 muestra la supervivencia a largo plazo, en función del tipo de indicación, de aquellos pacientes que sobrevivieron a la fase de soporte mecánico. De manera significativa (log rank: 0,002), la evolución más desfavorable fue para los pacientes con indicación de shock cardiogénico refractario postinfarto, con una supervivencia en el último seguimiento del 12,5% (1/8) de los enfermos. Por el contrario, la evolución fue mejor cuando las indicaciones fueron fallo agudo del injerto y MCP dilatada en fase terminal, con supervivencias en el último seguimiento del 50% (2/4) y del 67% (6/9) de los pacientes, respectivamente. El resultado más favorable fue para los pacientes con indicación de MCP aguda no isquémica y shock poscardiotomía, donde todos los pacientes continuaron vivos tras la retirada de la ECMO-VA.
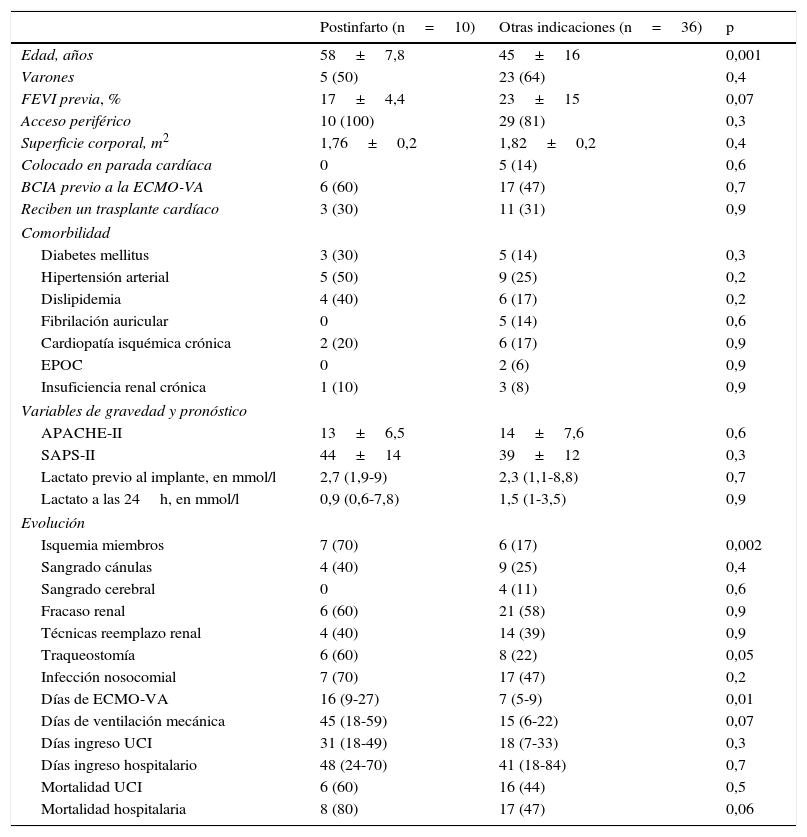
Shock cardiogénico postinfarto agudo de miocardioDebido al peor pronóstico de los pacientes asistidos por un shock cardiogénico postinfarto, estos 10 pacientes se analizaron de forma independiente. En 8 enfermos (80%) se intentó una intervención coronaria percutánea (62,5% con éxito), solo un caso se asistió con ECMO-VA antes de la realización de la ICP. La supervivencia a los 30 días fue del 60%, pero solo 2 pacientes (20%) fueron dados de alta del hospital (el 63% fallecieron por un fracaso multiorgánico refractario). Las características de estos enfermos y su comparación con el resto de pacientes se recogen en la tabla 3.
Diferencias entre pacientes asistidos por shock cardiogénico refractario secundario a infarto agudo de miocardio y el resto de indicaciones
| Postinfarto (n=10) | Otras indicaciones (n=36) | p | |
|---|---|---|---|
| Edad, años | 58±7,8 | 45±16 | 0,001 |
| Varones | 5 (50) | 23 (64) | 0,4 |
| FEVI previa, % | 17±4,4 | 23±15 | 0,07 |
| Acceso periférico | 10 (100) | 29 (81) | 0,3 |
| Superficie corporal, m2 | 1,76±0,2 | 1,82±0,2 | 0,4 |
| Colocado en parada cardíaca | 0 | 5 (14) | 0,6 |
| BCIA previo a la ECMO-VA | 6 (60) | 17 (47) | 0,7 |
| Reciben un trasplante cardíaco | 3 (30) | 11 (31) | 0,9 |
| Comorbilidad | |||
| Diabetes mellitus | 3 (30) | 5 (14) | 0,3 |
| Hipertensión arterial | 5 (50) | 9 (25) | 0,2 |
| Dislipidemia | 4 (40) | 6 (17) | 0,2 |
| Fibrilación auricular | 0 | 5 (14) | 0,6 |
| Cardiopatía isquémica crónica | 2 (20) | 6 (17) | 0,9 |
| EPOC | 0 | 2 (6) | 0,9 |
| Insuficiencia renal crónica | 1 (10) | 3 (8) | 0,9 |
| Variables de gravedad y pronóstico | |||
| APACHE-II | 13±6,5 | 14±7,6 | 0,6 |
| SAPS-II | 44±14 | 39±12 | 0,3 |
| Lactato previo al implante, en mmol/l | 2,7 (1,9-9) | 2,3 (1,1-8,8) | 0,7 |
| Lactato a las 24h, en mmol/l | 0,9 (0,6-7,8) | 1,5 (1-3,5) | 0,9 |
| Evolución | |||
| Isquemia miembros | 7 (70) | 6 (17) | 0,002 |
| Sangrado cánulas | 4 (40) | 9 (25) | 0,4 |
| Sangrado cerebral | 0 | 4 (11) | 0,6 |
| Fracaso renal | 6 (60) | 21 (58) | 0,9 |
| Técnicas reemplazo renal | 4 (40) | 14 (39) | 0,9 |
| Traqueostomía | 6 (60) | 8 (22) | 0,05 |
| Infección nosocomial | 7 (70) | 17 (47) | 0,2 |
| Días de ECMO-VA | 16 (9-27) | 7 (5-9) | 0,01 |
| Días de ventilación mecánica | 45 (18-59) | 15 (6-22) | 0,07 |
| Días ingreso UCI | 31 (18-49) | 18 (7-33) | 0,3 |
| Días ingreso hospitalario | 48 (24-70) | 41 (18-84) | 0,7 |
| Mortalidad UCI | 6 (60) | 16 (44) | 0,5 |
| Mortalidad hospitalaria | 8 (80) | 17 (47) | 0,06 |
Los resultados se expresan en media±DT, medina (RIQ) o número (porcentaje).
APACHE-II: Acute Physiology and Chronic Health Evaluation II; BCIA: balón de contrapulsación intraaórtico; ECMO-VA: membrana de oxigenación extracorpórea veno-arterial; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección de ventrículo izquierdo; MCP: miocardiopatía; SPAS-II: Simplified Acute Physiology Score II.
En nuestro centro, el soporte mecánico con ECMO-VA es una herramienta cada vez más utilizada en el manejo del shock cardiogénico refractario. La mortalidad aguda de nuestros enfermos fue elevada, pero hay que destacar que los pacientes que sobrevivieron al ingreso hospitalario tuvieron una supervivencia excelente, del 91% con una mediana de seguimiento de 27 meses, y una función cardíaca cercana a la normalidad. Estos resultados sugieren que este tipo de asistencia circulatoria podría conseguir rescatar y ofrecer una oportunidad de vida a largo plazo a los pacientes con shock cardiogénico refractario, incluso en algún caso colocándose en situación de parada circulatoria.
En nuestra serie, casi el 70% de los pacientes asistidos con ECMO-VA consiguieron sobrevivir a la fase inicial de soporte mecánico. Si comparamos estos resultados con los recogidos en otras series de al menos 35 pacientes que también incluyen shock cardiogénico refractario de diferentes etiologías, nuestros resultados son comparables a estos registros, donde entre el 38 y el 70% de los pacientes sobreviven a la fase de soporte mecánico12,13,17,18,24. En el presente trabajo, ninguna de las variables estudiadas ayudó a predecir éxito en el destete de la asistencia o recuperación de la función cardíaca. Sin embargo, trabajos previos han relacionado variables ecocardiográficas25, analíticas13,26, y clínicas26 con la predicción de destete. Es posible que la falta de resultados en nuestra serie se deba tanto al número limitado de pacientes incluidos como al diseño del estudio, que no fue dirigido para ese objetivo.
Respecto al pronóstico a corto plazo, nuestros resultados son similares a los arrojados por otras series. La supervivencia a los 30 días tras el implante de la ECMO-VA recogida en la literatura varía, en función del tipo de indicación, entre el 30 y el 65%2,12,14-16,25, siendo en nuestra serie mixta del 59%. En cuanto a la mortalidad hospitalaria, que en nuestro registro fue del 54%, los estudios reportan tasas en estos pacientes muy variables, entre el 35 y el 72%12,13,16,18, siendo las principales causas de fallecimiento el fracaso multiorgánico refractario, el daño neurológico severo y la infección coincidiendo con nuestros resultados13,18,27. En nuestra opinión, tiene más importancia analizar la evolución de los pacientes más allá de la ECMO-VA, ya que la retirada de la asistencia no implica necesariamente supervivencia. De hecho, hasta un tercio de nuestros enfermos que sobrevivieron a la fase de soporte mecánico fallecieron posteriormente durante el resto del ingreso hospitalario. Los trabajos que analizan la evolución de este subgrupo de enfermos son escasos, con tasas de mortalidad hospitalaria tras la retirada de la ECMO-VA de entre el 31 y el 59%17,18. Los factores que en nuestro registro se relacionaron con un peor pronóstico tras la retirada de la asistencia fueron una puntuación de SAPS-II y edad más elevadas, el sangrado de las cánulas y la indicación de shock tras un infarto agudo de miocardio. Concretamente, la edad fue el único factor independiente que se asoció a mayor mortalidad hospitalaria en el estudio multivariante. Estudios previos también relacionan el pronóstico de estos pacientes con la edad18,28,29, con el daño orgánico desarrollado13,28,29 y con la etiología del shock cardiogénico13,18,28, entre otros factores.
Hasta la fecha, este trabajo es el primer estudio español que reporta la evolución a largo plazo de los pacientes asistidos con ECMO-VA. Casi la mitad de los pacientes asistidos permanecían vivos al año y algo más del 40% a los 3 años de seguimiento, comparado con tasas de supervivencia al año de entre el 26 y el 57% según la serie consultada12-14,27. El tipo de enfermedad cardíaca que originó la necesidad de la asistencia mecánica se relacionó con la supervivencia a largo plazo de los pacientes tras la retirada de la misma. Fue especialmente desfavorable la evolución de los pacientes asistidos por un shock cardiogénico postinfarto. La supervivencia a los 30 días en este subgrupo de enfermos fue similar al 47% registrado en un reciente estudio que reúne 138 pacientes asistidos tras un infarto agudo de miocardio29. Sin embargo, la evolución hospitalaria de nuestros enfermos, a pesar de recibir el 30% un trasplante cardíaco, fue más desfavorable cuando se comparó con los resultados de otra serie española que reporta una supervivencia hospitalaria del 72,7% de sus pacientes asistidos con ECMO por un shock cardiogénico refractario postinfarto30. En nuestro registro, este subgrupo de enfermos es pequeño y no permite obtener conclusiones, pero es posible que el daño orgánico producido por el shock cardiogénico inicial pueda tener un papel relevante en la mala evolución posterior. Además, respecto al resto de pacientes, aquellos que fueron asistidos tras un infarto agudo fueron más mayores, tuvieron mayor incidencia de isquemia en miembros y un tiempo de soporte mecánico significativamente más prolongado. Estos factores, aunque nuestros resultados no permiten ninguna confirmación, pueden haber influido en la evolución más desfavorable.
El presente estudio tiene varias limitaciones. En primer lugar, el carácter retrospectivo del análisis y el número pequeño de pacientes. No obstante, se han incluido todos los pacientes asistidos con ECMO-VA en nuestro centro y se dispone de casi la totalidad de las variables a través de la historia clínica informatizada del centro. En segundo lugar, incluye una población de pacientes con shock cardiogénico refractario de diferentes etiologías. Finalmente, el carácter unicéntrico del trabajo puede dificultar la extrapolación de los resultados a otros centros, no obstante, es una de las series españolas más amplia publicada. En el futuro, sería deseable planificar estudios multicéntricos que aumenten la relevancia clínica de los resultados y permitan estudiar, de forma detallada, a cada una de las poblaciones específicas de pacientes que desarrollan shock cardiogénico y tienen indicación de asistencia mecánica con ECMO-VA.
ConclusionesPodemos concluir que, en nuestra experiencia, la ECMO-VA es un tipo de asistencia mecánica que puede utilizarse en el manejo de los pacientes con shock cardiogénico refractario a terapias convencionales. A pesar de la elevada mortalidad precoz que asocia, la supervivencia a largo plazo tras superar la fase hospitalaria es buena. Este tipo de dispositivo, además de aportar un soporte cardiovascular inmediato, puede utilizarse como terapia puente para recibir un trasplante cardíaco y, en casos seleccionados, para la colocación de asistencias de medio plazo. La edad y el tipo de enfermedad cardíaca que motiva la indicación de la asistencia son los factores con mayor impacto en la supervivencia de nuestra serie.
AutoríaRenata García Gigorro se ha encargado de la revisión de la literatura, de la recogida de los datos y de la escritura del artículo.
Emilio Renes Carreño ha contribuido en la concepción y diseño del estudio y en el análisis e interpretación de los datos. Además, ha contribuido a la revisión final crítica del artículo.
José Luis Pérez Vela ha contribuido a la recogida de datos y revisión crítica del artículo.
Helena Marín Mateos ha participado en la recogida de datos.
Julián Gutiérrez ha participado en el borrador del artículo.
María Angélica Corrés Peiretti ha participado en la revisión crítica del artículo.
Juan Francisco Delgado ha participado en la revisión crítica del artículo.
Enrique Pérez de la Sota ha participado en la revisión crítica del artículo.
José María Cortina Romero ha sido responsable de la provisión de los recursos.
Juan Carlos Montejo ha sido responsable de la provisión de los recursos necesarios para realizar el presente estudio. Además, ha dado la aprobación definitiva de la versión que se presenta.
Conflicto de interesesNo existen conflictos de intereses por parte de ninguno los autores del presente artículo. Tampoco existe financiación para la realización del presente artículo.