La tormenta arrítmica debida a taquicardia ventricular monomórfica sostenida (TVMS) es una situación de riesgo vital, en la cual la ablación con catéter es clave en el tratamiento, especialmente en presencia de escara1,2. Asimismo, es recomendable evaluar la presencia de isquemia coronaria y corregirla2. Pero ninguno de estos procedimientos está exento de riesgo, especialmente en presencia de inestabilidad hemodinámica o importante disfunción ventricular. A continuación presentamos un ejemplo de la utilidad de la ECMO en este escenario.
Un varón de 70 años acudió al Servicio de Urgencias de nuestro centro tras haber presentado 3 descargas de su desfibrilador automático implantable. Presentaba antecedentes de diabetes e hipertensión arterial. Además, 10 años antes había presentado una TVMS, con una fracción de eyección del ventrículo izquierdo de 30%, oclusión crónica de la arteria coronaria derecha y circunfleja con ausencia de viabilidad en dichos territorios según tomografía por emisión de fotón único, por lo que se implantó un desfibrilador automático implantable y se pautó amiodarona.
El paciente fue ingresado en la Unidad de Cuidados Cardiológicos Agudos y se revisó el dispositivo, confirmando que habían sido descargas apropiadas debidas a TVMS. En la monitorización se observaron frecuentes episodios autolimitados de dichas arritmias, por lo que se inició tratamiento con procainamida en perfusión y las terapias del desfibrilador automático implantable fueron desconectadas.
La ecocardiografía en esta ocasión mostraba una fracción de eyección del ventrículo izquierdo de un 25% y la coronariografía, una lesión severa de novo en la arteria descendente anterior proximal. Tras discutir el caso en «Heart-Team», se decidió llevar a cabo revascularización de la arteria descendente anterior y ablación de TVMS. Ambos procedimientos conllevaban un riesgo elevado, por lo que se consideró el soporte hemodinámico con ECMO venoarterial.
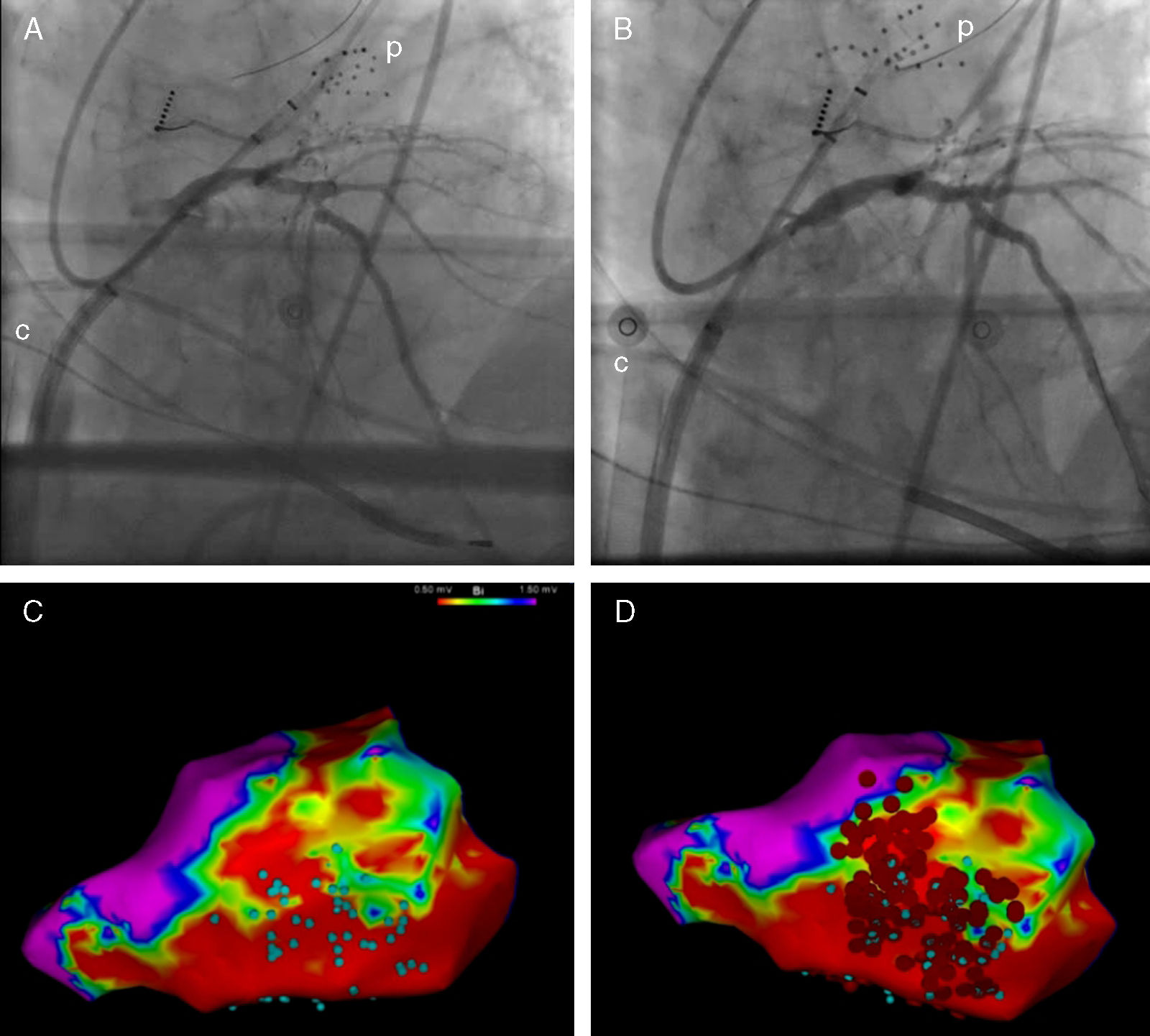
La intervención fue realizada en el laboratorio de electrofisiología con intubación, sedación con propofol, analgesia con remifentanilo y relajación con cisatracurio. En primer lugar, se accedió al ventrículo izquierdo mediante punción transeptal; tras ello se administró un bolo intravenoso de heparina y se implantó ECMO de manera percutánea y vía femoral. Se utilizó un dispositivo Cardiohelp® (Maquet, Alemania), con una cánula arterial de 15F y venosa de 23F. El soporte con ECMO fue iniciado con 1,5lpm, con la posibilidad de aumentar el flujo si fuese necesario. El paso siguiente fue tratar la estenosis de la arteria descendente anterior con un stent farmacoactivo (fig. 1A y B). Durante esta revascularización la presión arterial disminuyó y desapareció la pulsatilidad, por lo que se aumentó el flujo de la ECMO a 3lpm para mantener una presión arterial media por encima de 60mmHg. Esta situación persistió durante 15min debido a aturdimiento miocárdico, tras lo que se recuperó progresivamente la pulsatilidad. A continuación se comenzó el procedimiento de ablación. Se creó un mapa endocárdico en ritmo sinusal con un catéter multielectrodo con ayuda del sistema CARTO® 3 (Biosense Webster Inc., EE. UU.). Los límites de voltaje se fijaron en 1,5 y 0,5mV para definir escara y escara densa. Además, se identificaron dentro de la escara las áreas con electrogramas con componentes aislados o potenciales tardíos (fig. 1C). Durante la estimulación programada no se indujeron TVMS, pero sí una fibrilación ventricular que hubo de ser terminada mediante desfibrilación. De nuevo se observó tras el choque un periodo de varios minutos de hipotensión y pérdida de pulsatilidad, durante el cual se aumentó el soporte de ECMO. Finalmente, se realizó una ablación extensa de sustrato arrítmico (fig. 1D).
Fluoroscopia pre (A) y postintervencionismo cononario (B). Mapa electroanatómico de voltaje que muestra escara inferolateral. Áreas con electrogramas con componentes aislados o potenciales tardíos (C, puntos azules) y puntos de ablación (D, puntos rojos).
c: cánula venosa de ECMO; p: catéter mapeo electrofisiológico.
Al terminar el procedimiento el paciente se encontraba hemodinámicamente estable y con buena amplitud de pulso, por lo que se decidió retirar el soporte circulatorio. La decanulación se realizó en el propio laboratorio por parte del cirujano vascular, con reparación de vena y arteria femorales. La evolución posterior del paciente fue favorable, sin recurrencias de la TVMS y siendo alta a los 5 días del procedimiento.
El caso presentado refleja el beneficio que se puede obtener del soporte circulatorio en el tratamiento de la tormenta arrítmica. Este soporte puede ser necesario en caso de arritmia incesante e inestabilidad hemodinámica, así como también como apoyo a una intervención terapéutica de alto riesgo. En concreto, el paciente presentado mostraba una anatomía coronaria de alto riesgo, con lesión significativa en el único vaso permeable, lo que ocasionaba que tanto el procedimiento de revascularización como el de ablación resultasen de muy alto riesgo.
En la actualidad están disponibles varios dispositivos de apoyo hemodinámico para la realización de procedimientos percutáneos de alto riesgo: balón de contrapulsación, TandemHeart®, Impella®, ECMO-venoarterial3. De ellos, la ECMO ofrece la ventaja de garantizar un soporte circulatorio completo y una mínima interferencia en la manipulación de los catéteres. Existe experiencia previa en el apoyo con ECMO en procedimientos de revascularización percutánea, implante de válvulas percutáneas o ablación de arritmias3–6, y se ha utilizado también en el rescate hemodinámico de la tormenta arrítmica6,7. Por otro lado, el implante de ECMO, inicialmente quirúrgico, ha evolucionado hacia la canulación percutánea, lo que la convierte en una herramienta útil y accesible en los laboratorios de hemodinámica y electrofisiología8,9.
El caso presentado ilustra las posibilidades de la ECMO en el soporte circulatorio en procedimientos percutáneos. Además, tiene la peculiaridad de que es el primero en la literatura en el que se han realizado 2 procedimientos consecutivos (revascularización coronaria y ablación) durante un corto periodo de soporte, con la ventaja de reducir el tiempo de asistencia y de evitar una segunda canulación.