Analizar las complicaciones hematológicas y las necesidades transfusionales en niños tratados con oxigenación por membrana extracorpórea (ECMO).
DiseñoEstudio retrospectivo.
ÁmbitoUnidad de cuidados intensivos pediátricos.
PacientesNiños menores de 18 años tratados con ECMO entre septiembre de 2006 y noviembre de 2015.
IntervencionesNinguna.
Variables de interésCaracterísticas clínicas, de la ECMO, anticoagulación, parámetros hematológicos y de coagulación, transfusiones y evolución clínica.
ResultadosSe estudiaron 100 pacientes con una mediana de edad de 11 meses. Presentaron sangrado 76; el mediastino fue la localización más frecuente; 39 precisaron revisión quirúrgica. En los primeros 3 días de ECMO, el 97% de los pacientes precisaron transfusión de hematíes (34,4 ml/kg al día), el 94% plaquetas (21,1ml/kg al día) y el 90% plasma (26,6ml/kg al día). Los pacientes posquirúrgicos, con imposibilidad de salida de la circulación extracorpórea, los que presentaron sangrado al inicio de la ECMO, los que precisaron revisión quirúrgica y los que tuvieron canulación transtorácica requirieron mayor volumen de transfusiones. Se produjeron tromboembolias en 14 pacientes y hemólisis en 33. La mortalidad de los niños que presentaron sangrado al inicio de ECMO (57,6%) fue significativamente mayor que la del resto (37,5%) (p = 0,048).
ConclusionesLos niños tratados con ECMO presentan una elevada incidencia de sangrado y precisan un gran volumen de transfusiones. El postoperatorio de cirugía, el sangrado al inicio de la ECMO, la necesidad de revisión quirúrgica, la imposibilidad de salida de la circulación extracorpórea y la canulación transtorácica se asocian a un mayor volumen de transfusiones. Los niños que sangraron al inicio de la ECMO presentaron mayor mortalidad.
To analyze the hematological complications and need for transfusions in children receiving extracorporeal life support (ECLS).
DesignA retrospective study was carried out.
SettingA pediatric intensive care unit.
PatientsChildren under 18 years of age subjected to ECLS between September 2006 and November 2015.
InterventionsNone.
Variables of interestPatient and ECLS characteristics, anticoagulation, hematological and coagulation parameters, transfusions and clinical course.
ResultsA total of 100 patients (94 with heart disease) with a median age of 11 months were studied. Seventy-six patients presented bleeding. The most frequent bleeding point was the mediastinum and 39 patients required revision surgery. In the first 3days, 97% of the patients required blood transfusion (34.4ml/kg per day), 94% platelets (21.1ml/kg per day) and 90% plasma (26.6ml/kg per day). Patients who were in the postoperative period, those who were bleeding at the start of ECLS, those requiring revision surgery, those who could not suspend extracorporeal circulation, and those subjected to transthoracic cannulation required a greater volume of transfusions than the rest of the patients. Thromboembolism occurred in 14 patients and hemolysis in 33 patients. Mortality among the children who were bleeding at the start of ECLS (57.6%) was significantly higher than in the rest of the patients (37.5%) (P=.048).
ConclusionsChildren subjected to ECLS present high blood product needs. The main factors related to transfusions were the postoperative period, bleeding at the start of ECLS, revision surgery, transthoracic cannulation, and the impossibility of suspending extracorporeal circulation. Children with bleeding suffered greater mortality than the rest of the patients.
La oxigenación por membrana extracorpórea (ECMO) es una técnica de soporte circulatorio que tiene un alto riesgo de complicaciones; las más frecuentes son las hemodinámicas, neurológicas y hematológicas1-4.
Las complicaciones hematológicas más importantes son la hemorragia y los tromboembolismos4-7, que son responsables de hasta un 30-40% de las muertes de pacientes con ECMO8,9.
La hemorragia es la complicación más frecuente y severa en los niños con ECMO, especialmente en los neonatos y en los pacientes quirúrgicos10. La anticoagulación con heparina, necesaria para prevenir la formación de trombos, aumenta el riesgo de hemorragia11. Además, también es frecuente encontrar trombocitopenia por activación y consumo plaquetarios de origen multifactorial1. Por estos motivos los niños asistidos con ECMO reciben gran cantidad de transfusiones sanguíneas6.
El objetivo principal de este estudio ha sido analizar la incidencia y los factores predisponentes de complicaciones hematológicas y necesidades transfusionales en los niños tratados con ECMO. El objetivo secundario ha sido estudiar la relación de estas complicaciones con la mortalidad y la duración de ingreso en la unidad de cuidados intensivos pediátricos (UCIP).
Pacientes y métodosSe realizó un análisis retrospectivo de una base de datos prospectiva en la que se incluyó a todos los niños menores de 18 años asistidos con ECMO entre septiembre de 2006 y noviembre de 2015. No existieron criterios de exclusión. El estudio fue aprobado por el Comité de Ética local. Para realizar la ECMO se utilizó en todos los casos una bomba centrífuga (Rotaflow de Maquet®) y un oxigenador de fibra hueca de polimetilpenteno (Quadrox de Maquet®). En los pacientes con peso menor de 15kg se utilizó el oxigenador Quadrox-iD Pediatr® con una superficie de membrana de 0,8 m2 y un cebado de 81ml que admite un flujo de sangre entre 0,2 y 2,8 L/min. Para los pacientes con peso mayor de 15kg se utilizó el modelo Quadrox-D®, con una superficie de membrana de 1,8 m2 y un cebado de 250ml que admite un flujo de sangre entre 0,5 y 7 L/min. Existen 2tipos de circuitos pediátricos de 1/4 pulgadas (neonatal y lactante) y 3/8 pulgadas. La (figura 1 del material suplementario) muestra el esquema del circuito utilizado. La canulación de elección fue la vía cervical. Se realizó canulación transtorácica en pacientes con imposibilidad de salida de la circulación extracorpórea tras la cirugía, con esternotomía reciente y en situaciones de extrema urgencia.
La anticoagulación se realizó con heparina sódica en infusión continua a dosis entre 10 y 50 UI/kg· h−1. Para el control de la anticoagulación y la modificación de la dosis de heparina durante todo el estudio se utilizaron de forma combinada el tiempo de coagulación activada (TCA) a la cabecera del paciente cada 30 a 60 min, el tiempo de tromboplastina activada (TTPA) —medido al menos una vez al día— y los niveles de antifactor Xa (antiXa), que fueron utilizados como valor de referencia. Se recogieron las características de los pacientes (edad, peso, diagnóstico), la ECMO (indicación, tipo y duración), la anticoagulación (dosis de heparina), los parámetros hematológicos y de coagulación (hemoglobina [Hb], plaquetas, índice normalizado internacional [INR], TCA, TTPA, fibrinógeno, antiXa, Hb libre), la administración de transfusiones (concentrado de hematíes, plasma y plaquetas) y la evolución clínica (complicaciones hemorrágicas, trombosis, hemólisis, duración de ingreso en la UCIP, supervivencia).
Se consideró hemorragia significativa cualquier sangrado que producía un descenso de la Hb de más de 2g/dl en 24 h o que requirió transfusión. Se consideraron alteraciones hematológicas significativas que precisaban transfusión de hemoderivados unos valores de Hb < 9g/dl, plaquetas < 100.000, INR y alteración del TTPA > 2 veces el control y fibrinógeno < 150mg/dl. Estos valores se consideraron como indicadores generales de transfusión, pero la decisión fue individualizada en cada paciente teniendo en cuenta el estado clínico, el volumen de sangrado y las alteraciones hematológicas.
Se dividió el estudio en 2periodos iguales para analizar si existieron diferencias a lo largo del estudio.
El análisis estadístico se realizó con el programa IBM SPSS versión 21.0. Las variables cuantitativas con distribución normal se presentan con medias y desviaciones estándar (DE) y aquellas que no cumplen los supuestos de normalidad, como mediana y rango intercuartílico (RIC) (p25-p75). Las variables cualitativas se presentan como porcentajes. Para la comparación de variables cualitativas se utilizaron el test de la χ2 y el test exacto de Fisher. Para la comparación de variables cuantitativas se utilizaron la prueba t de Student y la prueba de los rangos con signo de Wilcoxon, según la normalidad de cada variable. Se realizó un estudio de regresión logística multivariante para analizar la influencia de cada uno de los factores relacionados con la necesidad de transfusión de concentrado de hematíes, plaquetas y plasma. Se consideró significativo un valor de p < 0,05.
ResultadosSe estudió a 100 pacientes (el 67% varones) con una mediana de 11 meses de edad (RIC 4-66 meses) y con una mediana de 7,4kg (RIC 4,8-16,8kg). El diagnóstico fue de cardiopatía en 94 pacientes (64 estaban en el postoperatorio de cirugía cardiaca), fallo respiratorio en 5 y shock séptico en uno. La indicación de ECMO fue la incapacidad para salir de extracorpórea en 27 pacientes, bajo gasto postoperatorio en 23, insuficiencia cardiaca severa no postoperatoria en 18, parada cardiaca en 12 y arritmias refractarias en 7.
El tipo de ECMO fue venoarterial en 98 pacientes y venovenosa en 2. Se colocaron cánulas cervicales en 55 pacientes, transtorácicas en 30 y en 15 se utilizaron ambos tipos de canulación. La tabla 1 resume los datos generales de los pacientes.
Características de los pacientes y la ECMO
| Mediana | RIC (p25-p75) | |
|---|---|---|
| Edad (meses) | 11 | 4-66 |
| Peso (kg) | 7,4 | 4,8-16,8 |
| Talla (cm) | 67 | 57-100 |
| Superficie corporal (m2) | 0,34 | 0,27-0,65 |
| Nivel de asistencia (% con respecto al gasto cardiaco estimado) | 78 | 63-89 |
| Duración de la técnica (horas) | 132 | 74-216 |
| Porcentaje (%) | ||
| Sexo (varón) | 67 | |
| Diagnóstico | ||
| Cardiopatía | 94 | |
| Insuficiencia respiratoria | 5 | |
| Shock séptico | 1 | |
| Indicación | ||
| Bajo gasto no postoperatorio | 18 | |
| Bajo gasto postoperatorio | 23 | |
| Hipoxemia | 13 | |
| No salida de CEC | 27 | |
| Parada cardiaca | 12 | |
| Arritmia | 7 | |
| Postoperatorio inmediato de cirugía cardiaca | 64 | |
| Tipo de ECMO | ||
| Venoarterial | 98 | |
| Venovenoso | 2 | |
| Tipo de canulación | ||
| Cervical | 55 | |
| Transtorácica | 30 | |
| Ambas | 15 | |
CEC: circulación extracorpórea; RIC: rango intercuartílico.
La Hb disminuyó de forma progresiva hasta al séptimo día y se recuperó con posterioridad. Solo existieron diferencias estadísticamente significativas entre la Hb a las 24 h y la de las 72 h y los 5 días (figura 2 del material suplementario). Las plaquetas disminuyeron hasta el séptimo día y se mantuvieron estables después. Existieron diferencias significativas entre las plaquetas basales y las del resto de la evolución (figura 3 del material suplementario).
El INR, que estaba alargado al inicio, fue normalizándose progresivamente (figura 4 del material suplementario), mientras que el fibrinógeno se mantuvo en rango normal en la mayoría de los pacientes desde el inicio de la ECMO (datos no mostrados).
Un 10% de los pacientes presentó una Hb < 9g/dl; un 30% tenía plaquetas inferiores a 100.000; un 19%, un INR > 2 y un 11%, un fibrinógeno < 150mg/dl.
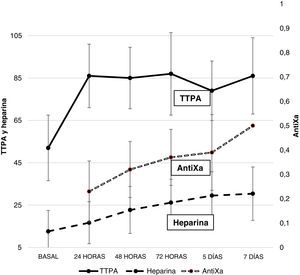
AnticoagulaciónLa figura 1 recoge la dosis de heparina y los valores de TTPA y antiXa. Durante la ECMO existió un aumento progresivo de la necesidad de heparina. El TTPA aumentó precozmente tras iniciar la anticoagulación y se mantuvo elevado durante toda la evolución. Solo el 22,2% de los pacientes tenían un antiXa en rango terapéutico el primer día; este objetivo se alcanzó al 5.° día de ECMO.
SangradoPresentaron sangrado en las primeras 24 h 52 pacientes y 76 a lo largo de todo el tratamiento. Otros 39 pacientes precisaron revisión quirúrgica por sangrado. La localización más frecuente de la hemorragia fue el mediastino (34 pacientes), que provocó taponamiento en 15 pacientes. Presentaron hemorragia difusa 14 pacientes; otros 14, hemorragia pulmonar; 6, hemorragia pericánula; 5, hemorragia digestiva y 3 presentaron hemorragia cerebral.
Los pacientes en el postoperatorio de cirugía presentaron una incidencia de sangrado en las primeras 24 h (67,2%) significativamente más elevada que el resto de los niños (25%) (p = 0,001).
Los pacientes con fibrinógeno < 150mg/dl y con plaquetas < 100.000/mm3 presentaron una mayor incidencia de sangrado inicial (81,8 y 66,7%) que aquellos con fibrinógeno > 150 y plaquetas > 100.000/mm3 (48,3 y 45,7%), pero las diferencias no alcanzaron significación estadística (p = 0,053 y p = 0,080, respectivamente). No se encontraron diferencias significativas en la incidencia de sangrado al inicio de la ECMO entre los niños que presentaban INR > 2 (52,6%) e INR < 2 (51,9%) (p = 1).
TransfusionesEn las primeras 24 h de ECMO, 85 pacientes recibieron transfusiones de hematíes, 78 de plaquetas y 83 de plasma. El volumen de transfusión de hematíes durante los 3primeros días de ECMO fue de 34,4ml/kg al día (DE 31,1), de plaquetas de 21,1ml/kg al día (DE 19,1) y de plasma de 26,6ml/kg al día (DE 24,8).
Los niños que estaban en postoperatorio de cirugía cardiaca, aquellos cuya indicación de ECMO fue la imposibilidad de salida de extracorpórea, los que presentaron sangrado inicial y los que requirieron revisión quirúrgica precisaron un volumen significativamente mayor de transfusiones (tabla 2).
Factores relacionados con la necesidad de transfusiones
| Hematíes | Plaquetas | Plasma | ||||
|---|---|---|---|---|---|---|
| ml/kg | ml/kg | ml/kg | ||||
| M (DE) | p | M (DE) | p | M (DE) | p | |
| Postoperatorio | ||||||
| Sí | 42,2 (34,6) | 0,001 | 25,4 (21,2) | 0,005 | 30,6 (27,3) | 0,020 |
| No | 21 (18) | 14,1 (12,1) | 18,3 (17,7) | |||
| No salida CEC | ||||||
| Sí | 59,8 (36,4) | 0,010 | 34,6 (22,6) | 0,010 | 40,6 (27,7) | 0,010 |
| No | 26 (24,2) | 16,8 (15,7) | 21,4 (22,1) | |||
| Sangrado | ||||||
| Sí | 44,7 (35,1) | 0,001 | 25 (19,8) | 0,037 | 32,9 (23,7) | 0,004 |
| No | 22,5 (24,7) | 16,8 (17,5) | 18,2 (24,2) | |||
| Revisión | ||||||
| Sí | 45,5 (36,7) | 0,004 | 23,8 (17,9) | 0,200 | 30,8 (20,6) | 0,097 |
| No | 26,8 (24,8) | 18,7 (19,4) | 22,1 (26,6) | |||
| p | ||||||
CEC: circulación extracorpórea; DE: desviación estándar; M: media; Postoperatorio: postoperatorio de cirugía cardiaca; Revisión: revisión quirúrgica; Sangrado: sangrado inicial.
El estudio de regresión logística multivariante mostró que los únicos factores estadísticamente relacionados con la necesidad de transfusión de concentrado de hematíes fueron la imposibilidad de salida de circulación extracorpórea como indicación de ECMO (odds ratio 23,43; IC 95%: 6,05-40,80; p = 0,009) y la canulación transtorácica (odds ratio 21,10; IC 95%: 6,08-36,11; p = 0,007). En los estudios multivariantes de la necesidad de transfusiones de plaquetas y plasma, ninguno de los factores estudiados alcanzó significación estadística.
No existieron diferencias significativas en la incidencia de alteraciones hematológicas ni en las necesidades de transfusiones en los 2periodos de estudio (tabla 3).
Comparación de las alteraciones hematológicas y las necesidades transfusionales en los 2 periodos de estudio
| Periodos de estudio | 2006-2010 | 2011-2015 | |
|---|---|---|---|
| Porcentaje | p | ||
| Hemoglobina < 9 g/dl | 10,2 | 8,5 | 0,700 |
| Trombocitopenia < 100.000 | 28 | 32 | 0,800 |
| INR > 2 | 26 | 12 | 0,074 |
| Fibrinógeno < 150 mg/dl | 12 | 10 | 0,750 |
| Sangrado | 48 | 56 | 0,420 |
| Revisión quirúrgica | 31,3 | 49 | 0,075 |
| Factor VII activado | 33,3 | 24,5 | 0,340 |
| Media (DE) | |||
| Transfusión de hematíes (ml/kg al día) | 34,4 (36) | 34,2 (25,5) | 0,980 |
| Transfusión plaquetas (ml/kg al día) | 21,2 (24) | 21,1 (12,5) | 0,980 |
| Transfusión plasma (ml/kg al día) | 26,5 (29,1) | 25,4 (19,8) | 0,890 |
INR: índice normalizado internacional.
Se produjeron 14 fenómenos tromboembólicos. La localización fue periférica en 6 pacientes, que presentaron embolias en zonas acras. Los 6fallecieron en situación de fallo multiorgánico. En 3 pacientes se produjeron tromboembolias cerebrales con infartos secundarios; falleció uno de los pacientes.
En controles ecográficos realizados por mal funcionamiento del circuito de ECMO se diagnosticaron un trombo en aurícula derecha, otro en cava inferior y otro en aorta. Uno de esos pacientes presentó embolia pulmonar. En un paciente se sospechó embolia peritoneal por sospecha de isquemia intestinal. Cinco pacientes presentaron un segundo tromboembolismo. En 21 pacientes se produjeron trombos en el oxigenador. En 10 de ellos las trombosis fueron en la cara arterial del oxigenador o provocaron su malfuncionamiento, por lo que fue necesario cambiar el circuito.
HemólisisLa evolución de los niveles de Hb libre se muestra en la figura 5 del material suplementario. Se observó una hemólisis excesiva (Hb libre > 50mg/dl) en 33 pacientes. El tiempo entre el inicio de la ECMO y la aparición de hemólisis fue de 3,9 días (DE 2). Se realizaron 5 cambios de circuito por hemólisis.
Los pacientes que presentaron hemólisis tenían una edad y un peso menor que el resto: 20,1 meses (DE 35,3) frente a 46,9 meses (DE 55,4) (p = 0,013) y 7,7kg (DE 5,9) frente a 16,4kg (DE 18,4) (p = 0,01).
No existió relación entre la hemólisis y el número de revoluciones utilizadas en la ECMO. El flujo de sangre en los niños con hemólisis fue menor que en los que no la presentaron (tabla 4).
Relación entre la hemólisis y el número de revoluciones y el flujo del circuito
| Revoluciones por minuto (rpm) | Flujo de sangre (L/min) | ||||||
|---|---|---|---|---|---|---|---|
| Hemólisis | No hemólisis | p | Hemólisis | No hemólisis | p | ||
| 8 h | M | 2.333,2 | 2.478,1 | 0,068 | 0,7 | 1,3 | 0,008 |
| DE | 335,1 | 349 | 0,5 | 1,2 | |||
| 24 h | M | 2.389,5 | 2.483 | 0,238 | 0,8 | 1,3 | 0,010 |
| DE | 309,5 | 375,1 | 0,5 | 1,1 | |||
| 48 h | M | 2.349,1 | 2.441,4 | 0,250 | 0,8 | 1,3 | 0,011 |
| DE | 338,1 | 351,1 | 0,5 | 1 | |||
| 72 h | M | 2.346 | 2.287,5 | 0,590 | 0,8 | 1,2 | 0,038 |
| DE | 350,8 | 499,5 | 0,5 | 1 | |||
DE: desviación estándar; ECMO: oxigenación por membrana extracorpórea; h: horas; M: media.
La ECMO se pudo retirar en 76 pacientes (61 pacientes por mejoría clínica, uno por sangrado, 7 por paso a un sistema de asistencia ventricular y 7 por realización de trasplante cardiaco). La duración de la ECMO fue de 5,5 días (RIC 3-9 días). En total, 52 pacientes sobrevivieron al alta del hospital.
La duración de ingreso en la UCIP fue de 21 días (RIC 10-38 días). No existieron diferencias significativas en la duración de ingreso en la UCIP entre los pacientes con sangrado inicial (40,2 días; DE 25,1) y el resto (49,6 días; DE 44; p = 0,385).
Fallecieron el 48% de los niños: el 56% de los niños menores de un año y el 40% de los mayores de esta edad (p = 0,161). La mortalidad de los niños que presentaron sangrado al inicio de ECMO (57,6%) fue significativamente mayor que la del resto de los pacientes (37,5%) (p = 0,048).
La mortalidad de los niños con alteraciones de la coagulación fue mayor que la de los del resto, pero las diferencias no fueron estadísticamente significativas: INR < 2 (63,2 frente a 44,4%; p = 0,202), fibrinógeno < 150mg/dl (72,7 frente a 44,9%; p = 0,112) y <100.000 plaquetas/mm3 (56,7 frente a 44,3%; p = 0,282).
La mortalidad de los pacientes que se encontraban en postoperatorio de cirugía cardiaca (53,1%) fue mayor que la del resto (39%), pero las diferencias tampoco alcanzaron significación estadística (p = 0,213).
DiscusiónNuestro estudio muestra que en los niños tratados con ECMO las alteraciones hematológicas son muy frecuentes y se asocian a una importante necesidad de transfusiones.
La incidencia de hemorragia en nuestro estudio fue superior a la referida en el registro ELSO2,4, aunque nosotros incluimos cualquier tipo de sangrado y el porcentaje de pacientes posquirúrgicos fue muy elevado, lo que puede explicar en parte estas diferencias. En nuestro estudio las alteraciones de coagulación y las necesidades transfusionales se mantuvieron estables en los 2periodos del estudio.
Algunos autores han propuesto valorar solo como complicación hemorrágica el sangrado que requiere transfusión. Otros proponen clasificar la hemorragia en leve si el sangrado es entre 10 y 20ml/kg en 24 h e importante si es mayor de 20ml/kg en 24 h, produce un descenso de la Hb de 2g/L en 24h, afecta al cerebro, pulmón o retroperitoneo o requiere intervención quirúrgica12. En nuestro estudio no se registró el volumen de sangrado, pero un 39% de los pacientes requirió revisión quirúrgica.
La causa de la hemorragia en los pacientes con ECMO es probablemente de origen multifactorial2. Por una parte, la enfermedad subyacente, la cirugía, la administración de fármacos y el fallo multiorgánico que suelen presentar estos niños alteran los mecanismos de coagulación. Por otra parte, la máquina y el circuito de ECMO que producen inflamación, activación plaquetaria1,8,13 y consumo de factores de coagulación3. Por último, el tratamiento con heparina.
En los niños y adultos tratados con ECMO se produce una disminución importante de las plaquetas y precisan frecuentes transfusiones1,13-15. La etiología de la trombocitopenia es probablemente multifactorial (infección, hemorragia, transfusión y el consumo plaquetario en el circuito de ECMO)8. En nuestro estudio se observó una disminución significativa de las plaquetas (de 186.500 a 105.700/mm3) en las primeras 24 h de tratamiento. Esta cifra se mantuvo a lo largo del tratamiento, con transfusiones periódicas de plaquetas.
El sangrado, la activación plaquetaria y el consumo de factores de coagulación explican las alteraciones hematológicas encontradas en estos pacientes y la necesidad de recibir transfusiones de hemoderivados. En nuestro estudio los factores que se relacionaron con una mayor necesidad de transfusiones de hemoderivados fueron el postoperatorio de cirugía cardiaca, el sangrado al inicio de la ECMO y la necesidad de revisión quirúrgica. hechos también referidos por otros autores16,17. En el estudio de regresión logística los factores estadísticamente relacionados con la necesidad de transfusión de concentrados de hematíes fueron la imposibilidad de salir de circulación extracorpórea y la canulación transtorácica.
No hay evidencias claras sobre las indicaciones de transfusiones en los niños tratados con ECMO12. La mayoría de los autores proponen mantener un hematocrito del 35% con un rango amplio de indicación de transfusión entre 25 y 40% y unas plaquetas de 100.000×10/L, con un rango de transfusión entre 50 y 200.00012. Estos criterios transfusionales son similares a los utilizados en nuestro estudio. Son necesarios estudios que valoren si una política transfusional más restrictiva puede reducir el volumen de transfusiones sin suponer un riesgo para el paciente.
La respuesta a la heparina es muy variable y cambiante durante la evolución, y es difícil mantener el circuito libre de trombos sin aumentar el riesgo de hemorragia18. Varios estudios han mostrado que existe una mayor correlación entre los niveles de heparina y el antiXa que con el TCA o TTPA8,19 y que además los niveles de antiXa no se afectan por los reactantes de fase aguda como el fibrinógeno y el factor vii8. Otros estudios han encontrado una disminución en la necesidad de toma de muestras de sangre, disminución en la transfusión de hemoderivados y menos complicaciones tanto trombóticas como hemorrágicas al utilizar el antiXa como parte del protocolo de monitorización de la coagulación19.
En nuestro estudio se utilizó el TCA para la monitorización de la anticoagulación a pie de cama y el TTPA y el antiXa para el control diario de la anticoagulación. Nuestro parámetro de referencia para el control de la anticoagulación fue el antiXa, pero como en nuestro hospital no puede realizarse de urgencia, se utilizó el TCA para la regulación horaria de la administración de heparina y el TTPA para valorar la necesidad de transfusión de plasma. Los niveles de antiXa se mantuvieron inicialmente por debajo del rango terapéutico en la mayoría de los pacientes respecto a la utilización de dosis más bajas de heparina para disminuir el sangrado.
Algunos autores han descrito que la utilización de dosis más bajas de heparina para mantener un TTPA entre 1,5 y 2 veces el control lleva a una menor incidencia de sangrado sin aumentar los tromboembolismos16, pero son necesarios estudios comparativos amplios que confirmen estos resultados.
Los fenómenos tromboembólicos se producen debido al contacto entre la sangre y las superficies no endoteliales, que desencadenan una respuesta inflamatoria y activación de la coagulación. En nuestro estudio 14 pacientes presentaron algún fenómeno tromboembólico. Los trombos periféricos fueron los más frecuentes. Los 6pacientes que presentaron este fenómeno fallecieron en situación de fallo multiorgánico, probablemente relacionado con un estado de coagulación intravascular diseminada. En el registro de la ELSO la localización más frecuente fue el sistema nervioso central, con un 5% de los niños con infarto cerebral4, cifra similar a la encontrada en nuestro estudio (3%).
En 21 pacientes se produjeron trombos en el oxigenador, que es el lugar más frecuente en el que aparecen los trombos dentro del circuito3,6,20. La cifra es similar a la referida en otros estudios3,20. Los trombos en la cara arterial del oxigenador son el factor de riesgo más importante de desarrollo de tromboembolias. Esto exige una cuidadosa vigilancia continua del circuito por el personal médico y de enfermería y una monitorización estrecha de la anticoagulación. La aparición de trombos en la parte del circuito postoxigenador obliga al cambio del circuito para evitar embolias, lo que ocurrió en 10 de nuestros pacientes.
En nuestro estudio un 33% de los pacientes presentó hemólisis, cifra significativamente menor al 66% encontrado por Lou et al.21.
La hemólisis es una complicación del soporte mecánico por un aumento de la tensión de cizallamiento producida por la bomba, que puede producir insuficiencia renal aguda y fallo multiorgánico3. También la caída de presión negativa a través de la membrana del oxigenador puede producir un efecto de succión que causa cavitación y trauma sobre los hematíes. Por otra parte, el uso de revoluciones altas también se ha relacionado con la hemólisis, de manera que cuando empieza a aumentar la Hb libre en sangre se recomienda, si es posible, disminuir las revoluciones por minuto (rpm)3. Lou et al. encontraron que en los niños con hemólisis las rpm y el flujo fueron mayores que en los que no la presentaron21. Sin embargo, en nuestro estudio no encontramos relación entre las rpm y la hemólisis y, sorprendentemente, el flujo de sangre fue menor en los niños que presentaron hemólisis que en los que no la presentaron.
Por otra parte, en nuestra serie la hemólisis fue mayor en los niños con menor edad y peso, dato que coincide con lo referido por Lou et al.21.
La supervivencia al alta del hospital en nuestro estudio (52%) es muy similar a la referida por el registro ELSO en pacientes pediátricos cardiacos (51%)4.
El sangrado es la principal causa de mortalidad en los pacientes ECMO3,6. En nuestro caso, la mortalidad de los niños que presentaron sangrado al inicio de la ECMO (57,6%) fue significativamente mayor que la del resto de los pacientes (37,5%), lo que coincide con lo referido en el registro ELSO2,6. El sangrado importante puede contribuir a la aparición de complicaciones orgánicas y aumenta la coagulopatía, y se produce un círculo vicioso coagulopatía-hemorragia-transfusiones que es muy difícil de controlar.
La duración mediana del soporte con ECMO en nuestro estudio (5,5 días) fue similar a la referida en el registro ELSO para los niños con indicación cardiaca (6,3 días)4.
La duración mediana de ingreso en la UCIP de los pacientes que precisaron ECMO fue de 21 días y la presencia de sangrado no se relacionó con una estancia más prolongada.
Nuestro estudio presenta varias limitaciones. En primer lugar, es un estudio unicéntrico realizado en un centro que es referente en cirugía cardiaca y nuestros datos pueden no ser completamente extrapolables a otros centros en los que la ECMO se realice en otro tipo de pacientes. En segundo lugar, se trata de un análisis retrospectivo de un registro con una duración prolongada, lo que aumenta la dificultad de recoger adecuadamente todas las variables y las posibilidades de que se produzcan sesgos, no se puede asegurar una homogeneidad total de los criterios transfusionales y no permite establecer relaciones causales.
Por último, el volumen de sangrado no fue cuantificado y los valores de los parámetros hematológicos están influidos por la cantidad de trasfusiones que recibieron los pacientes. En nuestro estudio no se recogieron los valores de los parámetros hematológicos antes y después de cada transfusión, lo que hubiera ayudado a valorar el efecto de las transfusiones.
Nuestros resultados muestran que los niños tratados con ECMO presentan frecuentes alteraciones hematológicas y de la coagulación, una elevada incidencia de sangrado y precisan un gran volumen de trasfusiones.
Los pacientes en el postoperatorio de cirugía, los que presentaron sangrado al inicio de la ECMO y los que requirieron revisión quirúrgica precisaron un mayor volumen de transfusiones, aunque no se puede establecer una relación causal de esta asociación. Los niños que sangraron al inicio de la ECMO presentaron una mayor mortalidad, pero no una mayor duración de ingreso en la UCIP. Nuestro estudio puede servir de base para desarrollar protocolos específicos de transfusión en los niños tratados con ECMO y para plantear estudios multicéntricos que analicen si los circuitos impregnados con heparina; una menor anticoagulación y una política transfusional más restringida reducen el riesgo de complicaciones hemorrágicas y tromboembólicas en los niños tratados con ECMO19.
FinanciaciónLos autores no han recibido financiación para realizar este estudio.
Autoría/colaboracionesMJS: concepción y diseño del estudio, recogida, análisis e interpretación de los datos, revisión crítica del texto y aprobación de la versión definitiva.
CG: recogida, análisis e interpretación de los datos, redacción del texto y aprobación de la versión definitiva.
IM: recogida, análisis e interpretación de los datos, redacción del texto y aprobación de la versión definitiva.
VM: recogida, análisis e interpretación de los datos, redacción del texto y aprobación de la versión definitiva.
PS: recogida, análisis e interpretación de los datos, redacción del texto y aprobación de la versión definitiva.
AS: concepción y diseño del estudio, recogida, análisis e interpretación de los datos, revisión crítica del texto y aprobación de la versión definitiva.
JLH: concepción y diseño del estudio, análisis e interpretación de los datos, redacción del texto y aprobación de la versión definitiva.
Conflicto de interesesLos autores declaran no tener conflictos de interés.
Los autores agradecen la colaboración del personal médico y de enfermería de la UCIP, del equipo de la Sección de Cardiología Pediátrica, de Cirugía Cardiaca Infantil y de las enfermeras perfusionistas, así como al Servicio de Hematología del Hospital General Universitario Gregorio Marañón en el tratamiento de los niños asistidos con ECMO.