Establecer el valor predictivo, para desarrollar deterioro neurológico tardío de origen isquémico (DNI), de un estudio doppler transcraneal (DTC) en pacientes con hemorragia subaracnoidea espontánea (HSA) en buena situación neurológica.
DiseñoEstudio descriptivo-observacional desarrollado durante 3 años.
ÁmbitoCuidados Críticos y Urgencias.
PacientesSe incluyeron de forma consecutiva aquellos pacientes con HSA en buena situación neurológica (Hunt-Hess I-III).
Variables de InterésDNI (disminución en 2 puntos del GCS o déficit focal), velocidad media (VM) en arterias cerebrales medias, índice de Lindegaard (IL). Se consideró patrón sonográfico de vasoespasmo (PSV) cuando la VM fue>120cm/s y existía un IL>3.
ResultadosLa media de edad de los 122 pacientes fue de 54,1±13,7 años. El 57,3% eran mujeres. Se detectaron 24 pacientes con PSV (19,7%) encontrándose VM elevadas en 38 pacientes (31,1%). 21 pacientes desarrollaron DNI (VM 183+/-49cm/s), todos presentaron PSV. En los pacientes con DNI se detectó un aumento de VM de 22+/-5cm/s/24h durante los 3 primeros días. Al comparar aquellos pacientes que no presentaron VM elevadas (85 pacientes/VM 67+/-16,6cm/s) con respecto a los que desarrollaron DNI encontramos diferencias en las VM (p<0,001) y en el ΔVM/24h (8,30+/-4,5cm/s Vs 22+/-5cm/s) durante los 3 primeros días (p=0,009). Mediante curvas ROC, se fijó que el ΔVM/día de 21cm/s (p<0,001), era el que mejor predecía el DNI.
ConclusiónDurante los 3 primeros días un incremento en la VM de 21cm/s/24h se asoció con el desarrollo de vasoespamo sintomático. El DTC es una herramienta útil para la detección de aquellos pacientes con HSA en riesgo de desarrollar DNI.
To examine the predictive value of an early transcranial Doppler ultrasound (TCD) study performed in the emergency department in patients with spontaneous subarachoniod hemorrhage (SAH) in good neurological condition, in order to know which patients are at high risk of developing delayed cerebral ischemia (DCI).
DesignA descriptive observational study was carried out involving a period of 3 years.
SettingCritical Care and Emergency Department.
PatientsThe study consecutively included patients with SAH of grade I-III on the Hunt and Hess scale.
Variables of InterestDCI (decrease of 2 points in GCS or focal deficit), Mean Velocity (MV) of middle cerebral arteries (MCA), Lindegaard Index (IL). Sonographic vasospasm pattern (SVP) was considered if MCA-MV>120cm/sc and IL>3.
ResultsThe mean age of the 122 patients was 54.1±13.7 years; 57.3% were women. SVP was detected in 24 patients (19.7%), although high velocities patterns (HVP) were present in 38 patients (31.1%). DCI developed in 21 patients (MV183+/-49cm/sc), all with previous SVP. In this group MV increased 22+/-5cm/sc/day during the first 3 days. The group without HVP (84 patients/MV of 67+/-16.6cm/sc), compared with DCI group, showed differences in highest MV (p<0.001), and also ΔMV/day (8.30+/-4,5cm/sc Vs 22+/-5cm/sc) during the first 3 days (p=0.009). In our series, ROC analysis selected the best cut-off value for ΔMV/day as 21cm/sc (p<0.001).
ConclusionDuring the first 3 days, an increase of 21cm/s/24h in MCA-MV was associated with the development of symptomatic vasospasm. TCD is a useful tool for the early detection of patients at risk of DCI after SAH.
La patología cerebrovascular hemorrágica de origen aneurismático supone alrededor del 80% de todos los sangrados extravasados al espacio subaracnoideo de origen no traumático. La hemorragia subaracnoidea espontánea (HSA) supone entre el 5-10% de todos los ictus, presentando una incidencia media de 6-10/100.000 habitantes y es la causa más habitual de muerte súbita por ictus1–4. Se ha detectado hasta un 20% de mortalidad evitable tras la HSA5. Una de las complicaciones principales, responsable de los resultados ominosos, y en especial de las secuelas neurológicas, es el vasoespasmo sintomático o deterioro neurológico isquémico (DNI)6,7. Este sucede en el 26,5-46% de los pacientes entre el 4.° y el 14.° día de evolución8,9. Se manifiesta clínicamente por un descenso del nivel de conciencia o aparición de déficit focal neurológico, no atribuible a resangrado o hidrocefalia. Su etiopatogenia y fisiopatología no es bien conocida hasta el momento. El diagnóstico se establece mediante arteriografía, al objetivarse una reducción del calibre arterial, o mediante ultrasonidos al registrarse incremento de la velocidad del flujo. Valores de velocidades medias (VM) superiores a 120 cm/s en la arteria cerebral media se correlacionan en forma significativa con el estrechamiento del vaso10.
Dada la frecuencia y gravedad del DNI se han realizado múltiples intentos de predecirlo precozmente. Para ello se han utilizado diferentes elementos, como el volumen del sangrado en la tomografía axial computada, la gravedad clínica, variados factores hematológicos y la sonografía doppler transcraneal (DTC)11–17.
Mientras que la utilidad del DTC para el diagnóstico y seguimiento del vasoespasmo, sintomático o no, en las HSA es una cuestión suficientemente establecida, su validez para la predicción del DNI por vasoespasmo está por determinar18–23. Hasta el momento se han estudiado diferentes elementos como el valor absoluto de las VM, su incremento, o la aplicación de técnicas sonográficas que permitan medir la capacidad autorreguladora cerebral17,24–26. Sin embargo, sus resultados contradictorios explicarían la inexistencia de recomendaciones para realizar el estudio DTC de forma urgente26–29. Por la misma razón, la posibilidad de utilizar esta técnica para decidir qué enfermos con HSA en buena situación neurológica deberían recibir una atención y un seguimiento más estrecho, no ha sido explorada. Discernir, en las primeras horas de asistencia, qué HSA no grave se beneficiaría del ingreso en UCI, por pertenecer a un grupo de alto riesgo de presentación de deterioro neurológico tardío, sería indispensable, además de eficiente, para poder instaurar un tratamiento profiláctico precoz y agresivo ante la presencia de isquemia cerebral secundaria al vasoespasmo.
Postulamos que el estudio DTC urgente, realizado dentro de las primeras 24 horas de ingreso en el hospital, podría predecir el vasoespasmo sintomático del territorio vasculocerebral anterior, ya que el espasmo arterial secundario a las HSA es progresivo y no súbito y acontece en las grandes arterias del polígono de Willis. Para ello debe estudiarse el incremento de velocidades/24 horas durante los 3 primeros días, y no los valores absolutos de VM de la ACM, en grupos clínicamente homogéneos. En este estudio nos planteamos indagar si el DTC practicado durante los 3 primeros días, en pacientes con HSA en buena situación neurológica, puede predecir la aparición ulterior de DNI.
Material y métodoEstudio descriptivo longitudinal desarrollado siguiendo las directrices del Comité de Investigación de nuestro Hospital, en el Servicio de Cuidados Críticos y Urgencias del Hospital Universitario de Traumatología, Virgen del Rocío, en el período 2005-2007.
Se han incluido todas las HSA espontáneas de baja gravedad clínica - según la escala de Hunt y Hess (HH), grados i al iii - en el momento del ingreso en el hospital12. Fueron excluidas las HSA traumáticas, los aneurismas incidentales, los pacientes sin ventana sónica para la realización de DTC y las HSA espontáneas en grados iv-v de HH. Se registró el tiempo transcurrido desde el inicio de los síntomas/signos hasta la llegada del paciente al hospital.
El diagnóstico de HSA se realizó en todos los casos mediante tomografía axial computerizada (TAC) o mediante punción lumbar cuando la TAC resultó negativa y la clínica era sugestiva de HSA. La gravedad del sangrado fue estimada mediante el estudio tomográfico, siguiendo la escala de Fisher11. Tras la llegada al hospital, los pacientes permanecieron durante 24-48 horas en el área de observación de urgencias. En espera de la realización de estudio arteriográfico urgente, los pacientes eran mantenidos en ayunas. Se realizó, desde un primer momento, tratamiento con nimodipino intravenoso a dosis de 0,5mg/h, con incremento gradual de la dosis en las siguientes 6 horas hasta 2mg/h, en ausencia de efectos hemodinámicos adversos. Posteriormente el tratamiento se continuaba vía oral a razón de 60mg/4 h, si no existía contraindicación.
El examen DTC (Doppler Multidop-P, DWL, Alemania) se realizó con una sonda de ultrasonidos de 2 MegaHertzios, a través de la ventana temporal, según el método descrito por Aaslid et al.30 Se practicó un estudio DTC en las primeras 24 horas y otro a las 48 horas, como mínimo. Una exploración sonográfica entre el 4.° y 14.° día de evolución de la HSA se realizó, excepto si el primer estudio se efectuó en este período y resultó normal. Solo 7 facultativos, con alta experiencia en DTC, efectuaron los estudios. Se determinó, en ambos hemisferios, la VM de la arteria cerebral media (ACM) proximal (M1). Si la VM obtenida era superior a 2 desviaciones estándar (DE) para la edad del paciente, alcanzase o no los 120cm./s, se insonó la carótida interna extracraneal (ACI-ex) homolateral a nivel submandibular y se calculó el Índice de Lindegaard (IL): VM ACM/VM ACI-ex. Los pacientes con relación Vm ACM/Vm ACI extracraneal>3, fueron catalogados como pacientes con vasoespasmo sonográfico. Los enfermos con VM>120cm/s e IL<3 fueron diagnosticados de incremento del flujo sanguíneo cerebral30–32. Si el paciente requirió drenaje ventricular, por hidrocefalia en las primeras 24 horas, el registro considerado como válido, fue el ulterior a la evacuación del líquido cefalorraquídeo. Se consideró vasoespasmo sintomático (DNI) la presencia de un deterioro del nivel de conciencia igual o superior a 2 puntos de la escala de coma de Glasgow (GCS) o ante la aparición de un déficit focal, entre el 4.° y el 14.° día del sangrado, no atribuibles a resangrado, hematoma, hidrocefalia o alteraciones metabólicas. Se consideró vasoespasmo secundario a exclusión de anomalía vascular, cuando la clínica anteriormente especificada se presentaba en relación temporal a la intervención quirúrgica, excepto si era consecuencia de clipado quirúrgico incidental.
Se realizó arteriografía cerebral, para la filiación etiológica de la HSA en todos los pacientes. Esta exploración se repitió a los 14 días si la primera resultó negativa y no se trataba de una HSA perimesencefálica. En los casos que fueron necesarios se realizó arteriografía cerebral para alcanzar el diagnóstico de vasoespasmo angiográfico. En el caso de arterias no insonadas (arteria basilar y arteria cerebral anterior) la existencia de vasoespasmo angiográfico no se contabilizó como tal, a efectos de este estudio.
Información al paciente y confidencialidad de los datosSe han seguido las recomendaciones de la Declaración de Helsinki en materia de investigación. El paciente fue informado del interés de su caso y se le solicitó permiso de forma oral para la recogida de la información y su inclusión en el estudio. No fue necesaria la autorización escrita expresa por ser un estudio en el que no se realizó intervención médica ni se obtuvieron muestras biológicas extraordinarias para análisis, fuera de las usuales de la práctica clínica habitual. La confidencialidad de los pacientes que formaron parte del estudio fue garantizada mediante la adjudicación a cada paciente de un código constituido por 2 dígitos iniciales que correspondieron al código del hospital que asistió en primera instancia el caso, seguido del número de la historia clínica (constituida hasta por 7 dígitos). La hoja de recogida permaneció custodiada por los responsables del estudio.
EstadísticaPara el análisis estadístico se utilizó el paquete SPSS 17.0. Consideramos estadísticamente significativos los valores de p<0,05. Las variables continuas se han expresado como media y su desviación estándar. Se ha llevado a cabo análisis mediante comparación de medias utilizando el test de la t de Student o U de Mann-Whitney cuando fue preciso. Las variables cualitativas se han comparado con el test de Chi cuadrado o el test exacto de Fisher. Excluidos los pacientes que desarrollaron hiperemia, mediante curva ROC se calculó el mejor punto de corte del incremento de Vm/24 h en el periodo prevasoespasmo.
ResultadosDurante el periodo de realización de nuestro estudio, se registraron 123 episodios de HSA. Un paciente fue excluido del estudio al no presentar ventana sonográfica. Se estudiaron un total de 122 pacientes. La distribución por sexo fue de 70 mujeres (57,3%) y 52 hombres (42,6%), con una media de edad de 54,1 ±13,7 años.
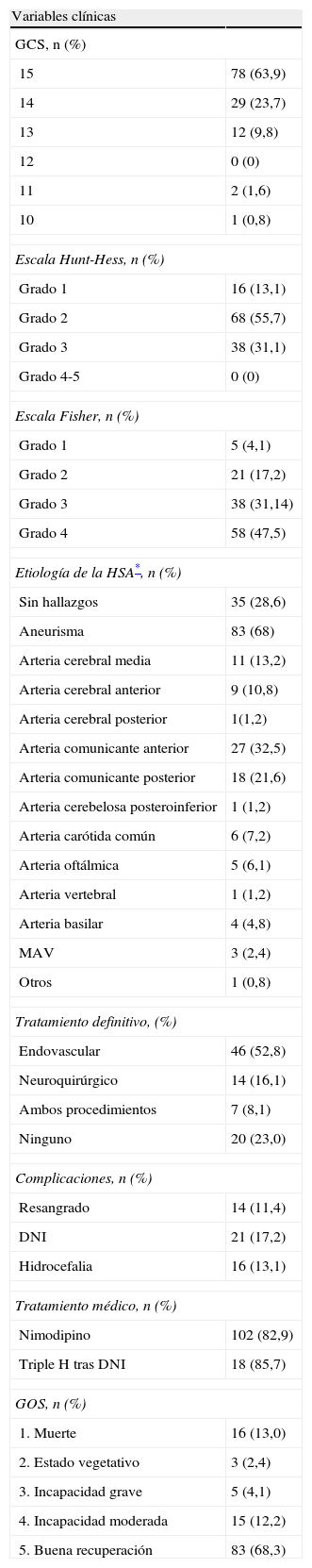
El 70,4% de los pacientes acudieron al hospital, en las primeras 24 horas del sangrado y fueron diagnosticados de HSA, antes de transcurridas 24 horas de la aparición de los síntomas. En 36 casos (29,5%) el diagnóstico se demoró más de 24 horas, bien porque el paciente no solicitara asistencia médica con anterioridad, bien porque no se filiara el proceso hasta ese momento. La evaluación del grado de alteración del nivel de conciencia a su recepción hospitalaria mostró como un 87,6% de los pacientes, se encontraba con una puntuación entre 14-15 según la GCS. La demora media en la realización de los estudios arteriográficos fue de 57 horas. La distribución según gravedad clínica en la escala de HH, la etiología de la HSA, la evolución clínica y el tratamiento aplicado queda reflejada en la tabla 1.
Características clínicas y evolución de los 122 pacientes con HSA
| Variables clínicas | |
| GCS, n (%) | |
| 15 | 78 (63,9) |
| 14 | 29 (23,7) |
| 13 | 12 (9,8) |
| 12 | 0 (0) |
| 11 | 2 (1,6) |
| 10 | 1 (0,8) |
| Escala Hunt-Hess, n (%) | |
| Grado 1 | 16 (13,1) |
| Grado 2 | 68 (55,7) |
| Grado 3 | 38 (31,1) |
| Grado 4-5 | 0 (0) |
| Escala Fisher, n (%) | |
| Grado 1 | 5 (4,1) |
| Grado 2 | 21 (17,2) |
| Grado 3 | 38 (31,14) |
| Grado 4 | 58 (47,5) |
| Etiología de la HSA*, n (%) | |
| Sin hallazgos | 35 (28,6) |
| Aneurisma | 83 (68) |
| Arteria cerebral media | 11 (13,2) |
| Arteria cerebral anterior | 9 (10,8) |
| Arteria cerebral posterior | 1(1,2) |
| Arteria comunicante anterior | 27 (32,5) |
| Arteria comunicante posterior | 18 (21,6) |
| Arteria cerebelosa posteroinferior | 1 (1,2) |
| Arteria carótida común | 6 (7,2) |
| Arteria oftálmica | 5 (6,1) |
| Arteria vertebral | 1 (1,2) |
| Arteria basilar | 4 (4,8) |
| MAV | 3 (2,4) |
| Otros | 1 (0,8) |
| Tratamiento definitivo, (%) | |
| Endovascular | 46 (52,8) |
| Neuroquirúrgico | 14 (16,1) |
| Ambos procedimientos | 7 (8,1) |
| Ninguno | 20 (23,0) |
| Complicaciones, n (%) | |
| Resangrado | 14 (11,4) |
| DNI | 21 (17,2) |
| Hidrocefalia | 16 (13,1) |
| Tratamiento médico, n (%) | |
| Nimodipino | 102 (82,9) |
| Triple H tras DNI | 18 (85,7) |
| GOS, n (%) | |
| 1. Muerte | 16 (13,0) |
| 2. Estado vegetativo | 3 (2,4) |
| 3. Incapacidad grave | 5 (4,1) |
| 4. Incapacidad moderada | 15 (12,2) |
| 5. Buena recuperación | 83 (68,3) |
GCS Glasgow Coma Scale; MAV Malformación Arterio-Venosa; DNI: deterioro neurológico isquémico; GOS: Glasgow outcome scale; Terapia Triple H (al menos uno de los siguientes: hipertensión, hemodilución, hipervolemia).
El 17,7% de los pacientes con anomalías vasculares presentaron vasoespasmo arteriográfico en el momento de su diagnóstico. La demora para la embolización se situó en 3,8±2,6 días y para la cirugía en 9,6±9 días. Ingresaron en UCI 76 pacientes (62,2%). No se utilizaron agentes antifibrinolíticos o corticoides. Recibieron nimodipino oral o intravenoso 102 pacientes (83,6%). Fueron administrados analgésicos en el área de urgencias al 99% de los enfermos. Durante la asistencia urgente se prescribieron fármacos antihipertensivos a 20 pacientes (16,3%).
En 18 pacientes que presentaron DNI (85,7%), al menos uno de los componentes de la terapéutica «triple H» (hipertensión, hemodilución e hipervolemia) fue establecido. Resangraron durante su evolución intrahospitalaria 14 enfermos (11,4%). Se insertó drenaje ventricular externo por hidrocefalia en 16 pacientes.
Se practicaron estudios sonográficos cerebrales mediante DTC en el 100% de los enfermos. Durante los primeros3 días se realizaron un total de 146 exploraciones de DTC. Encontramos un patrón sonográfico de alta velocidad, en algún momento de su evolución, en 38 pacientes (31,1%). Catorce enfermos tenían altas VM de forma bilateral, junto a un IL inferior a 3, atribuible a hiperemia cerebral.
En 24 pacientes se obtuvieron registros de vasoespasmo sonográfico con altas VM de forma unilateral o bilateral e IL elevado. Todos los pacientes, excepto uno, presentaron VM medias máximas superiores a 120cm/s (VM 177±45cm/s). La excepción (VM máxima 112cm/s) padecía hidrocefalia moderada que no precisó drenaje ventricular.
Tres pacientes mostraron patrón sonográfico de vasoespasmo sin que apareciera DNI ulterior. La VM máxima fue de 171±41, sin encontrarse diferencias estadísticamente significativas con las VM máximas del grupo con DNI.
El total de pacientes que presentó DNI tardío fue de 21 (17,1%). Previo a la aparición del déficit neurológico todos los pacientes desarrollaron patrón sonográfico de vasoespasmo. La VM máxima de este grupo fue de 183±49 y el día promedio de aparición del valor más alto de velocidad fue el décimo. El día promedio de comienzo del vasoespasmo sonográfico fue el 7±3,9 días. Si se excluyen los pacientes con vasoespasmo tras complicaciones hemorrágicas, o isquémicas, postexclusión aneurismática, el día promedio de aparición es inferior (5,7±3). El incremento medio de velocidad, durante los 3primeros días tras la HSA, en el grupo de pacientes que desarrolló DNI fue de 22± 5cm/s en 24 horas. (tabla 2)
Comparación de los registros sonográficos obtenidos mediante Doppler Transcraneal (DTC) entre los pacientes con patrón sonográfico de vasoespasmo (PSV) y aquellos con un patrón doppler normal
| Patrón DTC | DNI | n | VM (SD) cm/s | IL | ΔVM/día (SD) cm/s |
| PSV | Sí | 21 | 183 (49)* | > 3 | 22 (5)** |
| No | 3 | 171 (41)* | > 3 | ||
| Normal | No | 84 | 67,98 (16,6)* | n.a. | 8,3 (4,5)** |
DNI: deterioro neurológico isquémico; n.a: no aplicable; SD desviación estándar; VM: velocidad media.
Cinco de los 21 pacientes con DNI y vasoespasmo sonográfico acudieron al hospital con posterioridad al tercer día de evolución de su HSA (promedio de días: 6, rango del 4.° al 11.° día). Todos tenían VM iniciales en ACM superiores a 120cm/s (VM: 217±48). Estos hallazgos fueron independientes de la edad de los pacientes. En 2 casos el paciente presentó DNI el mismo día de su ingreso. En los 3 pacientes restantes el vasoespasmo sonográfico precedió en días al DNI.
No presentaron DNI ni patrón de alta velocidad por vasoespamo, u otra causa, 84 pacientes. No obstante, en este grupo se identificaron 2 enfermos con vasoespasmo arteriográfico. La velocidad media máxima en cualquier cerebral media y día de evolución, fue de 67,98±16,6cm/s. La diferencia con las VM máximas del grupo con vasoespasmo sonográfico fue estadísticamente significativa (p <0,001). El incremento de velocidad/24 h en el grupo que presentó un patrón normal en el registro DTC fue de 8,30±4,5cm/s. La diferencia con el incremento de velocidad/24h, en el mismo periodo, con el grupo que sufriría DNI y vasoespasmo sonográfico fue significativa, tanto si se mantenían los vasoespasmos postoperatorios (p<0,01) como si se excluían (p <0,001).
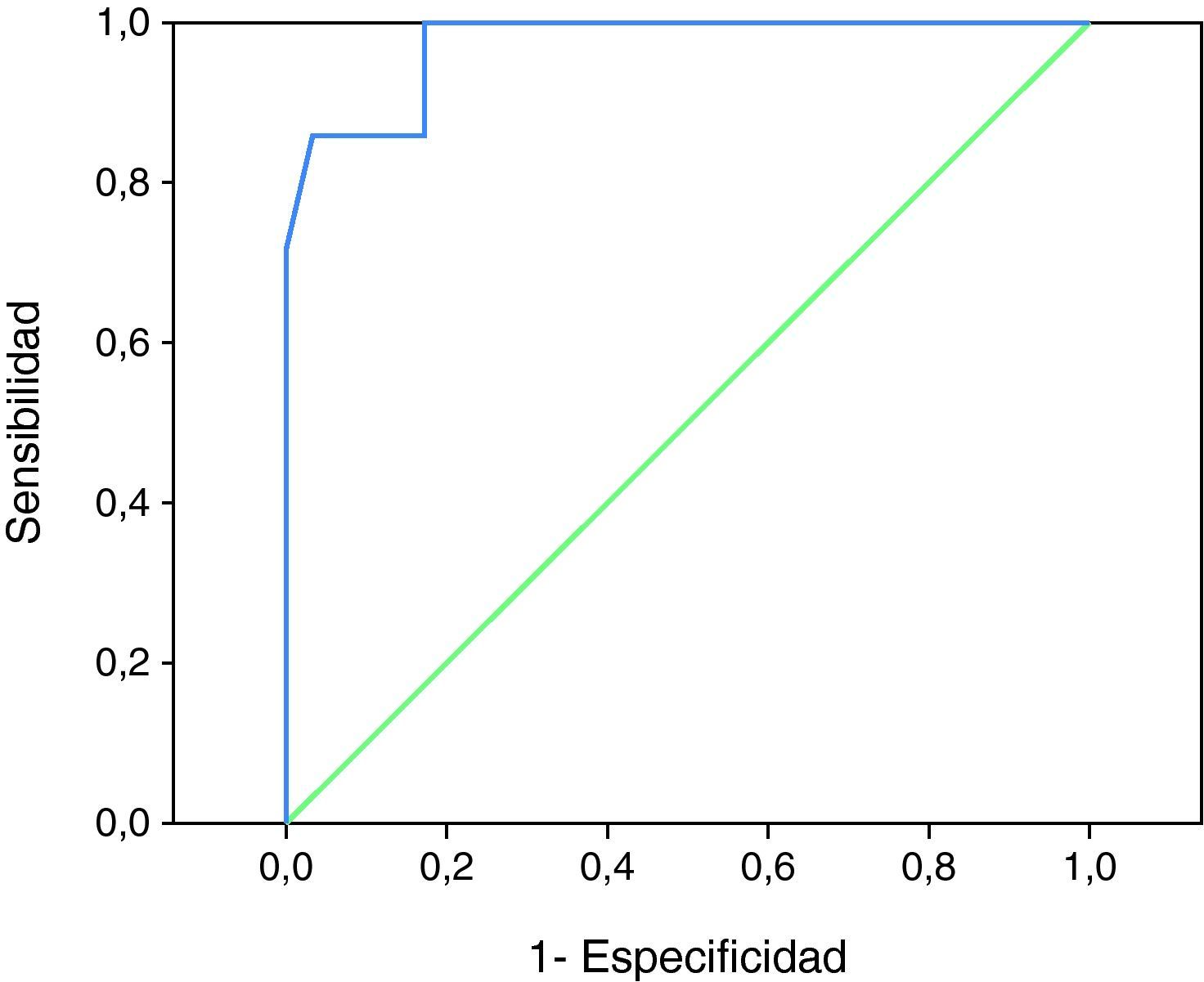
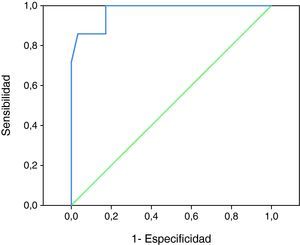
En el análisis por curva ROC, para establecer el aumento de velocidad que mejor identificaba a los pacientes en riesgo de DNI, fueron incluidos 88 DTC correspondientes a los enfermos con al menos dos registros sonográficos en las primeras 72 horas de evolución y sin desarrollo ulterior de hiperemia. Obtuvimos que los incrementos en las VM en la ACM podían diferenciar aquellos pacientes en riesgo de DNI (área bajo la curva: 0,973, p<0,001) (fig. 1). Tras analizar el mapa de coordenadas objetivamos que el mejor punto de corte, en el aumento de VM en la ACM durante los 3 primeros días, era de 21cm./s. En este punto se lograba una sensibilidad del 85,7%, una especificidad del 96,6%, un valor predictivo positivo del 85,7% y un valor predictivo negativo del 97,2%.
DiscusiónDe nuestros resultados se infiere que un incremento de velocidad media de 21cm/s/24 h en la ACM, en los 3 primeros días de evolución, se asocia de forma significativa con el desarrollo de vasoespasmo sintomático.
La VM máxima registrada en la ACM de nuestros pacientes con vasoespasmo sintomático superó en todos ellos 120cm/s, de forma homogénea en todas las franjas de edad, excepto en uno con velocidad amortiguada por hidrocefalia. Por tanto, es innecesario utilizar otros puntos de corte más bajos, como la velocidad media normal en su edad más 2 desviaciones estándar, que hacen complicados los cálculos sin reportar ventajas25,33.
Nuestro estudio explora de forma específica la utilidad predictiva del DTC para desarrollo de vasoespasmo sintomático en pacientes con HSA y buen grado neurológico, durante las primeras 72 horas de evolución, dado que al ingreso en el área de urgencias, es necesario establecer que pacientes, considerados leves dentro de la graduación clínica de HH, deben recibir un seguimiento más exhaustivo durante su evolución en áreas críticas, tal y como se hace con los grados 4-5 de HH. Nuestros resultados confirman la utilidad del incremento en los valores de la VM en la ACM, como predictor de DNI, así como la necesidad de usar el IL para una identificación apropiada de los patrones sonográficos34.
Quienes sostienen el bajo valor predictivo del DTC aducen varios argumentos. En el período prevasoespasmo, primeras 72 horas de la HSA, los valores de VM en las ACM y anteriores (ACA) se muestran usualmente dentro de los límites normales. Por tanto, considerar las cifras absolutas de VM en la ACM durante la fase precoz de la HSA carecería de valor17,25,26. En sentido opuesto, al menos parcialmente, se manifiestan algunos investigadores al considerar que aunque no exista una estrecha correlación entre las cifras elevadas de VM en la ACM y la aparición de DNI, el incremento/día de la velocidad de flujo ha de tenerse en cuenta21,26. Así, el ascenso rápido de la velocidad del flujo en 50cm/s en 24 horas, tendría valor predictivo para la aparición ulterior de manifestaciones clínicas del vasoespasmo24,26, aunque el incremento que denotan en las VM del territorio vascular anterior, siendo compatible con nuestros hallazgos actuales y previos34, es francamente superior. Sin embargo, la heterogeneidad clínica de los pacientes incluidos en la mayoría de dichos estudios, sin distinción del nivel de gravedad, hace que el aumento detectado, previo a la presencia de vasoespasmo sintomático, no sea comparable con nuestros resultados. Cabe remarcar que dicho incremento solo se evaluó en relación a las 24 horas previas al desarrollo del vasoespasmo sintomático, y no durante los primeros días de evolución. Tampoco hicieron distinción entre ACM y ACA, lo cual puede generar alteración en los valores medios, al mezclarse vasos con velocidades diferentes y sistemas de comunicación (ACA) entre ellos, así como la presencia, o no, de MAV que alterarían los flujos y los registros sonográficos.
Debido a la morbimortalidad significativa (50%) que se asocia con la HSA, así como la alta posibilidad de deterioro clínico, es fundamental el tratamiento precoz de las complicaciones médicas y neurológicas agudas. En este sentido el DTC es una herramienta crucial en el manejo de estos pacientes. Así, la Academia Americana de Neurología (AAN) recomienda su uso para el diagnóstico y seguimiento del vasoespasmo, con un nivel de evidencia tipo A, Clase II y es incluido ya de forma rutinaria en las guías de práctica clínica35,36. La sensibilidad del uso del DTC para la detección de vasoespasmo sintomático se ha encontrado equiparable a la angiografía29. No obstante, durante el período de vasoespasmo (4.° al 14.° día) muchos pacientes con DNI tienen cifras normales de VM en ACM (falsos negativos). Además, bastantes pacientes con valores sonográficos de vasoespasmo (cifras superiores a 120cm/s) no desarrollan nunca DNI (falsos positivos)25,26. Para explicar la ausencia de correlación estadísticamente significativa entre VM en ACM y DNI en esta etapa se postula, en los falsos positivos, una mayor colateralización del árbol cerebrovascular, que evitaría la isquemia por aporte sanguíneo por los vasos no espasmotizados, así como la presencia de otros factores tales como la presencia de actividad epileptiforme, entre otros. En los falsos negativos, el DNI dependería del estrechamiento de vasos no insonables, las arteriolas. Además, en pacientes neurológicamente afectados, la hipertensión intracraneal amortiguaría los valores de velocidad, provocando una falsa normalización. En concordancia con las recomendaciones de la AAN35, los pacientes de nuestra serie con velocidades superiores a 120cm/s presentaban una alta probabilidad de desarrollo de vasoespasmo sintomático.
La VM máxima en ACM registrada en nuestros pacientes con vasoespasmo sintomático superó en todos los 120cm/s independientemente de las franjas de edad exploradas. No obstante, quisiéramos remarcar que la fiabilidad diagnóstica del DTC para la detección de vasoespasmo haciendo uso únicamente de las VM en la ACM es baja31,37. Guiándonos únicamente por este valor se generarían falsos positivos debidos a la inclusión de fenómenos de hiperemia e hiperperfusión. Sin embargo, el uso de la definición completa de vasoespasmo sonográfico, IL>3 en pacientes con VM elevadas en la ACM, permite alcanzar una alta especificidad (94-100%) para la detección de vasoespasmo en la ACM38. En nuestra serie la VM máxima>120cm/s en la ACM y un IL >3, nos permitió seleccionar, de entre aquellos pacientes con VM elevadas, al 100% de los pacientes que presentaron posteriormente DNI secundario al vasoespasmo.
Nuestra serie presentó una tasa de HSA aneurismática similar a la descrita en otras series europeas, las cuales oscilan entre el 75%-80%1. El alto volumen (48%) de pacientes con un Grado 4 en la Escala de Fisher, probablemente es debido al seguimiento estricto del protocolo de gradación tomográfica. Nosotros, ante la presencia de sangre (independientemente de su cantidad) dentro del sistema ventricular asignamos el máximo grado de la escala de Fisher, a pesar de que la sangre objetivada en el espacio subaracnoideo fuera escasa. Probablemente la aplicación de la Escala de Fisher Modificada39 hubiera permitido una gradación más específica de las lesiones tomográficas de nuestra muestra.
Las escalas de gravedad utilizadas, hasta el momento, para catalogar los pacientes con HSA son principalmente clínicas, aportando información pronóstica global de los pacientes, así como una aproximación al riesgo de desarrollo de vasoespasmo11,12,14. Sin embargo, a pesar del alto interés de su uso, no nos permiten una evaluación continua de los pacientes. El seguimiento mediante estudio DTC permitiría una mayor discriminación para identificar cuales pueden desarrollar vasoespasmo tardío a pesar de la buena situación inicial post-sangrado. En nuestro trabajo, un elemento a resaltar es la buena situación clínica inicial de los pacientes. La no inclusión de los pacientes con HSA grado IV y V de HH hace que nuestros resultados se centren en pacientes donde las escalas clínicas habituales presentan una menor utilidad, dado que estos pacientes no siempre evolucionan de forma favorable debido a la aparición de vasoespasmo sintomático12.
Por tanto, según nuestros resultados, el estudio DTC permitiría discernir, durante la asistencia en las áreas de urgencias o equivalentes (unidades de cuidados intermedios, etc.), que pacientes con HSA sin deterioro neurológico presentan riesgo de desarrollar vasoespasmo sintomático, permitiendo la siguiente clasificación: grupo de alto riesgo y grupo de bajo riesgo. En el grupo de alto riesgo se incluirían aquellos enfermos con un aumento de VM en ACM>21cm/s/d durante las primeras 72 horas postsangrado y pacientes con una VM en ACM >120cm/s e IL> 3 a partir del cuarto día. El grupo de bajo riesgo estaría compuesto por aquellos pacientes sin incremento sustancial de las VM/24h en la ACM durante los 3 primeros días tras la HSA o con VM normales a partir del cuarto día. Por tanto, durante las primeras 72 horas de evolución, el paciente ingresado en áreas de observación o equivalentes, debería ser sometido a 2 estudios de DTC. El grupo de pacientes catalogado de alto riesgo, una vez identificado, debería ser priorizado para la realización de arteriografía urgente diagnóstico-terapéutica. Deberán ingresar en UCI o en Unidades de Cuidados Intermedios o Semicríticos, para someterse a vigilancia exhaustiva e instaurar un tratamiento profiláctico agresivo de la isquemia cerebral secundaria al vasoespasmo (hemodilución, hipervolemia, hipertensión arterial). Posiblemente, esta estrategia reducirá la tasa de DNI y las secuelas derivadas de esta complicación. El grupo en bajo riesgo podría ingresar en planta de hospitalización convencional.
El desarrollo de una selección positiva durante los primeros días de evolución de aquellos pacientes en riesgo de DNI, aunque su presentación pueda ser tardía evitaría, además, ineficiencias en el uso de las escasas camas de Cuidados Intensivos.
Nuestro estudio presenta algunas limitaciones. En primer lugar, la situación clínica de los pacientes, con un nivel de conciencia prácticamente intacto, explicaría la presencia de unas VM en ACM superiores, a las observadas en los pacientes neurológicamente afectados, sedados y conectados a ventilación mecánica24,26,38 Sin embargo, dicha situación no ha afectado al punto de corte de alta velocidad establecido en 120cm/s. En segundo lugar, entendemos que existen otras técnicas de reciente aparición como el dúplex transcraneal codificado en color, que permite el estudio ecográfico bidimensional del cerebro, la visualización en color de los vasos arteriales y el análisis del espectro doppler de los mismos40. En nuestro centro la técnica usada es el DTC ciego, la cual requiere de un entrenamiento apropiado tanto para la obtención del registro, como para la interpretación del mismo. A pesar que la primera técnica pudiera resultar más sencilla, en relación a la localización e identificación de las arterias del polígono de Willis, nuestro equipo médico altamente cualificado, posibilita la realización y la inferencia de sus resultados de forma precisa, lo cual puede no ser extrapolable a otros centros que no dispongan de personal específicamente entrenado36. En tercer lugar, nuestros estudios sonográficos se centraron únicamente en la ACM por su mayor accesibilidad y como fase preliminar de la investigación de la utilidad del DTC como herramienta predictora de vasoespasmo sonográfico postHSA en otros territorios vasculares. El resto del territorio del polígono de Willis, aunque fuera insonado para seguimiento clínico, no fue tenido en cuenta para el presente estudio. Reseñar que el incremento de velocidades en la ACM, que hemos identificado, se obtuvo únicamente de entre los pacientes que llegaron al hospital antes del tercer día de evolución, y se les pudiera practicar 2 registros de DTC. Por último, los datos actualmente recogidos y analizados son de un único centro, por lo que sería preciso un estudio ampliado a otros hospitales, para poder validar nuestros hallazgos.
Como fortalezas de este trabajo quisiéramos remarcar el número considerable de pacientes incluidos y la homogeneidad clínica de los mismos, todos con buena situación clínica neurológica tras el sangrado, o tras evacuar LCR en aquellos pacientes con hidrocefalia secundaria sintomática. Otro aspecto a destacar es el seguimiento exhaustivo llevado a cabo en lo pacientes, lo cual nos ha permitido la detección precoz de DNI a pesar de presentarse de forma tardía en su evolución.
ConclusionesLa anticipación al desarrollo de complicaciones isquémicas por vasoespasmo puede llevarse a cabo mediante el seguimiento evolutivo de la velocidad del flujo sanguíneo cerebral de los pacientes con HSA y buen grado neurológico. En este grupo de pacientes un incremento de VM en el registro DTC de 21cm/s/24 h en la ACM durante los 3 primeros días de evolución o la detección de una VM> 120cm/s con un IL>3, nos permite identificar aquellos pacientes en riesgo de desarrollar vasoespasmo sintomático en los días posteriores.
FinanciaciónLa realización de este estudio ha sido financiada mediante beca otorgada por la Consejería de Salud de Andalucía 2002. Número de Expediente 30/01.
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.