Editado por: Ana Ochagavía - Hospital Universitario de Bellvitge. L'Hospitalet de Llobregat. Barcelona. Spain.
Última actualización: Febrero 2024
Más datosLa ultrasonografía transcraneal es una técnica no invasiva y disponible a pie de cama que se ha convertido en una herramienta accesible y consolidada en la evaluación y el manejo clínico de los pacientes neurocríticos. Se trata de una técnica en continuo crecimiento cuyos fundamentos (y sus limitaciones) deben ser conocidos por el intensivista. Esta revisión aporta un enfoque práctico para el intensivista, incluyendo las diferentes ventanas y planos de insonación y su papel en la patología específica propia de los pacientes neurocríticos y en los pacientes críticos de otras etiologías.
Transcranial ultrasonography is a non-invasive, bedside technique that has become a widely implemented tool in the evaluation and management of neurocritically ill patients. It constitutes a technique in continuous growth whose fundamentals (and limitations) must be known by the intensivist. This review provides a practical approach for the intensivist, including the different sonographic windows and planes of insonation and its role in different conditions of the neurocritical patients and in critical care patients of other etiologies.
El empleo de la ultrasonografía se ha popularizado en las unidades de cuidados intensivos (UCI) de nuestro medio y forma parte habitual de la evaluación y el manejo clínico de los pacientes críticos. De este modo, la European Society of Intensive Care Medicine (ESICM) ha publicado un documento de consenso respecto a las competencias que deben tener los intensivistas en el paciente crítico en general1. De modo más específico, se han publicado también las competencias referentes al empleo de la ultrasonografía transcraneal en la UCI2.
Las primeras descripciones del empleo de la sonografía doppler transcraneal (DTC) para la evaluación sonográfica de las velocidades de las arterias cerebrales en el paciente neurocrítico se documentaron en 1982 por Aaslid et al.3. Con las mejorías tecnológicas, los ecógrafos permitieron analizar también el parénquima cerebral además de la visualización en color de los vasos arteriales y venosos basales y el análisis del espectro doppler de los mismos, todo ello en tiempo real, a la cabecera del paciente y de modo no invasivo mediante el empleo del dúplex transcraneal codificado en color (DTCC)4. El aumento de las capacidades técnicas, el mayor conocimiento de la técnica y su mayor difusión en las UCI han permitido ampliar estas aplicaciones a diferentes tipos de pacientes críticos5. En general, el DTCC se realiza con una sonda de 2-2,5MHz que nos permitirá la visualización de las principales estructuras del cerebro y el análisis de la hemodinámica cerebral5.
Las ventanas básicas de insonación y su principal aplicación se resumen a continuación:
- -
Temporal: Permite la identificación del mesencéfalo, sistema ventricular, evaluación de la desviación de la línea media (DLM) y la insonación de las principales arterias del polígono de Willis.
- -
Suboccipital o transforaminal: Permite la identificación del foramen magnum y con ello el análisis de las arterias vertebrales y la arteria basilar.
- -
Transorbitaria: Permite la insonación de la arteria oftálmica y el sifón carotídeo, además de la evaluación del diámetro de la vaina del nervio óptico (DVNO).
- -
Submaxilar: Permite la insonación de la porción extracraneal de la arteria carótida interna, útil para calcular el índice de Lindegaard.
En general, cualquier exploración debe iniciarse mediante el análisis de la ventana temporal. En esta ventana, tenemos 3 planos de insonación fundamentales.
Plano mesencefálico: Recomendamos analizar a una profundidad inicial de 15-16cm de modo que permita comprobar la correcta insonación de la calota contralateral (habitualmente a unos 14cm del transductor en adultos). Así, en el centro de la imagen obtenida identificaremos el mesencéfalo con su imagen característica hipoecoica en alas de mariposa.
Plano diencefálico: Angulando el transductor 10° en dirección craneal se identifica el tercer ventrículo, como una doble línea paralela hiperecoica pulsátil anterior al mesencéfalo.
Plano ventricular: Una angulación craneal adicional de 10° permitirá la visualización del tálamo y las astas frontales de los ventrículos laterales.
En todos los casos, la existencia de un defecto óseo en la calota o una cranectomía descompresiva aumenta el rendimiento de la exploración. A partir de estos planos podemos profundizar en las aplicaciones clínicas del estudio bidimensional:
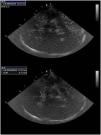
DLM: Uno de los factores asociados sistemáticamente a un peor resultado neurológico en los pacientes neurocríticos es el efecto masa, evaluado por la DLM. Múltiples estudios han mostrado una excelente correlación entre su evaluación por tomografía computarizada (TC) y DTCC realizado a pie de cama6-8. Su determinación se lleva a cabo desde la ventana temporal, dirigiendo el haz de ultrasonidos perpendicularmente a las paredes del 3V, que aparece como una doble línea hiperecoica en el centro del plano, y midiendo la distancia desde el transductor hasta el centro del 3V bilateralmente (distancias A y B). Posteriormente se aplica la fórmula: DLM=A-B/2 (fig. 1). En los pacientes con cranectomía descompresiva, Caricato et al. describieron un método específico con buen resultado9. En estos casos, la línea interventricular, definida como aquella entre los ventrículos laterales se traza con el ecógrafo. Después se traza una nueva línea del punto frontal al occipital de la hoz cerebral. La distancia entre ambas líneas constituye la DLM9.
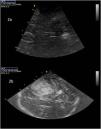
Dilatación del sistema ventricular: El tercer ventrículo aparece en el plano diencefálico como una doble línea paralela hipercoica (fig. 2a). Las astas frontales de los ventrículos laterales aparecen del mismo modo (fig. 2b). En ambos casos, salvo que se haya producido una hemorragia intraventricular su contenido es anecoico5. Diversos estudios han mostrado una excelente correlación en la medición del diámetro del tercer ventrículo10,11 y las astas frontales12 mediante TC y DTCC, permitiendo incluso valorar la respuesta al drenaje de líquido cefalorraquídeo12. Kiphuth et al. estimaron que un punto de corte inferior a 5,5mm de aumento en el diámetro ventricular tras clampaje del drenaje presentó una sensibilidad del 100%, una especificidad del 83% y un valor predictivo negativo del 100% en cuanto a la retirada segura del drenaje12. Esta es probablemente la principal consideración de esta aplicación, debe valorarse su carácter evolutivo. En el caso de las medidas realizadas en las astas frontales, es necesario tener en cuenta el ángulo de insonación para minimizar la posibilidad de mediciones erróneas13. En manos experimentadas, puede resultar útil incluso para valorar el normal o anormal posicionamiento de un drenaje ventricular y alertar de la necesidad de realizar pruebas adicionales5.
Hematomas intraparenquimatosos/extraaxiales: En la fase aguda (<10 días), la sangre intraparenquimatosa ofrece una imagen hiperecoica, que permite diferenciar de las lesiones isquémicas que aparecen hipoecoicas y presentan además otros signos indirectos como la demostración de una oclusión arterial, la existencia de flujos colaterales, la menor pulsatilidad de la zona infartada y el efecto masa medido por la DLM4,5,14. Así, en una serie de 151 pacientes de los que un 12% fueron excluidos por mala ventana acústica, Mäurer et al. mostraron un diagnóstico concordante entre la ultrasonografía transcraneal y la TC en el 95% de los casos15. Además, no se identificó ninguna complicación que hubiera podido requerir tratamientos adicionales15. En una serie de 34 pacientes con hematomas de gran volumen (86±45ml) en las 3 primeras horas, Santamarina-Pérez et al. mostraron una excelente correlación en el seguimiento del aumento del hematoma en todos los diámetros y en su volumen total, con un coeficiente de correlación de 0,888 (IC 95%: 0,8-0,937)16. Así, se recomienda realizar un estudio precoz y seguimiento diario para valorar aumento del hematoma que pueden evitar traslados diarios a la sala de TC14.
El DTCC también permite el diagnóstico de hematomas extraaxiales, epidurales o subdurales17,18, aunque resulta difícil distinguir entre uno y otro salvo por su morfología4.
Evaluación de la hemodinámica cerebralConceptos básicosLa ultrasonografía transcraneal permite evaluar la hemodinámica cerebral a través de la determinación de parámetros de velocidad del flujo sanguíneo de los grandes vasos intracraneales14. Se basa en el efecto Doppler, que permite monitorizar el movimiento de los eritrocitos dentro del vaso sanguíneo insonado. La ecuación derivada de este principio es la base para calcular la velocidad del flujo sanguíneo cerebral (FSC), aunque debe considerarse que para ello se asume un diámetro constante del vaso. El ángulo de insonación se asume constante en el DTC3 y puede ajustarse al trayecto del vaso insonado en el DTCC, lo que ocasiona algunos ajustes y mayor precisión en la determinación de las velocidades19, especialmente en aquellos casos con ángulo de insonación superior a 30°14.
De la adecuada insonación de los vasos intracraneales, podemos obtener una onda de pulso donde determinar velocidades de flujo (sistólica [Vs], diastólica [Vd] y media [Vm]) y calcular los índices de pulsatilidad (IP), de resistencia (IR) y de Lindegaard (IL).
El rango de valores normales de las velocidades de cada arteria se describió hace muchos años3; no obstante, múltiples factores influencian estos valores como: la edad, el sexo, la presión parcial de dióxido de carbono, la tensión arterial (TA) o la presión intracraneal (PIC)5. La Vs depende principalmente del gasto cardiaco. En cambio, la Vd se podría considerar un índice de hipoperfusión cerebral ya que un aumento en la PIC produce una disminución en la presión de perfusión cerebral (PPC), reflejándose en una disminución del flujo diastólico. Por último, la Vm se correlaciona con el FSC y se utiliza principalmente para estimar el flujo arterial cerebral3.
Por otra parte, el IP de Gosling ha sido posiblemente el parámetro hemodinámico cerebral más utilizado. Se obtiene de la fórmula (Vs–Vd)/Vm5. Su principal ventaja es que no se afecta de modo directo por el ángulo de insonación. Los valores normales van desde 0,5 a 1-1,4 y su valor se afecta por un gran número de parámetros como la frecuencia cardiaca, la TA, la PIC o la temperatura5,20. El IP nos informa de cambios en la hemodinámica cerebral pero no debe usarse de forma aislada para valorar la resistencia cerebral vascular ni la PIC20,21.
Vasoespasmo cerebralEl vasoespasmo cerebral constituye uno de los componentes fundamentales en la aparición de deterioro neurológico diferido en pacientes con hemorragia subaracnoidea aneurismática. El empleo de la ultrasonografía transcraneal en la detección del estrechamiento arterial reflejado a través de un aumento en las velocidades obtenidas constituye una práctica habitual en la mayoría de UCI de nuestro entorno, especialmente en la evaluación de la arteria cerebral media (ACM). De acuerdo a una reciente revisión sistemática, la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo del DTC es del 66,7; 89,5; 93,7 y 53,4%, aumentando en el caso del DTCC hasta el 81,5; 96,6; 98,2 y 69,1%22.
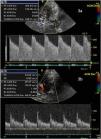
Tradicionalmente se han empleado puntos de corte en la ACM de 120cm/s y 200cm/s, siendo más sensible el primero y específico el segundo. Dichas determinaciones deben complementarse con la medición del IL, que expresa el cociente entre la velocidad en la ACM y la carótida interna ipsilateral en su porción extracraneal23. Este cociente permite distinguir situaciones de hiperaflujo (IL<3) con vasoespasmo severo (IL>6)24. Así, una Vm en la ACM<120cm/s tiene un VPN del 94%, mientras una Vm>200cm/s tiene un valor predictivo positivo del 87%. En el caso de la arteria basilar (AB), el cociente de la Vm entre la AB/arteria vertebral extracraneal>2 presenta una sensibilidad del 73% y especificidad del 80% en el diagnóstico de vasoespasmo24. Sin embargo, debe considerarse que estos valores son estáticos y la hemorragia subaracnoidea y el vasoespasmo son entidades dinámicas. Por ello, algunos autores sugieren que el incremento significativo de Vm en 24h es el mejor indicador sonográfico de estrechamiento arterial significativo incluso en los primeros días tras la hemorragia subaracnoidea25. Puede ser también de utilidad en la valoración de la respuesta a los tratamientos instaurados (fig. 3).
Más recientemente, y con la introducción del estudio de las principales venas del cerebro y su correlación con el flujo sanguíneo cerebral global, se ha descrito un nuevo parámetro, el cociente entre la velocidad media en la ACM y la vena basal de Rosenthal (Intracranial Arteriovenous Index [AVI]). En dicho estudio, un AVI>10 para la Vm y AVI>12 para la Vs proporcionó una precisión del 87 y 86%, ligeramente superior al empleo del IL26.
Autorregulación cerebralEl análisis del estado de la autorregulación cerebral puede realizarse a pie de cama con la ultrasonografía transcraneal, que permite analizar tanto los componentes estáticos como dinámicos de la autorregulación. La autorregulación estática (sROR) valora la respuesta del FSC a cambios en la PPC y se mide como el ratio del % de cambio en la resistencia cerebrovascular y el % de cambio en la PPC, siendo la resistencia cerebrovascular=TA media/ Velocidad de flujo14.
Por otro lado, la valoración de la autorregulación dinámica se puede realizar mediante pruebas como el test de respuesta hiperémica transitoria. Este test se basa en la vasodilatación compensatoria arteriolar tras una breve compresión externa de la arteria carótida común14,27. En los pacientes con autorregulación preservada, se produce un aumento en la Vs superior al 9% tras la compresión carotídea. Debe evaluarse en ambos ejes carotídeos14,24. También puede evaluarse analizando los cambios espontáneos en la TA y la PPC en el tiempo mientras medimos la velocidad del FSC. A tal efecto, se han descrito diversos parámetros como son el Mx (coeficiente de correlación móvil entre la Vm y la PPC), el Mxa (coeficiente de correlación entre la Vm y la TA) y el índice de autorregulación (ARI), un índice adimensional que oscila entre 0 y 9, para el cual se estima la respuesta de la velocidad del FSC a un hipotético cambio en la TA mediante el análisis de la función de transferencia de las fluctuaciones espontáneas de la TA y la velocidad del FSC28-30.
Detección de shuntsLa sonografía transcraneal permite la evaluación precoz de la presencia de foramen oval permeable o shunts arteriovenosos pulmonares en el diagnóstico etiológico del ictus isquémico24. Para la detección de microburbujas, es necesario inyectar un contraste gaseoso o preparar una jeringa de 10ml con 9ml de salino, 1ml de aire y agitarla, lo que genera microburbujas. Estas microburbujas pasan de la circulación derecha a la izquierda en el ciclo cardíaco, entran en la circulación sistémica y pueden ser detectadas con el DTC24. Así, el material embólico de origen cardíaco o arterial puede detectarse mediante DTC, ya que por su mayor impedancia acústica genera señales que se conocen como HITS (high intensity transient signals) o MES (microémbolos o microembolic signals) de alta intensidad (>3dB) y de corta duración (<300mseg), que aparecen por encima de la línea de base del sonograma con un sonido característico semejante a un «clic» y que son independientes del ciclo cardíaco.
Se debe repetir el estudio provocando maniobras de Valsalva para aumentar su precisión, que es muy cercana a la ecocardiografía transesofágica (prueba de elección) en manos experimentadas, por lo que la ultrasonografía transcraneal es especialmente interesante en el screening31.
Despistaje de hipertensión intracranealEl empleo de la ultrasonografía transcraneal en el despistaje de la hipertensión intracraneal (HTIC) resulta de especial interés en situaciones de recursos limitados. Puede evaluarse mediante diversos modos
Medición del diámetro de la vaina del nervio ópticoEl nervio óptico está cubierto por las meninges, extensión del espacio subdural y subaracnoideo cerebral. Por ello, al incrementarse la PIC, el líquido cefalorraquídeo se desplaza a dicho espacio incrementando así su diámetro, especialmente en la porción bulbosa, que es más distensible y está localizada a 3mm de la retina y disco óptico32,33.
Un reciente metaanálisis que incluyó 18 estudios prospectivos, mostró una sensibilidad de 0,9 y una especificidad de 0,85 para la detección de HTIC, con un coeficiente de correlación entre PIC invasiva y el DVNO de 0,7 (95% IC: 0,63-0,76; p<0,05)32. No existe un punto de corte exacto que indique HTIC, pero la mayoría de estudios sugieren puntos de corte entre 5-6mm5. La combinación de la medición del DVNO con la Vs del seno recto aumenta la precisión diagnóstica de la técnica34. También resulta de interés la asociación del DVNO con parámetros radiológicos asociados a la HTIC, especialmente en contextos donde la monitorización invasiva de la PIC no se encuentra disponible35-37.
Aunque el DVNO parece incrementarse en pocos minutos tras aumentar la PIC, resulta controvertido saber si la medición del DVNO puede reflejar los cambios dinámicos de modo preciso38,39. El trauma ocular es la única contraindicación absoluta para determinar el DVNO ecográficamente. Además, debe tenerse en cuenta que el artefacto producido por la arteria central de la retina puede llevar a errores de interpretación, ya que dicho vaso corre cercano y en paralelo al nervio y puede generar una imagen hipoecoica difícil de diferenciar del nervio óptico24,40.
Presión intracraneal según hemodinámica cerebralEl IP ha sido el parámetro hemodinámico aislado más utilizado para evaluar la existencia de HTIC, puesto que las resistencias al flujo circulatorio aumentan con el incremento de la PIC3,4. Así, Tamagnone et al. han propuesto un protocolo de resucitación del TCE grave guiado por un punto de corte IP>1,441; pero aunque el IP aporta información, creemos que no debe usarse de forma aislada en la evaluación de la PIC salvo en valores extremos20,21 sino en un contexto de monitorización multimodal (fig. 4). Así, un reciente metaanálisis evaluando métodos de predicción de HTIC mostró que el IP presenta un rendimiento pobre para determinar el incremento de la PIC (área bajo curvas ROC 0,55-0,72)42, debido fundamentalmente a que el IP depende de múltiples variables fisiológicas5,20.
Aun así, diferentes trabajos incluyendo a pacientes con TCE leve y moderado han establecido una asociación estrecha entre el incremento del IP y el descenso en las velocidades diastólicas con la posibilidad de deterioro neurológico y malos resultados finales, concluyendo que el DTC es una herramienta complementaria útil a la hora de establecer el triaje y seguimiento de este grupo de individuos43-45.
Más recientemente, el estudio multicéntrico IMPRESSIT-2 analizó sobre 262 pacientes neurocríticos la estimación de la PIC mediante la insonación de la ACM a través de la siguiente formula, basándose en los resultados obtenidos en un estudio piloto previo y comparándolo con la medición invasiva46,47:
PICtcd=MABP-PPCtcd
Siendo PPCtcd=MABP×Velocidad diastólica /Velocidad media+14
El valor predictivo negativo de esta forma de estimar la PIC fue elevado para todos los cortes de PIC evaluados de manera invasiva (PIC>20mmHg=91,3%; PIC>22mmHg=95,6% y PIC>25mmHg=98,6%). El punto de corte óptimo de este índice fue 20,5mmHg, mostrando una sensibilidad del 70% (IC 95%: 40,7-92,6%) y una especificidad del 72% (IC 95%: 51,9-94,0%) con área bajo la curva ROC del 76% (IC 95%: 65,6-85,5%)44. La concordancia entre la PICtcd y la PIC invasiva fue del 33,3% (IC 95%: 25,6-40,5%) con una deriva de −3,3mmHg. Considerando todos estos valores, los autores concluyeron que la ultrasonografía transcraneal tiene un alto valor predictivo negativo en el despistaje de HTIC y por lo tanto puede ser especialmente interesante en medios con recursos limitados, con contraindicación a la monitorización invasiva o como método de despistaje en casos de incertidumbre46.
Paro circulatorio cerebralLa ultrasonografía transcraneal es una herramienta útil en la detección del paro circulatorio cerebral (PCC) que acompaña a la muerte encefálica, 2 procesos evolutivos que no siempre coinciden en el tiempo48,49. Como norma general, el PCC se sitúa en el extremo final y desvastador de la HTIC, especialmente en lesiones supratentoriales. Por ello, los patrones sonográficos siguen a los cambios evolutivos del incremento de la PIC, caracterizados por patrones de alta resistencia in crescendo hasta el cese definitivo del flujo cerebral50,51.
Previa a la exploración sonográfica, deben asegurarse los prerrequisitos que incluyan estabilidad hemodinámica, normooxigenación, normocapnia y normotermia48. Además, se recomienda medir la ACM bilateral y la arteria basilar en 2 exploraciones separadas durante 30min para evitar falsos positivos52.
Clásicamente se reconocen 4 patrones50,51 (fig. 5):
- •
Ausencia de flujo diastólico: el flujo diastólico depende básicamente de las resistencias vasculares, que a su vez están determinadas principalmente por la PIC y el diámetro del vaso. Este patrón se manifiesta cuando la PIC iguala a la TA diastólica, de modo que al final de la diástole el flujo es cero. Es una señal que refleja HTIC severa, pero no se correlaciona con una situación de PCC en la arteriografía.
- •
Flujo reverberante o flujo oscilante: se manifiesta cuando los niveles de PIC son mayores o iguales a la TA sistólica. En este momento cesa la perfusión cerebral. Se representa como ondas que presentan un flujo sistólico anterógrado y un flujo diastólico retrógrado o invertido. Este patrón sí se correlaciona con el PCC en la arteriografía.
- •
Espículas, picos o espigas sistólicas: La PIC supera claramente la TA sistólica. Se producen ondas sistólicas cortas (menos de 200mseg) y de escasa velocidad (pico sistólico inferior a 50cm/seg). No se insona flujo diastólico. Deben emplearse filtros a bajos niveles (50Hz) para su detección. Este patrón sí se correlaciona con el PCC en la arteriografía.
- •
Ausencia de señal: Se produce en casos muy evolucionados en el tiempo y con PIC muy elevadas. En este contexto puede plantearse que la ausencia de señal pueda deberse a una ausencia de ventana acústica, por lo que para aceptar este patrón como diagnóstico de PCC la exploración debe haber sido realizada por el mismo operador y en las mismas condiciones que una exploración previa demostrando suficiente ventana acústica y flujo preservado. Para incrementar el rendimiento de la exploración pueden emplearse también ecopotenciadores, con lo que se consigue aumentar el número de vasos insonados y los estudios concluyentes53.
Un reciente metaanálisis mostró que la ultrasonografía transcraneal tiene una sensibilidad del 90% y una especificidad del 98% en el diagnóstico del PCC54. Los falsos positivos pueden ocurrir en pacientes con shock que no cumplen los prerrequisitos o en situaciones de un súbito de aumento de PIC como la existencia de ondas A o sangrado subaracnoideo en el momento de la rotura aneurismática. Todo ello resalta la necesidad de un examen riguroso y que se realice por operadores expertos en las condiciones adecuadas. Por otra parte, puede existir flujo persistente a pesar de una exploración sugestiva de muerte encefálica (falsos negativos) en casos con ausencia de estanqueidad craneal (cranectomía decompresiva, fracturas bóveda, fracturas base craneal, fontanelas abiertas, ventriculostomía) y en pacientes con otros mecanismos de lesión cerebral como las lesiones infratentoriales y la encefalopatía anóxico-isquémica54,55.
Empleo en pacientes críticos no neurológicosEn las últimas décadas se han descrito nuevas utilidades en el paciente crítico de etiología no neurológica, entre las que destacan la monitorización del FSC durante la RCP tras una parada cardíaca y tras la recuperación de la circulación espontánea (RCE) y su papel en los pacientes con hepatopatía crítica.
Parada cardíaca y tras la recuperación de la circulación espontáneaLa ultrasonografía transcraneal puede ser útil durante la reanimación cardiopulmonar (RCP) y tras la RCE. Durante la RCP permite monitorizar el efecto de las compresiones torácicas sobre la perfusión cerebral. En este contexto, el vaso ideal a insonar es el sifón de la arteria carótida interna a través de la ventana transorbitaria56, pero en ningún caso debe dificultar las maniobras de RCP5. De esta manera podemos observar la resolución de la parada cardíaca, al verse un aumento de la velocidad del FSC, así como la aparición del componente diastólico del espectro, incluso antes de identificar la presencia de pulso arterial periférico57.
Tras la RCE, la ultrasonografía transcraneal no es una herramienta precisa en la evaluación del pronóstico neurológico5, pero sí puede ser de utilidad en la optimización hemodinámica y ventilatoria y asegurar una perfusión cerebral adecuada58. De modo genérico, tras la RCE pueden observarse 3 patrones que tienen a normalizarse en las primeras 72horas57:
- -
Patrón hemodinámico normal, que en general se asocia a un buen pronóstico.
- -
Patrón hipodinámico (velocidad media baja e IP elevados), reflejo de hipoperfusión secundaria a trombosis y vasoespasmo de la microcirculación cerebral, de hipoperfusión secundaria a la edematización celular y capilar o de ambas.
- -
Patrón hiperdinámico (velocidad media elevada e IP bajos con IL<3), que por encima de los 30min se asocia a un peor pronóstico y desarrollo de hipertensión intracraneal.
Además, al igual que en otras poblaciones la pérdida de la autorregulación cerebral se asocia de un modo consistente a un peor pronóstico neurológico59.
Pacientes con fallo hepáticoEl papel fundamental de la ultrasonografía transcraneal en esta población reside en el despistaje de HTIC en paciente con fallo hepático fulminante. La monitorización invasiva rutinaria de la PIC no ha demostrado beneficio en la supervivencia, y por otro lado, puede conllevar complicaciones hemorrágicas fatales. Así, el empleo de la ultrasonografía transcraneal estimando la PIC y midiendo la DVNO puede seleccionar qué pacientes presentan HTIC y precisan monitorización invasiva. Sin embargo, en esta población su precisión parece menor que en otras poblaciones de pacientes neurocríticos5.
Además, es de interés reseñar que la hiperemia (que suele preceder a la HTIC) es común en esta población y que las alteraciones de la autorregulación se asocian a un peor pronóstico5, pero pueden recuperarse rápidamente al recuperar la función hepática60.
Otra utilidad en este contexto es la identificación de dilataciones vasculares intrapulmonares en pacientes con cirrosis hepática. Así, los resultados de la sonografía transcraneal con contraste son similares en cuanto a la detección del shunt derecha-izquierda tardío con recirculación a los obtenidos mediante ecocardiografía con contraste, técnica de elección61.
En resumen, la ultrasonografía transcraneal es una técnica no invasiva y disponible a pie de cama que permite un amplio abanico de aplicaciones en la monitorización del paciente crítico. Se trata de una técnica en continuo crecimiento cuyos fundamentos (y sus limitaciones) deben ser conocidos por el intensivista.
Contribución de los autoresLos doctores Llompart-Pou, Galarza, Amaya-Villar y Godoy han participado en la redacción de la primera versión del manuscrito. El doctor Llompart-Pou y el doctor Godoy han realizado las figuras que acompañan al manuscrito. El doctor Llompart-Pou redactó la versión final enviada que fue aprobada por todos los autores.
FinanciaciónNinguna
Conflicto de interesesLos autores declaran no tener conflicto de intereses relacionado con este manuscrito.