La forma de evaluar la perfusión tisular durante la reanimación de pacientes con sepsis grave y shock séptico es tema de estudio y debate en la actualidad. La saturación venosa de oxígeno y el lactato han sido los criterios más utilizados; sin embargo, presentan limitaciones reconocidas. La diferencia venoarterial de dióxido de carbono (delta de pCO2) es una variable que puede indicar el estado de perfusión tisular, por lo que su evaluación puede ser útil en estos pacientes.
MétodosRevisión sistemática cualitativa de la literatura que incluyó estudios que evaluaron el delta de pCO2 en pacientes adultos con sepsis grave o shock séptico, publicados entre enero de 1966 y noviembre de 2016 en las bases de datos Medline-PubMed, Embase-Elsevier, Cochrane Library y LILACS. No tuvo restricción de idiomas. Se siguió la declaración PRISMA y se evaluó la calidad metodológica.
ResultadosDoce estudios fueron incluidos, todos observacionales, 10 prospectivos, 9 publicados a partir del 2010. Cinco documentaron una mayor mortalidad entre pacientes con delta de pCO2 alto, en 3 incluso cuando conseguían metas de saturación venosa de oxígeno. En 4 estudios, un delta de pCO2 alto se relacionó con una menor saturación venosa de oxígeno y niveles mayores de lactato, y otros 3 documentaron un menor porcentaje de disminución de lactato.
ConclusiónEl delta de pCO2 ha sido evaluado en el manejo de los pacientes con sepsis grave y shock séptico con mayor frecuencia en los últimos años. Los estudios demuestran su relación con la mortalidad y otros desenlaces clínicos, de tal forma que puede ser una herramienta útil en el manejo de estos pacientes.
The way to assess tissue perfusion during the resuscitation of patients with severe sepsis and septic shock is a current subject of research and debate. Venous oxygen saturation and lactate concentration have been the most frequently used criteria, though they involve known limitations. The venous-to-arterial difference of carbon dioxide (pCO2 delta) is a parameter than can be used to indicate tissue perfusion, and its determination therefore may be useful in these patients.
MethodsA qualitative systematic review of the literature was made, comprising studies that assessed pCO2 delta in adult patients with severe sepsis or septic shock, and published between January 1966 and November 2016 in the Medline-PubMed, Embase-Elsevier, Cochrane Library, and LILACS databases. There was no language restriction. The PRISMA statement was followed, and methodological quality was evaluated.
ResultsTwelve articles were included, all of an observational nature, and including 10 prospective studies (9 published since 2010). Five documented greater mortality among patients with high pCO2 delta values, in 3 cases even when achieving venous oxygen saturation targets. In 4 studies, a high pCO2 delta was related to lower venous oxygen saturation and higher lactate levels, and another 3 documented lesser percentage lactate reductions.
ConclusionThe parameter pCO2 delta has been more frequently assessed in the management of patients with severe sepsis during the last few years. The studies demonstrate its correlation to mortality and other clinical outcomes, defining pCO2 delta as a useful tool in the management of these patients.
La sepsis es una de las principales causas de hospitalización en unidades de cuidados intensivos (UCI). Este síndrome heterogéneo y complejo puede alcanzar una mortalidad de entre el 20 y el 50% según la severidad del cuadro clínico1,2, la cual está relacionada con la presencia de disfunción de órganos, proceso en el que diversos mecanismos de daño celular se han visto involucrados. La interacción de los mecanismos individuales no se encuentra muy bien entendida en la actualidad, sin embargo, es claro que existen anormalidades microvasculares en la sepsis y que una disminución en el aporte y/o mala utilización del oxígeno disponible se encuentra como eje central de la disfunción de tales órganos3. Es por esto por lo que es primordial la identificación temprana del daño tisular en el manejo de estos pacientes.
La medición de algunas variables fisiológicas que evalúan el estado de perfusión tisular ha sido propuesta como parte del manejo inicial de estos pacientes. The Surviving Sepsis Campaign (Campaña Sobrevivir a la Sepsis) recomendó en sus primeras versiones la medición de la saturación venosa de oxígeno (SvO2), evaluada como saturación venosa mixta o saturación venosa central de oxígeno (SvcO2), y el lactato para tal fin y estableció unas metas predeterminadas de estas variables para lograr una reanimación adecuada4. Esta propuesta se basó principalmente en el protocolo de intervención temprana publicado por Rivers et al., donde se promueve la «normalización» de la SvcO2, la presión venosa central y la presión arterial media con el objetivo de mejorar la perfusión tisular5. Otro grupo de investigaciones, principalmente las de Jones et al., reforzaron la idea de que el lactato puede ser utilizado también dentro de estos protocolos6,7.
Aunque la utilidad de este protocolo fue evaluada en el contexto de estudios clínicos aleatorizados, cada una de las variables mencionadas tiene limitaciones reconocidas y el uso de una sola de ellas no parece ser la forma más adecuada de evaluar la perfusión tisular8,9. Más recientemente, estudios clínicos multicéntricos no confirmaron la utilidad del protocolo de Rivers et al., y la medición de la SvcO2 como guía para reanimar a un paciente fue desafiada10–12. Esto llevó a que la última versión de la Campaña Sobrevivir a la Sepsis no recomendara la utilización de esta variable como meta de reanimación inicial en el manejo de estos pacientes13.
Es por esto por lo que se hace necesaria la búsqueda de otros parámetros que evalúen la perfusión tisular para guiar la terapia. Uno de ellos es la diferencia venoarterial de la presión de CO2 (delta de pCO2 o ΔpCO2), la cual es un punto subrogado de la diferencia de contenido venoarterial de CO2. En condiciones fisiológicas, el contenido de CO2 venoso es mayor que el arterial, producto de la producción de CO2 a nivel periférico acoplada al consumo de oxígeno y el metabolismo en general. En rangos de normalidad, el contenido presenta una relación lineal con las presiones, por lo cual se ha propuesto la medición de tales presiones. En teoría, los estados de bajo flujo y las fuentes no anaerobias de producción del CO2 pueden incrementar el contenido venoso y así ampliar la diferencia normal14,15.
El delta de pCO2 ha sido propuesto como un parámetro que puede indicar alteración de la perfusión tisular en diversos contextos clínicos16,17, incluyendo la sepsis14,18. Sin embargo, su evaluación aún no es recomendada por la guía internacional de la Campaña Sobrevivir a la Sepsis y no hay claridad sobre su verdadera utilidad durante la reanimación inicial de estos pacientes o como meta de reanimación4,14. En el presente estudio se realiza una revisión sistemática de la literatura con el objetivo de identificar los estudios y resultados del uso del delta de pCO2 como medida de valor pronóstico o terapéutico en pacientes con sepsis grave o shock séptico.
MétodosSe realizó una búsqueda sistemática de la literatura en la cual se incluyeron estudios originales publicados en formato de texto completo, que tuvieran como objetivo principal evaluar el delta de pCO2 durante el manejo inicial de pacientes con shock séptico y/o sepsis grave y que incluyeran solo población con este tipo de shock. Se excluyeron estudios que evaluaran población<18 años o embarazadas. No hubo restricción por tipo de estudio o idioma de la publicación.
La búsqueda se realizó entre enero de 1966 y octubre de 2015, actualizada para noviembre de 2016, en las bases de datos Medline-PubMed, Embase-Elsevier, Cochrane Library y LILACS, con los términos de la estrategia planteada en el protocolo de investigación (anexo 1). Dos autores revisaron los títulos y resúmenes de la búsqueda, identificando los estudios que cumplieron con los criterios de selección. Los desacuerdos entre los investigadores se solucionaron por consenso con un tercer autor. Las referencias de los artículos seleccionados también fueron utilizadas para identificar estudios adicionales.
La información se sintetizó en un formulario de recolección de datos en donde se incluyeron el objetivo, el tamaño de la muestra, las características de la población estudiada, los principales desenlaces y las conclusiones de cada uno de los artículos. Específicamente se recolectaron datos acerca de la mortalidad intrahospitalaria, la mortalidad a 28 días, el gasto cardíaco (GC), el índice cardíaco (IC), otras variables de perfusión tisular, tales como el lactato y la SvO2, e intervenciones terapéuticas definidas en la metodología de los estudios. Para la ejecución de esta revisión sistemática se siguieron las directrices de la declaración PRISMA19. La evaluación del riesgo de sesgos se efectuó aplicando la propuesta de Altman de evaluación de variables de pronóstico, que utiliza un sistema de semaforización, aplicado a 6 factores: la muestra de pacientes, el seguimiento de los pacientes, el resultado evaluado, la variable que marca el pronóstico (factor pronóstico), el análisis de los datos y el tratamiento subsiguiente a la inclusión en la cohorte20. El estudio fue aprobado por el comité de investigación de la Facultad de Medicina de la Fundación Universitaria de Ciencias de la Salud y el Hospital de San José de Bogotá, y el comité de ética de esta última institución.
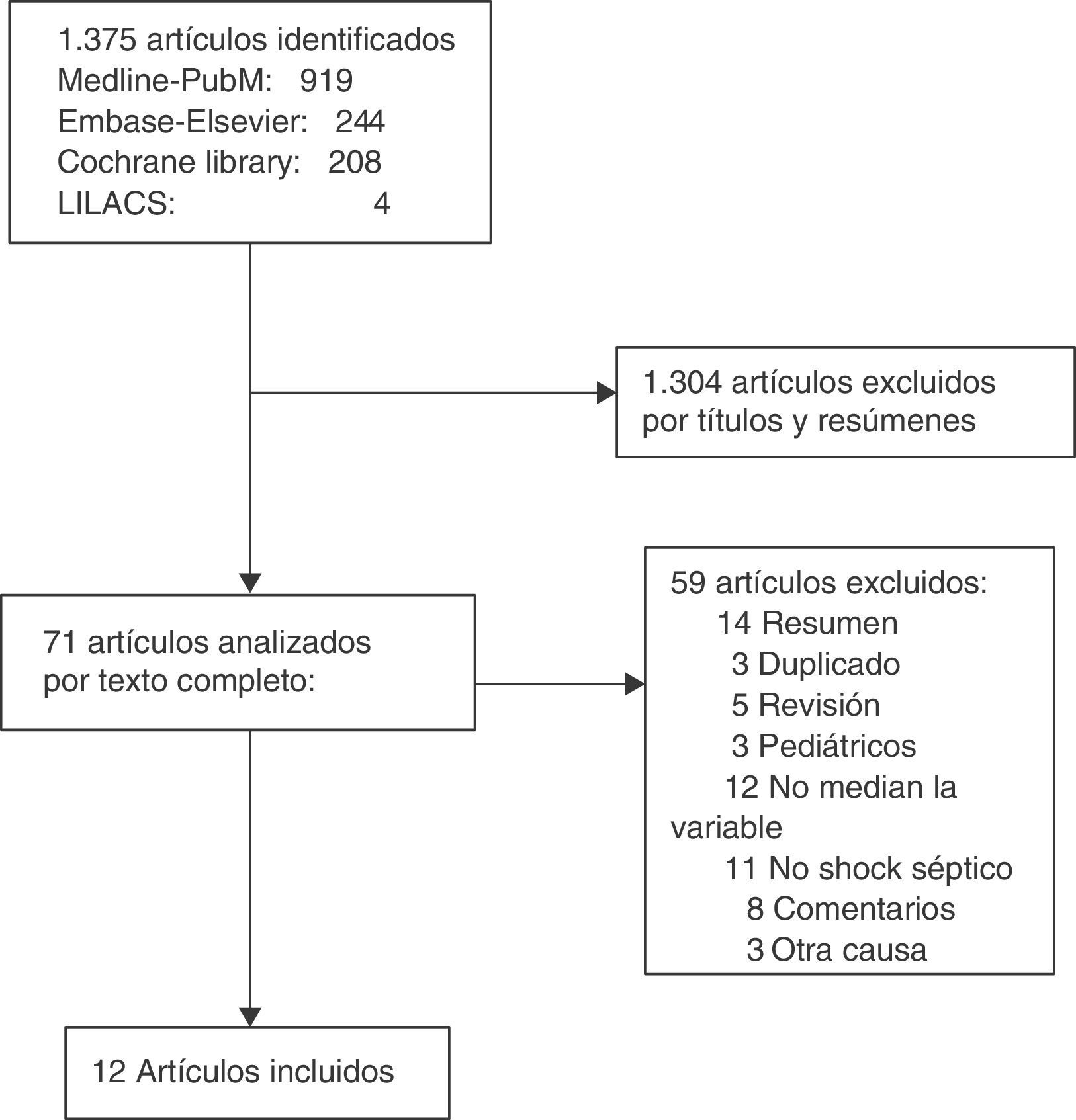
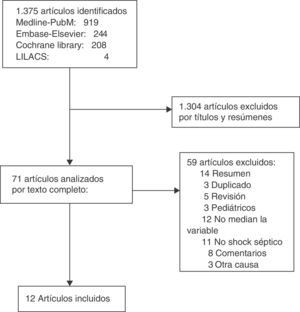
ResultadosLa búsqueda arrojó un total de 1.375 artículos, de los cuales 1.304 fueron descartados por título y resumen. De los 71 analizados en texto completo, 12 cumplieron los criterios de inclusión21–32. No hubo discrepancias entre los revisores. En la figura 1 se muestra el proceso de selección de los artículos incluidos.
Todos los estudios fueron observacionales, 10 prospectivos, 10 publicados en idioma inglés y 2 en chino. En todos los estudios la selección de la muestra fue por conveniencia. Los principales aspectos relacionados con posibles sesgos fueron el tiempo corto de seguimiento y la falta de ajuste estadístico para otros factores pronósticos de importancia (anexo 2).
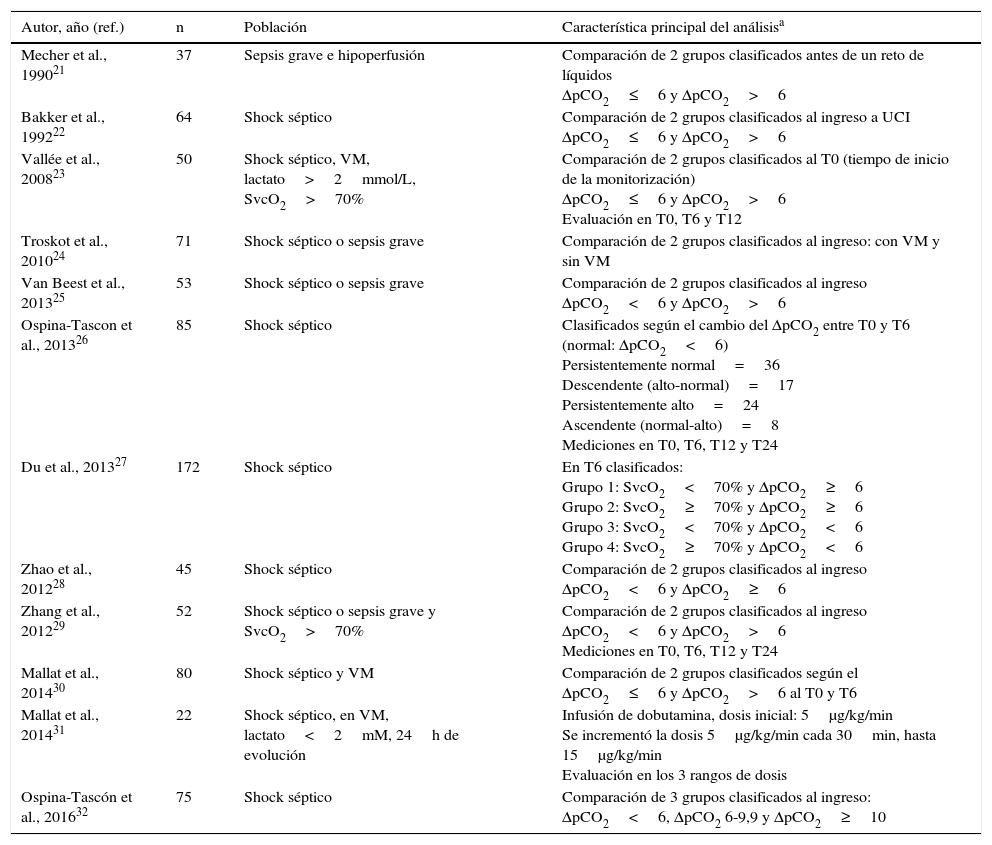
Las características de los estudios incluidos se muestran en la tabla 1. Los principales resultados se presentan a continuación, según aspectos específicos evaluados con relación al delta de pCO2.
Características principales de los estudios que cumplieron criterios de inclusión
| Autor, año (ref.) | n | Población | Característica principal del análisisa |
|---|---|---|---|
| Mecher et al., 199021 | 37 | Sepsis grave e hipoperfusión | Comparación de 2 grupos clasificados antes de un reto de líquidos ΔpCO2≤6 y ΔpCO2>6 |
| Bakker et al., 199222 | 64 | Shock séptico | Comparación de 2 grupos clasificados al ingreso a UCI ΔpCO2≤6 y ΔpCO2>6 |
| Vallée et al., 200823 | 50 | Shock séptico, VM, lactato>2mmol/L, SvcO2>70% | Comparación de 2 grupos clasificados al T0 (tiempo de inicio de la monitorización) ΔpCO2≤6 y ΔpCO2>6 Evaluación en T0, T6 y T12 |
| Troskot et al., 201024 | 71 | Shock séptico o sepsis grave | Comparación de 2 grupos clasificados al ingreso: con VM y sin VM |
| Van Beest et al., 201325 | 53 | Shock séptico o sepsis grave | Comparación de 2 grupos clasificados al ingreso ΔpCO2<6 y ΔpCO2>6 |
| Ospina-Tascon et al., 201326 | 85 | Shock séptico | Clasificados según el cambio del ΔpCO2 entre T0 y T6 (normal: ΔpCO2<6) Persistentemente normal=36 Descendente (alto-normal)=17 Persistentemente alto=24 Ascendente (normal-alto)=8 Mediciones en T0, T6, T12 y T24 |
| Du et al., 201327 | 172 | Shock séptico | En T6 clasificados: Grupo 1: SvcO2<70% y ΔpCO2≥6 Grupo 2: SvcO2≥70% y ΔpCO2≥6 Grupo 3: SvcO2<70% y ΔpCO2<6 Grupo 4: SvcO2≥70% y ΔpCO2<6 |
| Zhao et al., 201228 | 45 | Shock séptico | Comparación de 2 grupos clasificados al ingreso ΔpCO2<6 y ΔpCO2≥6 |
| Zhang et al., 201229 | 52 | Shock séptico o sepsis grave y SvcO2>70% | Comparación de 2 grupos clasificados al ingreso ΔpCO2<6 y ΔpCO2>6 Mediciones en T0, T6, T12 y T24 |
| Mallat et al., 201430 | 80 | Shock séptico y VM | Comparación de 2 grupos clasificados según el ΔpCO2≤6 y ΔpCO2>6 al T0 y T6 |
| Mallat et al., 201431 | 22 | Shock séptico, en VM, lactato<2mM, 24h de evolución | Infusión de dobutamina, dosis inicial: 5μg/kg/min Se incrementó la dosis 5μg/kg/min cada 30min, hasta 15μg/kg/min Evaluación en los 3 rangos de dosis |
| Ospina-Tascón et al., 201632 | 75 | Shock séptico | Comparación de 3 grupos clasificados al ingreso: ΔpCO2<6, ΔpCO2 6-9,9 y ΔpCO2≥10 |
SvcO2: saturación venosa central de oxígeno; T0: tiempo cero (tiempo de ingreso del paciente al estudio); T6: 6h después del T0; T12: 12h después del T0; T24: 24h después del T0; UCI: Unidad de Cuidados Intensivos; VM: ventilación mecánica; ΔpCO2: diferencia venoarterial de dióxido de carbono.
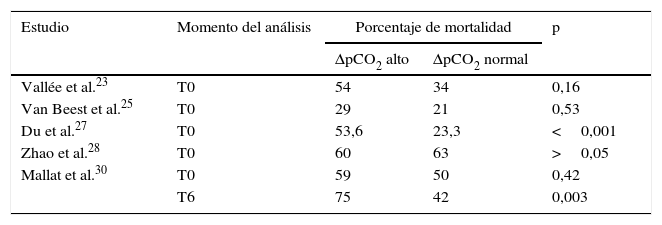
Tres artículos evaluaron la mortalidad intrahospitalaria relacionada con delta de pCO222,24,25 y 5, la mortalidad a 28 días23,26–28,30. Cinco estudios compararon la mortalidad entre grupos de pacientes con delta de pCO2 alto y normal al ingreso; en ellos se evidencia un mayor porcentaje de mortalidad en pacientes con delta de pCO2 alto, sin embargo, las diferencias en los porcentajes fueron variables y en 2 estudios no alcanzaron significación estadística (tabla 2).
Porcentaje de mortalidad según el grupo de delta pCO2
| Estudio | Momento del análisis | Porcentaje de mortalidad | p | |
|---|---|---|---|---|
| ΔpCO2 alto | ΔpCO2 normal | |||
| Vallée et al.23 | T0 | 54 | 34 | 0,16 |
| Van Beest et al.25 | T0 | 29 | 21 | 0,53 |
| Du et al.27 | T0 | 53,6 | 23,3 | <0,001 |
| Zhao et al.28 | T0 | 60 | 63 | >0,05 |
| Mallat et al.30 | T0 | 59 | 50 | 0,42 |
| T6 | 75 | 42 | 0,003 | |
T0: tiempo cero (tiempo de ingreso del paciente al estudio); T6: 6h después del T0; ΔpCO2: diferencia venoarterial de dióxido de carbono.
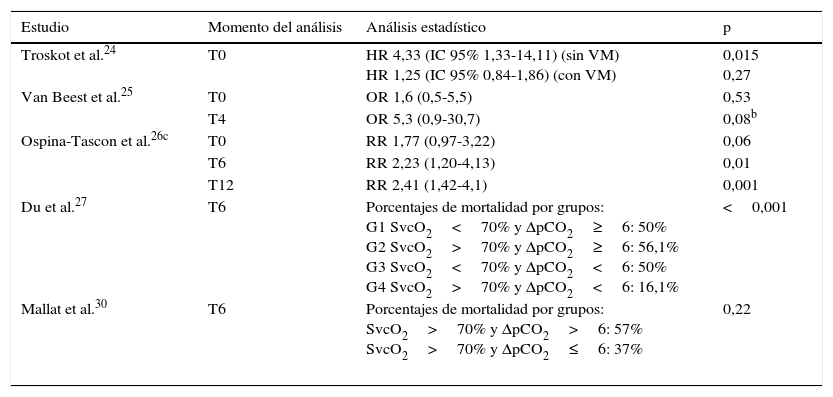
En 6 estudios se realizaron otros análisis relacionados con la mortalidad. Troskot et al.24 mostraron que el delta de pCO2 es un factor de riesgo para mortalidad en pacientes no ventilados, mientras que Bakker et al.22. demostraron que en no supervivientes el delta de pCO2 fue mayor que en los supervivientes (5,9±3,4 vs. 4,4±2,3, respectivamente; p<0,05), aunque el resultado estuvo influido por un mayor compromiso pulmonar en el primer grupo y anota en su conclusión que su valor pronóstico fue modesto24. Van Beest et al.25 mostraron que un delta de pCO2>6mmHg a las 4h de ingreso tuvo una OR de 5,3 (IC 95% 0,9-30,7; p=0,08) para mortalidad intrahospitalaria, mientras que en el estudio de Ospina-Tascon et al.26, los pacientes con delta de pCO2 persistentemente alto durante las primeras 6h tuvieron una menor sobrevida a 28 días comparados con quienes normalizaron esta variable (log-rank, Mantel-Cox: 19,21, p<0,001). En el estudio de Du et al.27 se pudo evidenciar que entre los pacientes que lograron en la reanimación inicial metas terapéuticas de SvO2, quienes presentaron delta de pCO2 alto tuvieron una mayor mortalidad con relación a los que normalizaron esta variable. Este resultado también fue evidenciado en los estudios de Ospina-Tascon et al.26 y de Mallat et al.30, aunque en este último no fue estadísticamente significativo (tabla 3).
Relación entre mortalidad y delta de pCO2a
| Estudio | Momento del análisis | Análisis estadístico | p |
|---|---|---|---|
| Troskot et al.24 | T0 | HR 4,33 (IC 95% 1,33-14,11) (sin VM) HR 1,25 (IC 95% 0,84-1,86) (con VM) | 0,015 0,27 |
| Van Beest et al.25 | T0 | OR 1,6 (0,5-5,5) | 0,53 |
| T4 | OR 5,3 (0,9-30,7) | 0,08b | |
| Ospina-Tascon et al.26c | T0 | RR 1,77 (0,97-3,22) | 0,06 |
| T6 | RR 2,23 (1,20-4,13) | 0,01 | |
| T12 | RR 2,41 (1,42-4,1) | 0,001 | |
| Du et al.27 | T6 | Porcentajes de mortalidad por grupos: G1 SvcO2<70% y ΔpCO2≥6: 50% G2 SvcO2>70% y ΔpCO2≥6: 56,1% G3 SvcO2<70% y ΔpCO2<6: 50% G4 SvcO2>70% y ΔpCO2<6: 16,1% | <0,001 |
| Mallat et al.30 | T6 | Porcentajes de mortalidad por grupos: SvcO2>70% y ΔpCO2>6: 57% SvcO2>70% y ΔpCO2≤6: 37% | 0,22 |
HR: hazard ratio; IC 95%: intervalo de confianza del 95%; OR: odds ratio; RR: riesgo relativo; SvcO2: saturación venosa central de oxígeno; T0: tiempo cero (tiempo de ingreso del paciente al estudio); T4: 4h después del T0; T6: 6h después del T0; T12: 12h después del T0; VM: ventilación mecánica; ΔpCO2: diferencia venoarterial de dióxido de carbono.
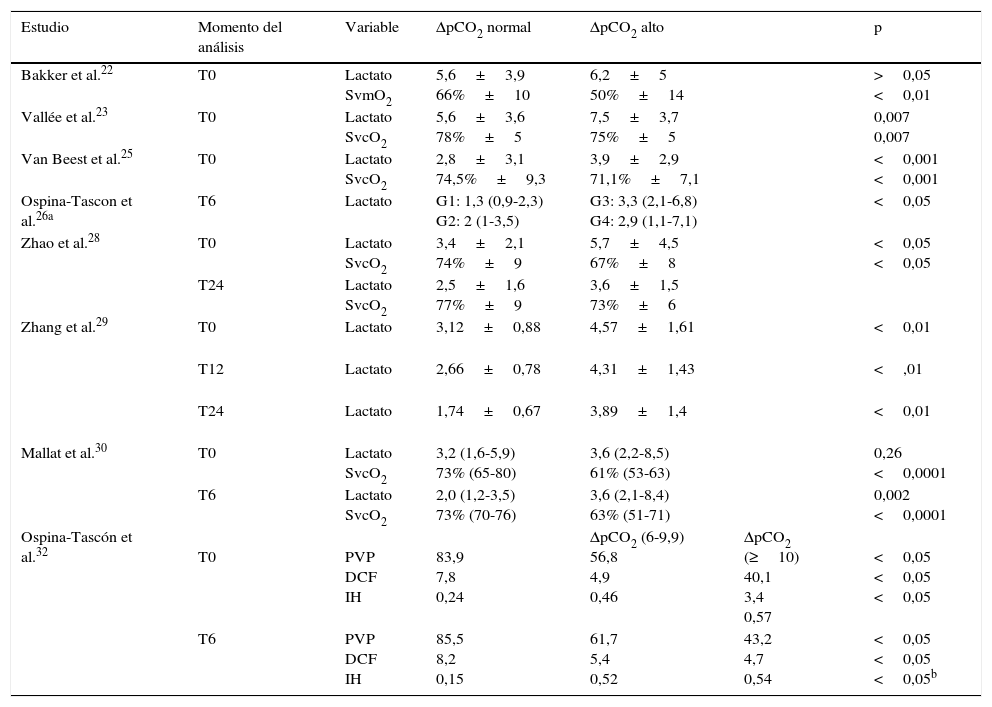
Nueve estudios evaluaron el delta de pCO2 con relación a otras variables de perfusión tisular22,23,25–30,32. Vallée et al.23, Van Beest et al.25, Mallat et al.30 y Zhao et al.28 encontraron niveles de lactato sérico mayores y SvcO2 más bajas cuando los pacientes tuvieron delta de pCO2>6mmHg, comparados con los de delta de pCO2<6mmHg, mientras que Bakker et al.22 no reportaron diferencias estadísticamente significativas para el lactato, pero evidenciaron una saturación venosa mixta de oxígeno más baja en el grupo de delta de pCO2 alto (tabla 4). En el estudio de Ospina-Tascon et al. se clasificaron los pacientes según el valor del delta de pCO2 de ingreso y de 6h. El grupo de delta de pCO2 persistentemente elevado (alto a las 0 y 6h) tuvo un mayor nivel de lactato comparado con el grupo que normalizó este delta (alto a las 0 horas y normal a las 6h) (tabla 4).
Variables de perfusión tisular y delta pCO2
| Estudio | Momento del análisis | Variable | ΔpCO2 normal | ΔpCO2 alto | p | |
|---|---|---|---|---|---|---|
| Bakker et al.22 | T0 | Lactato SvmO2 | 5,6±3,9 66%±10 | 6,2±5 50%±14 | >0,05 <0,01 | |
| Vallée et al.23 | T0 | Lactato SvcO2 | 5,6±3,6 78%±5 | 7,5±3,7 75%±5 | 0,007 0,007 | |
| Van Beest et al.25 | T0 | Lactato SvcO2 | 2,8±3,1 74,5%±9,3 | 3,9±2,9 71,1%±7,1 | <0,001 <0,001 | |
| Ospina-Tascon et al.26a | T6 | Lactato | G1: 1,3 (0,9-2,3) G2: 2 (1-3,5) | G3: 3,3 (2,1-6,8) G4: 2,9 (1,1-7,1) | <0,05 | |
| Zhao et al.28 | T0 | Lactato SvcO2 | 3,4±2,1 74%±9 | 5,7±4,5 67%±8 | <0,05 <0,05 | |
| T24 | Lactato SvcO2 | 2,5±1,6 77%±9 | 3,6±1,5 73%±6 | |||
| Zhang et al.29 | T0 | Lactato | 3,12±0,88 | 4,57±1,61 | <0,01 | |
| T12 | Lactato | 2,66±0,78 | 4,31±1,43 | <,01 | ||
| T24 | Lactato | 1,74±0,67 | 3,89±1,4 | <0,01 | ||
| Mallat et al.30 | T0 | Lactato SvcO2 | 3,2 (1,6-5,9) 73% (65-80) | 3,6 (2,2-8,5) 61% (53-63) | 0,26 <0,0001 | |
| T6 | Lactato SvcO2 | 2,0 (1,2-3,5) 73% (70-76) | 3,6 (2,1-8,4) 63% (51-71) | 0,002 <0,0001 | ||
| Ospina-Tascón et al.32 | T0 | PVP DCF IH | 83,9 7,8 0,24 | ΔpCO2 (6-9,9) 56,8 4,9 0,46 | ΔpCO2 (≥10) 40,1 3,4 0,57 | <0,05 <0,05 <0,05 |
| T6 | PVP DCF IH | 85,5 8,2 0,15 | 61,7 5,4 0,52 | 43,2 4,7 0,54 | <0,05 <0,05 <0,05b |
DCF: densidad capilar funcional; IH: índice de heterogeneidad; PVP: porcentaje de vasos pequeños perfundidos; SvcO2: saturación venosa central de oxígeno; SvmO2: saturación venosa mixta de oxígeno; T0: tiempo cero (tiempo de ingreso del paciente al estudio); T6: 6h después del T0; T12: 12h después del T0; T24: 24h después del T0; ΔpCO2: diferencia venoarterial de dióxido de carbono.
Tres estudios23,27,30 encontraron que el porcentaje de disminución del lactato fue mayor cuando los pacientes tuvieron delta de pCO2<6mmHg. Vallée et al.23 mostraron una disminución de lactato entre 0 y 12h de −38±39 vs. −17±33% (p=0,04), respectivamente, mientras que en el de Mallat et al.30, la disminución de lactato entre 0 y 6h fue de 33,3±28,9 vs. 7,8±41,2 (p=0,016). Por su parte, Du et al.27 realizaron un estudio en el que clasificaron los pacientes según la meta de SvcO2 y el delta de pCO2 a las 6h. En el grupo de pacientes que lograron meta de SvcO2, la depuración de lactato fue mayor entre el subgrupo con delta de pCO2 normal comparado con el de delta de pCO2 alto, 0,21±0,31 vs. 0,01±0,61 (p=0,023) respectivamente, mientras que en el grupo que no lograron metas de SvcO2 no se observaron estas diferencias (−0,04±0,43 vs. −0,09±0,59, respectivamente)27.
Un estudio analizó la perfusión microvascular evaluada por videomicroscopia y el delta de pCO2. En este se mostró que un mayor delta de pCO2 se relacionó con una menor proporción de vasos pequeños perfundidos, menor densidad capilar funcional y mayor índice de heterogeneidad (tabla 4).
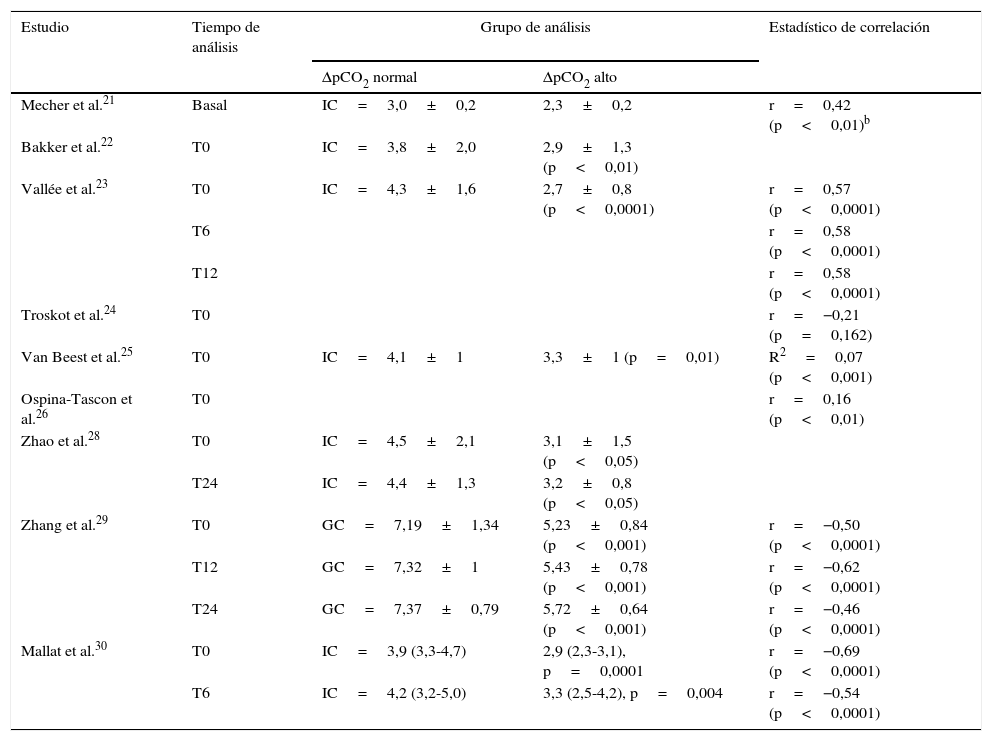
Delta de pCO2 y gasto cardíaco o índice cardíacoNueve artículos evaluaron la relación entre el delta de pCO2 y el GC o IC21,28–30. Cinco compararon los promedios del IC o GC en los grupos con delta de pCO2 alto o bajo. En todos encontraron que valores de delta de pCO2>6mmHg se asociaron con un menor GC o IC22,23,28–30. Adicionalmente, la correlación calculada entre el delta de pCO2 y el IC o GC fue discreta (tabla 5). En ningún caso el coeficiente de correlación fue mayor de 0,7.
Índice cardíaco o gasto cardíaco y su correlación con el delta de pCO2a
| Estudio | Tiempo de análisis | Grupo de análisis | Estadístico de correlación | |
|---|---|---|---|---|
| ΔpCO2 normal | ΔpCO2 alto | |||
| Mecher et al.21 | Basal | IC=3,0±0,2 | 2,3±0,2 | r=0,42 (p<0,01)b |
| Bakker et al.22 | T0 | IC=3,8±2,0 | 2,9±1,3 (p<0,01) | |
| Vallée et al.23 | T0 | IC=4,3±1,6 | 2,7±0,8 (p<0,0001) | r=0,57 (p<0,0001) |
| T6 | r=0,58 (p<0,0001) | |||
| T12 | r=0,58 (p<0,0001) | |||
| Troskot et al.24 | T0 | r=−0,21 (p=0,162) | ||
| Van Beest et al.25 | T0 | IC=4,1±1 | 3,3±1 (p=0,01) | R2=0,07 (p<0,001) |
| Ospina-Tascon et al.26 | T0 | r=0,16 (p<0,01) | ||
| Zhao et al.28 | T0 | IC=4,5±2,1 | 3,1±1,5 (p<0,05) | |
| T24 | IC=4,4±1,3 | 3,2±0,8 (p<0,05) | ||
| Zhang et al.29 | T0 | GC=7,19±1,34 | 5,23±0,84 (p<0,001) | r=−0,50 (p<0,0001) |
| T12 | GC=7,32±1 | 5,43±0,78 (p<0,001) | r=−0,62 (p<0,0001) | |
| T24 | GC=7,37±0,79 | 5,72±0,64 (p<0,001) | r=−0,46 (p<0,0001) | |
| Mallat et al.30 | T0 | IC=3,9 (3,3-4,7) | 2,9 (2,3-3,1), p=0,0001 | r=−0,69 (p<0,0001) |
| T6 | IC=4,2 (3,2-5,0) | 3,3 (2,5-4,2), p=0,004 | r=−0,54 (p<0,0001) | |
GC: gasto cardíaco; IC: índice cardíaco; r: coeficiente de correlación; R2: coeficiente de determinación; T0: tiempo cero (tiempo de ingreso del paciente al estudio); T6: 6h después del T0; T12: 12h después del T0; T24: 24h después del T0; ΔpCO2: diferencia venoarterial de dióxido de carbono.
Mallat et al.31 encontraron una disminución estadísticamente significativa del delta de pCO2 cuando se administró dobutamina en una dosis creciente entre 5 y 15μg/kg/min, mientras que Mecher et al.21 evaluaron la respuesta del delta de pCO2 ante un reto de líquidos, encontrando mejoría en esta variable luego de la administración de coloides.
DiscusiónLa presente revisión sistemática documentó que la mayor parte de las publicaciones del delta de pCO2 en población con sepsis grave y shock séptico son de los últimos 6 años. Aun cuando hay evidencia de su potencial utilidad desde finales de los años 8016,17, y 2 artículos identificados son de principios de los 9021,22, el interés más reciente en la investigación de este parámetro está posiblemente vinculado a las múltiples limitaciones expuestas en la utilización de las variables más recomendadas en el manejo de estos pacientes: el lactato y la SvO233,34. La evaluación de la microcirculación con métodos más novedosos y la evidencia de alteraciones de la microcirculación a pesar de la normalidad aparente en las variables macrodinámicas, incluyendo la SvO2, ponen en evidencia la necesidad de buscar variables adicionales8,9.
Los estudios mostraron, en general, que los valores altos de delta del pCO2 se relacionaron con unos peores resultados clínicos, incluyendo deterioro de parámetros hemodinámicos, de perfusión tisular y una mayor mortalidad tanto intrahospitalaria como a 28 días. En cuanto a la mortalidad, cabe resaltar la importancia de las mediciones seriadas de esta variable en su valor pronóstico. En los estudios que aportaron datos de mediciones seriadas, se observó que la segunda medida del delta de pCO2 se relacionaba más con la mortalidad que la medida inicial25,30. Aun cuando diversos estudios han demostrado que tanto la SvO2 como el lactato, de forma individual, tienen significado pronóstico en cuanto a la mortalidad5,6,35, obtener la medición del delta de pCO2 pareciera ofrecer información adicional. Lo anterior se observa en 3 estudios que analizaron a los pacientes que lograron metas adecuadas de SvO2 a las 6h de reanimación, en quienes tener un delta de pCO2 normal implicó un mejor pronóstico para estos pacientes. Esto puede indicar la utilidad de realizar un enfoque seriado durante la reanimación inicial de los pacientes con shock séptico, en el cual primero se logre la meta de SvO2 y seguidamente se logre una meta adicional utilizando el delta de pCO2. El punto de corte de 6mmHg para categorizar los 2 grupos (normal y alto) fue bastante consistente a través de todos los estudios y, en general, hacían referencia al estudio de Bakker et al.22 para tomar este parámetro.
Sin embargo, es importante anotar que la importancia de las mediciones seriadas ha sido mejor establecida para el caso del lactato. Al respecto, la importancia de los porcentajes de disminución (clearance) de lactato, incluso como meta de reanimación, ha sido documentada tanto en sepsis como en población general de pacientes críticos6,36. En nuestra investigación, los estudios que analizaron el delta de pCO2 en relación con el porcentaje de disminución del lactato23,27,30 evidenciaron que este porcentaje de disminución fue mayor en los grupos de pacientes con delta bajo, sobre todo si es evaluado a las 6h, lo cual refuerza la importancia de la medición seriada del delta de pCO2 y también evidencia la potencial utilidad de las mediciones en conjunto con el lactato.
Teniendo en cuenta que el aumento del delta de pCO2 se relaciona con los estados de bajo flujo y la acumulación del CO2 secundario a un fenómeno de estancamiento, un grupo de estudios evaluó la relación de este parámetro con el GC o el IC. Estos estudios mostraron en general una relación inversa esperada entre las 2 variables, sin embargo, algunos mostraban coeficientes de correlación o de determinación bajos entre las 2, aun cuando fuera estadísticamente significativo21,22,24, observándose además una alta dispersión de los puntos analizados. Adicionalmente, 2 estudios no mostraron tal relación24,26. Lo anterior puede ser muestra de la complejidad fisiopatológica en la interpretación del aumento del delta de pCO2 en el contexto de estos pacientes y, además, la evidente variabilidad individual que hay en tales casos. Por lo tanto, su valor para evaluar de forma indirecta el GC puede llegar a ser inconsistente.
Además de su implicación en el pronóstico, 2 estudios evaluaron el impacto de intervenciones terapéuticas sobre el delta de pCO2, demostrando que la administración de líquidos o inotrópicos puede tener un impacto positivo sobre esta variable. Esto es algo importante, ya que conocer de antemano como se puede modificar esta variable es relevante a la hora de construir un algoritmo de manejo para estos pacientes, en el escenario de un estudio clínico que evalúe el delta de pCO2 como meta de reanimación en los pacientes con shock séptico.
A pesar de la evidencia encontrada, diversos autores han planteado las limitaciones de esta variable en la evaluación de la hipoperfusión tisular. El delta de pCO2 puede estar normal en casos de hipoperfusión evidente y GC elevado y también puede estar incrementado en ausencia de hipoperfusión teniendo en cuenta el efecto Haldane37. Es por esto por lo que se ha propuesto la evaluación de los contenidos de CO2 en relación con los del oxígeno como otra forma de acercarse al estado de perfusión tisular. La relación Cv-aCO2/Da-vO2 es una variable que puede identificar pacientes con metabolismo anaerobio en diversas condiciones críticas incluyendo el shock séptico38–40, por lo que este parámetro también puede tener relevancia clínica en el manejo de pacientes con sepsis.
En los últimos años, nuevos métodos para evaluar de forma más directa la perfusión tisular han sido desarrollados41. Uno de ellos es la utilización de la videomicroscopia sublingual con técnica de corriente lateral de campo oscuro, la cual ofrece diversos parámetros para evaluar la microcirculación. Utilizando este dispositivo, se han documentado diversas alteraciones microcirculatorias en pacientes con shock séptico y su mejoría con ciertas intervenciones42–44. Sin embargo, la utilización de esta tecnología al lado de la cama del paciente tiene múltiples desafíos y aún no se encuentra establecida su importancia en el manejo de estos pacientes. Es por esto por lo que continúan vigentes los parámetros de fácil medición como los discutidos anteriormente. Al respecto, el estudio de Ospina-Tascón et al.32 aporta datos importantes, teniendo en cuenta que el delta de pCO2 fue la variable que mejor se relacionó con alteraciones microcirculatorias, aun cuando el significado clínico de estas relaciones no está bien definido.
Teniendo en cuenta lo anterior, ¿debe ser el delta de pCO2 una variable que se utilice como meta de reanimación en pacientes con shock séptico?; la respuesta aún no se encuentra disponible, y como es esperable, la hipótesis debe estar sujeta a la evaluación en ensayos clínicos. La SvO2 y el lactato son las variables que más se han evaluado en estos pacientes, y la guía más reciente de la Campaña Sobrevivir a la Sepsis recomienda solo la medición del lactato4; por lo tanto, la forma en que se debe involucrar el delta de pCO2 en el manejo de estos pacientes y de relacionarlo con las variables antes mencionadas no es clara, pensado, por ejemplo, en qué se debe «normalizar» primero, cuántas metas de reanimación deben ser logradas o cómo se debe llegar a cumplir las mismas. Lo anterior, sin embargo, no priva de la posibilidad de que el delta de pCO2 sea tenido en cuenta en el manejo de los pacientes con shock séptico, en el contexto de un enfoque multimodal en conjunto con otras variables, con mediciones seriadas, de forma individualizada, durante la reanimación inicial. De hecho, el consenso más reciente de shock circulatorio y monitorización hemodinámica de la Sociedad Europea de Medicina de Cuidados Intensivos recomienda la medición de esta variable como parte de la evaluación y el manejo del paciente con shock séptico que tenga un catéter venoso central45.
En el presente estudio no fue posible realizar un metaanálisis teniendo en cuenta la alta heterogeneidad propia de los diseños de los estudios, los reportes de los resultados y la naturaleza de la enfermedad. Una de las limitaciones de la revisión sistemática fue que incluyó estudios del delta del pCO2 en población exclusiva de pacientes con sepsis grave y shock séptico, privando así de la posibilidad de extenderlo a un contexto más amplio de pacientes críticos y ampliar el análisis de sus potenciales usos y limitaciones; sin embargo, esto fue también parte fundamental del propósito del mismo. Algunos estudios que analizaron el delta de pCO2 en poblaciones de pacientes críticos no fueron tenidos en cuenta, aunque contaran con pacientes con sepsis grave y shock séptico, ya que no siempre se mostraban los resultados en estos últimos pacientes38,46. Otros estudios de pacientes con shock séptico analizaron el delta de pCO2; sin embargo, al no ser el objetivo principal, la evaluación de esta variable era limitada39,47,48.
Se puede concluir que el delta de pCO2 ha sido evaluado en el manejo de los pacientes con sepsis grave y shock séptico con mayor frecuencia en los últimos años, y que sus valores altos se relacionaron en la mayor parte de los casos con peores resultados clínicos, incluyendo menor IC, lactato alto, SvO2 más bajas, menores tasas de depuración de lactato y mayor mortalidad, aunque los estudios fueron heterogéneos y con algunas limitaciones metodológicas. Aun cuando no se ha investigado su utilidad en una investigación clínica dentro de un protocolo de reanimación inicial de pacientes con sepsis grave y shock séptico, los resultados en conjunto demuestran que puede ser una variable a tener en cuenta en el manejo de estos pacientes.
AutoríaJuan José Diaztagle: idea de investigación, diseño del protocolo, búsqueda de datos, análisis de resultados, discusión del artículo, redacción.
Jorge Camilo Rodríguez: diseño del protocolo, búsqueda de datos, análisis de resultados, discusión del artículo.
John Jaime Sprockel Díaz: diseño del protocolo, análisis de resultados, discusión del artículo.
Conflicto de interesesNinguno.
A Diana Buitrago, de la División de Investigaciones, Fundación Universitaria de Ciencias de la Salud, por su valioso apoyo en la búsqueda de la información.