La quemadura grave induce estrés oxidativo severo, respuesta inflamatoria sistémica, hipermetabolismo e hipercatabolismo severo y persistente con sarcopenia secundaria, disfunción orgánica, sepsis y mayor mortalidad. El déficit energético, el balance negativo de proteínas y la deficiencia de micronutrientes antioxidantes durante la agresión térmica están asociados a malos resultados clínicos. En este contexto, una terapia nutricional personalizada, priorizando la nutrición enteral precoz, está indicada desde el inicio de la fase de resucitación. En las últimas 4 décadas se han estudiado diferentes intervenciones nutricionales y farmacológicas moduladoras de la respuesta inmune y metabólica. Dichas estrategias han demostrado ser capaces de minimizar la malnutrición aguda, modular la respuesta inmunoinflamatoria y mejorar los resultados clínicos. El propósito del presente estudio de revisión es analizar la evidencia más reciente sobre la respuesta metabólica y la terapia nutricional en el paciente quemado crítico.
Major burn injury triggers severe oxidative stress, a systemic inflammatory response, and a persistent hypermetabolic and hypercatabolic state with secondary sarcopenia, multiorgan dysfunction, sepsis and an increased mortality risk. Calorie deficit, negative protein balance and antioxidant micronutrient deficiency after thermal injury have been associated to poor clinical outcomes. In this context, personalized nutrition therapy with early enteral feeding from the start of resuscitation are indicated. Over the last four decades, different nutritional and pharmacological interventions aimed at modulating the immune and metabolic responses have been evaluated. These strategies have been shown to be able to minimize acute malnutrition, as well as modulate the immunoinflammatory response, and improve relevant clinical outcomes in this patient population. The purpose of this updating review is to summarize the most current evidence on metabolic response and nutrition therapy in critically ill burn patients.
El paciente quemado crítico es un modelo de paciente con traumatismo caracterizado por el desarrollo precoz de un estado de hipermetabolismo e hipercatabolismo severo, con un gasto energético (GE) que puede duplicar el GE de reposo, pudiendo persistir estas alteraciones durante meses tras la agresión térmica inicial1. La magnitud de este estado depende de diversas alteraciones biomoleculares, presentando una relación directa con la extensión de la superficie corporal total quemada (SCTQ). Por otra parte, el daño térmico es una importante causa de pérdida de macronutrientes (proteínas) y micronutrientes (elementos traza y vitaminas) a través de las áreas quemadas. La intensa respuesta hipermetabólica e hipercatabólica genera el desarrollo de malnutrición aguda, sarcopenia secundaria y debilidad muscular adquirida, favoreciendo la aparición de infecciones, disfunción orgánica múltiple, sepsis y finalmente la muerte. Por otra parte, el balance negativo de micronutrientes antioxidantes durante el daño térmico favorece el desarrollo de estrés oxidativo, el cual mantiene y perpetúa la respuesta inflamatoria sistémica, la disfunción mitocondrial y las alteraciones metabólicas antes descritas.
En el año 2015 Czapran et al.2 publicaron los resultados correspondientes a pacientes quemados críticos que requirieron ventilación mecánica por un período mayor a las 72horas y que fueron parte del International Nutrition Survey entre los años 2007 y 2011. El análisis de dichos resultados permite afirmar que estos 90 pacientes tuvieron un déficit energético estimado de 943±654kcal/d y un déficit de proteínas de 49±41g/d2. Por otra parte, estos datos revelaron que el 21% de los pacientes fallecieron dentro del período de seguimiento de 60 días después de la admisión en la unidad de cuidados intensivos (UCI), habiéndose constatado en los pacientes fallecidos un mayor déficit energético (1.251±742 vs. 861±607kcal/d, p=0,02) y proteico (67±42 vs. 44±39g/d, p=0,03)2.
Por lo expuesto, una terapia metabólica y nutricional adecuadas son fundamentales, con el objetivo de promover la recuperación del paciente quemado grave, modulando la respuesta inmunoinflamatoria y minimizando la malnutrición aguda asociada a la enfermedad crítica3. En tal sentido la implementación de una terapia nutricional adecuada, precoz e individualizada ha demostrado ser capaz de mejorar los resultados clínicos, en particular disminuyendo la incidencia de complicaciones infecciosas, la estancia hospitalaria y acelerando el proceso de cicatrización de heridas4. Por consiguiente, la terapia nutricional es una piedra angular dentro de la estrategia terapéutica del paciente quemado crítico, desde la fase de reanimación inicial hasta la fase de curación y rehabilitación definitiva.
El objetivo de la presente revisión es analizar el estado actual del conocimiento sobre las alteraciones metabólicas y la estrategia nutricional en el paciente quemado crítico, con particular énfasis en aspectos tales como la meta calórica y proteica, la evidencia más reciente sobre las estrategias farmaconutricionales y anticatabólicas en esta población de pacientes críticos.
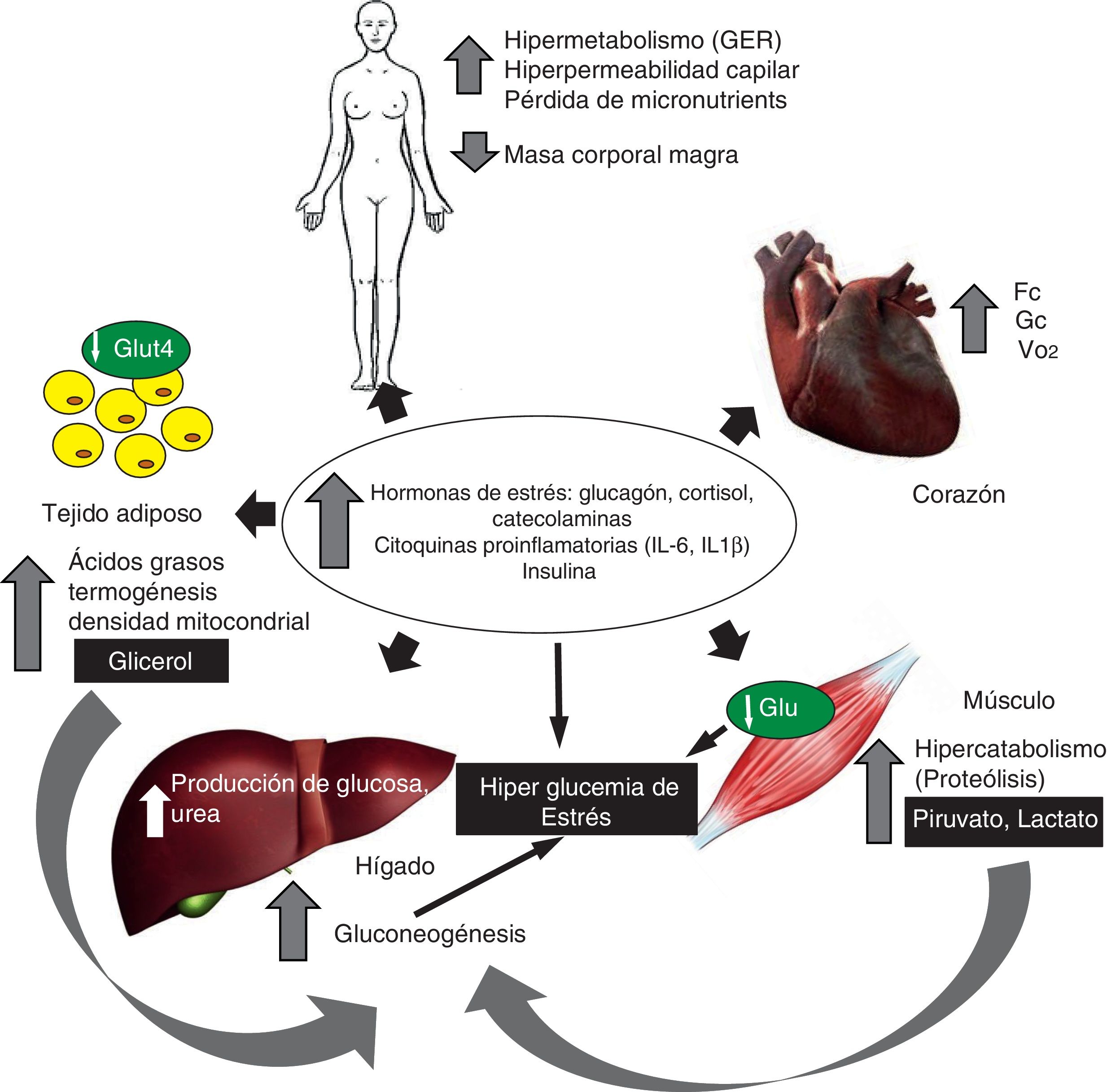
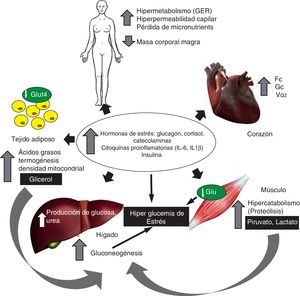
Metabolismo energético y respuesta inflamatoria en el daño térmicoEl traumatismo genera inflamación sistémica mediada por las citoquinas proinflamatorias (interleuquina IL-6, IL-1β, factor de necrosis tumoral alfa FNT-α) y las hormonas de estrés, lo cual induce una respuesta hipermetabólica pronunciada y persistente. Esta respuesta se caracteriza por el aumento de la tasa metabólica basal, incremento del gasto cardíaco, del consumo miocárdico de oxígeno, así como degradación de la proteína muscular y resistencia a la insulina (fig. 1)5. La respuesta hipermetabólica inducida por la agresión térmica se caracteriza por aumento de la tasa metabólica basal (hasta 40% por encima de los valores normales) con importantes alteraciones de la función mitocondrial. En individuos sanos aproximadamente 2/3 del consumo de oxígeno está acoplado a la fosforilación oxidativa, en tanto que el tercio restante es atribuible a la termogénesis5. En el paciente quemado crítico esta relación se invierte, presentando un 1/3 de la respiración mitocondrial acoplada con la fosforilación oxidativa, en tanto que los 2/3 restantes de la respiración total son disipados como calor. Este desacoplamiento de la fosforilación oxidativa mitocondrial en el músculo esquelético es un contribuyente mayor al aumento de la tasa metabólica basal, siendo responsable del hipermetabolismo6,7. En tal sentido, Porter et al.8 han demostrado que en estos pacientes el control del acoplamiento mitocondrial está disminuido, aun luego de transcurridos 2 años de la agresión térmica con más del 30% de SCTQ, lo cual se asocia a un incremento significativo de la termogénesis. Más recientemente, en un modelo experimental de agresión térmica, Szczesny et al.9 analizaron las modificaciones de la bioenergética mitocondrial, demostrando que las mismas son tiempo-dependientes después de la quemadura, con un descenso en la respiración basal y del turnover del ATP. Asimismo, los autores de este estudio demostraron un daño tisular específico del ADN, y en particular del ADN mitocondrial en el tejido pulmonar y en el músculo estriado cardíaco. Finalmente, este grupo estudió la evolución del estrés oxidativo y de la infiltración de neutrófilos medida por la actividad de mieloperoxidasa, constatando que dichos efectos fueron más pronunciados en el corazón y en los pulmones9. Estos hallazgos, sumados a los datos derivados del estudio de Porter et al.8 permiten evidenciar que la disfunción mitocondrial podría ser en el futuro un verdadero target terapéutico en el paciente quemado crítico. Sin embargo, dichos hallazgos necesitan ser corroborados antes de conducir estudios preclínicos, con el objetivo de evaluar la eficacia y seguridad de estas estrategias.
En 2014 Jeschke et al.10, en una cohorte prospectiva de 230 niños quemados críticos con más del 30% de SCTQ, demostraron que aquellos individuos que no sobrevivían al daño térmico exhibían una respuesta inflamatoria más intensa, evidenciada por un mayor incremento en los niveles de IL-6, IL-8, factor estimulante de granulocitos, proteína 1 quimio-atractiva de monocitos, complemento C3, α2-macroglobulina, haptoglobina, α1-glucoproteína ácida y proteína C reactiva. Asimismo, las alteraciones metabólicas fueron más profundas en estos pacientes, con mayores niveles de glucemia, insulina, urea y creatinina plasmática. Finalmente, estos autores mostraron que el GE de reposo medido por calorimetría indirecta era significativamente mayor entre los no sobrevivientes a la quemadura crítica. Todas estas alteraciones inmunoinflamatorias y metabólicas permiten afirmar que las mismas son predictoras de morbimortalidad en el paciente quemado crítico10.
Metabolismo de la glucosaEn la fase precoz posterior a la quemadura el aumento de la tasa de producción y oxidación de glucosa, así como una extracción tisular inadecuada de la misma, generan hiperglucemia e hiperlactatemia11. La hiperglucemia (valores>180mg/dl) se asocia con resultados clínicos adversos, tales como: hipercatabolismo, hipermetabolismo, retardo en la curación de las heridas, mayor incidencia de infecciones y mayor mortalidad12,13. La lesión térmica induce estrés sobre el retículo endoplásmico (RE) en piel, tejido adiposo y muscular, fenómeno asociado con resistencia a la insulina14. Este estrés del RE es censado por diferentes clases de enzimas, tales como inositol-requiring enzyme 1, protein kinase RNA-like ER kinase y la activating transcription factor 6; estas proteínas son responsables de fenómenos de transcripción, traslación genética, desplegado, translocación y secreción proteica15. En 2012 Jeschke et al.16 demostraron que los marcadores de estrés del RE permanecen elevados hasta transcurridos 250 días posteriores a la agresión, lo cual coincide con resistencia a la insulina e hiperglucemia de estrés.
En estos pacientes el control glucémico moderado (100 a 140mg/dl) con el uso de insulina intravenosa (iv) parece asociarse a menor variabilidad de la glucemia con escaso riesgo de hipoglucemia, tal cual fuera demostrado por Stoecklin et al.17 en 229 pacientes adultos quemados graves. La insulina media la captación de glucosa en el tejido adiposo y el músculo esquelético, así como inhibe la gluconeogénesis hepática. Por otra parte, la insulina modula la producción y liberación de las citoquinas proinflamatorias (TNF-α e IL-1β) y antiinflamatoria IL-10, así como la expresión de las moléculas de ahesión ICAM-1 y selectin-E18. En tal sentido el tratamiento con insulina iv obteniendo un nivel de glucemia ≤130mg/dl parece atenuar la respuesta hipermetabólica, en tanto que niveles de 140mg/dl han sido asociados a una reducción de la morbilidad y la mortalidad, lo cual fuera sugerido por Jetschke et al.19. En el paciente traumatizado las guías recomiendan iniciar el tratamiento con insulina cuando el nivel de glucemia≥150mg/dl, el cual debe titularse con el objetivo de mantener valores inferiores a 180mg/dl y en especial <150mg/dl, evitando la hipoglucemia (valores <70mg/dl)20.
Sin embargo, recientemente han sido introducidos los conceptos de paradoja de la diabetes, y en especial del control metabólico previo a la agresión mediante la determinación de la hemoglobina glucosilada21. En virtud de estos nuevos conocimientos el rango objetivo de glucemia durante la enfermedad crítica estaría condicionado por el valor de la hemoglobina glucosilada, de modo tal que valores mayores a 6,5-7,0 permitirían ser más tolerantes con el rango objetivo (160-220mg/dl); sin embargo, hasta el momento actual el fenómeno de la paradoja de la diabetes y los nuevos rangos objetivos no han sido pesquisados en pacientes quemados graves21.
Metabolismo proteicoEl hipercatabolismo severo genera sarcopenia, la cual se asocia a disfunción orgánica, debilidad muscular y mayor mortalidad22. En pacientes quemados ha sido estimado que un metro cuadrado de piel quemada genera una pérdida diaria de nitrógeno (N) de 20 a 25g, lo cual determina una pérdida del 20-25% de masa magra corporal. Asimismo, ha sido estimado que la pérdida media de N en el paciente quemado sin terapia nutricional supera los 0,2g de N/kg/día (15-20g/día), lo cual supone una pérdida de peso del 10% en la primera semana. Esta depleción proteica aguda se asocia a disfunción inmune, alteraciones en la cicatrización, úlceras por presión, así como a una mayor incidencia de infecciones22.
La respuesta hipercatabólica disminuye con el aporte de insulina exógena, desviando el balance entre la síntesis y la proteólisis, lo cual ocurre fundamentalmente en el músculo esquelético; en tal sentido ha sido demostrado un incremento de hasta el 400% en la síntesis proteica con el aporte de insulina iv. Este efecto de la insulina parece estar mediado por un aumento del transporte de aminoácidos, habiéndose descrito un aumento del 500% en la captación de fenilalanina23. Asimismo, estrategias no nutricionales como el uso de propranolol aumentan el reciclaje intracelular de aminoácidos libres, los cuales son reutilizados en la síntesis proteica en el miocito, habiéndose demostrado una mayor captación de fenilalanina marcada y síntesis fraccional de proteínas19.
Metabolismo de los lípidosPosteriormente a la quemadura se produce una movilización de ácidos grasos (AG) desde el tejido adiposo. La lipólisis y el aumento del flujo de AG hacia el plasma están mediados por el incremento de los niveles de catecolaminas, glucagón y adenocorticotrofina24; la lipólisis puede permanecer aumentada entre 5 días y 2 meses posteriores a la agresión térmica, siendo las alteraciones en el perfil de ácidos grasos más pronunciadas entre el día 7 y 10 postagresión. Estas alteraciones favorecen el estado inflamatorio y de inmunospupresión posterior a la quemadura. Por su parte, se constata un aumento persistente en los niveles de glicerol, traducción de una mayor lipoperoxidación; asimismo, la mayor parte de los AG son reesterificados, lo que se manifiesta por un aumento de la lipoproteína LDL, triglicéridos y un descenso en los niveles de cuerpos cetónicos5. Por otra parte, el análisis del perfil de AG plasmático muestra un aumento de los AG saturados y monoinsaturados de acción proinflamatoria, en tanto que los AG poliinsaturados de perfil antiinflamatorio están descendidos. Finalmente, es importante destacar que el incremento de la lipólisis posterior a la quemadura contribuye al incremento de la morbimortalidad por infiltración grasa, en particular del hígado, lo cual se asocia a resistencia a la insulina25.
Estrés oxidativo y estatus de micronutrientes antioxidantesLa quemadura representa un modelo de estrés oxidativo con una depleción severa de las defensas antioxidantes endógenas, por aumento de la excreción urinaria y a través de las áreas quemadas, en particular de los micronutrientes antioxidantes cobre (Cu), selenio (Se) y cinc (Zn)26. Este fenómeno es particularmente ostensible hacia el final de la primera semana posterior a la agresión térmica. Asimismo, la fuga capilar secundaria a la inflamación sistémica explica la redistribución de elementos traza durante la fase aguda, lo cual disminuye la capacidad antioxidante y afecta los mecanismos de reparación tisular. Recientemente, Jafari et al.27 en 15 pacientes quemados con una SCTQ promedio de 29±25% evaluaron el nivel de 12 elementos traza en los exudados de las áreas quemadas. Para la mayoría de los micronutrientes, y en particular para Se, Cu, Zn, boro (B), bromo (Br), hierro (Fe) y yodo (I) las mayores pérdidas se producían durante el día uno, con una reducción de las pérdidas tras las primeras 24horas27.
Por su parte, estos pacientes exhiben una deficiencia de vitaminas A, C, D y E; en tal sentido, en los últimos años el estudio de la vitamina D ha sido de notable interés en diferentes poblaciones de pacientes críticos28. Recientemente, Blay et al.29 en 318 pacientes quemados constataron la presencia de una deficiencia severa (25-dihidroxivitamina D<10ng/ml) en n=46 (14,5%), insuficiencia (10-29ng/ml) en n=207 (65,1%), en tanto que el restante 20,4% de los pacientes presentaba niveles séricos normales de vitamina D. En el grupo de pacientes con insuficiencia o deficiencia de vitamina D los autores constataron una prolongación en los tiempos de estancia en UCI y hospitalaria29. Estos hallazgos, sumados a los trabajos pioneros de Berger et al.30,31, son responsables del notable interés en la estrategia de suplementación de micronutrientes antioxidantes en el paciente quemado crítico, la cual ha sido desarrollada durante los últimos 30 años.
Ruta de la terapia nutricionalLa vía enteral es de elección en el paciente quemado crítico32; en tal sentido, la American Burn Association (ABA)33, y en 2011 la Sociedad Española de Medicina Crítica y Unidades Coronarias y de la Sociedad Española de Nutrición Parenteral y Enteral (SEMICYUC-SENPE)34, han recomendado el inicio precoz de la misma, el cual debería ser tan precoz como sea posible. De modo similar, la guía práctica adoptada por la Inflammation and Host Response to Injury (Glue Grant)35 recomiedan la NE precoz aunque sin indicar un momento específico de inicio. En 2011 Moisier et al.4, en 153 pacientes quemados, constataron que el 80% inició la NE precoz en las primeras 24horas, en tanto que el 95% lo hizo en las primeras 48horas. Por su parte, la NE precoz estuvo asociada a una reducción de la estancia en UCI (p=0,03) y de la infección de las heridas (p=0,01). Hasta el momento algunos estudios han mostrado que la NE muy precoz en las primeras 6-12horas es segura y capaz de modular la respuesta hipermetabólica, disminuyendo de modo significativo los niveles de catecolaminas, cortisol y glucagón, con un aumento concomitante de la producción de inmunoglobulinas32,34. Esta estrategia nutricional mantiene la integridad de la barrera intestinal, la motilidad y el flujo sanguíneo esplácnico; asimismo, tal cual fue demostrado por Vicic et al.36, la NE precoz se asocia a una reducción de las infecciones, con excepción de la neumonía nosocomial. Sin embargo, y de acuerdo con la evidencia actual la NE precoz en pacientes quemados, no siempre ha demostrado beneficios clínicos. En tal sentido, en 2015 Guo et al.37, en una revisión sistemática y metaanálisis incluyendo 6 ensayos clínicos aleatorizados (ECA) realizados en pacientes quemados críticos, evaluaron el impacto de la NE precoz sobre outcomes clínicos relevantes en pacientes quemados, tales como la tasa de infección de la herida, los tiempos de ventilación mecánica, el uso de antibióticos y la mortalidad. A pesar de que este estudio, a solicitud de los autores, fue eliminado de PubMed y del sitio electrónico de la revista, el análisis de los resultados no mostró beneficios clínicos de la NE precoz en pacientes adultos quemados críticos.
Con relación a la adecuación nutricional en el paciente quemado, en 2015 Sudenis et al.38, en una cohorte de 90 pacientes quemados con más del 10% de SCTQ, mostraron que al día uno posterior a la quemadura el aporte efectivo de calorías por vía enteral fue del 19%, en tanto que al día 14 fue del 91%, habiéndose iniciado la NE en una mediana de 9,5horas posteriores al ingreso.
Sin embargo, un aspecto relevante que puede limitar el uso de la vía enteral en el paciente quemado es la disfunción gastrointestinal y el fallo intestinal secundario al desarrollo de hipertensión abdominal, y eventualmente de un síndrome compartimental abdominal (SCA). En efecto, la enérgica reanimación con fluidos genera una reducción de la complacencia de la pared abdominal e íleo paralítico que pueden conducir al SCA. En tal sentido, la aparición de disfunción intestinal contraindica la vía enteral, siendo por lo tanto indicación de nutrición parenteral (NP)39. Con relación a la composición de la NP en el paciente quemado, el tipo de emulsión lipídica a utilizar ha sido evaluado en diferentes ensayos clínicos. En 2005 García de Lorenzo et al.40, en un ECA llevado a cabo en 22 pacientes quemados graves, evaluaron una emulsión que contenía aceite de oliva (ClinOleic® 20%, Baxter, Francia) en comparación con una emulsión 50/50 TCL:TCM (Lipofundina® 20%, B. Braun, Alemania). El grupo de pacientes que recibió la emulsión rica en oliva mostró menos alteraciones en los test de función hepática, aunque los parámetros de fase aguda, la tolerabilidad de la NP y el metabolismo de los ácidos grasos no mostraron diferencias. Por su parte, en 2008 Mateu-de Antonio et al.41, en un estudio de 2 cohortes retrospectivas, analizaron los efectos de una emulsión lipídica 100% soja (Intralipid® 20%, Fresenius Kabi, España) contra una emulsión de alternativa rica en oliva (ClinOleic® 20%, Baxter, España). El análisis de los resultados no mostró diferencias entre ambos grupos en la incidencia de infecciones, estancia en UCI y hospitalaria y en la mortalidad, aunque el valor pico de leucocitos se elevó (p=0,036) al final de la NP en la cohorte que recibió la emulsión lipídica rica en oliva41.
Requerimientos nutricionalesLos requerimientos nutricionales del paciente quemado grave son elevados debido al hipermetabolismo e hipercatabolismo severos. Por lo tanto, las directivas de la terapia nutricional se basan en la optimización del aporte calórico y proteico, lo cual ha permitido mejorar la sobrevida de estos pacientes. El requerimiento energético difiere en cada paciente, y de acuerdo al momento evolutivo después de la agresión térmica, tal cual fuera demostrado por Cunninghan42 en una revisión de estudios que utilizaron la calorimetría indirecta para evaluar GE basal. Es por ello que el mismo debe ser estimado de forma diaria e individualizada, preferiblemente mediante el uso de la calorimetría indirecta, la cual actualmente es considerada el estándar de oro. Sin embargo, este recurso no está siempre disponible en las unidades de quemados, lo cual hace que el uso de ecuaciones predictoras sea una práctica habitual. Por su parte, Rimdeika et al.43 han demostrado que el uso un valor predeterminado de 25-30kcal/kg de peso corporal es posible que resulte en hipoalimentación enteral, por lo que actualmente no es una estrategia recomendada.
Con relación al uso de las ecuaciones predictoras, la ecuación de Toronto (tabla 1) parece ser la más adecuada, ya que considera la variabilidad de los requerimientos energéticos a medida que evoluciona la enfermedad, en tanto que para niños quemados críticos la fórmula de Schoffield ha demostrado ser de elección44. En tal sentido, diversos estudios han mostrado que el incremento del GE es más pronunciado en las primeras etapas de la quemadura para luego disminuir de modo progresivo.
Ecuación predictivas de uso en pacientes quemados críticos adultos
| Ecuaciones predictivas para el cálculo de necesidades energéticas en el paciente quemado crítico |
| Ecuación de Toronto (resultado se aproxima a calorimetría indirecta) REE=(–4343+[10,5×% SCQ]+[0,23×ingesta calórica]+[0,84×Harris Benedict]+[114×temperatura rectal en °C]–[4,5×día posquemadura]) |
| Ecuación de Carlson REE=GEB×(0,89142+0,01335×SCTQ)×m2×FA |
| Ecuación de Harris-Benedict (el resultado debe multiplicarse por el factor de estrés [1,2 a 2,0]) |
| Hombres: 66.437+ (5.0033×altura [cm])+ (13.7516×peso [kg])–edad [años]) |
| Mujeres: 655,0955+ (1,8496×altura [cm])+(9,5634×peso [kg])– (4,6756×edad [años]) |
FA: factor de actividad de 1,25; GMB: gasto metabólico basal; m2: metros cuadrados de superficie corporal; REE: requerimientos energéticos estimados; SCTQ: superficie corporal total quemada.
En 2010 un análisis observacional retrospectivo en una población heterogénea de pacientes críticos que no incluía pacientes quemados demostró que la mortalidad a los 60 días era significativamente menor cuando a los 12 días los pacientes recibían un 80-85% de la meta calórica estimada45. Por su parte, más recientemente Nicolo et al.46, en un grupo de pacientes críticos de similares características, demostraron una disminución de la mortalidad cuando administraban más del 80% de la proteína prescrita al día 4 (odds ratio [OR]: 0,68; 95% intervalo de confianza [IC]: 0,50-0,91) y al día 12 (OR: 0,60; 95% IC: 0,39-0,93). Asimismo, los autores observaron que el tiempo hasta el alta hospitalaria vivo era menor cuando los pacientes recibieron ≥80% de la proteína prescrita (hazard ratio [HR]: 1,25; 95% CI: 1,04-1,49) al día 1246. En tal sentido, la optimización del aporte calórico y proteico se obtiene con la aplicación de un protocolo de adecuación nutricional. En pacientes quemados críticos Conrad et al.47 recientemente demostraron que la implementación de un algoritmo nutricional dirigido por el personal de enfermería se asociaba con un aporte del 100% de las calorías prescritas en el 85,4% de los días con relación al 61,6% en un grupo control retrospectivo que recibía NE; sin embargo, no hubo diferencias en la mortalidad, estancia en la UCI y en los días de ventilación mecánica entre los grupos.
Hidratos de carbonoLos hidratos de carbono (HC) deben ser aportados a una dosis de 4-5g/kg/día, no debiéndose superar un aporte de calorías de 1.400-1.500kcal/día como HC34 (tabla 2). Las dietas ricas en HC y proteínas favorecen la recomposición de la masa magra corporal mediante el aumento de la síntesis proteica y la liberación de insulina endógena48. Sin embargo, en aquellos pacientes quemados con al menos un 10% de SCTQ, la reducción del riesgo de neumonía nosocomial podría ser el único beneficio clínico con el uso de fórmulas enterales ricas en proteínas y HC y pobres en lípidos48.
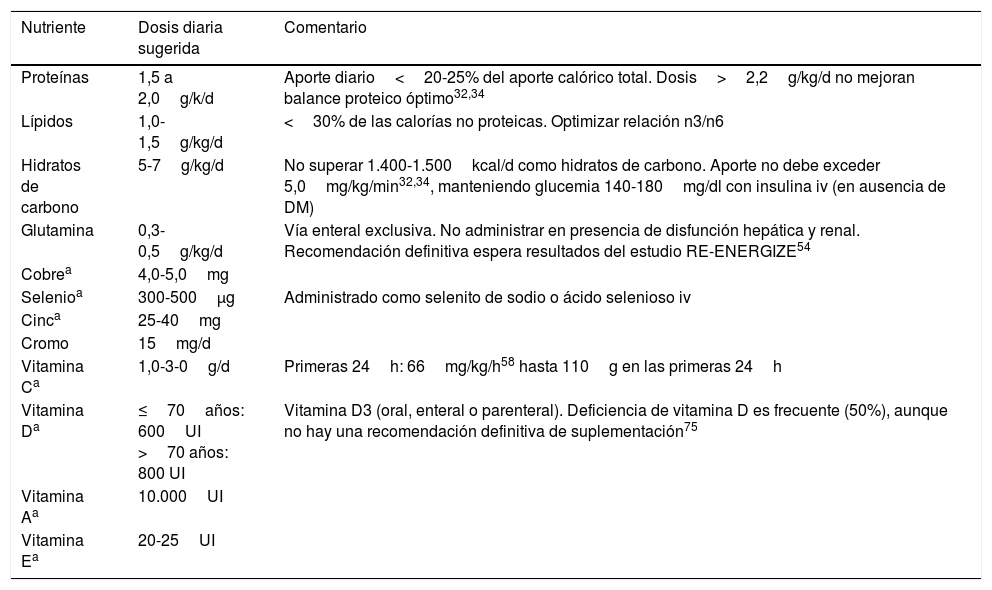
Recomendaciones actuales de los macro y micronutrientes en el paciente quemado crítico
| Nutriente | Dosis diaria sugerida | Comentario |
|---|---|---|
| Proteínas | 1,5 a 2,0g/k/d | Aporte diario<20-25% del aporte calórico total. Dosis>2,2g/kg/d no mejoran balance proteico óptimo32,34 |
| Lípidos | 1,0-1,5g/kg/d | <30% de las calorías no proteicas. Optimizar relación n3/n6 |
| Hidratos de carbono | 5-7g/kg/d | No superar 1.400-1.500kcal/d como hidratos de carbono. Aporte no debe exceder 5,0mg/kg/min32,34, manteniendo glucemia 140-180mg/dl con insulina iv (en ausencia de DM) |
| Glutamina | 0,3-0,5g/kg/d | Vía enteral exclusiva. No administrar en presencia de disfunción hepática y renal. Recomendación definitiva espera resultados del estudio RE-ENERGIZE54 |
| Cobrea | 4,0-5,0mg | |
| Selenioa | 300-500μg | Administrado como selenito de sodio o ácido selenioso iv |
| Cinca | 25-40mg | |
| Cromo | 15mg/d | |
| Vitamina Ca | 1,0-3-0g/d | Primeras 24h: 66mg/kg/h58 hasta 110g en las primeras 24h |
| Vitamina Da | ≤70años: 600UI >70 años: 800 UI | Vitamina D3 (oral, enteral o parenteral). Deficiencia de vitamina D es frecuente (50%), aunque no hay una recomendación definitiva de suplementación75 |
| Vitamina Aa | 10.000UI | |
| Vitamina Ea | 20-25UI |
DM: diabetes mellitus; iv: intravenosa; UI: unidades internacionales.
La proporción de grasas debe estar en torno a 15-18%, no superando el 20-30% del aporte total calórico no-proteico (1,0-1,5g/kg/día)34. La mayor fuente de lípidos son los ácidos grasos omega-6 (efecto proinflamatorio). En pacientes quemados las fórmulas enterales ricas en ácidos grasos omega-3, como el ácido eicosapentaenoico, ácido γ-linolenico y micronutrientes antioxidantes no han sido evaluadas. Por otra parte, la suplementación de omega-3 como estrategia inmunonutriente única ha demostrado efectos beneficiosos, tales como modulación de la respuesta inflamatoria, mejor tolerancia a la glucosa y menor riesgo de infecciones; en efecto, Tihista et al.49, en 92 pacientes quemados con una SCTQ>15% y daño inhalatorio compararon los efectos de una fórmula enteral con 50% de los lípidos como omega-3 vs. una fórmula convencional pobre en grasas (18% del aporte energético). El análisis de los resultados mostró que aquellos pacientes que recibieron la dieta rica en omega-3 exhibieron menos episodios de sepsis y shock séptico, así como una mejor tolerancia a la NE.
ProteínasLos pacientes quemados graves tienen requerimientos proteicos un 50% mayores con relación a los individuos sanos en ayunas, por lo que el requerimiento proteico debe ser no menor al 20-25% del aporte calórico total (>1,5 a 2,0g/k/día)34 (tabla 2). Sin embargo, el aporte proteico óptimo en estos pacientes aún no ha sido definitivamente establecido.
Nutrientes específicos: glutaminaLa glutamina, un aminoácido condicionalmente esencial en la enfermedad crítica, ha sido un tópico de debate en los últimos años. En 2001 Oudemans-van Straaten et al.50, en una cohorte de 80 pacientes quirúrgicos críticos, demostraron que niveles de glutamina plasmática inferiores a 0,42mmol/l se asociaban a mayor mortalidad. Sin embargo, más recientemente Heyland et al.51 no fueron capaces de demostrar una deficiencia de glutamina en presencia de 2 o más disfunciones orgánicas.
En 2013 el estudio Reducing Death due to Oxidative Stress, un ECA multicéntrico, internacional (n=1.223) administró glutamina y antioxidantes siguiendo un esquema factorial de tipo 2×251. Los pacientes suplementados con glutamina recibieron una dosis de 0,35g/kg/día (Dipeptiven®, Fresenius Kabi, Alemania) por vía parenteral y 30g/día adicionales por vía enteral. El análisis de los resultados mostró que el aporte de altas dosis de glutamina aumentaba la mortalidad hospitalaria en presencia de disfunción orgánica. Más recientemente, Van Zanten et al.52, en 300 pacientes críticos médicos y quirúrgicos, administraron una dieta enteral rica en glutamina, ácidos grasos omega-3 y antioxidantes vs. una dieta enteral con alto contenido proteico. En los pacientes críticos médicos la dieta rica en glutamina estuvo asociada con una mayor mortalidad a los 6 meses (53,7% vs. 34,5% en el grupo control, p=0,044).
Hasta el momento actual han sido publicados escasos ECA evaluando el aporte de dipéptidos de glutamina en pacientes quemados críticos. En 2013 Lin et al.53, tras agregar 4 ECA (n=155) demostraron que la administración de glutamina podía asociarse con una reducción en la incidencia de bacteriemias por gram negativos (OR: 0,27, 95% IC: 0,08-0,92, p=0,04) y de la mortalidad hospitalaria (OR=0,13, 95% IC: 0,03-0,51, p=0,004). Más recientemente van Zanten et al. 54, después incluir 6 ECA (n=225) demostraron un efecto positivo de la glutamina enteral en la sobrevida (risk ratio [RR]: 0,22, 95% IC: 0,07-0,62, p=0,005), así como una reducción significativa en el tiempo de estancia hospitalaria (weighted mean difference, expresada en días: 6,06, 95% IC: 9,91-2,20, p=0,002), aunque ningún efecto sobre las infecciones nosocomiales pudo ser demostrado54.
Actualmente, Heyland et al.55 están llevando a cabo el estudio RandomizEd trial of ENtERal Glutamine to minimIZE thermal injury (RE-ENERGIZE, NCT00985205), un ECA multicéntrico, pragmático, doble ciego que incluirá 2.700 pacientes quemados graves tratados con glutamina enteral (0,5g/kg/d) o placebo. Este ECA que se está realizando en más de 60 unidades de quemados de Canadá, EE. UU., Europa y América Latina tiene como objetivo primario evaluar la sobrevida hospitalaria; por su parte, son objetivos secundarios la incidencia de bacteriemias nosocomiales por bacilos gram negativos, estancia en UCI y hospitalaria, así como calidad de vida posterior a la quemadura, siendo sus resultados esperados para el año 2021.
Micronutrientes antioxidantesElementos traza: cócteles antioxidantesLos trabajos pioneros del grupo suizo liderado por Berger30,31 en pacientes quemados han sugerido que el aporte de cócteles antioxidantes era capaz de disminuir la incidencia de complicaciones infecciosas. En este sentido, en 2006, después de agregar 2 ECA (n=41), Berger et al.30 constataron que el aporte de Cu 2,5 a 3,1mg/d, Se 315 a 380μg/d y Zn 26,2 a 31,4mg/d durante 8 a 21 días se asociaba a una reducción de la incidencia de neumonía nosocomial. Posteriormente, el mismo grupo demostró que el aporte parenteral de un cóctel antioxidante con Cu, Se y Zn durante 14 a 21 días era capaz de mejorar el estatus antioxidante y los niveles plasmáticos y cutáneos de Se y Zn asociado a una menor incidencia de neumonía31.
En 2015 Kurmis et al.56 demostraron que la administración parenteral de Cu, Se y la suplementación de Zn por vía enteral y parenteral combinadas fue capaz de disminuir la estancia hospitalaria. Sin embargo, la evidencia actual con relación al efecto sobre el estatus antioxidante con la suplementación de micronutrientes antioxidantes en el paciente quemado es aún controvertida. En tal sentido, recientemente Raposio et al.57, en un pequeño ECA (n=20), demostraron que el aporte enteral de escualeno 100mg, vitamina C 30mg, coenzima Q10 10mg, Zn 5mg, β-caroteno 3,6mg, bioflavonoides 30mg y Se 55μg durante 2 semanas no mejoraba la capacidad antioxidante del plasma. Con relación a la duración del tratamiento antioxidante, la misma depende de la SCTQ; en efecto, una SCTQ del 20-40% requiere un aporte de 7 a 8 días, en tanto que 2 semanas son recomendadas para una SCTQ del 40% al 60% y de 30 días cuando la misma es mayor al 60%57.
VitaminasLa vitamina C tiene un reconocido efecto protector endotelial mediante la prevención de la desfosforilación de la ocludina y el daño de la unión estrecha, con lo cual disminuye la hiperpermeabilidad capilar y mejora el flujo en la microcirculación58. De acuerdo al conocimiento actual una dosis diaria de 3g/d (30 veces superior a la dosis diaria recomendada) durante un período de 3-6 días sería necesaria para reestablecer los niveles de vitamina C en el período posterior a la agresión. En el año 2000 Tanaka et al.59 demostraron que altas dosis de vitamina C por vía parenteral durante la fase de reanimación inicial (0,66mg/kg/h por 24 horas) eran capaces de disminuir los requerimientos de fluidos, el edema tisular y la ganancia de peso corporal, así como los días de ventilación mecánica. En 2012 Khan et al.60, en una revisión retrospectiva de 40 pacientes quemados críticos con más del 20% de SCTQ, demostraron que en estos pacientes la administración de altas dosis de vitamina C era capaz de disminuir los requerimientos de fluidos, con aumento del gasto urinario. Asimismo, estos autores demostraron que el uso de megadosis de vitamina C era seguro sin aumentar el riesgo de fallo renal60.
La terapia nutricional estándar parece ser insuficiente para corregir los niveles de 25 dihidroxivitamina D en el paciente quemado crítico, por lo que dosis más elevadas deberían ser consideradas tal cual fuera sugerido por Mayes et al.61. Sin embargo, hasta el momento actual un escaso número de ECA han evaluado la suplementación con altas dosis de vitamina D por vía oral, enteral y parenteral en pacientes críticos no quemados. En 2016 2 revisiones sistemáticas y metanálisis evaluaron la suplementación de vitamina D en UCI (Putzu et al.62 y Weng et al.63; en el presente año Langlois et al.64 después de agregar 6 ECA [n=695]) y no encontraron diferencias en la mortalidad, estancia en UCI o hospitalaria, ni en los días de ventilación mecánica. El análisis de subgrupos demostró que el uso de dosis mayores a 300.000UI/d podía estar asociado con una tendencia hacia la reducción de la mortalidad (p=0,12) y de la estancia en UCI (p=0,12)64.
En pacientes quemados adultos la suplementación de vitamina D3 y calcio ha sido realizada fuera del período crítico de la enfermedad. En tal sentido, Rousseau et al.65 demostraron que en estos pacientes la hipovitaminosis D y la osteopenia son frecuentes, en tanto que la administración de altas dosis de vitamina D después del alta de la UCI estaba asociada con mejoría de la fuerza muscular del cuádriceps. Por su parte, en el presente año, Ebid et al.66 en 48 niños quemados demostraron que el aporte de vitamina D3 de modo concomitante con un plan de entrenamiento fue capaz de mejorar la fuerza muscular, la masa magra corporal y los niveles séricos de vitamina D.
Probióticos y simbióticosLa enfermedad crítica se caracteriza por un sobrecrecimiento de bacterias patógenas con una disminución concomitante de las denominadas «bacterias promotoras de salud» (Lactobacillus y Bifidobacterium) del microbioma, fenómeno conocido como disbiosis67. Con el objetivo de reestablecer el balance bioecológico intestinal, el aporte de probióticos y simbióticos ha sido una estrategia probada en diversas poblaciones de pacientes críticos. Recientemente, Manzanares et al.68, tras agregar 30 ECA en pacientes adultos críticos no quemados, demostraron que el uso de probióticos era capaz de disminuir la incidencia de infecciones adquiridas en la UCI (RR: 0,80; 95% IC: 0,68-0,95, p=0,009) y de neumonía asociada a la ventilación mecánica (RR: 0,74; 95% IC: 0,61-0,90, p=0,002). Sin embargo, en pacientes quemados el uso de probióticos ha sido escasamente estudiado; en tal sentido, en 2015 Mayes et al.69 en 20 niños quemados críticos administraron Lactobacillus gorbach goldin vs. placebo a una dosis diaria de 2×105UFC/ml dentro de los 10 días posteriores del ingreso en la UCI. Los resultados del estudio no mostraron beneficios clínicos en términos de reducción de infecciones, uso de antibióticos o tolerancia digestiva69.
Por lo expuesto, la evidencia actual sobre probióticos no deriva de estudios realizados en pacientes quemados críticos. Asimismo, las actuales recomendaciones no hacen referencia al momento de inicio ni al tipo de probiótico a utilizar, con la única excepción de Saccharomyces boulardii67. En tal sentido, el 40% de las infecciones invasivas (fungemias y endocarditis infecciosa) por Saccharomyces han sido reportadas en pacientes donde Saccharomyces boulardii ha sido administrado como probiótico70, habiéndose descrito la fungemia en pacientes quemados como complicación de su uso71. Por consiguiente, Saccharomyces boulardii no es considerado un probiótico en pacientes críticos y no debe ser administrado en los pacientes quemados graves.
En virtud de lo expuesto, la ecoinmunonutrición con probióticos y simbióticos en pacientes quemados aún no puede ser recomendada, siendo necesaria la realización de nuevos ensayos clínicos bien diseñados en esta población de pacientes críticos.
Estrategias farmacológicas moduladoras del hipermetabolismo e hipercatabolismoDurante las últimas décadas han sido probadas diversas estrategias farmacológicas (no nutricionales) tendientes a reducir el catabolismo y/o mejorar el anabolismo en el paciente quemado grave32,34. En tal sentido, los fármacos investigados han sido diversas hormonas anabólicas tales como la hormona de crecimiento, insulina, oxandrolona, testosterona, el insulin-like growth factor-1 y asociaciones de este y el insulin-like growth factor-binding protein 3, así como ciertos fármacos tales como la metformina y el propranolol. Dentro de las estrategias anteriormente citadas, el bloqueo del estímulo betaadrenérgico ha sido la terapéutica más estudiada y la reconocida por el consenso de la American Burn Association de 201372 como la más adecuada en el control de la respuesta metabólica al estrés en estos pacientes. Ello es debido a que durante la quemadura se observa un incremento significativo en el tenor de catecolaminas, con niveles hasta 10 veces el valor basal, lo que en parte explica el aumento de la tasa metabólica basal. El uso de propranolol, un agente bloqueador beta no específico, es capaz de atenuar la hiperactividad simpática reduciendo la termogénesis y el GE en reposo73. Por otra parte, disminuye la lipólisis periférica y aumenta la eficiencia de la síntesis proteica, promoviendo una mejor cinética proteica en el músculo esquelético con mejoría del balance proteico neto, el cual ha sido demostrado que aumenta hasta en un 82%73. Asimismo, Williams et al.74 demostraron que el propranolol a 4mg/kg/d disminuye el gasto y el trabajo cardíaco, así como la frecuencia cardíaca, sin afectar la presión arterial media en el período posquemadura. Por su parte, Barrow et al.75 en niños quemados con más del 40% de la SCTQ demostraron que la administración de propranolol evitaba la aparición de hepatomegalia, lo cual es secundario a una reducción en la captación hepática de ácidos grasos libres. En 2014, en una interesante revisión sistemática de la literatura, Núnez-Villaveirán et al.76 identificaron 15 ECA evaluando los efectos del propranolol en pacientes quemados mayoritariamente pediátricos y adolescentes. El análisis de estos ensayos clínicos muestra que el rango de dosis utilizado con el objetivo de reducir en 15-20% el valor inicial de la frecuencia cardíaca, ha variado entre 4-6mg/kg/d administrados por vía oral, enteral o parenteral.
Más recientemente Flores et al.77 publicaron los resultados de una nueva revisión sistemática y metaanálisis incluyendo 10 estudios de los cuales 9 eran ECA, incluyendo 1.062 pacientes. Los hallazgos más significativos de este metaanálisis demostraron que el uso de propranolol se asocia a una reducción significativa del GE basal (Hedges’ g=–0,64, 95% IC: –0,8 a –0,5; p<0,001), de la grasa abdominal (g=–0,3, 95% IC: –0,4 a –0,1; p<0,001), así como un aumento de la masa magra periférica (g=–0,45; 95% IC: –0,3, –0,6; p<0,001). Por su parte, los autores observaron que el propranolol fue una terapéutica iniciada entre las 48horas y el día 12 después del daño, que se mantenía por tiempos variables entre 10 días y 12 meses con una media de 21 días, habiendo demostrado ser una estrategia segura77.
El uso de oxandrolona (0,1mg/kg cada12h durante tiempos variables de 6 a 12 meses) ha demostrado efectos beneficiosos en términos de estancia hospitalaria78, ganancia de peso corporal, fuerza y masa muscular, curación de heridas y del metabolismo óseo79; estos efectos han sido particularmente descritos en niños quemados durante la fase aguda y de rehabilitación.
Actualmente, el estudio Assessment of the Treatment of Severely Burned With Anabolic Agents on Clinical Outcomes, Recovery and Rehabilitation (NCT00675714)80, desarrollado por la University of Texas Medical Branch, se propone incluir 1.100 pacientes, en los cuales evalúa el uso precoz de propranolol, oxandrolona, hormona del crecimiento recombinante y ketoconazol como estrategia única o combinada.
ConclusionesEl paciente gran quemado es un modelo de malnutrición aguda con intenso hipermetabolismo e hipercatabolismo. La correcta evaluación de los requerimientos, adecuando el aporte energético y proteico según el momento evolutivo, ha logrado mejorar el pronóstico de estos enfermos. De acuerdo al conocimiento actual, la nutrición enteral precoz es de elección; asimismo, durante la fase de reanimación el paciente quemado debe recibir altas dosis de vitamina C, así como suplementos de cócteles antioxidantes por vía parenteral, los que deben ser administrados por períodos de tiempo variable según la SCTQ. Asimismo, el aporte de glutamina enteral parece ser una estrategia segura capaz de optimizar la terapéutica, aunque es necesaria evidencia más robusta que avale su uso. Finalmente, el uso de estrategias no nutricionales moduladoras del hipermetabolismo y del hipercatabolismo, en particular propranolol y oxandrolona, han demostrado beneficios clínicos en la población de pacientes quemados graves.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses que declarar con relación al presente manuscrito.