El shock cardiogénico (SC) se caracteriza por la presencia de un estado de hipoperfusión tisular secundario a disfunción ventricular. La monitorización hemodinámica nos permite obtener información acerca de la fisiopatología cardiovascular que nos ayudará a realizar el diagnóstico y guiar la terapéutica en las situaciones de SC. El sistema de monitorización más utilizado en el SC es el catéter de arteria pulmonar, puesto que proporciona variables hemodinámicas clave en el SC, como son el gasto cardíaco, la presión de arteria pulmonar y la presión de oclusión de arteria pulmonar. Por otro lado, la ecocardiografía permite obtener, a pie de cama, datos anatómicos y hemodinámicos que complementan la información obtenida mediante los dispositivos de monitorización continua.
La monitorización del SC puede considerarse multimodal e integradora al incluir parámetros hemodinámicos, metabólicos y ecocardiográficos que permiten describir las características del SC y guiar las intervenciones terapéuticas durante la reanimación hemodinámica.
Cardiogenic shock (CS) is characterized by the presence of a state of tissue hypoperfusion secondary to ventricular dysfunction. Hemodynamic monitoring allows us to obtain information about cardiovascular pathophysiology that will help us make the diagnosis and guide therapy in CS situations. The most used monitoring system in CS is the pulmonary artery catheter since it provides key hemodynamic variables in CS, such as cardiac output, pulmonary artery pressure, and pulmonary artery occlusion pressure. On the other hand, echocardiography makes it possible to obtain, at the bedside, anatomical and hemodynamic data that complement the information obtained through continuous monitoring devices.
CS monitoring can be considered multimodal and integrative by including hemodynamic, metabolic, and echocardiographic parameters that allow describing the characteristics of CS and guiding therapeutic interventions during hemodynamic resuscitation.
Desde el punto de vista fisiopatológico, el fenómeno primario que tiene lugar en el shock cardiogénico (SC) es una disfunción ventricular con bajo gasto cardíaco (GC) que conduce a un estado de hipoperfusión tisular y fracaso multiorgánico1,2. A esta disfunción cardíaca se añaden otras alteraciones, como son fenómenos inflamatorios, de isquemia y alteraciones del tono vascular2. La complejidad de las manifestaciones clínicas y hemodinámicas del SC es secundaria a estos componentes fisiopatológicos, así como a la etiología y a los mecanismos subyacentes, la gravedad del shock y el tipo de afectación ventricular1-5.
La monitorización hemodinámica constituye una ayuda valiosa en el proceso de reanimación del SC porque proporciona datos hemodinámicos que ayudan a describir las características y la gravedad del shock. Además, permite detectar y monitorizar de manera precisa la disfunción orgánica y la oxigenación tisular. En última instancia, sirve como guía para la optimización de fármacos vasopresores e inotrópicos y proporciona información para decidir la instauración de soporte mecánico. Es preciso señalar que la monitorización ha demostrado ser particularmente útil en las fases precoces de la reanimación hemodinámica y, sin embargo, su utilidad es menor cuando el fallo orgánico está establecido4,5.
Las recomendaciones internacionales enfatizan el inicio de una monitorización hemodinámica básica en las primeras horas del shock. Por otra parte, en aquellos pacientes con insuficiente respuesta a las medidas aplicadas durante las primeras 3-6horas o en pacientes con situaciones complejas de shock, en las que podríamos precisar un mayor conocimiento de la fisiopatología del proceso, nos plantearemos un mayor grado de monitorización hemodinámica continua1,4,5 que nos permitirá optimizar nuestras intervenciones, cuantificar sus efectos y evitar complicaciones derivadas de los tratamientos aplicados. La ecocardiografía también proporciona datos anatómicos y hemodinámicos que complementan la información obtenida por los dispositivos de monitorización continua.
Monitorización hemodinámica básicaPresión arterialLa medición de la presión arterial (PA) es uno de los métodos de monitorización de la perfusión de los órganos más clásico6. En el paciente crítico se recomienda la medición invasiva para mejorar la fiabilidad y la precisión de las medidas. La monitorización de la PA permite también obtener la variación de presión de pulso (VPP), aunque su utilidad y la de otros parámetros dinámicos de respuesta a volumen en el SC no está bien establecida7.
Las cifras tensionales que se han considerado mínimas para mantener la autorregulación en el paciente en SC no están del todo consensuadas, y la recomendación de alcanzar una PA media (PAM) de 65mmHg procede de extrapolar los resultados obtenidos en otros tipos de shock. Algunos estudios señalan que probablemente la disfunción orgánica comience con PAM<75-80mmHg6,8. En la misma línea, otros trabajos sobre pacientes en SC de causa isquémica demuestran que el aumento de PAM a 80mmHg se asocia a mejores valores de índice cardíaco (IC) y de saturación venosa central (ScvO2)9. En este sentido, un estudio encontró que aquellos pacientes que presentaron en las primeras 24horas tras el SC de origen isquémico una PAM de 85-100mmHg tuvieron mejor supervivencia que aquellos que fueron tratados con PAM<65mmHg10. Otros, sin embargo, fracasan en intentar demostrar una mejoría de la perfusión con el aumento de la PAM mediante el uso de noradrenalina11. Ante la falta de una clara evidencia sobre el valor de la PAM objetivo, parece razonable alcanzar una PAM entre 65-70mmHg.
Presión venosa centralLa presión venosa central (PVC) es una variable compleja que refleja la presión en la aurícula derecha (PAD), así como la precarga del ventrículo derecho (VD), y puede estimar el grado de congestión de órganos extratorácicos. Aunque su fiabilidad para representar la respuesta del paciente a volumen es controvertida, proporciona una información interesante sobre las tendencias del estado de volemia12. La PVC puede ser útil en la distinción del fallo orgánico relacionado con congestión más que con hipoperfusión tisular. Además, es un indicador precoz de disfunción de VD, por lo que es importante su medición de forma continua en pacientes en SC13. De hecho, en pacientes en SC con soporte mecánico del ventrículo izquierdo (VI), una PVC >12mm Hg marca una disfunción de VD, la cual se asocia a mayor mortalidad14.
Parámetros de oxigenación tisular y perfusión periférica- -
SvcO2o saturación venosa mixta (SvO2). Estas variables reflejan la relación entre la demanda y el aporte de oxígeno, por lo que un descenso en sus valores indica una disponibilidad insuficiente4. El SC condiciona una mayor tasa de extracción de oxígeno por parte de las células, con el consecuente descenso de las saturaciones venosas. Estos parámetros pueden verse alterados antes que el aumento del lactato, lo que permite, por tanto, identificar precozmente la hipoxia tisular. Valores excesivamente elevados podrían también ser indicativos de incapacidad celular para la extracción de oxígeno y fallo celular6.
- -
Lactato. Es un metabolito resultante del metabolismo anaerobio con un valor normal de 1mEq/l, y se ha evidenciado que pequeñas elevaciones se asocian a un aumento de la mortalidad. Este incremento puede deberse a un aumento de la producción o bien a un descenso del aclaramiento15. El paradigma predominante defiende que la hiperlactatemia es secundaria a la aparición de una glucólisis anaeróbica inducida por la hipoperfusión tisular. Sin embargo, algunos estudios proponen que este aumento en la generación de lactato sería también secundario al aumento en la producción aeróbica, independientemente del aclaramiento, probablemente por la estimulación adrenérgica16. De modo que la elevación de los niveles de lactato sería secundaria tanto a una situación de bajo gasto e hipoperfusión como al estrés adrenérgico.
La clasificación de la Society for Cardiovascular Angiography and Intervention (SCAI) del SC utiliza el lactato como elemento clave en la identificación y estratificación de este tipo de pacientes. Existen, incluso, protocolos hospitalarios del manejo del SC que utilizan, entre otros parámetros, el lactato para la escalada del tratamiento17.
Hay que tener en cuenta que los niveles de lactato no son estáticos, sino que presentan una evolución en el tiempo, por lo que se ha postulado que la valoración de ese cambio de concentración en la evolución podría mejorar su capacidad pronóstica y podría aportar más información que la medición puntual para guiar el tratamiento16,18.
Existen varios trabajos que han profundizado en el uso del lactato como marcador pronóstico y de gravedad en el SC. En el subanálisis del ensayo IABP-SHOCKII realizado por Fuernau et al.19 se identificó que los valores de lactato a las 8horas de ingreso tuvieron mejor valor pronóstico de mortalidad que los valores basales y el aclaramiento medido durante las primeras 8horas. A su vez, el valor de 3,1mEq/l a las 8horas de ingreso fue el mejor indicador pronóstico en los pacientes en SC19. En un estudio derivado del ensayo DOREMI se encontró que el aclaramiento de lactato fue un buen marcador pronóstico y permitió guiar el manejo terapéutico20. En otro trabajo, procedente del estudio Cardshock15, los autores concluyeron que los niveles de lactato basales, a las 6, 12 y 24horas de evolución, fueron predictores de mortalidad, así como el descenso del lactato durante las 24 horas.
- -
GapCO2. Este parámetro de hipoperfusión tisular corresponde a la diferencia veno-arterial de pCO2 (P(v-a)CO2)21,22. En situaciones de bajo GC, el aumento de la producción de CO2 anaeróbico junto con una estasis del flujo venoso generan un aumento de la diferencia del GapCO2; valores >6mmHg se asocian a situaciones de hipoperfusión tisular23,24. En relación con los pacientes en SC, la evidencia científica es escasa. Un estudio realizado en esta población de pacientes para valorar la cinética del GapCO2 identificó que las determinaciones al ingreso, a las 6, 12, 24 y 48horas del GapCO2 fueron más elevadas, aunque sin diferencia estadística, en el grupo de no supervivientes en comparación con los supervivientes21. Asimismo, estos autores hallaron que un valor de GapCO2 <6mmHg a las 12horas de ingreso permitía detectar a los pacientes con bajo riesgo de muerte intrahospitalaria. Del mismo modo, encontraron que aquellos pacientes con valores de GapCO2 más elevados fueron identificados como SC refractario21. En otro estudio realizado en una población de pacientes con shock poscardiotomía se encontró que los valores de GapCO2 se relacionaban mejor con el pronóstico que la SvcO2 o los niveles de lactato. Además, se demostró una correlación entre el IC y el GapCO2, lo que llevó a los autores a afirmar que la identificación de pacientes con GapCO2 elevado podría ayudar a reconocer a aquellos pacientes con estados de bajo GC22. En estudios realizados en población de pacientes en SC y asistencia mediante membrana de oxigenación extracorpórea veno-arterial se ha evidenciado mejor supervivencia en aquellos con valores de GapCO2 <6mmHg en las primeras 24horas desde el implante del dispositivo25.
- -
Tiempo de relleno capilar (TRC) y livideces. La evaluación de la perfusión periférica incluye signos clínicos, como el TRC y las livideces. Estos signos son fácilmente evaluables a pie de cama, easy to use, easy to learn, y parecen estar relacionados con la gravedad de la disfunción orgánica y la evolución clínica, independientemente de la hemodinámica sistémica26. Se ha evidenciado que estos marcadores de perfusión periférica, junto con el GapCO2, están asociados con las alteraciones del flujo a nivel microcirculatorio en el shock séptico27. Múltiples estudios han demostrado que en el SC también existe afectación de la macro y la microcirculación, por lo que estos marcadores podrían ser útiles en esta situación26-28.
En este sentido, estudios recientes han evaluado estos parámetros en el SC. El FRENSHOCK29, registro observacional multicéntrico, evidenció la presencia de livideces en el 39% de los pacientes en SC en el momento de ingreso. Estos pacientes presentaron mayor mortalidad a los 30días (31% vs 23%, p=0,031) y al año (54 vs 42%, p=0,003) comparados con aquellos sin livideces. Por otro lado, Merdji et al.30 encontraron que un TRC>3s se asociaba con una mortalidad mayor a los 90días (HR: 10,50; IC95%: 2,48-45,3) en una población de pacientes en SC.
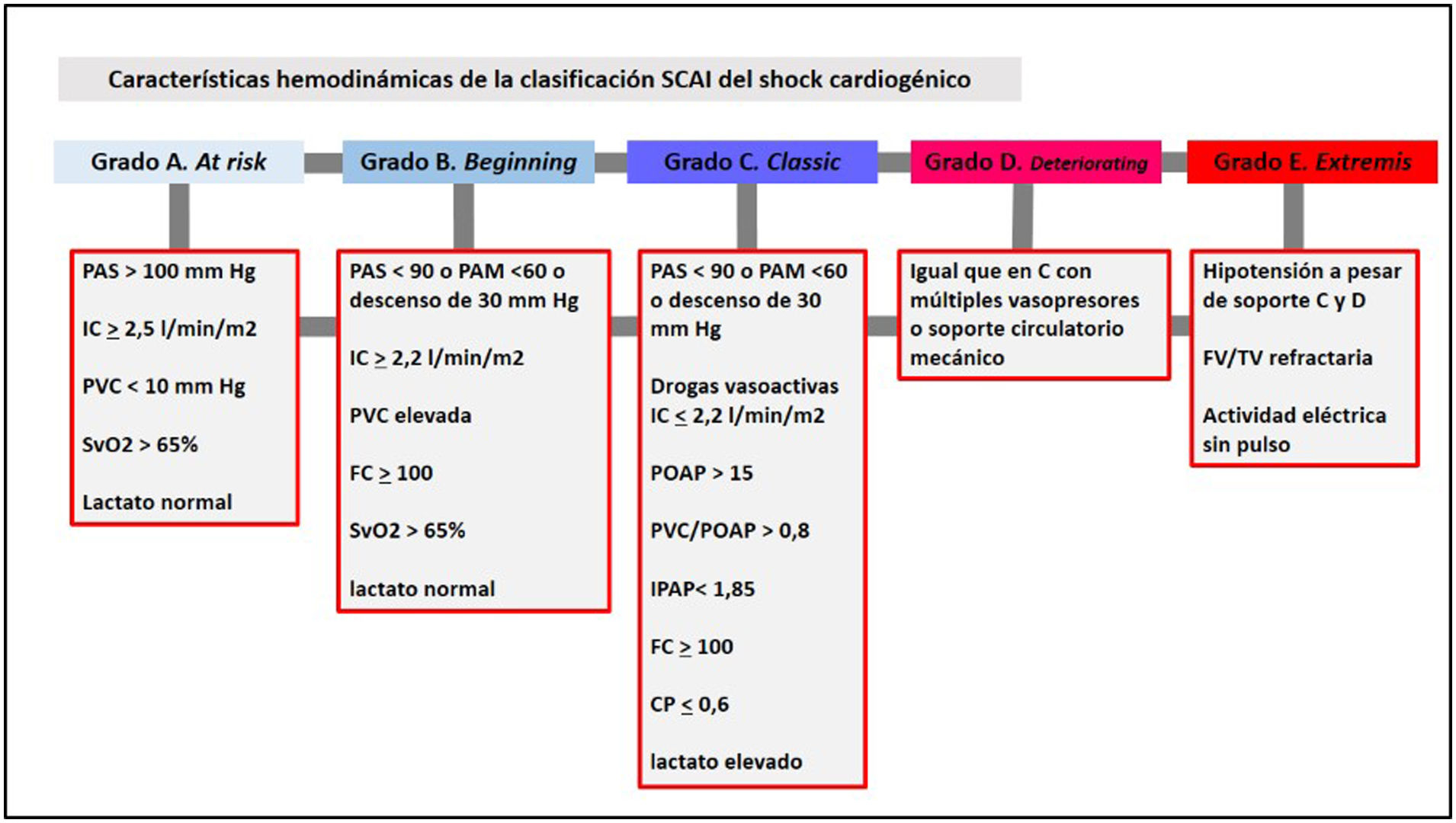
El sistema de monitorización hemodinámica avanzada más utilizado en el SC es el catéter de arteria pulmonar (CAP). Su introducción por Swan y Ganz en 1970 revolucionó la monitorización de la medicina intensiva. El CAP ha permitido profundizar en el conocimiento de la función cardiovascular del paciente crítico, al proporcionar el cálculo del GC por termodilución, la presión de arteria pulmonar (PAP), la presión de oclusión de arteria pulmonar (POAP) y parámetros de transporte/consumo de oxígeno (DO2 y VO2)4,5. El CAP ha sido utilizado para definir SC (índice cardíaco ≤2,2l/min/m2 y POAP≥15mmHg en el caso de disfunción ventricular izquierda) o para establecer patrones hemodinámicos clásicos (hipovolemia, edema agudo de pulmón, shock cardiogénico, shock obstructivo, etc.)31. La reciente clasificación de la SCAI32 describe cinco estadios de gravedad del SC que incluyen diferentes parámetros hemodinámicos (fig. 1).
Características hemodinámicas de la clasificación de la Society for Cardiovascular Angiography and Intervention (SCAI)17 del shock cardiogénico.
CP: potencia cardíaca; FC: frecuencia cardíaca; FV: fibrilación ventricular; IC: índice cardíaco; IPAP: índice de pulsatilidad de la arteria pulmonar; PAM: presión arterial media; PAS: presión arterial sistólica; POAP: presión de oclusión de arteria pulmonar; PVC: presión venosa central; SvO2: saturación venosa mixta de oxígeno.
El CAP puede ser una herramienta útil para el manejo de condiciones circulatorias complejas en las que se considera de especial importancia el conocimiento de la PAP, la POAP y los parámetros de oxigenación tisular (p.ej., fallo derecho e izquierdo agudo, hipertensión pulmonar, pacientes sometidos a cirugía cardíaca, con soporte mecánico o pendientes de trasplante cardíaco)1,4,5,33.
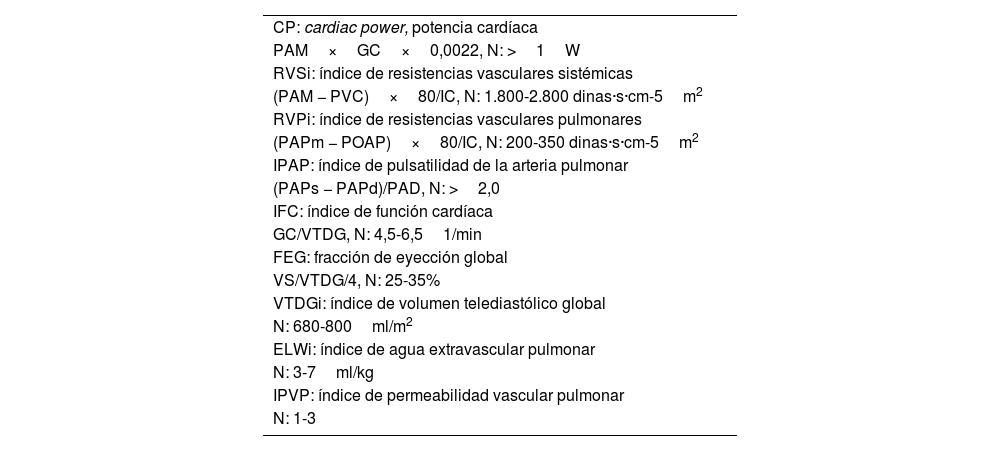
Por otro lado, el CAP permite calcular otros parámetros hemodinámicos relevantes, entre los que destacan el cardiac power (CP) y el índice de pulsatilidad de la arteria pulmonar (IPAP) (tabla 1):
- -
CP. El corazón puede ser considerado como una bomba mecánica capaz de generar energía hidráulica que puede expresarse como potencia cardíaca, definida como el producto del flujo y la presión generados por el corazón. Por lo tanto, el CP es el producto del GC y la PAM (CP: GC×PAM×0,0022). Diversos estudios han encontrado que el CP está asociado con el pronóstico de los pacientes en situación de SC34-36. En concreto, un CP ≤0,53 fue el mayor predictor independiente de mortalidad hospitalaria en pacientes con infarto agudo de miocardio (IAM) complicado con SC del registro SHOCK35. El CP puede obtenerse mediante cualquier sistema de monitorización hemodinámica que proporcione el GC o mediante ecocardiografía.
- -
IPAP. Refleja los componentes del sistema del VD: sistema venoso, función del VD y circulación pulmonar relacionando la presión de pulso de arteria pumonar y la PAD. Se calcula mediante la fórmula: (presión arterial pulmonar sistólica −presión arterial pulmonar diastólica) /PAD. Este parámetro puede ser utilizado como predictor de fallo ventricular derecho tras la colocación de una asistencia ventricular izquierda. Además, se ha objetivado un alto valor predictivo de mortalidad hospitalaria en pacientes con IAM de VD33,37,38.
Parámetros hemodinámicos
| CP: cardiac power, potencia cardíaca |
| PAM×GC×0,0022, N: >1W |
| RVSi: índice de resistencias vasculares sistémicas |
| (PAM − PVC)×80/IC, N: 1.800-2.800 dinas·s·cm-5m2 |
| RVPi: índice de resistencias vasculares pulmonares |
| (PAPm − POAP)×80/IC, N: 200-350 dinas·s·cm-5m2 |
| IPAP: índice de pulsatilidad de la arteria pulmonar |
| (PAPs − PAPd)/PAD, N: >2,0 |
| IFC: índice de función cardíaca |
| GC/VTDG, N: 4,5-6,51/min |
| FEG: fracción de eyección global |
| VS/VTDG/4, N: 25-35% |
| VTDGi: índice de volumen telediastólico global |
| N: 680-800ml/m2 |
| ELWi: índice de agua extravascular pulmonar |
| N: 3-7ml/kg |
| IPVP: índice de permeabilidad vascular pulmonar |
| N: 1-3 |
ELWi: índice de agua extravascular pulmonar; GC: gasto cardíaco; IPVP: índice de permeabilidad vascular pulmonar; PAD: presión aurícula derecha; PAM: presión arterial media; PAPd: presión arterial diastólica de arteria pulmonar, PAPm: presión arterial media de arteria pulmonar; PAPs: presión arterial sistólica de arteria pulmonar; POAP: presión de oclusión de arteria pulmonar; PVC: presión venosa central; VS: volumen sistólico; VTDG: volumen telediastólico global.
El estudio multicéntrico aleatorizado ESCAPE39, publicado en 2005, incluyó 433 pacientes con insuficiencia cardíaca sin SC asignados a dos grupos terapéuticos: uno de ellos guiado por la información obtenida por un CAP y el otro guiado solamente por los datos de la evaluación clínica. En esta población de pacientes no se encontraron diferencias en la morbimortalidad entre los dos grupos de tratamiento. Los resultados de este estudio generaron todavía más incertidumbre acerca del papel del CAP en el shock.
Sin embargo, es importante tener en cuenta que la mayoría de los estudios iniciales que fueron diseñados para evaluar el impacto del CAP en la evolución clínica, incluido el estudio ESCAPE, excluyeron a los pacientes en SC. Por este motivo, el papel del CAP en este tipo de pacientes no ha sido claramente definido40. No obstante, estudios recientes realizados en la población de pacientes en SC han mostrado que la utilización del CAP se asocia con una mejor evolución clínica41-45.
En concreto, el Cardiogenic Shock Working Group, un gran registro multicéntrico que representa el «mundo real» de la estrategia diagnóstica y terapéutica de los pacientes en SC, encontró que la disponibilidad de los datos hemodinámicos completos antes del inicio de asistencia mecánica se asociaba con una mayor supervivencia en todos los grados de SCAI41. Este hallazgo fue consistente con los resultados de otros estudios, como el de Tehrani et al.42. Estos autores evaluaron una estrategia terapéutica basada en un shock-team y encontraron que el algoritmo que utilizaba la información obtenida mediante monitorización hemodinámica invasiva, incluyendo un score con el CP y el IPAP, mejoraba la evolución de los pacientes. Asimismo, otros estudios uni o multicéntricos han encontrado también una disminución de la mortalidad a corto y a largo plazo con el uso del CAP en pacientes en SC43,44. Por último, un metaanálisis muy reciente, que incluye estudios observacionales, ha hallado una incidencia más baja de mortalidad con inserción del CAP45. Todos estos resultados prometedores a favor de la utilización del CAP deberían ser confirmados con estudios prospectivos multicéntricos. Las guías y consensos internacionales recomiendan el CAP en pacientes seleccionados que no responden al tratamiento inicial (IIB/C) o en el caso de diagnóstico o terapia incierta (casos de shock mixto o pacientes con disfunción de VD grave)5,46-48.
Termodilución transpulmonar y sistemas mínimamente invasivosPor otro lado, los dispositivos de monitorización hemodinámica avanzada basados en la termodilución transpulmonar (TDTP) permiten estimar el GC (técnica de TDTP y mediante el análisis de la onda de pulso, calibrado con la TDTP). Además, se pueden obtener parámetros como el índice de volumen telediastólico global (VTDGi), el índice de función cardíaca (CIF), la fracción de eyección global (FEG), el agua extravascular pulmonar (EVLW) y el índice de permeabilidad vascular pulmonar (IPVP)33,49,50 (tabla 1). Un bajo CIF debería alertar de una posible alteración de la contractilidad del VI, aunque es imprescindible la realización de un examen ecocardiográfico para descartar disfunción ventricular derecha. La TDTP no puede ser utilizada en pacientes con asistencias mecánicas33.
Por el contrario, los dispositivos que calculan el GC mediante el análisis del contorno de la onda de pulso sin calibración externa no deberían utilizarse en pacientes en SC por su baja fiabilidad en situaciones con GC bajo51. Finalmente, los dispositivos de monitorización no invasivos, como la biorreactancia, no son recomendados en esta población de pacientes por su falta de fiabilidad y de precisión33,52.
Objetivos de la reanimación hemodinámica en el shock cardiogénicoEl objetivo final del proceso de reanimación hemodinámica de cualquier tipo de shock es la restauración del aporte de oxígeno a los tejidos de acuerdo con sus necesidades metabólicas. En la práctica clínica, este proceso de reanimación consiste en optimizar el GC para revertir los signos de hipoperfusión tisular clínicos y metabólicos (lactato, saturación venosa de oxígeno) y en garantizar una PAM suficiente para mantener la presión de perfusión mínima a los tejidos1,4.
En el SC, el tratamiento comúnmente aceptado está dirigido a incrementar el GC y a reducir la POAP por debajo de 15mmHg. Sin embargo, no se ha evaluado prospectivamente en ningún algoritmo de reanimación hemodinámica si el alcanzar unas cifras concretas de GC como objetivo terapéutico mejora el pronóstico del SC. En este sentido, no existe una clara evidencia sobre cuáles son los parámetros «objetivo de reanimación» idóneos en el SC. A pesar de esta falta de evidencia, los datos publicados acerca de los resultados de las estrategias de tratamiento del SC, basadas en equipos multidisciplinares (shock-team) y protocolos terapéuticos del SC, ofrecen una información que puede ser muy valiosa en la toma de decisiones42,53-57.
Entre estas estrategias se encuentra la Inova Heart and Vascular Institute Cardiogenic Shock Initiative, de Tehrani et al.42, comentada previamente. El algoritmo de reanimación propuesto incluyó la medición seriada de lactato, CP e IPAP, evidenciándose una mejoría de la supervivencia si se conseguía un CP>0,6W, un lactato <3mg/dl y un IPAP <1,0. Por otro lado, la National Cardiogenic Shock Initiative53-55 también incluyó la CP y la IPAP en su protocolo terapéutico. Este estudio multicéntrico encontró que, en una población de pacientes con SC secundario a IAM, el hallazgo de unos niveles de lactato <4mmol/l y un CP>0,6W a las 12-24horas se asociaba con una supervivencia hospitalaria del 95%, por lo que los autores concluyeron que estos parámetros podían guiar la toma de decisiones precoz en el SC. Finalmente, la UTAH Cardiac Recovery Shock Team56 propuso un protocolo de reanimación hemodinámica en el que la escalada de tratamiento a un dispositivo de asistencia mecánica se basó en la persistencia de signos de hipoperfusión tisular y/o IC <2,2l/min/m2 junto a una POAP o presión telediastólica del VI>15mmHg.
Un estudio muy reciente ha propuesto un algoritmo de reanimación hemodinámica en pacientes en SC secundario a IAM con «objetivos de reanimación» que incluyó un CP>0,6W, una PAPi>1, un lactato <4mmol/l y requerimientos de menos de dos vasopresores57. Los pacientes que alcanzaban los cuatro parámetros objetivo a las 24horas tuvieron mayor supervivencia hospitalaria (OR: 11,21; IC95%: 1,7-123,7).
Por el momento se desconoce cómo pueden integrarse el TRC y la presencia de livideces en los «objetivos de reanimación» del SC.
Ecocardiografía en el shock cardiogénicoLa ecocardiografía es una modalidad de diagnóstico no invasiva, segura, disponible a la cabecera del paciente y relativamente económica que se puede realizar e interpretar rápidamente en situaciones agudas. Estos elementos la convierten en una herramienta de diagnóstico y monitorización de primera línea en la evaluación diferencial de la inestabilidad hemodinámica, especialmente en el SC1,58.
En este sentido, la evaluación ecocardiográfica puede ser estratificada, con una primera ecografía en la fase inicial de atención3 realizada a pie de cama4, seguida de una evaluación ecocardiográfica avanzada (transtorácica o transesofágica) por parte de un experto con competencias avanzadas59.
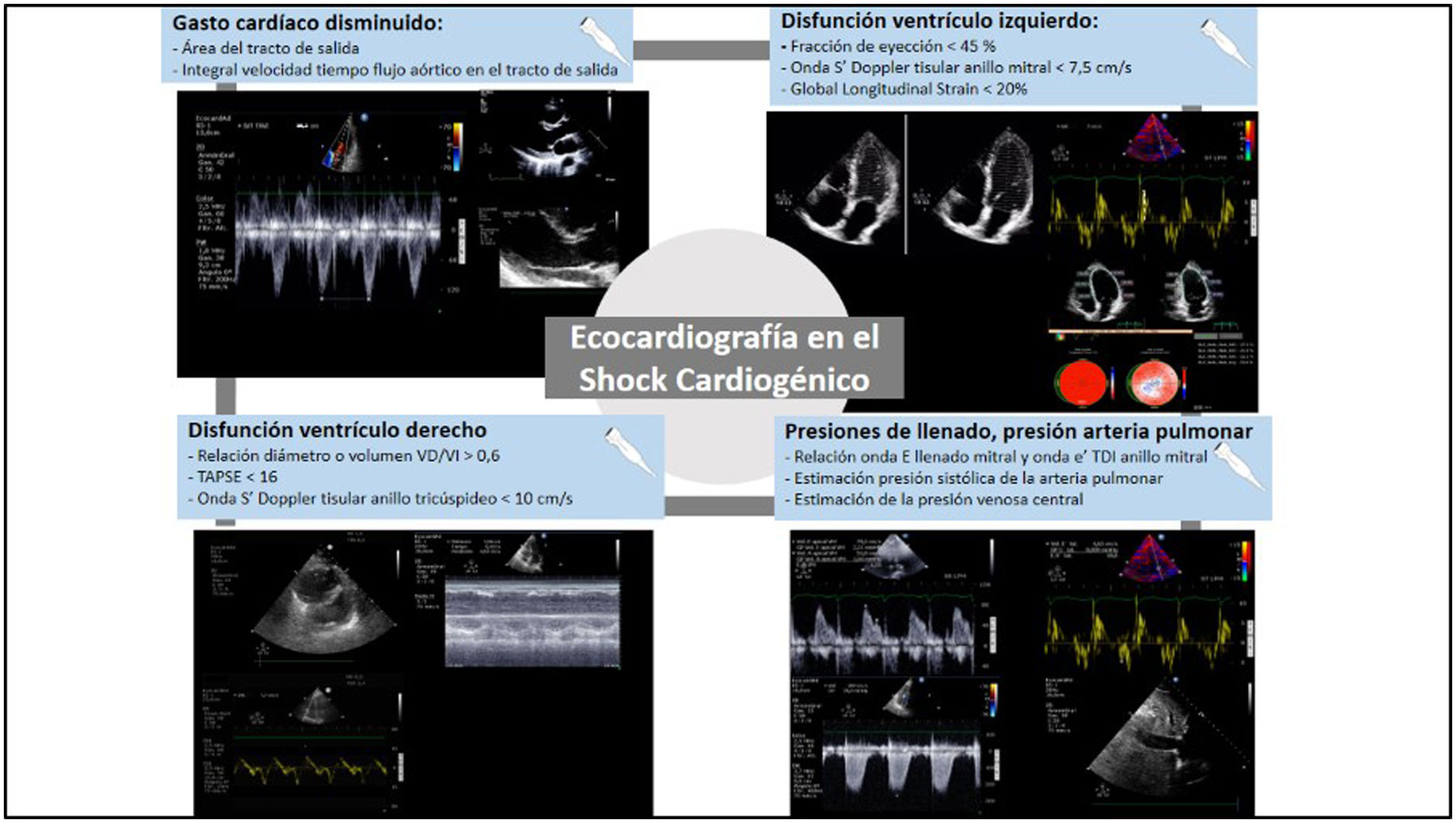
Ecocardiografía básicaLa ecografía inicial debe llevarse a cabo durante la fase de identificación lo más pronto posible. Esto permitirá realizar una evaluación básica de la contractilidad ventricular izquierda y derecha, respaldando o descartando el diagnóstico de SC. Además, ayudará a identificar etiologías potencialmente mortales del shock, como el taponamiento cardíaco (fig. 2)5.
Utilidad de la ecocardiografía en el shock cardiogénico. Cálculo del gasto cardíaco mediante la fórmula volumen sistólico=área del tracto de salida del ventrículo izquierdo×integral velocidad tiempo del tracto de salida del ventrículo izquierdo. Evaluación de la función ventricular izquierda y derecha, así como análisis de las presiones de llenado y presión de arteria pulmonar mediante Doppler pulsado del flujo transmitral en relación al estudio mediante Doppler tisular del anillo mitral.
La fracción de eyección del ventrículo izquierdo (FEVI) constituye el método más empleado en la práctica clínica para valorar la función ventricular izquierda. Esta medida proporciona una evaluación cuantitativa de la función sistólica global del VI. No obstante, es crucial tener presente que la FEVI es un parámetro sumamente influenciado por factores como la precarga y la poscarga. Estos factores pueden distorsionar la interpretación de la FEVI y deben ser considerados cuidadosamente al utilizarla como herramienta diagnóstica y pronóstica en pacientes con SC60.
En este punto, la ecocardiografía también es útil para valorar las alteraciones segmentarias de la contractilidad, información crucial, ya que sugiere la presencia de un síndrome coronario agudo como causa subyacente61.
Respecto a la función del VD, además de valorar el tamaño con relación al VI, un parámetro básico que nos permite estimar la función sistólica es la excursión del plano del anillo tricuspídeo (TAPSE). Medido en el plano apical 4 cámaras, calcula el grado de desplazamiento longitudinal del segmento anular del VD desde telediástole hasta el pico sistólico. Un valor <17mm sugiere disfunción sistólica del VD62.
Asimismo, en esta fase se debería descartar la existencia de patología valvular grave o taponamiento cardiaco63.
Ecocardiografía avanzadaEl objetivo del estudio ecocardiográfico avanzado es confirmar la etiología, realizar una evaluación hemodinámica, guiar la respuesta al tratamiento inicial y ayudar a orientar la necesidad de dispositivos de soporte circulatorio mecánico.
Evaluación de la función ventricular izquierdaLa ecocardiografía puede estimar de manera no invasiva el volumen sistólico mediante el estudio con Doppler pulsado del tracto de salida del ventrículo izquierdo (TSVI)64, siendo útil para monitorizar la respuesta a los tratamientos65. Se mide mediante el producto del área de sección transversal del TSVI con la integral de velocidad-tiempo (IVT) del flujo aórtico en el TSVI (fig. 2). La evaluación única de la IVT se ha tomado como sustituto del GC y se ha utilizado con éxito, especialmente en la cuantificación de la respuesta a volumen6. Asimismo, la ecocardiografía permite medir de forma no invasiva el CP36.
Por último, el análisis ecocardiográfico mediante Doppler tisular de la onda sistólica del anillo mitral o mediante el strain miocárdico podría representar un parámetro más fiable en comparación con la FEVI, siendo capaz de identificar cambios miocárdicos más tempranos y pequeños, representando un buen predictor del pronóstico temprano en pacientes con SC complicando un IAM66.
Evaluación de la función diastólicaLa ecocardiografía permite el estudio de la función diastólica y de las presiones de llenado mediante el estudio con Doppler pulsado del flujo transmital (onda E) y tisular del anillo mitral (onda e’)67,68 (fig. 2). Considerando la ratio E/e’ se puede hacer una aproximación a las presiones de llenado del VI, de forma que valores de E/e’>14 estiman presiones capilares pulmonares elevadas y E/e’<8 estiman presiones normales69. En un reciente estudio retrospectivo se mostró que varios parámetros ecocardiográficos (incluyendo índice de volumen sistólico bajo y una relación E/e’ elevada) se correlacionaron con la clasificación SCAI del SC y la mortalidad70.
Evaluación de la función ventricular derechaLa ecuación de Bernoulli simplificada permite calcular el gradiente de presión entre la aurícula y el ventrículo derecho mediante el uso del Doppler continuo en el trazado de la regurgitación tricuspídea. Al incorporar la PAD, este cálculo proporciona una estimación de la presión arterial sistólica de arteria pulmonar (PAPs).
Para el estudio de la función sistólica del VD, además del TAPSE, cuyas principales limitaciones son la dependencia de la carga, una reducción en el contexto de fibrilación auricular y los casos de disfunción regional, podemos optar por parámetros como la onda sistólica del Doppler tisular del anillo tricúspideo o el cambio de área fraccional (fig. 2).
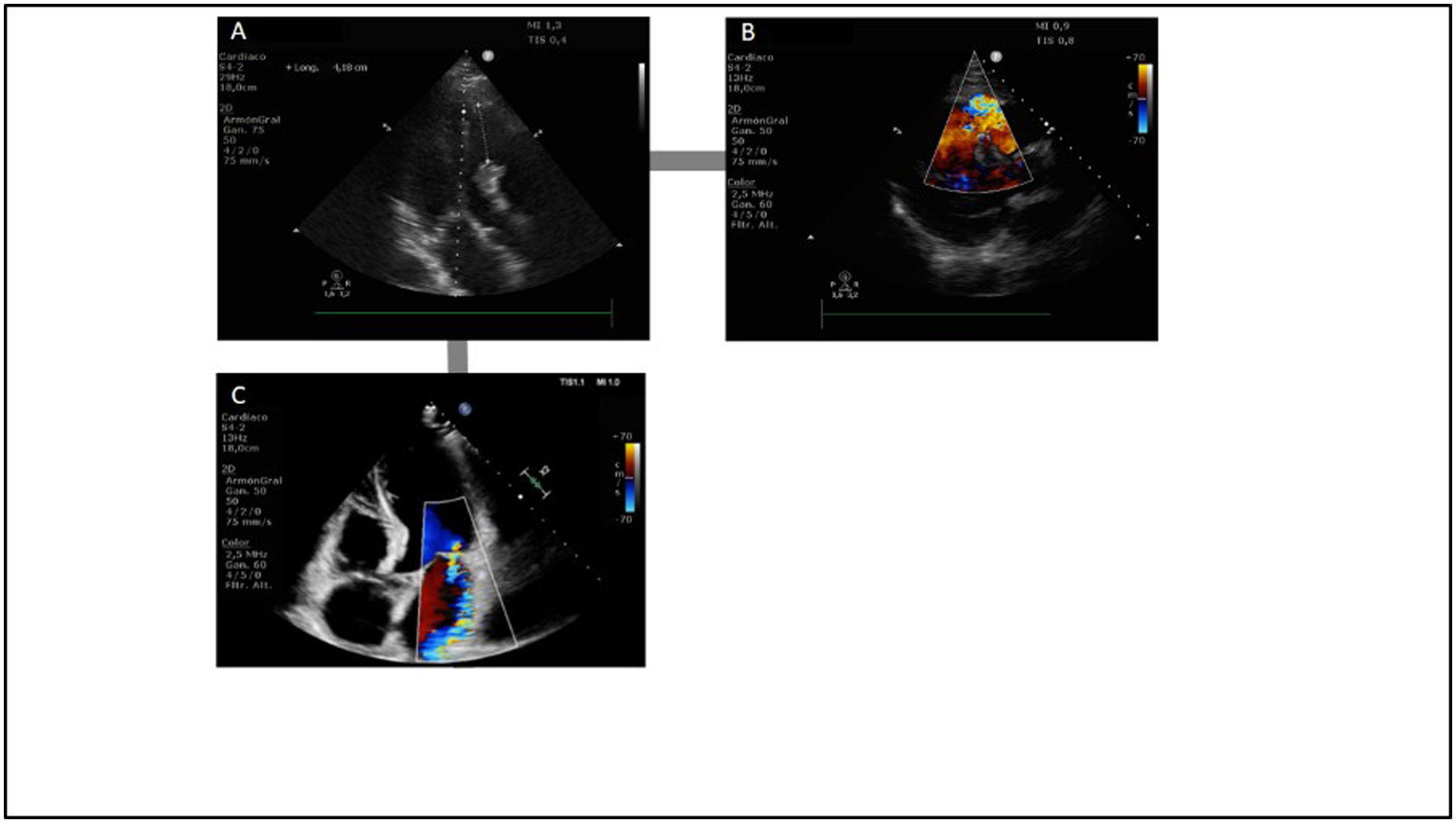
Complicaciones mecánicas en el shock cardiogénico isquémicoLas ecocardiografías seriadas pueden detectar complicaciones mecánicas en casos de IAM, como la rotura de la pared libre del VI o del VD, la comunicación interventricular o complicaciones relacionadas con el soporte mecánico circulatorio (fig. 3). En este último escenario incluso puede ser de gran utilidad para ayudar en el control de la inserción de la cánula y en la monitorización de la recuperación de la función cardíaca y el momento adecuado para el destete71.
Fenotipos del shock cardiogénico, más allá de la ecocardiografíaLa revisión de la escala SCAI pone de manifiesto que dentro de cada estadio existen diferentes niveles de gravedad en función del fenotipo del shock, existiendo tres perfiles diferenciados en pronóstico2,72:
- 1.
No congestivo: disfunción izquierda aislada sin congestión.
- 2.
Cardiorrenal: disfunción izquierda significativa con daño renal y congestión pulmonar.
- 3.
Cardiometabólico o hemometabólico: disfunción ventricular derecha, congestión sistémica, hiperlactatemia y disfunción multiorgánica.
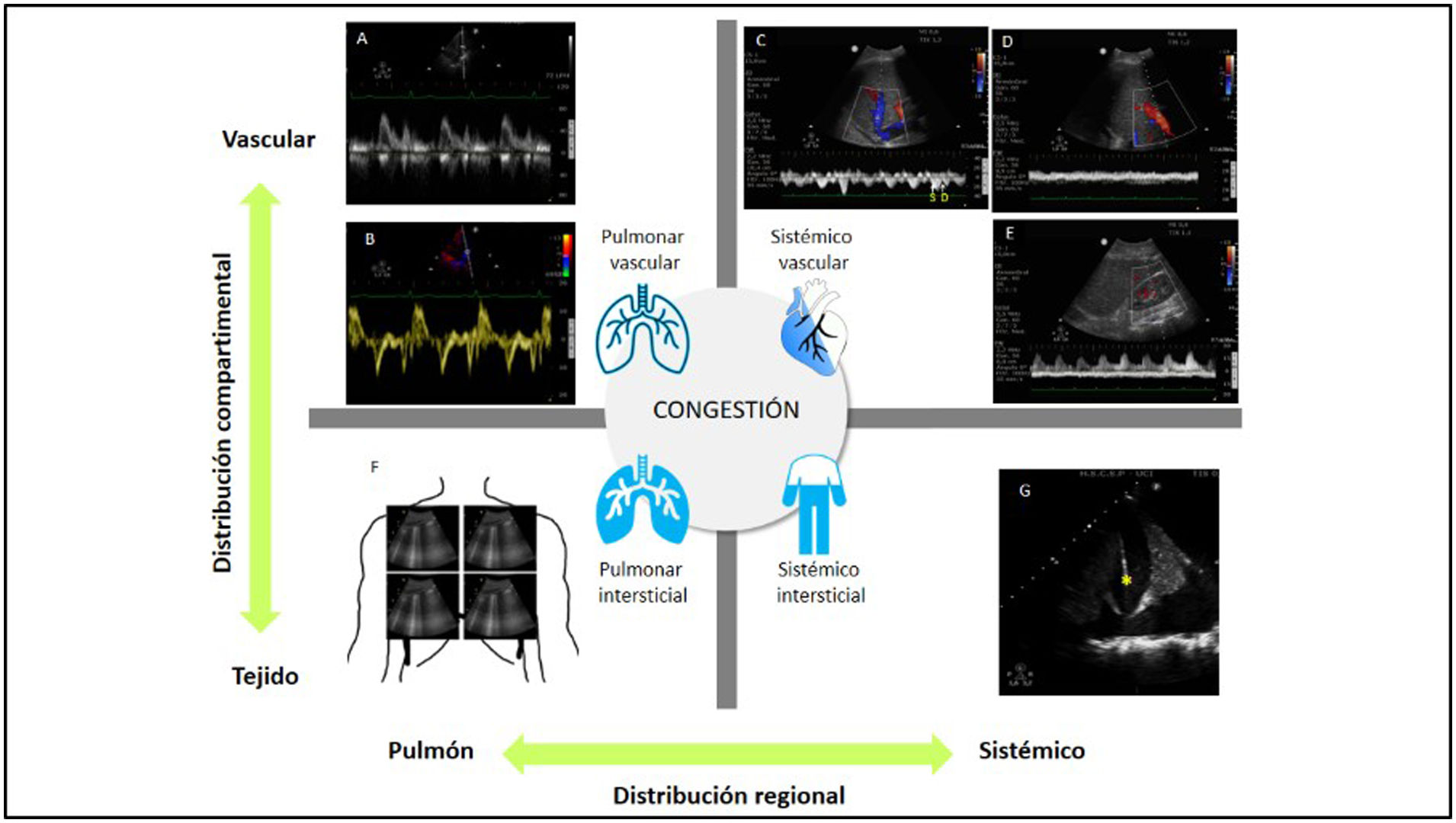
La ecografía clínica permite evaluar el grado de congestión tanto pulmonar como sistémica, añadiendo valor pronóstico y terapéutico (fig. 4). La ecografía pulmonar permite identificar y cuantificar el edema pulmonar mediante el recuento de líneasB73, así como monitorizar la respuesta al tratamiento descongestivo. Por otra parte, el estudio de la pulsatilidad del flujo en vasos venosos del compartimento abdominal (venas suprahepática, porta y renal) relacionados en el índice de puntuación de congestión venosa por ultrasonido (VExUS)74 permite establecer el grado de congestión sistémica, si bien su valor en el SC todavía no ha sido estudiado75.
Estudio de la congestión en el shock cardiogénico. A)Estudio mediante Doppler pulsado del flujo transmitral. B)Estudio mediante Doppler tisular de la zona lateral del anillo mitral. C)Estudio mediante Doppler pulsado del flujo normal de la vena suprahepática; nótese que se compone de dos ondas anterógradas, una mayor sistólica (S) y otra menor diastólica (D), así como una onda retrógrada (sístole auricular). A medida que aumentan las presiones en la aurícula derecha, la onda S reduce su magnitud, hasta que, en grados graves de congestión, la onda S invierte su flujo. D)Estudio mediante Doppler pulsado del flujo normal de la vena porta. E)Estudio mediante Doppler pulsado del flujo normal de la vena y arteria renal. F)Estudio de ecografía pulmonar mostrando patrón de líneasB. G)Estudio de ecografía pleuro-pulmonar y abdominal mostrando derrame pleural y ascitis perihepática; el asterisco señala el diafragma, quedando la cavidad torácica a su derecha y la abdominal a su izquierda.
Las principales limitaciones tanto de la ecocardiografía transtorácica como de la transesofágica radican en que ninguna de las dos es una herramienta de monitorización continua y que son operador dependiente. Otras limitaciones de la transtorácica incluyen una mala ventana en algunos pacientes, mientras que la transesofágica ya representa un método invasivo, con riesgos de lesiones traqueales, hipofaríngeas, esofágicas o gástricas76.
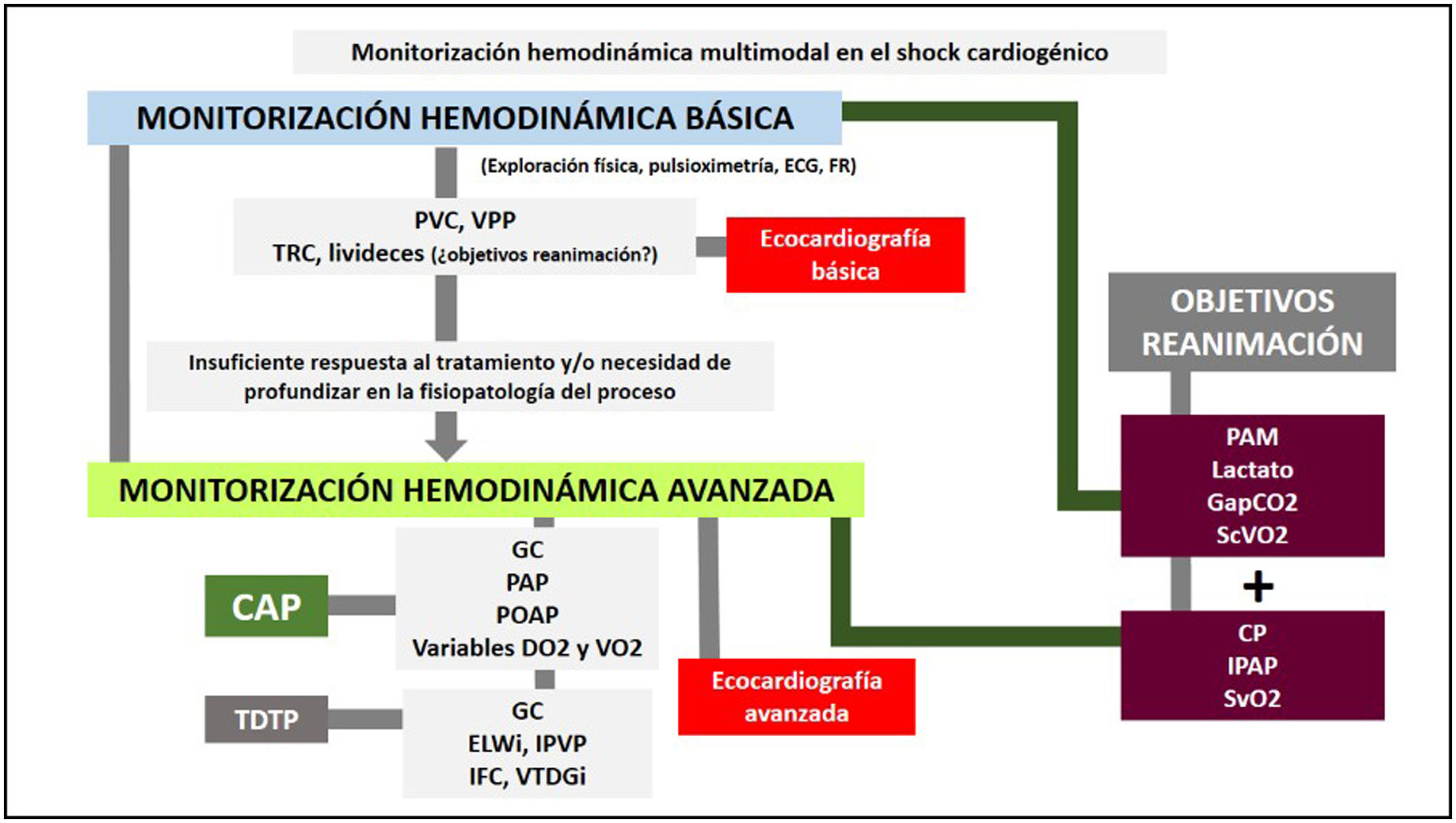
Conclusiones. Monitorización multimodal en el shock cardiogénicoEn definitiva, la monitorización hemodinámica del SC puede contemplarse como una monitorización multimodal que incluye e integra diversos parámetros hemodinámicos, metabólicos y ecocardiográficos que ofrecen una información detallada y complementaria que permite describir las características del SC y guiar las intervenciones terapéuticas (fig. 5).
Monitorización multimodal en el shock cardiogénico.
CAP: catéter de arteria pulmonar; CP: potencia cardíaca; DO2: aporte de oxígeno; ELWi: agua extravascular pulmonar indexada; GapCO2: diferencia veno-arterial de pCO2; GC: gasto cardíaco; IFC: índice de función cardíaca; IPAP: índice de pulsatilidad de la arteria pulmonar; IPVP: índice de permeabilidad vascular pulmonar; PAM: presión arterial media; PAP: presión de arteria pulmonar; POAP: presión de oclusión de arteria pulmonar; PVC: presión venosa central; ScVO2: saturación venosa central de oxígeno; SvO2: saturación venosa mixta de oxígeno; TDTP: termodilución transpulmonar; TRC: tiempo de relleno capilar; VO2: consumo de oxígeno; VPP: variación de presión de pulso; VTDGi: índice de volumen telediastólico global.
Ana Ochagavía, Nora Palomo, Virgina Fraile y Luis Zapata han redactado y revisado el manuscrito.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.